(2: 湖北省地质环境总站, 武汉 430034)
(2: Geological Environmental Center of Hubei Province, Wuhan 430034, P.R. China)
甲氧氯(methoxychlor, MXC)是一种有机氯化物农药,具有杀虫谱广、杀虫效果好、对人畜毒性较低等优点,已取代了传统的二氯二苯三氯乙烷(滴滴涕,DDT),在世界各地的农业、林业、卫生等领域得到广泛应用[1]。由于MXC的广泛使用,其在世界各地的地表水、地下水、饮用水和沉积物中经常被检测到[2]。特别是在中国,MXC的产量逐年增加,导致了MXC的大量排放和环境积累。例如,在青石滩水库地表水(水库、池塘、水塘)中,检测到MXC的最大浓度为13.90 ng/L[3]。在国外MXC被频繁检测到,例如,墨西哥韦拉克鲁斯州的阿尔瓦拉多泻湖沉积物中,MXC的最大检出浓度为29.40 ng/g[4]。MXC的积累可以对生物体产生负面影响,通过干扰正常的内分泌活动和破坏生物体内的化学物质,影响生物的繁殖和生存[5]。MXC的辛醇/水分配系数(lgKow)为4.68[6],MXC的有机碳-水分配系数(lgKoc)为4.99[7]。水流动态实验和静态生态系统实验中,MXC在鱼体内的浓度与在水中的浓度之比,即生物富集系数(bioconcentration factors, BCFs)分别为185和1550 [6],这些数据说明了MXC在鱼类中具有较强的生物富集作用。研究表明MXC对水生生物具有多种毒性作用。例如,MXC对骨条藻(Skeletonema costatum)的半数致死浓度为0.1 mg/L[8]。另外,由于MXC的生物富集作用,世界各地都有大量鱼类死亡的报道[9]。食用具有生物积累的水生生物,会严重威胁人类健康。因此,MXC对水生生物和生态系统潜在的长期不良影响越来越受到关注。
污染物具有从水向沉积物的迁移趋势,然而,MXC的水质基准(water quality criteria, WQC)和沉积物质量基准(sediment quality criteria, SQC)却鲜有研究。因此,开展MXC的WQC和SQC研究显得尤为重要,它们是进行生态风险评价的重要参考依据[10]。WQC和SQC是地表水和沉积物中污染物的阈值浓度,制定这两项基准规范旨在保护生活在地表水或沉积物中的水生生物免受不利影响。物种敏感性分布(species sensitivity distribution, SSD)是一种与生态系统中单个生物物种的毒性阈值相匹配的累积概率分布,构建SSD是为了从毒性值的分布中估计5% 的危险浓度(hazardous concentration for 5% of species, HC5),从而根据HC5来推导出WQC[11]。在澳大利亚和新西兰,SSD已被正式用于制定污染物水质指南。近期,中国生态环境部也推荐SSD作为污染物水质基准的标准方法(淡水生物水质基准制定技术导则,第一版为HJ 831—2017,更新为HJ 831—2022)[12-13]。目前,SSD已经用于推导多种污染物的WQC并用于水环境的生态风险评价,如土霉素和重金属等[11, 14]。此外,在数据充足的条件下,SSD也被用于推导沉积物中酚类化合物、三氯生和重金属等污染物的SQC[10, 15-16]。当环境污染物的沉积物毒性数据不能满足SSD推导SQC的要求时,可以根据情况选择使用生物效应法、相平衡分配法和评价因子法[17]。
本文利用收集的MXC对淡水水生生物的急性和慢性毒性数据,运用SSD模型对MXC的短期水质基准(short-term water quality criterion, SWQC)和长期水质基准(long-term water quality criterion, LWQC)进行了推导。在WQC的基础上,采用相平衡分配方法进一步推导了MXC的SQC。此外,我们还收集了中国淡水水体和沉积物中MXC的暴露浓度数据,并采用风险商值法(risk quotient, RQ)评估了MXC在水环境及沉积物环境中的生态风险。本研究的结果将为中国水生生物保护、水污染治理和有效降低MXC带来的生态风险提供有益信息。
1 材料与方法 1.1 毒性数据的收集和筛选水环境中MXC的急性和慢性毒性数据来自美国环保局生态毒理学数据库(ECOTOX数据库,https://cfpub.epa.gov/ecotox/)、Web of Science (http://www.webofscience.com)、中国知网(http://www.cnki.net)和ELSEVIER (http://www.sciencedirect.com)。毒性数据统计截至时间为2023年3月。从这些数据库中筛选出符合条件的毒性数据。毒性数据的筛选主要基于《淡水生物水质基准推导技术指南》,具体原则为:1)被试物种应为在中国境内分布的淡水水生生物;2)测试介质应为水;3)对于水生动物的急性毒性数据(包括LC50和EC50,不区分优先性),轮虫、水溞、摇蚊和其他物种的暴露时间分别为24、48、48和96 h左右。对于水生植物的急性毒性数据(包括LC50和EC50,不区分优先性),暴露时间应在96 h左右;4)对于水生动物的慢性毒性数据(MATC>EC20>EC10=NOEC>LOEC>EC50>LC50),轮虫的暴露时间应≥48 h,其他动物的暴露时间应≥21 d或敏感生命阶段(如鱼类早期生命阶段毒性试验)。对于水生植物的慢性毒性数据(MATC>EC20>EC10=NOEC>LOEC>EC50>LC50),暴露时间应≥21 d或覆盖一代。
1.2 暴露数据的收集和筛选MXC在淡水和沉积物中的暴露浓度数据来源于Web of Science (http://www.webofscience.com)、中国知网(http://www.cnki.net)和ELSEVIER (http://www.sciencedirect.com)。对收集到的暴露浓度数据进行了筛选,用以进行生态风险评估。MXC暴露数据统计截至时间为2023年3月,所选暴露数据均使用最新和最高的暴露浓度。
1.3 甲氧氯水质基准的SSD推导SSD是基于假设不同物种对某种压力源的敏感性服从某种累积概率分布,如对数正态分布模型(Log-normal)和对数逻辑斯谛分布模型(Log-logistic)。通过物种敏感性分布模型计算保护大多数物种的有害浓度(HCx),并将其作为保护大多数物种的阈值。一般取x为5,HC5为化学物质的浓度,在该浓度范围以下可以保护95% 的物种[18]。采用基于MATLAB的SSDToolbox软件进行数据拟合,拟合MXC对水生生物的SSD曲线,推导HC5值。以毒性数据的对数值为自变量x,对应的累积频率为因变量y,分别采用Log-normal和Log-logistic进行SSD拟合。然后,通过拟合评价参数:赤池信息准则(Akaike's information criterion, AIC)和概率P值(K-D检验),选取最佳拟合模型计算HC5。基于水生生物的急性毒性值,推导MXC的SWQC;基于水生生物的慢性毒性值,推导MXC的LWQC。由公式(1)计算SWQC和LWQC:
| $\mathrm{WQC}=\mathrm{HC}_5 / \mathrm{AF} $ | (1) |
一般情况下,当有效毒性数据包括的物种数量>15时,评估因子(assessment factor, AF)值为2。当有效毒性数据包括的物种数量≤15时,一般取值为3[13]。
1.4 甲氧氯沉积物质量基准的相平衡分配法推导在推导SQC时,由于MXC在沉积物中的毒性数据不够充足,因此,根据《沉积物质量基准技术指南》,通过相平衡分配法,以WQC为基础来推导SQC [17]。基于热力学动态平衡分配理论,相平衡分配方法适用于已经推导出水生生物水质基准的非离子型有机化合物。该方法假设:(1)水环境中污染物在沉积物与间隙水之间的交换是快速可逆的,处于热力学平衡状态;(2)沉积物中污染物的生物有效性浓度与间隙水中污染物的游离浓度(非络合态的活性浓度)有良好的相关性,而与沉积物中污染物的总浓度无相关性;(3)底栖生物对上覆水生物具有相似的敏感性,因此水质基准可应用于沉积物质量基准的推导。根据相平衡分配理论,当水环境中MXC的浓度达到WQC时,此时沉积物中MXC浓度即视为MXC的SQC,由公式(2)计算:
| $ \mathrm{SQC}=K_{\mathrm{oc}} \times f_{\mathrm{oc}} \times \mathrm{WQC} $ | (2) |
式中,Koc为有机碳-水分配系数,是污染物在沉积物有机碳和水中浓度的比值;foc为沉积物中有机碳的质量分数,式中foc按照1% 计算[17]。
通过该方法推导SQC,以SWQC推导得到的值作为沉积物质量基准高值(SQC-H),以LWQC推导得到的值作为沉积物质量基准低值(SQC-L)。
1.5 甲氧氯的生态风险评价采用风险商值法(risk quotient, RQ)对淡水和沉积物中的MXC进行生态风险评价,确定RQ的计算公式如下[14]:
| $ \mathrm{RQ}=\mathrm{EPC} / \mathrm{WQC} $ | (3) |
| $ \begin{gathered} \mathrm{RQ}=\mathrm{EPC} / \mathrm{SQC} \end{gathered} $ | (4) |
式中,EPC为MXC的暴露浓度。
这种方法的假设是,如果污染物的暴露浓度>其WQC(或SQC),则可能发生潜在危害,其风险程度与风险商值呈正比关系。在风险评价方面,环境风险有4种类型,根据风险分级标准,分为4个风险等级:RQ<0.01、0.01≤RQ<0.1、0.1≤RQ<1、RQ≥1分别表示无风险、低风险、中风险和高风险[19]。
2 结果与讨论 2.1 甲氧氯的WQC推导目前,通过收集筛选得到了4门11科17种动植物的急性物种毒性数据(0.78~440 μg/L),具体数据如表 1所示。初级生产者骨条藻(Skeletonema costatum)表现出一定的耐受性,其急性毒性数据为100 μg/L。蚤状溞(Daphnia pulex)对MXC急性暴露最敏感,为0.78 μg/L,与急性毒性数据最大(440 μg/L)的水生生物的埃及伊蚊(Aedes aegypti)相比,蚤状溞比埃及伊蚊敏感564倍。蓝鳃太阳鱼(Lepomis macrochirus)是对MXC急性暴露最敏感的鱼类,其敏感性甚至高于水生植物S. costatum。在鱼类中,孔雀花鳉(Poecilia reticulata)对MXC的急性毒性数据为120 μg/L,是鱼类中最耐受的。几种溞类(锯顶低额溞(Simocephalus serrulatus)、蚤状溞、大型溞(Daphnia magna)、模糊网纹溞(Ceriodaphnia dubia))的耐受性均较低,急性毒性数据分别为5.6、0.78、16.0和14.1 μg/L。其中,近缘物种模糊网纹溞的敏感性与大型溞相似。
| 表 1 甲氧氯的水生生物急性毒性数据 Tab. 1 Acute aquatic toxicity data of MXC |
通过筛选获得了4门8科10种动植物的慢性毒性数据(0.49~100 μg/L),如表 2所示。短脉纹石蛾(Cheumatopsyche sp.)对MXC的暴露最敏感,蓝太阳鱼(Lepomis cyanellus)对MXC的暴露最耐受,它们之间的慢性毒性值相差了204倍。MXC是通过影响蓝太阳鱼的代谢功能产生毒性[30]。但与蓝太阳鱼同一科的蓝鳃太阳鱼对MXC的长期暴露毒性值为10 μg/L,二者对MXC的耐受性相差10倍。急慢性毒性数据都至少包括10个物种,涵盖了生产者、初级消费者和次级消费者3个营养级,满足《淡水生物水质基准推导技术指南》(HJ 831—2022)的最少毒性数据需求。
| 表 2 甲氧氯的水生生物慢性毒性数据 Tab. 2 Chronic aquatic toxicity data of MXC |
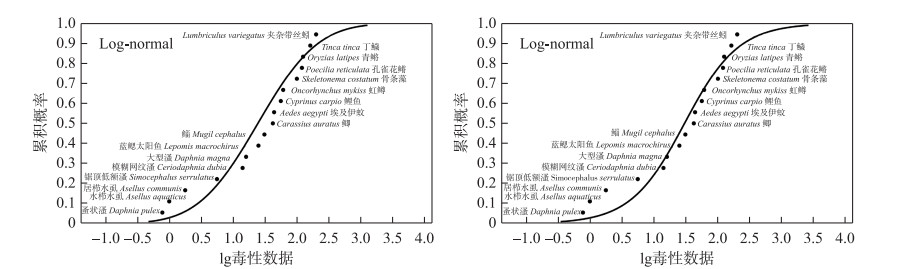
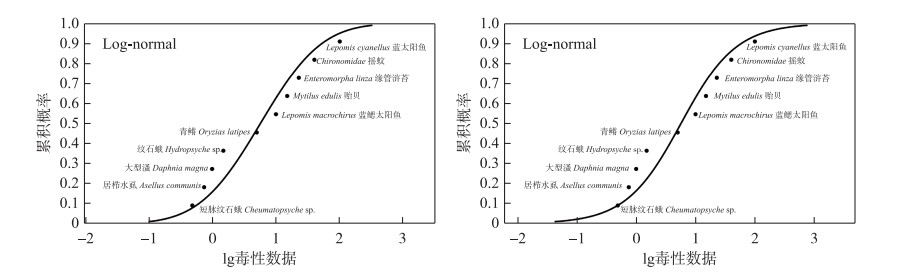
表 3为MXC急慢性数据的SSD模型拟合评价结果。Log-normal分布模型是推导短期水质基准(SWQC)的最优拟合模型(SSD曲线见图 1)。由曲线可得HC5为1.50 μg/L。由于急性毒性数据数量大于15个,覆盖了足够的营养级,AF值为2。通过计算,最终得到SWQC为0.75 μg/L。在慢性毒性值的SSD模型拟合评价结果的基础上(表 3),Log-normal分布模型同样也是用于推导长期水质基准(LWQC)的最优拟合模型。SSD曲线如图 2所示,通过SSD曲线测得HC5为0.33 μg/L。由于慢性毒性数据未超过15个,覆盖了足够的营养级,AF值为3,最终LWQC为0.11 μg/L。
| 表 3 甲氧氯的急性和慢性SSD拟合结果 Tab. 3 Summary of fitting data with acute and chronic species sensitivity distribution of MXC |
|
图 1 甲氧氯的急性物种敏感度分布曲线 Fig.1 The acute species sensitivity distribution curves for MXC |
|
图 2 甲氧氯的慢性物种敏感度分布曲线 Fig.2 The chronic species sensitivity distribution curves for MXC |
由于《地表水环境质量标准》(GB 3838—2002)尚未规定MXC的标准限值。因此,本文基于我国地理环境下的生物毒性数据,总结出适于本土物种的敏感性分布,以获得更准确的MXC水质基准值,为我国制定MXC标准限值提供参考。在制定《地表水环境质量标准》中MXC的标准限值时,不仅需要充分考虑维护人体健康,还要维护水生生物的生存代谢,满足淡水水生生物的正常生存需求。本文所推导的SWQC和LWQC可以为保护我国淡水水生生物提供重要的参考依据。
2.2 甲氧氯的SQC推导根据《沉积物质量基准制定技术指南》[17],推导SQC的方法有4种,在获得足够毒性数据的情况下,SSD法是最优方法。然而,关于MXC对沉积物中底栖生物的毒性研究较少,导致沉积物毒性数据缺乏。相平衡分配法是推导化学物SQC的替代方法,MXC为非离子型有机化合物,其lgKoc为4.99[7]。因此,根据推导出的MXC的SWQC和LWQC,进一步推导出沉积物质量基准高值(SQC-H)和沉积物质量基准低值(SQC-L)分别为0.73和0.11 mg/kg。更重要的是,沉积物作为疏水污染物的存储介质,在水质发生变化时,会对地表水造成二次污染[36]。因此,推导MXC的SQC是非常必要的,这将有助于我们进一步控制水污染,保护水生生物,特别是更好地保护底栖生物。
目前,美国已经推导得出了MXC沉积物质量基准值为1.9 mg/kg[7]。值得注意的是,本文推导出的MXC的SQC-L低于美国所推导得出的基准值。造成基准值差异的原因可能在于,不同地区物种区系的差异。本文的SQC是由WQC通过相平衡分配法推导得来,而由于物种的选择不同,直接影响到WQC的结果,从而影响了SQC的结果。本文在推导WQC时,选用的是中国本土物种,因此所得出的结果对于中国水质基准研究更具有启示性。而美国在推导基准值时,也是基于美国本土的物种进行研究,因此本文与美国得出的沉积物质量基准值存在差异。
2.3 淡水中甲氧氯的生态风险评价在国内外报道中,在淡水水域中检测到MXC的文献较少,通过收集和筛选中国淡水中MXC的暴露数据,可以明确了解中国淡水中MXC浓度的检测范围为2.33~79.25 ng/L(详细信息见表 4)。由于MXC主要用于农业生产,只有当MXC大量泄漏时,才会造成严重污染,对该地区的物种产生急性毒性作用。因此,我们只评估了MXC在中国河流或湖泊的长期生态风险,即使用LWQC对其进行风险评价。在目前的工作中,对于中国的某水库、河流或湖泊,只使用最新和最高的暴露浓度。采用RQ对淡水生态风险进行评估,结果如表 4所示。
在所收集的8个地表水区域中,4个区域为低风险,4个区域为中风险。东南沿海的入海河流中MXC检出浓度较高,闽江河口MXC检出浓度最高,为79.25 ng/L;流溪河的检出浓度次之,为20.02 ng/L;黄浦江的检出浓度为19.04 ng/L,黄浦江的支流苏州河检出浓度为11.00 ng/L,这4个区域地表水风险等级为中风险,显示出对区域水生生物具有一定的生态风险。这4条入海河流检出浓度高可能与入海排污口的排放有关。这8个地表水区域中MXC的检出浓度均低于SWQC,表明地表水中的MXC不会对淡水生物造成急性毒性影响。个别地区的MXC浓度接近LWQC,这些地区的MXC浓度可能对部分淡水生物产生慢性毒性影响。RQ分析结果显示,淮河江苏段、官厅水库、青石滩水库和高邮湖水源地的RQ值介于0.02~0.04,处于较低的生态风险。
| 表 4 不同地表水中甲氧氯的生态风险商值 Tab. 4 Ecological risk quotients of MXC in different surface river |
综上所述,我国地表水中MXC对淡水生物存在一定的影响,部分地区具有一定的生态风险。综合上述水质基准推导过程及对我国部分流域MXC的生态风险评估结果,建议我国地表水环境质量标准中MXC的推荐值为0.11 μg/L。为了保护水生环境,需要限制MXC在农业生产中的使用,并采取其他措施,如增加淡水环境中MXC的检测以及优化控制MXC污染的手段。
2.4 沉积物中甲氧氯的生态风险评价沉积物中MXC的暴露浓度范围为0.048~44.14 ng/g(具体情况见表 5)。然而,由于MXC在沉积物中的半衰期较长,沉积物中的MXC可以保持较长时间。因此,基于SQC-L收集了不同站点沉积物的最新暴露浓度和最大暴露浓度进行生态风险评价,结果如表 5所示。
| 表 5 不同区域沉积物中甲氧氯的生态风险商值 Tab. 5 Ecological risk quotients of MXC in different sediments from different regions |
从国内总体情况来看,仅海河河口站点与青石滩水库站点为中风险,这可能与当地丰富的农业生产活动有关。而大多数的站点为低风险或无风险。从局地角度看,海河河口站点与青石滩水库站点的沉积物环境风险为中风险,说明这些地区的水生生物存在MXC毒性作用的风险,应采取措施控制沉积物中MXC的污染。此外,官厅水库和千岛湖沉积物中MXC的生态风险可忽略。我们还应该关注其他低风险区域,如闽江河口、黄浦江、苏州河、扎龙湿地、太湖、三江营和高邮水源地,应尽快控制污染,以保护更多的水生生物。
2.5 不确定性分析无论采用何种生态风险评估法,生态风险评价的不确定性是不可避免的。这种不确定性与多种因素相关,包括单一水体和沉积物中特定采样点的MXC暴露浓度、基于不同毒性终点收集的MXC毒性数据、筛选生物的方法、各种风险模型以及一些未知因素等[52]。本研究中有些MXC的毒性数据距今时间较长,具有一定的时效性。为了避免毒性数据时效性的影响,需要通过实验来获得更多本土物种当前的毒性数据。其次,关于MXC暴露浓度的时间和空间变化的信息很少,这导致了一个重要的不确定性来源。为了更准确地描述MXC环境暴露并尽可能减少不确定性,还需要进一步的工作来获得更多不同时间和空间尺度上的MXC暴露数据。相应地,由于SQC是使用相平衡分配法推导出的,因此也可以降低其毒性数据主要来源于WQC的不确定性。此外,在拥有足够的沉积物中MXC生物毒性数据的基础上,可以利用SSD方法推导SQC,以提高其准确性。
3 结论1) 本研究利用SSD推导出了MXC的SWQC (0.75 μg/L)和LWQC (0.11 μg/L)。进一步,通过相平衡分配法,分别推导出了MXC的SQC-H (0.73 mg/kg)和SQC-L (0.11 mg/kg)。
2) 基于RQ对地表水和沉积物中MXC的生态风险进行了评价,发现地表水中超过一半的站点为中风险状态,沉积物中大部分站点为无风险或低风险状态。
3) 建议有关政府部门控制MXC在农业生产中的使用,限制MXC的排放,并加强对地表水和沉积物中MXC的监测和治理。
| [1] |
Bai H, Yang YX, Yuan HM et al. Preparation of Fe3O4@Fe(0) immobilized enzyme to enhance the efficient degradation of methoxychlor. Environmental Science and Pollution Research, 2023, 30(1): 917-929. DOI:10.1007/s11356-022-22265-9 |
| [2] |
Gupta VK, Ali I. Removal of endosulfan and methoxychlor from water on carbon slurry. Environmental Science & Technology, 2008, 42(3): 766-770. DOI:10.1021/es7025032 |
| [3] |
Zeng HH, Fu X, Liang YP et al. Risk assessment of an organochlorine pesticide mixture in the surface waters of Qingshitan Reservoir in Southwest China. RSC Advances, 2018, 8(32): 17797-17805. DOI:10.1039/C8RA01881B |
| [4] |
del Refugio Castañeda-Chávez M, Lango-Reynoso F, Navarrete-Rodríguez G. Hexachlorocyclohexanes, cyclodiene, methoxychlor, and heptachlor in sediment of the alvarado lagoon system in Veracruz, Mexico. Sustainability, 2018, 10(1): 76. DOI:10.3390/su10010076 |
| [5] |
Vaithinathan S, Saradha B, Mathur PP. Methoxychlor induces apoptosis via mitochondria- and FasL-mediated pathways in adult rat testis. Chemico-Biological Interactions, 2010, 185(2): 110-118. DOI:10.1016/j.cbi.2010.03.014 |
| [6] |
Kenaga EE. Correlation of bioconcentration factors of chemicals in aquatic and terrestrial organisms with their physical and chemical properties. Environmental Science & Technology, 1980, 14(5): 553-556. DOI:10.1021/es60165a001 |
| [7] |
Robert MB, Walter JB, David RM et al. Procedures for the derivation of equilibrium partitioning sediment benchmarks (ESBs) for the protection of benthic organisms: Compendium of tier 2 values for nonionic organics. Washington DC: Office of Research and Development, 2008.
|
| [8] |
Sikka HC, Rice CP. Interaction of selected pesticides with marine microorganisms. Arlington: Office of Naval Research, 1974.
|
| [9] |
Huang Y, Li J, Yang YX et al. Characterization of enzyme-immobilized catalytic support and its exploitation for the degradation of methoxychlor in simulated polluted soils. Environmental Science and Pollution Research, 2019, 26(27): 28328-28340. DOI:10.1007/s11356-019-05937-x |
| [10] |
Liu XY, Tu MC, Wang SP et al. Research on freshwater water quality criteria, sediment quality criteria and ecological risk assessment of triclosan in China. Science of the Total Environment, 2022, 816: 151616. DOI:10.1016/j.scitotenv.2021.151616 |
| [11] |
Kong XZ, He W, Qin N et al. Assessing acute ecological risks of heavy metals to freshwater organisms by species sensitivity distributions. China Environmental Science, 2011, 31(9): 1555-1562. [孔祥臻, 何伟, 秦宁等. 重金属对淡水生物生态风险的物种敏感性分布评估. 中国环境科学, 2011, 31(9): 1555-1562.] |
| [12] |
中华人民共和国环境保护部. 淡水水生生物水质基准制定技术指南: HJ 831—2017. 北京: 中国环境出版社, 2017.
|
| [13] |
中华人民共和国生态环境部. 淡水水生生物水质基准制定指南(修订征求意见稿): HJ 831—2022. 北京: 中国环境出版社, 2022.
|
| [14] |
Si JY, Hong YJ, Xia P et al. Water quality criteria/standards and ecological risk assessment of oxytetracycline for freshwater organisms in China. Research of Environmental Sciences, 2023, 36(2): 403-413. [司静宜, 洪亚军, 夏鹏等. 我国土霉素的淡水生物水质基准与标准及生态风险评估研究. 环境科学研究, 2023, 36(2): 403-413.] |
| [15] |
Yin W, Fan DL, Wang Z et al. Pollution characteristics and ecological risks of 7 phenolic compounds of high concern in the surface water and sediments of Tianjin, China. Asian Journal of Ecotoxicology, 2020, 15(1): 230-241. [殷伟, 范德玲, 汪贞等. 天津市地表水体与沉积物中7种高关注酚类化合物的污染特征与生态风险分析. 生态毒理学报, 2020, 15(1): 230-241. DOI:10.7524/AJE.1673-5897.20190125002] |
| [16] |
Zhang YB, Wu J. Ecological risk assessment of heavy metals in reservoir sediments of Haihe River Basin based on species sensitivity distribution. South-to-North Water Transfers and Water Science & Technology, 2022, 20(3): 544-551. [张昀保, 吴劲. 海河流域典型区域重金属沉积物生态风险研究. 南水北调与水利科技: 中英文, 2022, 20(3): 544-551.] |
| [17] |
中国环境科学学会. 沉积物质量基准制定技术指南: T/CSES 11—2020. 北京: 中国环境出版社, 2020.
|
| [18] |
Wheeler JR, Grist EPM, Leung KMY et al. Species sensitivity distributions: Data and model choice. Marine Pollution Bulletin, 2002, 45(1/2/3/4/5/6/7/8/9/10/11/12): 192-202. DOI:10.1016/S0025-326X(01)00327-7 |
| [19] |
Liu N, Jin XW, Feng CL et al. Ecological risk assessment of fifty pharmaceuticals and personal care products (PPCPs) in Chinese surface waters: A proposed multiple-level system. Environment International, 2019, 136: 105454. DOI:10.1016/j.envint.2019.105454 |
| [20] |
Mayer F, Ellersieck M. Manual of acute toxicity: Interpretation and data base for 410 chemicals and 66 species of freshwater animals. USDI Fish and Wildlife Service, 1986, 505. |
| [21] |
Henderson C, Pickering QH, Tarzwell CM. Relative toxicity of ten chlorinated hydrocarbon insecticides to four species of fish. Transactions of the American Fisheries Society, 1959, 88(1): 23-32. DOI:10.1577/1548-8659(1959)88[23:rtotch]2.0.co;2 |
| [22] |
Knapek R, Lakota S. Biological testing to determine toxic effects of pesticides in water (Einige biotests zur untersuchung der toxischen wirkung von pestiziden im wasser). Tagungsber Akad Landwirtschaftswiss, 1974, 126: 105-109. |
| [23] |
Lakota S. Toxic action of methoxychlor on certain water animals (Die toxische wirkung von methoxychlor auf einige wassertiere). Tagungsber Akad Landwirtschaftswiss, 1974, 126: 111-115. |
| [24] |
Nimrod AC. Environmental estrogens and reproductive toxicity in fish. Oxford: University of Mississippi, 1996.
|
| [25] |
Lee JH, Nash CE, Sylvester JR. Effects of mirex and methoxychlor on juvenile and adult striped mullet, Mugil cephalus L. Bulletin of Environmental Contamination and Toxicology, 1975, 14: 180-186. DOI:10.1007/BF01701311 |
| [26] |
Oris JT, Winner RW, Moore MV. A four-day survival and reproduction toxicity test for Ceriodaphnia dubia. Environmental Toxicology and Chemistry, 1991, 10(2): 217-224. DOI:10.1002/etc.5620100210 |
| [27] |
Anderson RL, DeFoe DL. Toxicity and bioaccumulation of endrin and methoxychlor in aquatic invertebrates and fish. Environmental Pollution Series A, Ecological and Biological, 1980, 22(2): 111-121. DOI:10.1016/0143-1471(80)90187-7 |
| [28] |
Bailey HC, Liu DH. Lumbriculus variegatus, a benthic oligochaete, as a bioassay organism. Environmental Science, Biology·ASTM Special Technical Publications. 1980, 205-215.
|
| [29] |
Zeng ZQ, Shan T, Tong Y et al. Development of estrogen-responsive transgenic medaka for environmental monitoring of endocrine disrupters. Environmental Science & Technology, 2005, 39(22): 9001-9008. DOI:10.1021/es050728l |
| [30] |
Reinbold KA. Effects of the synergist piperonyl-butoxide on toxicity and metabolism of pesticides in green sunfish (Lepomis cyanellus Rafinesque). Illinois Urbana-Champaign: University of Illinois at Urbana-Champaign, 1974.
|
| [31] |
Kennedy HD, Eller LL, Walsh DF. Chronic effects of methoxychlor on bluegills and aquatic invertebrates. U.S. Fish and Wildlife Service, 1970, 53: 18. |
| [32] |
Baer KN, Owens KD. Evaluation of selected endocrine disrupting compounds on sex determination in Daphnia magna using reduced photoperiod and different feeding rates. Bulletin of Environmental Contamination and Toxicology, 1999, 62(2): 214-221. DOI:10.1007/s001289900862 |
| [33] |
Merna JW, Eisele PJ. The effects of methoxychlor on aquatic biota. Washington: U.S. EPA, 1973: 59.
|
| [34] |
Liu DHW, Lee JM. Toxicity of selected pesticides to the Bay Mussel (Mytilus edulis). Corvallis: U.S. EPA, 1975, 102.
|
| [35] |
Sikka HC, Butler GL, Rice CP. Effects, uptake, and metabolism of methoxychlor, mirex, and 2, 4-D in seaweeds. Gulf Breeze: U.S. EPA, 1976, 39.
|
| [36] |
Chen ZF, Wen HB, Dai XX et al. Contamination and risk profiles of triclosan and triclocarban in sediments from a less urbanized region in China. Journal of Hazardous Materials, 2018, 357: 376-383. DOI:10.1016/j.jhazmat.2018.06.020 |
| [37] |
Zhang ZL, Hong HS, Zhou JL et al. Fate and assessment of persistent organic pollutants in water and sediment from Minjiang River Estuary, Southeast China. Chemosphere, 2003, 52(9): 1423-1430. DOI:10.1016/S0045-6535(03)00478-8 |
| [38] |
Wang B, Yu G, Huang J et al. Tiered aquatic ecological risk assessment of organochlorine pesticides and their mixture in Jiangsu reach of Huaihe River, China. Environmental Monitoring and Assessment, 2009, 157(1): 29-42. DOI:10.1007/s10661-008-0512-2 |
| [39] |
Xia F, Hu XX, Han ZH et al. Distribution characteristics of organochlorine pesticides in surface water from the Huangpu River. Research of Environmental Sciences, 2006, 19(2): 11-15. [夏凡, 胡雄星, 韩中豪等. 黄浦江表层水体中有机氯农药的分布特征. 环境科学研究, 2006, 19(2): 11-15. DOI:10.13198/j.res.2006.02.25.xiaf.003] |
| [40] |
Xue ND, Xu XB, Jin ZL. Screening 31 endocrine-disrupting pesticides in water and surface sediment samples from Beijing Guanting reservoir. Chemosphere, 2005, 61: 1594-1606. DOI:10.1016/j.chemosphere.2005.04.091 |
| [41] |
Hu XX, Xia DX, Han ZH et al. Distribution characteristics and fate of organochlorine pesticide in water-sediment of Suzhou River. China Environmental Science, 2005, 25(1): 124-128. [胡雄星, 夏德祥, 韩中豪等. 苏州河水及沉积物中有机氯农药的分布与归宿. 中国环境科学, 2005, 25(1): 124-128. DOI:10.3321/j.issn:1000-6923.2005.01.028] |
| [42] |
Tang JJ, Liu XY, Zhan ZW et al. Ecological risk assessment of organochlorine pesticides OCPs in water of Liuxi River. Acta Scientiae Circumstantiae, 2014, 34(10): 2709-2717. [汤嘉骏, 刘昕宇, 詹志薇等. 流溪河水体有机氯农药的生态风险评价. 环境科学学报, 2014, 34(10): 2709-2717. DOI:10.13671/j.hjkxxb.2014.0639] |
| [43] |
Chen C, Li TT, Zou WB et al. Spatial distribution and sources of organochlorine pesticides in surface waters of Shanghai, China. SN Applied Sciences, 2020, 2(10): 1-11. DOI:10.1007/s42452-020-03507-2 |
| [44] |
Hu XX, Han ZH, Zhou YK et al. Distribution of organochlorine pesticides in surface sediments from Huangpu River and its risk evaluation. Environmental Science, 2005, 26(3): 44-48. [胡雄星, 韩中豪, 周亚康等. 黄浦江表层沉积物中有机氯农药的分布特征及风险评价. 环境科学, 2005, 26(3): 44-48. DOI:10.13227/j.hjkx.2005.03.010] |
| [45] |
Liu GM, Li JCZ, Yin LL et al. Distribution characteristics of organochlorine pesticides in surface and vertical sediments from the Zha Long Wetland, China. Environmental Science and Pollution Research, 2012, 19: 2681-2689. DOI:10.1007/s11356-012-0762-y |
| [46] |
Wang T, Huang J, Yu G. Source apportionment of polychlorinated biphenyls and organochlorine pesticides in surface sediments of Haihe. China Environmental Science, 2009, 29(7): 722-726. [王泰, 黄俊, 余刚. 海河河口表层沉积物中PCBs和OCPs的源解析. 中国环境科学, 2009, 29(7): 722-726. DOI:10.3321/j.issn:1000-6923.2009.07.010] |
| [47] |
Tao YQ, Xue B, Yao SC. Sedimentary records of historical occurrence and sources of 21 organochlorine pesticides in Lake Taihu, China. Journal of Soils and Sediments, 2020, 20(2): 1026-1033. DOI:10.1007/s11368-019-02429-w |
| [48] |
Chen F, Tang FL, Xu JF et al. Residue characteristics and ecological risk assessment of organochlorine pesticide(OCPs) in the surface sediments of Lake Qiandao. J Lake Sci, 2014, 26(4): 593-599. [陈峰, 唐访良, 徐建芬等. 千岛湖表层沉积物中有机氯农药的残留特征及生态风险评价. 湖泊科学, 2014, 26(4): 593-599. DOI:10.18307/2014.0414] |
| [49] |
Liang YP, Chen GN, Zeng HH et al. Characteristics and risk assessment of organochlorine pesticide residues in surface sediments collected at the Qingshitan Reservoir. Toxicological & Environmental Chemistry, 2016, 98(5/6): 658-668. DOI:10.1080/02772248.2015.1133384 |
| [50] |
Li CW, Xu YA, Song WW. Pollution characteristics and risk assessment of typical antibiotics and persistent organic pollutants in reservoir water sources. Water, 2023, 15(2): 259. DOI:10.3390/w15020259 |
| [51] |
Chen YQ, Wang LF, Hu XD et al. Characteristics and risk assessment of persistent organic pollutants in representative drinking water sources in Jiangsu Province. Jiangsu Water Resources, 2020, 278(4): 1-9. [程逸群, 王龙飞, 胡晓东等. 江苏省代表性水源地持久性有机污染物污染特征及风险评价. 江苏水利, 2020, 278(4): 1-9.] |
| [52] |
Chen CS. Ecological risk assessment for aquatic species exposed to contaminants in Keelung River, Taiwan. Chemosphere, 2020(4): 1-9. |
 2024, Vol. 36
2024, Vol. 36 

