(2: 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072)
(3: 黑龙江流域渔业生态省野外科学观测研究站, 哈尔滨 150070)
(4: 农业农村部黑龙江流域渔业生态环境监测中心, 哈尔滨 150070)
(2: National Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: Heilongjiang River Basin Fisheries Ecology Observation and Research Station of Heilongjiang Province, Harbin 150070, P. R. China)
(4: Heilongjiang River Basin Fishery Ecological Environment Monitoring Center, Ministry of Agriculture and Rural Affairs, Harbin 150070, P. R. China)
次级生产力是动物或异养微生物在特定时期基于自身繁殖和生长而储存或积累的能量,研究次级生产力可表征生物种群密度、生物量、繁殖率、生活史及捕食作用[1]。底栖动物作为食物链的中间环节,其次级生产力则是监测栖息地能量流动的重要工具[2]。另一方面,底栖动物迁移能力有限,对环境变化的响应灵敏,其次级生产力受环境因子的作用机制可揭示栖息地生态系统与外源环境的关系[3]。发展至今,世界范围内对于淡水底栖动物次级生产力的研究主要集中于河流生态系统,而对于湖库型水体,尤其是北方大型湖泊的关注相对有限[4-5]。
连环湖是由第四纪冰川后期地形沉积和风蚀侵袭而形成的冲击型平原内陆浅水湖,枯水期时湖泊内部由高大禾草及小型岛屿分隔,分化成18个独立的小型湖泊,丰水期时18个湖泊水域相通,形成具备城市供水、候鸟栖息、调节气候、旅游度假等多种综合功能的大型湖泊[6-7]。同时,连环湖具有较高的渔业经济价值,盛产鳜(Siniperca chuatsi)、鳙(Aristichthys nobilis)、大银鱼(Protosalanx hyalocranius)等多种经济鱼类[8]。近年来,伴随农业生产(耕地覆盖率)活动加剧和城镇化(人造地表覆盖率)发展扩张,连环湖周边农业、畜牧业及旅游业高速兴起,而土地利用和水环境因子已被公认为是影响湖泊生态系统的关键因素,如农业生产和城镇建设比重的增加是导致水体营养富集、湖泊生境破碎化、生物多样性退化的常见原因[9]。以往长期研究表明连环湖水体呈富营养化状态,其生态环境和结构功能已受到潜在威胁,这是以连环湖为代表的中国湖泊面临的关键生态问题[6-7, 10-12]。
作为中国北方重要的平原型碱水湖泊,有关连环湖的报道仅集中于岩心沉积物和浮游生物等方面,且以往研究只在一两个小湖展开[10-11]。而系统性的生态调查或底栖动物次级生产力方面的分析鲜有报道。在此背景下,本研究基于2020年连环湖13个主要湖泊的底栖动物、土地利用和水环境因子调查数据,采用主成分分析确定环境因子的时空变化,根据Brey经验公式分析底栖动物次级生产力和P/B值的时空分布,并基于通径分析和典范对应分析确定驱动次级生产力变化的关键环境因子,拟丰富底栖动物次级生产力在湖泊生态系统中的研究,以期为连环湖底栖动物资源合理的开发利用及其生态环境质量的监测提供科学依据。
1 材料与方法 1.1 研究区域连环湖(46°30′~46°50′N,123°59′~124°15′E)位于中国黑龙江省大庆市杜尔伯特县,地处松嫩沉降盆地中心最洼处,系构造断陷形成,为中国北方典型的沉降湖泊群[8]。湖泊平均深度2.14 m,最大深度4.6 m,集水面积580 km2。连环湖流域属北温带大陆性气候区,年平均气温4℃,冰封期长达165天,年平均降水量400 mm,其中70% 发生在6—8月,3—5月干燥少雨,伴有频繁的大风天气[11]。除大气降水补给外,汇入湖区的天然河流还包括乌裕尔河、双阳河和嫩江支流托力河[13]。本研究于连环湖设立34个采样点,覆盖位于连环湖上、中、下游的13个主要湖泊(图 1)。
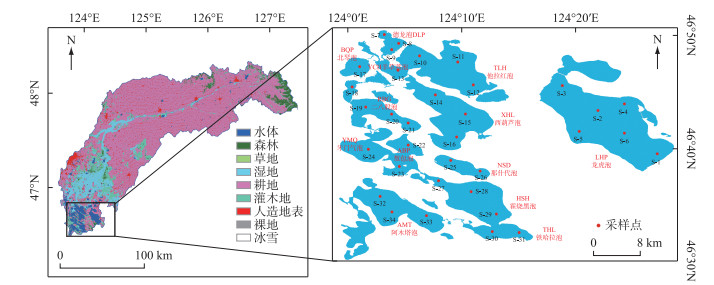
|
图 1 连环湖流域土地利用类型、采样点分布及湖泊编号 Fig.1 Distribution of land use types, sampling sites and lake numbering in the Lake Lianhuan Group watershed |
2020年春季(6月)、夏季(8月)、秋季(10月)于各采样点使用改良的1/16 m2的Perterson's采泥器对底栖动物进行定量采集,底泥使用425 μm分样筛冲洗,后于湖岸边及湖泊相连沟渠使用D型抄网对底栖动物进行定性采集,将拣出的底栖动物用5% 的甲醛溶液固定后带回实验室,再用75% 的乙醇溶液保存。在实验室内采用体视显微镜(ZEISS,德国)和显微镜(Echo,美国)进行种类鉴定,所有样品尽量鉴定至最低分类单元,后采用滤纸吸取体表贮存液,置于万分之一电子天平进行称重(软体动物去壳)并记录个体数。
1.3 环境因子的测定采用5 L有机玻璃采水器采集表层(0.5 m深)和底层(离底0.5 m)两处混合水样,使用YSI Professional plus(Xylem,美国)现场测定电导率(CON)、水温(WT)、溶解氧(DO)和pH;使用SM-5A测深仪(SpeedTech,美国)测定水深(WD);总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)和高锰酸盐指数(CODMn)参照国标法测定[14];叶绿素a(Chl.a)和悬浮物(SS)分别采用90% 丙酮萃取法和称重法测定。
土地利用数据来源为GlobeLand30网站(www.globallandcover.com),数据集包含2020年连环湖流域地表覆盖类型(30 m分辨率),采用ArcGIS(ver. 10.7)计算每个湖泊周围300 m半径土地利用情况,获取缓冲区内土地利用类型覆盖百分比,主要包含6类:耕地、林地、草地、湿地、裸地和人造地表(附表Ⅰ)。
1.4 数据处理底栖动物的优势种采用相对重要性指数(IRI)确定[15], 公式为:
| $ I R I=(W+N) \times F $ | (1) |
式中,W为某物种生物量占总生物量的百分比;N为某物种密度占总密度的百分比;F为某物种的出现频率。优势种IRI值>1000,重要种IRI值为100~1000。
底栖动物次级生产力的计算采用Brey经验公式[16]:
| $ \lg P=-0.4+1.007 \lg B-0.27 \lg W $ | (2) |
式中,P为各采样点不同物种次级生产力(g/(m2 ·a));B为各采样点不同物种去灰干重(AFDW)生物量(g/m2),软体动物去壳后以5 ∶1作为湿重(g/m2)转化为干重的比例,其余物种直接进行转化,以10 ∶9作为干重转化为去灰干重的比例;W 为各采样点不同物种个体去灰干重(g),公式为:
| $ W=B/A $ | (3) |
式中,A 为各采样点不同物种栖息密度(ind/m2)。为便于计算,合并公式(2)、(3)为:
| $ P=A^{0.27} \times B^{0.737}/10^{0.4} $ | (4) |
采用ArcGIS进行反距离权重法空间插值处理绘制次级生产力和P/B值的空间分布图。基于底栖动物纲级分类单元,对次级生产力和P/B值进行结构分析,由于昆虫纲中摇蚊科生态指示意义较为特殊,将摇蚊科单独列为1类,将出现频次较低的蛭纲与其他昆虫合并为其他类群。
采用SPSS(ver. 17.0)进行基于多元逐步线性回归的通径分析,筛选出对底栖动物年均次级生产力影响显著(P < 0.05)的环境因子,并确定其直接作用和间接作用。分析前,对年均次级生产力进行正态性检验及对数转化以校正[17]。
采用R(ver. 4.0.5)[18]中的“ade4”包进行主成分分析(PCA),明确土地利用和水环境因子的时空变化。采用“vegan”包对3季底栖动物次级生产力进行去趋势对应分析(DCA),各季节DCA最长排序轴均大于4,故采用典范对应分析(CCA)以确定不同季节影响底栖动物次级生产力的环境因子,基于方差膨胀因子法(VIF)剔除共线性较高(VIF值>20)的环境因子,采用基于最高adjusted R2(Radj2)的前项选择法筛选对底栖动物次级生产力具有显著影响(P < 0.05)的环境因子。分析前,对次级生产力进行Hellinger转化,将环境因子(除pH)进行lg(x+1)转化。
2 结果与分析 2.1 环境因子的时空变化检验发现各湖泊水环境因子方差非齐次,采用Kruskal-Wallis(非参数检验)检验不同湖泊水环境因子的差异并比较不同湖泊土地利用覆盖类型。结果表明,不同湖泊水环境因子差异较大(P < 0.05),龙虎泡及西葫芦泡、那时代泡、牙门气泡和二八股泡等连环湖中下游湖区,处于较高的营养水平和污染水平,TP浓度和CON较高,而土地利用类型以耕地为主,覆盖率已超过50% (51%~77%)。德龙泡、北琴泡和羊草蒿泡等连环湖上游湖区,营养水平(NH3-N)、污染水平(CON)和悬浮物(SS)均相对较低,而土地利用类型以湿地为主(65%~88%)(附表Ⅰ)。连环湖环境因子的PCA分析(图 2)显示,第1排序轴的方差解释率为21.3%,其与CON、NO2--N、pH、SS、TP、耕地、人造地表呈显著正相关,与湿地和TN呈显著负相关,该轴具备明显的空间梯度,从根本上区分了连环湖上游德龙泡、北琴泡、羊草蒿泡与连环湖中下游湖区及东部的龙虎泡。第2排序轴的方差解释率为14.6%,其与Chl.a、WT、pH、CODMn呈显著正相关,与NO3--N呈显著负相关,该轴具备明显的时间梯度,从根本上区分了夏季与秋季的环境因子。
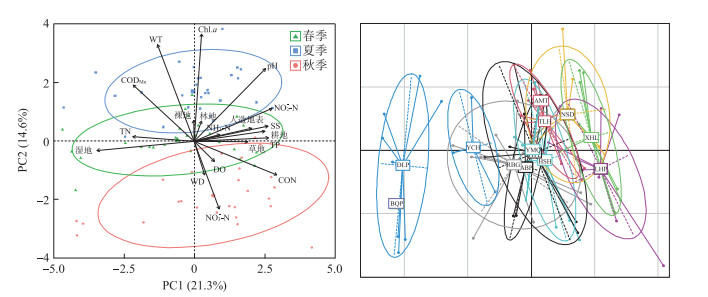
|
图 2 连环湖各湖泊环境因子的主成分分析排序图 Fig.2 Principal component analysis sequencing diagram of environmental factors for each lake in Lake Lianhuan Group |
调查期间,共采集底栖动物32科56属75种。昆虫纲种类数最多,共50种,占总物种数的66.67%。其中摇蚊幼虫15种,占昆虫纲物种数的30.00%;腹足纲次之,共12种,占总物种数的16.00%;双壳纲和寡毛纲均4种,分别占总物种数的5.33%;蛭纲共3种,占总物种数的4.00%;甲壳纲最少,共2种,占总物种数的2.67%。在所有底栖动物中,出现频率超过10% 的种类以昆虫纲和腹足纲为主,其中摇蚊幼虫共8种,占总数的50%。前突摇蚊属1(Procladius sp.1)全湖平均密度最高,为18 ind./m2。背角无齿蚌(Anodonta woodiana)全湖平均生物量最高,为0.28 g/m2。前突摇蚊属1为第一优势种属(附表Ⅱ)。
2.3 大型底栖动物次级生产力的时空分布次级生产力在空间和季节上存在差异(图 3),春、夏、秋季平均次级生产力分别为5.65、6.06和4.31 g/(m2 ·a)。从空间尺度分析,春季次级生产力主要集中于东北部湖区,其中北琴泡(S-17)最高,为20.37 g/(m2 ·a),龙虎泡次级生产力集中于湖心区(S-2),为4.34 g/(m2 ·a);夏季次级生产力分布逐渐向各湖区扩散,而龙虎泡次级生产力偏低,为0.41 g/(m2 ·a);秋季次级生产力主要集中于西北部及东南部湖区,但最高值出现在龙虎泡东北部(S-4),为14.08 g/(m2 ·a)。P/B值的分布情况与次级生产力不同,春、夏、秋季平均P/B值分别为2.74、2.55和2.40 a-1。春季P/B值主要集中于东部湖区,龙虎泡南部(S-6)P/B值最高,为4.28 a-1;夏季P/B值的分布由东部向西部逐渐扩散,龙虎泡P/B值集中于南部(S-5),为3.13 a-1;秋季P/B值由东部向西部逐渐于各湖区扩散完全,龙虎泡P/B值集中于南部(S-6),为3.31 a-1。
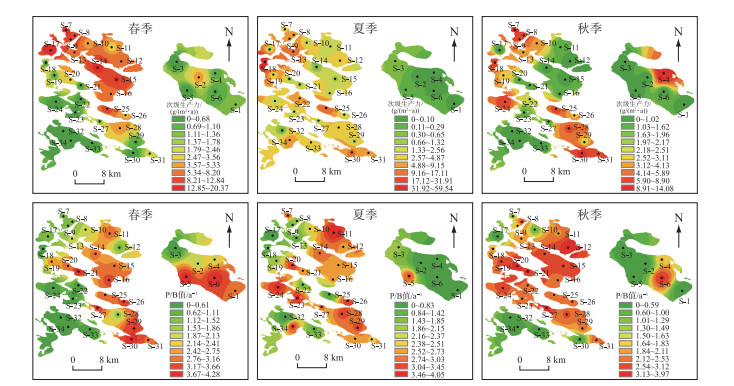
|
图 3 连环湖大型底栖动物次级生产力和P/B值的时空分布 Fig.3 Temporal and spatial distribution of secondary productivity and P/B ratio of macroinvertebrates in Lake Lianhuan Group |
次级生产力和P/B值的结构于不同季节不同湖泊存在差异(图 4)。春季次级生产力主要由腹足纲(49.90%)构成,寡毛纲(1.32%)占比最小;进入夏季后双壳纲(50.46%)取代腹足纲(24.87%)次级生产力的主导地位,甲壳纲(12.69%)同时出现;秋季对次级生产力贡献最高的依旧为双壳纲(51.34%),寡毛纲(13.05%)占比逐渐提高。摇蚊幼虫于各湖泊间均有分布,其次级生产力主要贡献于西葫芦泡(87.42%)、牙门气泡(96.71%)等连环湖中部湖区;腹足纲次级生产力主要贡献于他拉红泡(68.13%)、北琴泡(93.67%)、二八股泡(92.89%)和敖包泡(57.65%)等连环湖北部湖区;双壳纲次级生产力主要贡献于那时代泡(64.83%)、霍烧黑泡(41.91%)和铁哈拉泡(59.00%)等连环湖东南部湖区;寡毛纲次级生产力主要集中于龙虎泡(57.80%),而甲壳纲仅出现于阿木塔泡(39.24%)。腹足纲和摇蚊幼虫P/B值随季节的推移呈先升后降的趋势,其最大值出现在霍烧黑泡和龙虎泡,分别为2.57和3.51 a-1;寡毛纲和双壳纲P/B值随季节的推移逐渐降低,其最大值出现在铁哈拉泡和霍烧黑泡,分别为3.99和1.15 a-1。
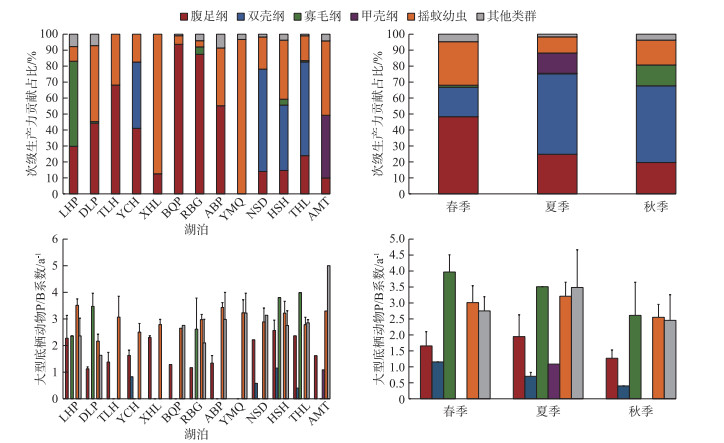
|
图 4 连环湖大型底栖动物次级生产力和P/B值结构的时空分布 Fig.4 Temporal and spatial distribution of secondary productivity and P/B ratio structure of macroinvertebrates in Lake Lianhuan Group |
基于多元逐步线性回归法,以底栖动物年均次级生产力为因变量,各环境因子为自变量进行通径分析(表 1),于19个环境因子中确定了人造地表、pH和Chl.a 3个对年均次级生产力存在显著影响的环境因子(P < 0.05)。各环境因子对年均次级生产力直接作用的大小依次为:pH(-0.410)>人造地表(-0.342)>Chl.a(0.272),其中人造地表和pH对年均次级生产力的直接作用为负向效应。各环境因子间接作用的大小依次为:Chl.a(-0.243)>人造地表(-0.066)>pH(0.044),其中Chl.a和人造地表对年均次级生产力的间接作用为负向效应。
| 表 1 环境因子对大型底栖动物年均次级生产力的通径分析 Tab. 1 Path analysis of environmental factors on average annual secondary productivity of macroinvertebrates |
环境因子对底栖动物年均次级生产力的决定系数存在差异(表 2),单个环境因子中pH(0.168)对年均次级生产力的决定系数最大,人造地表(0.117)次之,Chl.a(0.074)最小。在两个环境因子的联合作用下,pH和Chl.a对年均次级生产力的共同决定系数最大,而pH通过Chl.a对年均次级生产力的间接作用为0.130,Chl.a通过pH对年均次级生产力的间接作用为-0.196,二者之和为负,因此pH和Chl.a联合作用时对年均次级生产力产生抑制作用。
| 表 2 环境因子对大型底栖动物年均次级生产力的决定系数 Tab. 2 Determinants of environmental factors on average annual secondary productivity of macroinvertebrates |
CCA分析结果表明,环境因子与底栖动物次级生产力相关性显著且不同季节对次级生产力产生显著影响(P < 0.05)的环境因子不同(图 5)。春季前两轴解释了物种-环境关系变异的77.29%,各环境因子对次级生产力数据变异解释能力的高低依次为湿地(8.77%)、TP(4.77%)和CON(4.38%)(P < 0.01),前突摇蚊(Procladius sp.)和长跗摇蚊(Tanytarsus sp.)受CON影响较大,水丝蚓(Limnodrilus sp.)主要受TP的影响,纹沼螺(Parafossarulus manchouricus)受湿地占比的影响更大;夏季前两轴解释了物种-环境关系变异的72.08%,各环境因子对次级生产力数据变异解释能力的高低依次为TP(2.82%)、NH3-N(2.78%)和CON(2.12%)(P < 0.05),水丝蚓受TP影响较大,前突摇蚊、壳粗腹摇蚊(Conchapelopia sp.)主要受NH3-N的影响,长跗摇蚊受CON的影响更大;秋季前两轴解释了物种-环境关系变异的82.46%,NO3--N、TP和林地是显著影响(P < 0.05)次级生产力分布的环境因子且对次级生产力数据变异的解释能力相近,这3个环境因子共解释了10.87% 的次级生产力数据变异(Radj2=0.1087)。
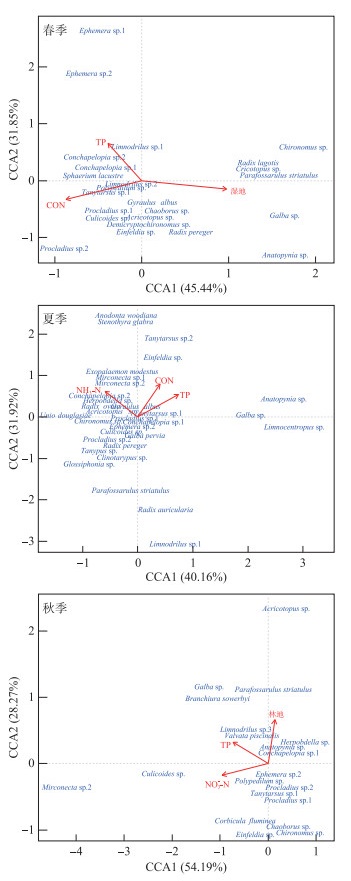
|
图 5 大型底栖动物次级生产力与环境因子的典范对应分析 Fig.5 Canonical correspondence analysis between macroinvertebrate secondary productivity and environmental factors |
历史上,有关连环湖底栖动物的调查报道相对有限,仅有1998年出版的《中国湖泊志》记载,连环湖底栖动物41种,以蚌类为主,螺类较少[13]。本研究2020年于连环湖采集底栖动物75种,其中水生昆虫种类数最多,软体动物次之,与其他平原型碱水湖泊底栖动物的群落特征基本一致[19],但与以往报道相比主要存在两大变化:1)底栖动物物种数有所增加;2)底栖动物逐渐由以蚌类为主向水生昆虫如摇蚊幼虫等小个体种类为主转变。产生此种现象的原因可能与研究的采集方式和湖泊的营养水平有关,本研究于湖泊相连沟渠进行定性采集获取部分河道型底栖生物,此外已有众多研究表明连环湖水体呈富营养化状态[1-2, 4-5],本次调查以TP、TN、CODMn和Chl.a构建综合营养状态指数TLI(∑)=53.14,也表明连环湖处于轻度富营养化状态,栖息水域营养水平的提升促使底栖动物趋于简单化演替,逐渐以耐污能力较强的小型机会种为主导[20]。相对重要性指数也表明优势种和重要种以生态位较宽的摇蚊幼虫和腹足纲中的前鳃亚纲为主[21],一般认为,摇蚊幼虫如前突摇蚊、长跗摇蚊、壳粗腹摇蚊等对富营养化和环境污染有较强的耐受性,而前鳃亚纲具备腮、厣又以有机碎屑和着生藻类为食,也具备较强的生存能力[22]。前突摇蚊为第一优势种属,该种属摇蚊幼虫为富营养化湖泊常见种,但也有部分种类分布于非富营养化水体中,结合连环湖富营养化状态的背景,第一优势种的形成可能与湖泊富营养化有关,而致使其分布优势度较高的主要影响因素还有待进一步确定[23]。
3.2 大型底栖动物次级生产力的时空变化底栖动物次级生产力的时空格局存在较大差异,土地利用及水环境因子的PCA分析也表明连环湖生态环境具有较强的时空异质性。一方面连环湖为多个彼此相连的湖泊形成的湖泊群的统称,空间格局较为复杂,另一方面该流域地处温带大陆季风区,水文条件具有较强的季节性[24],环境因子的时空变化势必对底栖动物次级生产力的时空分布产生影响。从时间尺度分析,底栖动物次级生产力分布情况为夏季>春季>秋季。一定条件下水体温度的提升是提高次级生产力的利好因素[25],夏季连环湖水温较高,水生植物茂盛,不但能为底栖动物提供立体多样化的小生境,还能为某些物种提供食物来源,又能为依附者提供附着基质[26]。春季常伴有大风天气,连环湖湖盆呈圆盘状,强烈的风浪搅动底层有机碎屑和营养物质,导致水体营养盐浓度增加,同时提高溶解氧浓度,促进次级生产力的提高[24]。进入秋季后光照时长变短,水体温度迅速下降,部分底栖动物羽化飞离水面,次级生产力达到最低[8, 27]。次级生产力的结构也由腹足纲为主转向双壳纲占主导地位,这可能与不同类群底栖动物的繁殖周期有关,腹足纲繁殖季节主要在3—9月,双壳纲繁殖季节以4—10月为主,不同类群的生殖发育是影响次级生产力及其结构变化的重要因素之一[28]。从空间尺度来看,北琴泡、羊草蒿泡和德龙泡均为次级生产力分布的主要湖区,这3个湖区位于连环湖上游河口,水源补给首先汇入,携带泥沙和有机质冲击,水域整体交换速率加快,生境异质性较强,此外PCA分析也将这3个湖区与其他湖区划分开,其缓冲区内土地类型区别于其他湖区,以自净效能较高的湿地为主(覆盖率为65%~88%)[29]。位于杜尔伯特县和连环湖镇之间的龙虎泡次级生产力整体偏低,其缓冲区内耕地利用类型达51%,受人类活动的干扰较为强烈,虽秋季次级生产力以龙虎泡东北部(S-4)最高,但苏氏尾鳃蚓(Branchiura sowerbyi)和水丝蚓贡献度为58.11%,此类生物常于污染水体大量孳生[30],这表明龙虎泡的生态环境存在逐渐恶化的趋势,底栖动物正处于退化阶段。他拉红泡次级生产力随着季节的迁移呈现由西向东逐渐递减的趋势,这主要是因为其西部与生境较好的羊草蒿泡汇通,但东部已开发以旅游业为主的连环湖温泉景区,水上及沿岸娱乐设施的建造势必改变他拉红泡东部的水文形态和底质类型,进而对底栖动物次级生产力形成威胁[31]。值得注意的是,夏季丰水期各湖区底栖动物次级生产力分布相对均匀,主要存在两种机制作用于此现象:1)丰水期内各湖区水文连通性加强,湖区间水环境因子的差异逐渐缩小,对底栖动物次级生产力的影响趋于统一;2)各湖区水域交互能力提高,水生生物通过水道实现湖区间迁移,促进了底栖动物的分布和扩散[32]。秋季与春季次级生产力分布的差异表现为其不仅集中于上游河口,下游河口也存在集中分布的现象,次级生产力较高的湖区主要分布纹沼螺(Parafossarulus manchouricus)、萝卜螺(Radix sp.)、河蚬(Corbicula fluminea)等软体动物。全秋梅等[3]认为软体动物或体质量较高的物种是提供底栖动物次级生产力的关键。从水动力角度来看,河口较高的水体流速会冲刷泥沙保留砾石底质,营造稳固的基底环境,为腹足纲、双壳纲等软体动物的锚定和埋栖提供有利的生存条件[33-34]。
3.3 大型底栖动物P/B值的时空变化P/B值为次级生产力与生物量之比,可反映生态群落世代更替速度及新陈代谢高低[35]。各类底栖动物P/B值的大小依次为:寡毛纲>摇蚊幼虫>腹足纲>甲壳动物>双壳纲。一般认为小个体底栖生物发育速度快,繁殖周期短,对环境污染的耐受性较强,P/B值也相对较高[36]。连环湖P/B值随着季节的推移呈现由东向西逐渐增加的趋势,这表明底栖动物群落由东向西逐渐向耐污能力较强的小型机会种演替,产生此现象的原因可能与人为活动的干扰有关,连环湖东部为杜尔伯特县和连环湖镇,土地利用类型以耕地为主,畜牧养殖和农业活动较为发达,当地农民倾向引用湖水进行农田浇灌,雨水淋溶、地表径流及湖水倒灌极易裹挟残留的化肥和农药直接进入湖区引发面源性污染[24],而连环湖西南、西北部土地利用类型以草地及湿地为主,生态环境相对原始,受人类活动影响较小。从时间尺度来看,底栖动物P/B值分布情况为春季>夏季>秋季。一般认为底栖动物P/B值随水温的升高而增加[37],Benke[38]也认为多数水生昆虫P/B值与水温呈正相关,连环湖摇蚊幼虫等水生昆虫P/B值的季节分布符合上述推论。但刘勇等[39]指出底栖动物P/B值与水温呈正相关并不是刚性结论。本研究也发现连环湖底栖动物P/B值并未在水温较高的夏季达到最大值,而是随季节变迁逐渐降低,这也表明连环湖底栖动物的发育速度及新陈代谢正处于下降阶段。《大水面增养殖容量计算方法》(SC/T 1149—2020)指出,东北地区底栖动物P/B值为2~5 a-1,连环湖年均P/B值为2.56 a-1,在其范围之内,基于经验公式也可确定连环湖底栖动物为2年一代[36]。
3.4 大型底栖动物次级生产力与环境因子的关系通径分析和CCA分析均表明,底栖动物次级生产力受土地利用和水环境因子的显著影响(P < 0.05),且不但影响年均与季节次级生产力的环境因子存在差异,不同季节间影响次级生产力的环境因子也不同。pH对年均次级生产力的负向效应直接作用最大、决定系数最高,这与连环湖高盐碱的土地类型及水体常年介于较高的pH(8~10)状态有关[24, 40],高碱度水体不仅影响底栖动物的新陈代谢和生长发育,甚至会对其直接产生毒害作用[41-42]。此外,pH对水体中高效营养盐的循环存在重要影响,pH的升高会促进底泥中无机磷的活化释放,栖息在湖泊底部的底栖动物首先受到威胁[43]。Chl.a与pH的共同决定系数及间接作用均对年均次级生产力产生较大的负面影响。理论上,Chl.a能促进藻类生物的光合作用,提高初级生产力,拓宽滤食性底栖动物的食物来源,Chl.a对年均次级生产力的直接作用为正向效应也支持了这一观点,但浮游植物的光合作用占绝对优势时,会打破碳酸盐可逆的动态平衡,其通过还原CO2合成有机物,导致pH的升高,从而间接抑制底栖动物次级生产力[44]。人造地表的直接、间接作用均对年均次级生产力产生显著的抑遏影响,其作为人类活动的量化指标,是城镇化在土地利用上的直接体现,这也阐明了连环湖周边城镇化建设对底栖动物次级生产力形成负面作用。CCA表明虽影响次级生产力的环境因子于不同季节间存在差异,但TP和CON的影响作用分布于2个及2个以上的季节。一般认为TP浓度是衡定湖泊富营养化程度的关键指标[45],而CON则是表征水体受人为活动污染的重要变量[46],苏氏尾鳃蚓、水丝蚓等寡毛类次级生产力主要集中于TP、CON附近(图 5),表明连环湖受人为活动的干扰存在一定的水质污染,较高的磷浓度及离子浓度促使水体富营养化的形成,致使次级生产力结构向耐污类群演变,且以上作用不受季节因素的限制[30]。此外,PCA表明TP、CON与耕地、人造地表呈显著正相关,进一步揭示了人为活动如农业生产等主要通过改变水体营养水平及离子浓度间接影响底栖动物[7, 9]。春季与秋季对次级生产力产生显著影响的土地类型不同,其由湿地转变为林地,这可能与连环湖的水文特征及陆岸植被的季节性变换有关[24],虽有差异但湿地及林地附近主要以鱼盘螺(Valvata piscinalis)、纹沼螺(Parafossarulus manchouricus)等排序,此类现象与湿地、林地受人类干扰的影响相对较小有关外,腹足纲更倾向于陆岸植被茂盛的水域分布也是重要影响因素之一[26]。
4 结论在连环湖共发现底栖动物75种,以昆虫纲最多,腹足纲次之,优势种及重要种以耐污类群为主。土地利用及水环境因子具备明显的时空梯度,相应的底栖动物次级生产力和P/B值也存在明显的时空变化。缓冲区内耕地、人造地表与TP、CON、pH、SS和NO2--N呈显著正相关,其中pH、人造地表和Chl.a是影响年均底栖动物次级生产力的关键环境因子, TP和CON是影响不同季节底栖动物次级生产力的重要环境变量。连环湖流域内农业生产(耕地)和城镇建设(人造地表)的增加是其呈富营养化状态的重要原因,且此现象已对底栖动物次级生产力形成威胁。
土地利用和水环境因子对底栖动物次级生产力的影响是一个长期积累的过程。本研究仅覆盖春、夏、秋3个季节且未涉及连环湖所有湖泊。因此,本研究具有一定的时空局限性。对于连环湖这种受人类活动影响严重的湖泊来讲,如何制定合理的湖泊管理方案,仍需长期系统性监测。未来应通过控制农业面源污染、秸秆腐熟还田、鼓励粪便施肥、科学规划用地等措施改善连环湖流域的生态环境,以促进底栖动物资源合理的开发利用。
5 附录附表Ⅰ和Ⅱ见电子版(DOI: 10.18307/2024.0332)。
| 附表Ⅰ 连环湖13个湖泊的形态特征、土地利用和水环境因子* Appendix Ⅰ Morphological characteristics, land use and water environment factors from 13 lakes of Lake Lianhuan Group |
| 附表Ⅱ 连环湖大型底栖动物种类组成、密度、生物量、出现频率和IRI指数 Appendix Ⅱ The species composition, density, biomass, frequency and IRI index of macroinvertebrates in Lake Lianhuan Group |
| [1] |
Fang PF, Zhang SS, Bao YX et al. Secondary productivity of macrobenthos in Tianhe intertidal zone of Wenzhou, Zhejiang Province of East China. Chinese Journal of Ecology, 2013, 32(1): 106-113. [方平福, 章书声, 鲍毅新等. 温州天河潮间带大型底栖动物的次级生产力. 生态学杂志, 2013, 32(1): 106-113.] |
| [2] |
Chu TJ, Sheng Q, Wang SK et al. Spatial variability of macrobenthic secondary production along a creek-order gradient. Journal of Fudan University: Natural Science, 2016, 55(4): 460-470. [储忝江, 盛强, 王思凯等. 沿潮沟级别大型底栖动物群落的次级生产力空间变异. 复旦学报: 自然科学版, 2016, 55(4): 460-470.] |
| [3] |
Quan QM, Xu SN, Xiao YY et al. Secondary productivity of macrozoobenthos in Jiaozhou Bay. Journal of Fishery Sciences of China, 2020, 27(4): 414-426. [全秋梅, 徐姗楠, 肖雅元等. 胶州湾大型底栖动物次级生产力. 中国水产科学, 2020, 27(4): 414-426. DOI:10.3724/SP.J.1145.2010.00667] |
| [4] |
Benke AC. Secondary production as part of bioenergetic theory—Contributions from freshwater benthic science. River Research and Applications, 2010, 26(1): 36-44. DOI:10.1002/rra.1290 |
| [5] |
Li B, Zhang M, Cai QH. Spatial distribution of macrobenthic secondary production of Danjiangkou Reservoir. Asian Journal of Ecotoxicology, 2018, 13(4): 22-29. [李斌, 张敏, 蔡庆华. 丹江口水库底栖动物群落次级生产力空间分布. 生态毒理学报, 2018, 13(4): 22-29. DOI:10.7524/AJE.1673-5897.20180413001] |
| [6] |
Chen X, Li Z, Tang FJ et al. Zooplankton community structure and its relationship with environmental factors in Lianhuan Lake. Journal of Hydroecology, 2020, 41(6): 89-97. [陈昕, 李喆, 唐富江等. 连环湖两水体浮游动物群落结构特征及水质评价. 水生态学杂志, 2020, 41(6): 89-97. DOI:10.15928/j.1674-3075.2020.06.011] |
| [7] |
窦乾明. 连环湖大型底栖动物群落结构及水质生物学评价[学位论文]. 天津: 天津农学院, 2021.
|
| [8] |
Zhao C, Cong YF, Wang L et al. Proliferation effects of artificial fish egg collectors in Lianhuan Lake (Tiehala Lake). Chinese Journal of Fisheries, 2022, 35(5): 56-63. [赵晨, 丛艳锋, 王乐等. 连环湖(铁哈拉泡)人工鱼巢增殖效果研究. 水产学杂志, 2022, 35(5): 56-63. DOI:10.3969/j.issn.1005-3832.2022.05.008] |
| [9] |
Du X, Song D, Ming K et al. Response of macroinvertebrate communities to land use and water quality in Wudalianchi Lake. Ecology and Evolution, 2021, 11(3): 1368-1377. DOI:10.1002/ece3.7140 |
| [10] |
Wu WH, Liu B, Yuan LF. Water quality analysis and composition of plankton from Lianhuan Lake (Huoshaohei Lake). Journal of Anhui Agricultural Sciences, 2012, 40(35): 17130-17133. [吴文化, 刘博, 袁龙福. 连环湖火烧黑泡水质分析与浮游生物组成. 安徽农业科学, 2012, 40(35): 17130-17133. DOI:10.3969/j.issn.0517-6611.2012.35.058] |
| [11] |
Duan MC, Xiao HF. Variation characteristics and pollution assessment in surface sediments from Xiaodong Lake in Lianhuan Lake. Environmental Science and Management, 2015, 40(10): 49-53. [段木春, 肖海丰. 连环湖区域小东湖表层沉积物营养盐变化特征与污染评价研究. 环境科学与管理, 2015, 40(10): 49-53. DOI:10.3969/j.issn.1673-1212.2015.10.012] |
| [12] |
Yu HH, Dong XR, Yu D et al. Effects of eutrophication and different water levels on overwintering of Eichhornia crassipes at the northern margin of its distribution in China. Frontiers in Plant Science, 2019, 10: 1261. DOI:10.3389/fpls.2019.01261 |
| [13] |
王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998.
|
| [14] |
Wang QL. A comparison of rapid water quality testing methods and national standard methods in water quality testing. China Plant Engineering, 2021(4): 167-168. [王青玲. 水质快速检测方法与国标法在水质检测中的应用比较. 中国设备工程, 2021(4): 167-168. DOI:10.3969/j.issn.1671-0711.2021.04.106] |
| [15] |
Pianka ER. Ecology of the agamid lizard Amphibolurus isolepis in Western Australia. Copeia, 1971, 1971(3): 527. DOI:10.2307/1442450 |
| [16] |
Brey T. Estimating productivity of macrobenthic invertebrates from biomass and mean individual weight. Archive of Fishery & Marine Research, 1990, 32(4): 329-343. |
| [17] |
Du JJ, Chen ZW. The method of path analysis using SPSS linear regression. Bulletin of Biology, 2010, 45(2): 4-6. [杜家菊, 陈志伟. 使用SPSS线性回归实现通径分析的方法. 生物学通报, 2010, 45(2): 4-6.] |
| [18] |
Team R. R: A language and environment for statistical computing. Austria: R foundation for statistical computing Vienna, 2018.
|
| [19] |
Long ZY, Sun SJ, Ou Y et al. Characteristics of quality of water environment and macrobenthos community in the 10 shallow lakes in western Jilin Province. Wetland Science, 2018, 16(5): 642-650. [龙振宇, 孙世军, 欧洋等. 吉林省西部10个浅水湖泊水环境质量和大型底栖动物群落特征. 湿地科学, 2018, 16(5): 642-650.] |
| [20] |
Chen J, Shen HL, Zhu TS et al. Macroinvertebrate community structure and its relationships with environmental factors in the Gaoyou Lake, Eastern China. Acta Ecologica Sinica, 2021, 41(16): 6486-6493. [陈静, 申恒伦, 朱天顺等. 高邮湖大型底栖动物群落结构及影响因素. 生态学报, 2021, 41(16): 6486-6493. DOI:10.5846/stxb202005291399] |
| [21] |
Lu WZ, Ren R, Rao X et al. Macrobenthic community structure and influencing factors in urban lakes of the Taihu Lake basin. Journal of Water Ecology, 2022, 43(4): 8-15. [陆文泽, 任仁, 饶骁等. 太湖流域城市湖泊大型底栖动物群落结构及影响因素研究. 水生态学杂志, 2022, 43(4): 8-15.] |
| [22] |
Li MJ, Zhang Y, Zhang Y et al. Effects of littoral zone utilization on benthic macroinvertebrate community structure: A case study of Lake Hongze. J Lake Sci, 2022, 34(6): 2055-2070. [黎明杰, 张又, 张颖等. 湖滨带开发利用对大型底栖动物群落结构的影响: 以洪泽湖为例. 湖泊科学, 2022, 34(6): 2055-2070. DOI:10.18307/2022.0620] |
| [23] |
Ding HY, Ning PF, Zhang Q et al. Spatial distribution of chironomid larvae and water quality assessment in Jianhu Lake. Journal of Hydroecology, 2017, 38(3): 58-65. [丁煌英, 宁鹏飞, 张庆等. 剑湖摇蚊幼虫的空间分布与水质评价. 水生态学杂志, 2017, 38(3): 58-65. DOI:10.15928/j.1674-3075.2017.03.009] |
| [24] |
轩福华. 连环湖流域沉积污染与人类经济活动的耦合关系研究[学位论文]. 哈尔滨: 哈尔滨师范大学, 2013.
|
| [25] |
Gong ZJ, Xie P, Yan YJ. Theories and methods of studies on the secondary production of Zoobenthos. J Lake Sci, 2001, 13(1): 79-88. [龚志军, 谢平, 阎云君. 底栖动物次级生产力研究的理论与方法. 湖泊科学, 2001, 13(1): 79-88. DOI:10.18307/20010112] |
| [26] |
He XB, Liu XQ, Cui YD et al. Benthic communities in different habitats in the coastal zone of Lake Baikal. Journal of Aquatic Biology, 2011, 35(3): 516-522. [何雪宝, 刘学勤, 崔永德等. 贝加尔湖沿岸带不同生境底栖动物群落研究. 水生生物学报, 2011, 35(3): 516-522.] |
| [27] |
Huo TB, Liu MH, Jiang ZF et al. Macrobenthos community structure of macrobenthos and bioassessment of water quality in main stream of Songhua River. Chinese Journal of Applied Ecology, 2012, 23(1): 247-254. [霍堂斌, 刘曼红, 姜作发等. 松花江干流大型底栖动物群落结构与水质生物评价. 应用生态学报, 2012, 23(1): 247-254. DOI:10.13287/j.1001-9332.2012.0040] |
| [28] |
刘月英. 中国经济动物志: 淡水软体动物. 北京: 科学出版社, 1979.
|
| [29] |
Guo Y, Xie HJ, Zhang J. Effects of different benthic fauna on water purification in surface flow constructed wetland system. Acta Hydrobiologica Sinica, 2022, 46(10): 1501-1509. [郭颖, 谢慧君, 张建. 不同类型底栖动物对表面流人工湿地系统水质净化的影响. 水生生物学报, 2022, 46(10): 1501-1509. DOI:10.7541/2022.2022.0145] |
| [30] |
Xia ML, Yu JL, He H et al. Effects of cyanobacterial detritus on water quality and the biomass of periphyton and Limnodrilus spp. in Lake Taihu. J Lake Sci, 2020, 32(4): 1050-1059. [夏曼莉, 于谨磊, 何虎等. 太湖蓝藻碎屑对水质及附着藻和水丝蚓生物量的影响. 湖泊科学, 2020, 32(4): 1050-1059. DOI:10.18307/2020.0414] |
| [31] |
Liu ZG. SWOT analysis on brand strategy construction of lianhuanhu hot spring scenic spot. Market Modernization, 2013(32): 167. [刘志刚. 连环湖温泉景区品牌战略构建SWOT分析. 商场现代化, 2013(32): 167.] |
| [32] |
He ZF, Tong CF. Community composition andspatio-temporal distribution characteristics of benthic macroinvertebrates in Taipu River. Acta Ecologica Sinica, 2023, 43(11): 4619-4631. [贺湛斐, 童春富. 太浦河大型底栖动物群落组成及时空分布特征. 生态学报, 2023, 43(11): 4619-4631. DOI:10.5846/stxb202202060299] |
| [33] |
Liu JM, Ren FH, Yang H. Preliminary study on the ecological characteristic of Rapana venosa (Valenciennes). Fisheries Science, 2003, 22(1): 17-18. [刘吉明, 任福海, 杨辉. 脉红螺生态习性的初步研究. 水产科学, 2003, 22(1): 17-18.] |
| [34] |
Morales Y, Weber LJ, Mynett AE et al. Effects of substrate and hydrodynamic conditions on the formation of mussel beds in a large river. Journal of the North American Benthological Society, 2006, 25(3): 664-676. |
| [35] |
Dolbeth M, Cusson M, Sousa R et al. Secondary production as a tool for better understanding of aquatic ecosystems. Canadian Journal of Fisheries and Aquatic Sciences, 2012, 69(7): 1230-1253. DOI:10.1139/f2012-050 |
| [36] |
Zhou XP, Wu PF, Li Z et al. Spatial and temporal characteristics of macrobenthos secondary productivity in the intertidal zone of Fujian Minjiang Estuary. Marine Bulletin, 2020, 39(3): 342-350. [周细平, 吴培芳, 李贞等. 福建闽江口潮间带大型底栖动物次级生产力时空特征. 海洋通报, 2020, 39(3): 342-350.] |
| [37] |
Brey T, Gerdes D. High Antarctic macrobenthic community production. Journal of Experimental Marine Biology and Ecology, 1998, 231(2): 191-200. DOI:10.1016/S0022-0981(98)00060-4 |
| [38] |
Benke AC. Concepts and patterns of invertebrate production in running waters. SIL Proceedings, 1922-2010, 1993, 25(1): 15-38. DOI: 10.1080/03680770.1992.11900056.
|
| [39] |
Liu Y, Xian WW, Sun SC et al. Primary studies on the biomass abundance and secondary production of macrobenthos in Changjiang Estuary. Periodical of Ocean University of China, 2008, 38(5): 749-756. [刘勇, 线薇薇, 孙世春等. 长江口及其邻近海域大型底栖动物生物量、丰度和次级生产力的初步研究. 中国海洋大学学报: 自然科学版, 2008, 38(5): 749-756.] |
| [40] |
Dou QM, Du X, Cong YF et al. Influence of environmental variables on macroinvertebrate community structure in Lianhuan Lake. Ecology and Evolution, 2022, 12(2): e8553. DOI:10.1002/ece3.8553 |
| [41] |
Wu FL, Xie Z, Lan YW et al. Short-term exposure of Mytilus coruscus to decreased pH and salinity change impacts immune parameters of their haemocytes. Frontiers in Physiology, 2018, 9: 166. DOI:10.3389/fphys.2018.00166 |
| [42] |
Peiffer S, Beierkuhnlein C, Sandhage-Hofmann A et al. Impact of high aluminium loading on a small catchment area (Thuringia slate mining area)—Geochemical transformations and hydrological transport. Water, Air, and Soil Pollution, 1997, 94(3): 401-416. DOI:10.1007/BF02406072 |
| [43] |
Qin BQ. Shallow Lake limnology and control of eutrophication in Lake Taihu. J Lake Sci, 2020, 32(5): 1229-1243. [秦伯强. 浅水湖泊湖沼学与太湖富营养化控制研究. 湖泊科学, 2020, 32(5): 1229-1243. DOI:10.18307/2020.0501] |
| [44] |
Shi HJ, Chen QH, Zhang YT et al. Temporal and spatial variation of DO and pH and their correlation with chlorophyll a in the northern bay of Taihu Lake. Sichuan Environment, 2022, 41(2): 110-117. [施红菊, 陈启慧, 张玉田等. 北部太湖DO、pH时空变化及其与叶绿素a的相关性分析. 四川环境, 2022, 41(2): 110-117.] |
| [45] |
Wang J, Zhang JT, Zan FY et al. Study on sediment TN and TP criteria in eastern shallow lakes, China. Ecology and Environmental Sciences, 2014, 23(6): 992-999. [王健, 张靖天, 昝逢宇等. 中国东部浅水湖泊沉积物总氮总磷基准阈值研究. 生态环境学报, 2014, 23(6): 992-999.] |
| [46] |
Lou XS, Chen AY, Zhang Y et al. Response relationship between conductivity and water quality index of rural domestic sewage in Zhejiang. The Administration and Technique of Environmental Monitoring, 2022, 34(1): 64-67. [楼显盛, 陈安瑶, 张研等. 浙江省农村生活污水电导率与水质指标的响应关系分析. 环境监测管理与技术, 2022, 34(1): 64-67.] |
 2024, Vol. 36
2024, Vol. 36 

