(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
(3: 苏州科技大学地理科学与测绘工程学院,苏州 215009)
(4: 江苏水处理技术与材料协同创新中心,苏州 215009)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
(3: School of Geographic Sciences and Geomatics Engineering, Suzhou University of Science and Technology, Suzhou 215009, P.R.China)
(4: Jiangsu Collaborative Innovation Center for Water Treatment Technology and Materials, Suzhou 215009, P.R.China)
社会发展加速了水体富营养化进程,导致浅水湖泊水柱内藻类过量繁殖,水下光环境急剧恶化,大型沉水植物消失,最终导致生境异质性消失,水生生态系统退化[1]。其中,磷的生物地球化学循环不平衡是湖泊富营养化问题的重要原因[2-3]。前人的研究表明,水柱中磷含量过量是引起水体富营养化的主要原因。近年来,一些研究人员已经认识到大型水生植物能够吸收超过其生长需求的营养物质,即所谓的“超量吸收”现象[4]。在湖泊生态系统中,大型水生植物可以作为营养库富集水体中的氮、磷等营养盐[5]。这表明,大面积的大型水生植物具有削减局部水体营养盐,控制富营养化的潜力[6]。
沉水植物为大型水生植物的重要组成部分,可通过减少风浪引起的底泥再悬浮、过量吸收营养、分泌克藻有机物、保护浮游动物进而增加对浮游植物的捕食等作用来降低水体营养盐浓度维持清水状态[7-8]。沉水植物的根位于沉积物中,具有固定和吸收沉积物中营养盐的作用,茎、叶都可直接对水中的营养盐吸收利用,也能通过其他途径如共沉淀来削减水柱中的氮磷营养盐。沉水植物的这些功能有助于提高水体的自净能力[9-10]。
世界范围内,许多浅水湖泊中观察到溶解的磷与方解石(CaCO3)的共沉淀现象[11-12],这种共沉淀过程被认为是湖水重要的自净机制[13-14]。水生植物吸收二氧化碳(CO2)或碳酸氢根离子(HCO3-)时,导致水体pH值升高,进而使方解石过饱和,形成CaCO3-P的共沉淀[15-16]。Hartley的研究指出,一旦方解石开始沉淀,无机磷便会与之共同沉淀[17]。另外,在一项关于湖泊碳循环的研究中发现,夏季沉水植物的繁盛生长导致上覆水体的碱度降低,而在碳酸钙形成过程中,大量的碳酸钙会导致湖水碱度降低15%~25%[18]。Stewart等的研究指出,水温季节性上升可能会促进沉淀的发生[19]。研究显示菹草叶腹面(上面或近轴面)可产生CaCO3-P共沉淀[20]。
以上研究表明,共沉淀受水环境影响较大,并且很少有研究将CaCO3-P共沉淀与沉水植物生长环境联系起来。菹草(Potamogeton crispus)为眼子菜科多年生沉水植物,广泛分布于湖泊、河流等水体,是我国沉水植物的优势种[21]。本文选取菹草为研究对象,通过模拟实验,系统分析不同水环境因子对菹草在水体中削减磷的影响以及对植物叶面CaCO3-P共沉淀过程的影响。这项研究旨在为自然水体的生态保护与修复提供理论支持。
1 材料与方法 1.1 实验预处理植物选自太湖胥口湾长势良好的菹草群落,菹草采集后用软毛刷清洗表面的附着物,并用去离子水漂洗,再截取若干长约18~20 cm的菹草顶端枝条,控制每段菹草茎叶重量为1 g,置于装有纯水的玻璃烧杯中备用。
1.2 钙浓度对水体磷的影响实验设计本实验采用室内模拟方法,将经过预处理的菹草顶端转入玻璃瓶中,每个玻璃瓶3株,鲜重约3 g,使用10 g瓷环固定在植株底部。每个玻璃瓶中添加1 L不同钙浓度的培养液。Ca2+添加处理通过无水CaCl2实现,参考中国五大淡水湖泊的钙离子范围[22],将Ca2+浓度设定为0、20、35、50、65 mg/L,共5个水平,无机磷处理通过添加K2HPO4获得,磷浓度为0.3 mg/L。水体碱度通过添加NaHCO3和KHCO3调节,碱度为250 mg/L CaCO3;其他营养元素的浓度采用改进Hoagland溶液配方[23],KI浓度为0.08 mg/L,MgSO4为4.93 mg/L,NH4NO3为0.30 mg/L。将玻璃瓶置于光照培养箱(20℃)中,光照(5000 lx)12 h,黑暗12 h为一个周期。实验共持续10 d,每个处理设置15个重复,并设置无菹草的对照组。每2天在每个光周期开始前随机选择3个重复,采集50 mL水样,用来测定培养液的总磷(TP)和溶解性磷酸盐(SRP)浓度。
1.3 水环境因子对叶面共沉淀的影响实验设计采用单因子设计分别研究碱度、磷浓度及温度对钙磷共沉淀的影响。经过预处理后,将菹草放入玻璃瓶中,每瓶放入3株植株,植株的鲜重约为3 g,使用10 g瓷环固定在植株底部。每个玻璃瓶中添加1 L不同磷浓度和碱度的培养液,碱度处理设定5个水平,分别是0、100、200、300、400 mg/L CaCO3;磷浓度设定5个水平,分别是0、0.1、0.2、0.3、0.4 mg/L,温度处理设定11、14、17、20℃,共4个水平;Ca2+浓度保持为50 mg/L,其他营养元素浓度采用改进Hoagland溶液配方,本研究共有14种处理(表 1),并设置无菹草的对照组,每个处理设置3个平行,整个实验周期为8 d。在实验期间,每天使用蠕动泵(BT100FC)缓慢更换培养液,以保持培养液的恒定。实验结束时,收集并处理叶腹面上的共沉淀。
| 表 1 实验分组设计 Tab. 1 Experiment grouping design |
将水样预先用0.45 μm孔径的醋酸纤维滤膜过滤,采用钼酸铵分光光度法(GB 11893 1989)测定水样TP和SRP。实验结束后,将植物取出, 30℃烘48 h至恒重,用软毛刷轻扫菹草叶面的钙磷共沉淀,使用精度为0.0001 g的电子天平称量沉淀重量。
1.5 数据分析碱度、磷浓度和温度对CaCO3-P共沉淀量的影响用SPSS 25软件进行单因素方差(One-way ANOVA)分析,当P值<0.05认为差异显著,使用Origin 2023软件绘制数据图。通过PHREEQC Interactive 3.3.5水化学模拟软件对无菹草组的培养液进行地球化学模拟,计算决定矿物溶解沉淀过程结果的饱和指数。矿物饱和指数(SI)是判别水体中各矿物溶解沉淀能力的重要参数。在本实验中利用PHREEQC Interactive软件对不同碱度、磷浓度和温度下无植物对照实验组水体矿物饱和状态进行模拟。
当某种矿物的SI>0时,说明该矿物在水中处于过饱和状态;SI<0时,说明该矿物在水中处于非饱和状态;SI=0时,说明该矿物在水中处于动态平衡状态[24-25]。
| SI=lg(IAPKsp) | (1) |
式中, SI为化合物的饱和指数;IAP为水体中化学成分离子活度乘积;Ksp为水体中化合物沉淀平衡常数。
| SI=lg(I△APKc) | (2) |
式中, IΔAP为[Ca2+][CO32-]的离子活度积(mol/L),Kc为碳酸钙溶于水的平衡常数。
2 实验结果 2.1 不同钙浓度条件下TP和SRP浓度的变化在菹草培养组中,随着时间的变化,溶液中TP浓度逐渐降低,第2天下降速度最快(图 1A)。在外加钙浓度较低(20 mg/L)时,TP浓度由初始平均值0.30 mg/L降至0.22 mg/L,降幅为26.67%;高钙处理的两组(50和65 mg/L)中TP浓度下降显著;在无菹草对照组中,水体TP浓度随时间变化幅度较小,平均值维持在0.29~0.30 mg/L之间。
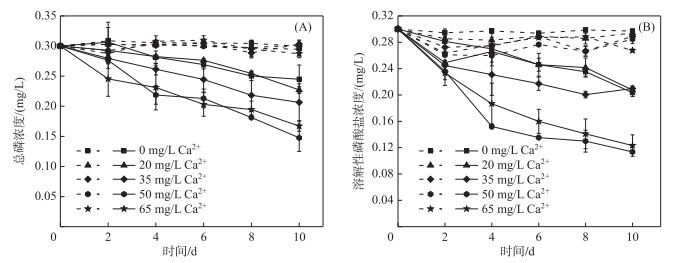
|
图 1 不同Ca2+处理水平下培养组溶液总磷(A)及溶解性磷酸盐(B)浓度变化(实线表示为有菹草培养组;虚线表示为无菹草培养组) Fig.1 Changes in total phosphorus (A) and soluble reactive phosphorus (B) concentrations in solution of culture groups in response to different Ca2+ treatment levels(Solid line indicates culture groups with Potamogeton crispus; Dashed line indicates culture groups without P. crispus) |
在菹草培养组中,随着时间的变化,溶液中SRP浓度逐渐降低(图 1B)。第10天收获菹草时,20 mg/L钙处理组的SRP平均浓度为0.21 mg/L,降幅为30%;35 mg/L钙处理组的SRP浓度平均值为0.21 mg/L,降幅为30%;50 mg/L钙处理组的SRP浓度平均值为0.11 mg/L,降幅为63.33%;65 mg/L钙处理组的SRP浓度平均值为0.13 mg/L,降幅为56.67%。菹草培养组中低钙处理组(20和35 mg/L)的SRP降低幅度低于高钙处理组(50和65 mg/L);高钙处理的两组(50和65 mg/L)SRP浓度在第2天时降低的更多。在不同钙浓度处理下,无菹草对照组溶液中SRP浓度变化趋势相同,随着时间推移,SRP浓度变化幅度较小。
2.2 水环境因子下叶面共沉淀产生量的变化当水体磷浓度及温度相同时,菹草叶片腹面的CaCO3-P共沉淀量随碱度的增加呈现上升的趋势。共沉淀量在高碱度(400 mg/L CaCO3)处理条件下最高,每株菹草每天平均产生34.85 mg共沉淀(图 2A);在100 mg/L CaCO3处理条件下最低,每株每天平均产生0.18 mg共沉淀。单因素方差分析显示,碱度对菹草的CaCO3-P共沉淀量影响极显著(P<0.01),各碱度处理组间有显著性差异。当碱度及温度相同时,随磷浓度的升高,菹草叶腹面的共沉淀产生量呈先升高后降低的趋势,总体变化趋势较小,磷浓度为0.1、0.2、0.3 mg/L处理间并无显著性差异(图 2B)。不同磷浓度处理对叶面共沉淀量没有产生显著影响(P>0.05)。叶面共沉淀在中等磷水平(0.2 mg/L)产生量最高,每株菹草每天平均产生23.12 mg共沉淀,在磷浓度为0.4 mg/L时产生量最低,每株菹草每天平均产生18.42 mg共沉淀。在碱度及磷浓度相同条件下,菹草叶腹面的共沉淀产生量随温度的变化总体呈上升的趋势,温度为14、17、20℃时共沉淀量无显著性差异。共沉淀在中等温度水平(17℃)产生量最高(图 2C),每株菹草每天平均产生16.61 mg共沉淀;共沉淀在11℃时产生量最低,每株菹草每天平均产生9.89 mg共沉淀。
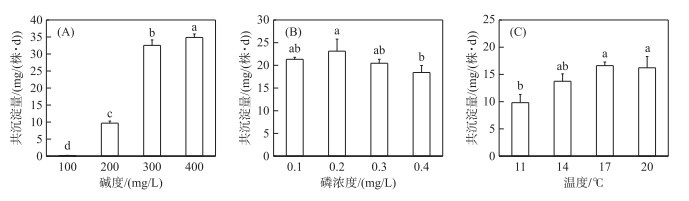
|
图 2 菹草叶面共沉淀量受碱度(A)、磷浓度(B)、温度(C)的变化(不同的小写字母代表处理间差异显著) Fig.2 The co-precipitation amount on the leaf surface of Potamogeton crispus is affected by changes in alkalinity(A), phosphorus concentration (B), and temperature (C) (Different capital letters represent significant differences between treatments) |
为了解不同碱度,磷浓度及温度条件下无菹草的各处理组共沉淀过程对削减水体磷的影响,利用PHREEQC Interactive对无菹草的各处理组水体相关矿物饱和指数(SI)进行模拟计算(表 2)。无菹草的各处理组水体的其他离子浓度均相同,其中NH4+浓度为0.07 mg/L,NO3-浓度为0.23 mg/L,Cl-浓度为88.44 mg/L,Ca2+浓度为50 mg/L,Mg2+浓度为0.98 mg/L,SO42-浓度为3.52 mg/L。结果表明各处理组各水体中方解石饱和指数SIc均大于0,达到过饱和状态,霰石饱和指数SIa大多都大于0。
| 表 2 不同处理组的矿物饱和指数变化特征 Tab. 2 Characteristics of mineral saturation index changes in different treatment groups |
方解石和霰石均为碳酸钙矿物,但晶体结构不同。图 3可知方解石和霰石的饱和指数趋势一致,在相同条件下霰石的饱和指数均比方解石饱和指数小。控制碱度处理组中方解石矿物饱和指数SIc为0.04~0.95;霰石的矿物饱和指数SIa为-0.11~0.80。处理组水体的饱和指数随碱度的增加而呈现上升的趋势(图 3A),碱度在400 mg/L CaCO3时方解石和霰石的矿物饱和指数最大,SIc为0.95,SIa为0.80。控制磷浓度处理组中SIc为0.91~1.24;SIa为0.77~1.10;水体的SIc及SIa均随磷浓度的增加而呈现先上升后下降的趋势,刚开始阶段饱和指数SI大幅度增加,SIc由0.91增长至1.24,SIa由0.77增长至1.10,后期又陡然降低,变化幅度较大(图 3B);水体磷浓度在0.30 mg/L时SI达到最大值,SIc为1.24,SIa为1.10。控制温度处理组组的SIc为0.86~0.97, SIa为0.71~0.82。水体的SIc和SIa均随温度的增加而呈现先下降后升高的趋势,饱和指数SI变化趋势较小,后SIc由0.86增长至0.97,SIa由0.71增长至0.82,说明在无菹草的条件下温度的小幅变化对SI的影响较小(图 3C)。
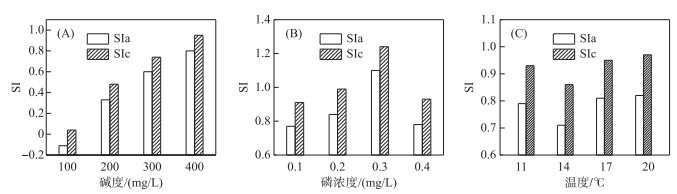
|
图 3 饱和指数受碱度(A)、磷浓度(B)、温度(C)的影响变化 Fig.3 The saturation index is affected by alkalinity (A), phosphorus concentration (B) and temperature (C) |
从饱和系数值的变化而言,磷浓度和温度变量的影响有限。综上所述,就单因素变化影响而言,碱度对饱和趋势的影响大于磷浓度和温度。
3 讨论 3.1 钙的添加对水体磷浓度的影响钙是植物必需的营养元素,具有极其重要的生理功能,同时也是重要的胞内信号分子,参与植物体内多种生理生化过程的调控[26]。朱端卫等[27]认为沉水植物驱动的水环境钙泵在水体磷循环中发挥着重要的作用,能将水柱中少量的SRP分配在碳酸钙中形成CaCO3-P共沉淀,导致水体中可溶性磷向难溶性磷转化。在相同钙浓度条件下,菹草培养组的水体TP和SRP浓度下降幅度远大于无菹草组,表明菹草可以有效促进对水体磷的吸收。在无菹草对照组中,钙的浓度增加对水体磷浓度的影响较小。在菹草培养组中,高钙浓度组在第2天时SRP浓度小于低钙及未添加钙浓度组,且SRP变化比TP更为明显(图 1),表明在菹草的介导下添加的钙浓度促进了水中的溶解性磷向颗粒态磷转变,显著降低水体活性磷的浓度。实验结束时,高钙浓度组的菹草叶面有CaCO3-P沉淀,而低钙浓度组的菹草叶面无CaCO3-P沉淀,说明钙浓度的大小影响菹草去除水体磷的效率和方式。结论与前人的研究基本一致,菹草能通过CaCO3-P的共沉淀作用有效地削减水体中的磷,在提高钙浓度的条件下,可增强菹草对水体磷的去除效率[28]。钙浓度较低的情况下,主要通过植物吸收除磷;而在钙浓度较高的情况下,除了植物吸收磷,水柱中一部分溶解性磷通过与植物叶面释放的钙结合形成CaCO3-P共沉淀。实验结果表明沉水植物可能影响溶度积,间接促进钙磷共沉淀的形成,进而削减水体磷负荷。在水生生态系统中,钙与磷结合形式减少了水相中磷的营养负荷,从而通过上行效应对浮游植物的生长和数量进行控制。
3.2 水环境因子对菹草叶面共沉淀的影响实验初期菹草培养组与无菹草对照组水体中的磷和钙没有产生共沉淀,但随着植物的生长和光合作用的相应增加,水体pH值升高,监测显示本实验pH的上升幅度介于3.6%~12.9%之间,菹草培养组中出现CaCO3-P共沉淀。表明植物在钙磷共沉淀中发挥着重要作用,这可能与植物的光合作用有关,光合作用改变水体的碱度,提高了方解石的过饱和指数,促进共沉淀[29]。水生植物在光合作用中能利用不同形式的碳源,而碳酸氢盐是菹草光合作用中无机碳的重要来源[30-31]。赵文等发现菹草在碱度为6.69 mmol/L时生产力最高,表明菹草可以有效利用水柱中的碳酸氢盐[32]。水体添加的碳酸氢根成为植物生长的促进因子,增强了植物光合效率,进一步提高了菹草茎叶微界面的pH和碱度,磷和钙的溶解度将进一步降低,并促进CaCO3-P共沉淀。Lee等的研究中发现水体碱度会引起沉淀的多晶形态的变化和二氧化碳分压(pCO2)值[33]。结果表明菹草在碱性水环境中生长及削减水体磷具有一定的优势。
磷浓度控制实验验证了自然水体磷浓度的大小对菹草叶面CaCO3-P共沉淀量的产生差异较小。这与陈琦等[28]的实验结果一致,即菹草在较高磷浓度(2 mg/L)时去除磷的效果比低磷浓度(0.2 mg/L)更好。Karami等[34]研究表明可溶性磷与湖中方解石之间的关系,含磷有机颗粒的沉降与方解石的沉淀同时发生,可能是因为磷酸盐能够被细颗粒强烈吸附,并随着细颗粒沉淀到底层沉积物中。这个过程可能有助于将水体中的磷沉淀到底层,起到去除磷的作用。更高的磷浓度意味着有更多的可溶性磷可用于与方解石结合形成沉淀[35]。然而自然水体的磷浓度通常不会很高,水体磷浓度对共沉淀的促进效果较小。Kleiner[36]的研究表明,自然湖水中的共沉淀速率与方解石的沉淀速率呈正比。此外,Dittrich等[37]的研究还发现天然或人工方解石均可与水体中的磷发生共沉淀以削减水体磷浓度,实验处理导致全流域总磷年浓度从0.04 mg/L(1992 1994年)下降到0.02 mg/L(1996 1997年)。总之,这些研究结果表明方解石对水体磷的地球化学循环起着重要的作用,可以与磷形成共沉淀,增加磷元素的埋藏效应,削减水体活性态磷浓度,从而维护水体的水质。无菹草对照组的SI均大于0,表现出有沉淀的趋势,但并未产生实际的共沉淀。同时,通过对比菹草培养处理组和对照组的共沉淀产生量,在相同条件下,沉水植物菹草可促进碳酸钙与磷的共沉淀的生成,这可能对富营养化水体的治理具有潜在的积极影响。
温度是影响沉水植物繁殖生长的重要因素,最适宜菹草生长的温度为10~20℃[38-39],温度超过20℃,菹草进入衰亡期。实验设置的温度处理均在菹草生长最适温度范围内。温度控制实验结果表明,沉水植物的存在可以显著降低水体中的磷浓度。在适合菹草生长的温度范围内,温度的增加对叶面共沉淀的含量的影响差异不大,可能是因为温度同时是影响植物光合作用速率和CaCO3-P共沉淀溶解度的重要因素。Liu的[40]研究表明,在室温和恒温条件下,CaCO3-P共沉淀物的结构没有显著差异。25℃和20℃时,磷酸钙Ca3(PO4)2的Ksp分别为10-26.52和10-25.20[41],磷酸钙的溶度积较小,温度的变化(<5℃)对反应(Ksp)的影响不大,表明温度的小幅波动不能显著影响钙磷共沉淀的发生强度,与实验结果一致。可见,菹草在生长周期内存在于水生生态系统中时,水体中的磷浓度可以维持在相对较低的水平。
实验表明,共沉淀的形成与上覆水性质密切相关,而且共沉淀可以降低上覆水中的磷浓度,但这些关系的微观机制有待进一步研究。采用菹草植段的无土培养,排除了底泥的干扰,菹草的无土培养结果与自然实际情况有一定的差异,沉积物可能会通过影响植物的钙和磷营养效率而影响叶面淀积物的形成强度。
4 结论菹草可通过共沉淀途径削减水体磷,并且钙浓度、碱度及温度等水环境因子都对菹草叶面共沉淀的产生有不同程度的影响,有助于深入了解沉水植物对水生态系统的钙-磷循环调控机制。
1) 菹草可以通过CaCO3-P共沉淀有效削减水体中的磷,钙的添加提高了菹草对水体磷的去除效率,促进了CaCO3-P共沉淀。
2) CaCO3-P共沉淀量随碱度的增加而增加,共沉淀在碱度最高水平(400 mg/L CaCO3)含量最高,在中等磷(0.2 mg/L)及中等温度(17℃)水平最高。单因素方差分析表明,碱度是影响菹草叶面CaCO3-P共沉淀的关键因素之一。
3) 在水环境因子相同的情况下,无菹草的对照组有结晶趋势,但未产生沉淀,而添加菹草的处理组产生了钙磷共沉淀,表明菹草促进CaCO3-P共沉淀的产生,具有较强的形成CaCO3-P共沉淀的能力。
| [1] |
Feng T, Wang C, Wang PF et al. How physiological and physical processes contribute to the phenology of cyanobacterial blooms in large shallow lakes: A new Euler-Lagrangian coupled model. Water Research, 2018, 140: 34-43. DOI:10.1016/j.watres.2018.04.018 |
| [2] |
Conley DJ, Paerl HW, Howarth RW et al. Controlling eutrophication: Nitrogen and phosphorus. Science, 2009, 323(5917): 1014-1015. DOI:10.1126/science.1167755 |
| [3] |
Zaaboub N, Ounis A, Helali MA et al. Phosphorus speciation in sediments and assessment of nutrient exchange at the water-sediment interface in a Mediterranean lagoon: Implications for management and restoration. Ecological Engineering, 2014, 73: 115-125. DOI:10.1016/j.ecoleng.2014.09.017 |
| [4] |
Gerloff GC, Krombholz PH. Tissue analysis as a measure of nutrient availability for the growth of angiosperm aquatic plants. Limnology and Oceanography, 1966, 11(4): 529-537. DOI:10.4319/lo.1966.11.4.0529 |
| [5] |
Carpenter SR, Adams MS. The macrophyte tissue nutrient pool of a hardwater eutrophic lake: Implications for macrophyte harvesting. Aquatic Botany, 1977, 3: 239-255. DOI:10.1016/0304-3770(77)90026-2 |
| [6] |
Wang SR, Jin XC, Zhao HC et al. Phosphate biosorption characteristics of a submerged macrophyte Hydrilla verticillata. Aquatic Botany, 2008, 89(1): 23-26. DOI:10.1016/j.aquabot.2008.01.006 |
| [7] |
Hilt S, Van de Weyer K, Köhler A et al. Submerged macrophyte responses to reduced phosphorus concentrations in two peri-urban lakes. Restoration Ecology, 2010, 18(s2): 452-461. DOI:10.1111/j.1526-100x.2009.00577.x |
| [8] |
Brönmark C, Hansson LA. The biology of lakes and ponds. Oxford: Oxford University Press, 2017.
|
| [9] |
Bai GL, Zhang Y, Yan P et al. Spatial and seasonal variation of water parameters, sediment properties, and submerged macrophytes after ecological restoration in a long-term (6 year) study in Hangzhou west lake in China: Submerged macrophyte distribution influenced by environmental variables. Water Research, 2020, 186: 116379. DOI:10.1016/j.watres.2020.116379 |
| [10] |
Srivastava J, Gupta A, Chandra H. Managing water quality with aquatic macrophytes. Reviews in Environmental Science and Bio/Technology, 2008, 7(3): 255-266. DOI:10.1007/s11157-008-9135-x |
| [11] |
Danen-Louwerse HJ, Lijklema L, Coenraats M. Coprecipitation of phosphate with calcium carbonate in Lake Veluwe. Water Research, 1995, 29(7): 1781-1785. DOI:10.1016/0043-1354(94)00301-m |
| [12] |
House WA, Donaldson L. Adsorption and coprecipitation of phosphate on calcite. Journal of Colloid and Interface Science, 1986, 112(2): 309-324. DOI:10.1016/0021-9797(86)90101-3 |
| [13] |
Sylvan JB, Dortch Q, Nelson DM et al. Phosphorus limits phytoplankton growth on the Louisiana shelf during the period of hypoxia formation. Environmental Science & Technology, 2006, 40(24): 7548-7553. DOI:10.1021/es061417t |
| [14] |
Du YX, Ramirez CE, Jaffé R. Fractionation of dissolved organic matter by co-precipitation with iron: Effects of composition. Environmental Processes, 2018, 5(1): 5-21. DOI:10.1007/s40710-017-0281-4 |
| [15] |
Neal C, Jarvie HP, Howarth SM et al. The water quality of the River Kennet: Initial observations on a lowland chalk stream impacted by sewage inputs and phosphorus remediation. Science of the Total Environment, 2000, 251/252: 477-495. DOI:10.1016/s0048-9697(00)00400-9 |
| [16] |
Barat R, Montoya T, Borrás L et al. Interactions between calcium precipitation and the polyphosphate-accumulating bacteria metabolism. Water Research, 2008, 42(13): 3415-3424. DOI:10.1016/j.watres.2008.05.003 |
| [17] |
Hartley AM, House WA, Callow ME et al. The role of a green Alga in the precipitation of calcite and the coprecipitation of phosphate in freshwater. Internationale Revue der Gesamten Hydrobiologie und Hydrographie, 1995, 80(3): 385-401. DOI:10.1002/iroh.19950800302 |
| [18] |
McConnaughey TA, LaBaugh JW, Rosenberry DO et al. Carbon budget for a groundwater-fed lake: Calcification supports summer photosynthesis. Limnology and Oceanography, 1994, 39(6): 1319-1332. DOI:10.4319/lo.1994.39.6.1319 |
| [19] |
Stewart AJ. Alkalinity dynamics in a hard-water Prairie-Margin stream. Archiv für Hydrobiologie, 1988, 112(3): 335-350. DOI:10.1127/archiv-hydrobiol/112/1988/335 |
| [20] |
Wang LZ, Song HL, Wu XY et al. Relationship between the coprecipitation of phosphorus-on-calcite by submerged macrophytes and the phosphorus cycle in water. Journal of Environmental Management, 2022, 314: 115110. DOI:10.1016/j.jenvman.2022.115110 |
| [21] |
Jia FC, Wu YB, Zhao JY et al. Progress of research on the growth habit and management method of a submerged macrophyte Potamogeton crispus. Pearl River, 2021, 42(6): 47-51. [贾凤聪, 吴亚斌, 赵进勇等. 沉水植物菹草生长习性与治理方法研究进展. 人民珠江, 2021, 42(6): 47-51. DOI:10.3969/j.issn.1001-9235.2021.06.008] |
| [22] |
窦鸿身, 姜加虎. 中国五大淡水湖. 合肥: 中国科学技术大学出版社, 2003.
|
| [23] |
Hoagland DR. The water culture method for growing plants without soil. California Agricultural Experiment Station, 1950, 347: 1-32. |
| [24] |
Sun YQ, Qian H, Wu XH. Hydrogeochemical modeling of minerals in groundwater in Yinchuan Region. Journal of Safety and Environment, 2006, 6(6): 29-32. [孙亚乔, 钱会, 吴学华. 银川地区地下水矿物的水文地球化学模拟. 安全与环境学报, 2006, 6(6): 29-32.] |
| [25] |
Shi XD, Yao JX, Zhao BY et al. Characteristics of karst development and controlling factors in Fengxi section of Qingfeng Fracture Zone. Resources Environment & Engineering, 2023, 37(5): 537-544, 577. [史箫笛, 姚建新, 赵碧义等. 青峰断裂带丰溪段岩溶发育特征及控制因素研究. 资源环境与工程, 2023, 37(5): 537-544, 577.] |
| [26] |
Jing DW, Xing SJ, Ma BY et al. Research progress on calcium nutrition in soil and plants. Biological Disaster Science, 2012, 35(4): 447-51. [井大炜, 邢尚军, 马丙尧等. 土壤与植物中钙营养研究进展. 生物灾害科学, 2012, 35(4): 447-451. DOI:10.3969/j.issn.2095-3704.2012.04.026] |
| [27] |
Zhu DW, Zhu H, Ni LS et al. Relationship between calcium pump driven by submerged macrophytes and phosphorus cycle in water. J Lake Sci, 2012, 24(3): 355-361. [朱端卫, 朱红, 倪玲珊等. 沉水植物驱动的水环境钙泵与水体磷循环的关系. 湖泊科学, 2012, 24(3): 355-361. DOI:10.18307/2012.0305] |
| [28] |
Chen Q, Wang HY. Effect of calcium addition on phosphorus enrichment capacity of two submerged plants (Potamogeton crispus L. and Ceratophyllum demersum L. ) in water bodies. J Lake Sci, 2020, 32(2): 406-416. [陈琦, 王和云. 钙离子添加对沉水植物菹草(Potamogeton crispus L.)和金鱼藻(Ceratophyllum demersum L.)富集水体磷的影响. 湖泊科学, 2020, 32(2): 406-416. DOI:10.18307/2020.0210] |
| [29] |
Yasue T, Takemura H, Arai Y. Capture of calcium ion in hard water by precipitation reaction of sodium silicate-sodium aluminate system. Journal of the Ceramic Society of Japan, 1990, 98(1143): 1217-1222. DOI:10.2109/jcersj.98.1217 |
| [30] |
Madsen TV, Sand-Jensen K. Photosynthetic carbon assimilation in aquatic macrophytes. Aquatic Botany, 1991, 41(1/2/3): 5-40. DOI:10.1016/0304-3770(91)90037-6 |
| [31] |
Sand-Jensen K, Gordon DM. Differential ability of marine and freshwater macrophytes to utilize HCO3- and CO2. Marine Biology, 1984, 80(3): 247-253. DOI:10.1007/BF00392819 |
| [32] |
Zhao W, Dong SL, Shen TQC et al. Studies on aquatic macrophytes in saline ponds. Plant Research, 2001(1): 140-146. [赵文, 董双林, 申屠青春等. 盐碱池塘水生大型植物的研究. 植物研究, 2001(1): 140-146. DOI:10.3969/j.issn.1673-5102.2001.01.034] |
| [33] |
Lee J, Morse JW. Influences of alkalinity and pCO2 on CaCO3 nucleation from estimated Cretaceous composition seawater representative of "calcite seas". Geology, 2010, 38(2): 115-118. DOI:10.1130/g30537.1 |
| [34] |
Karami F, Balci N, Guven B. A modeling approach for calcium carbonate precipitation in a hypersaline environment: A case study from a shallow, alkaline lake. Ecological Complexity, 2019, 39: 100774. DOI:10.1016/j.ecocom.2019.100774 |
| [35] |
Sang YX, Yang JL, Xiong Y et al. Comparison of phosphorus enrichment and calcium-phosphorus content of two submerged macrophytes under different light and phosphorus levels. Environmental Science, 2020, 41(6): 2698-2705. [桑雨璇, 杨珈乐, 熊怡等. 不同光照和磷水平下两种沉水植物磷富集和钙磷含量的比较. 环境科学, 2020, 41(6): 2698-2705. DOI:10.13227/j.hjkx.201909258] |
| [36] |
Kleiner J. Coprecipitation of phosphate with calcite in lake water: A laboratory experiment modelling phosphorus removal with calcite in Lake Constance. Water Research, 1988, 22(10): 1259-1265. DOI:10.1016/0043-1354(88)90113-3 |
| [37] |
Dittrich M, Koschel R. Interactions between calcite precipitation (natural and artificial) and phosphorus cycle in the hardwater lake. Hydrobiologia, 2002, 469(1): 49-57. DOI:10.1023/A:1015571410442 |
| [38] |
Jin SD, Li YH, Wang YL. Effects of ecological factors on photosynthesis of Potamogeton crispus. Acta Hydrobiologica Sinica, 1991, 15(4): 295-302. [金送笛, 李永函, 王永利. 几种生态因子对菹草光合作用的影响. 水生生物学报, 1991, 15(4): 295-302. DOI:10.3321/j.issn:1000-3207.1991.04.003] |
| [39] |
Qiu WJ, Geng MD, Qian CY et al. Effects of different forms of nitrogen on response to Cd stress in Potamogeton crispus. Journal of Biology, 2021, 38(1): 66-71. [邱伟建, 耿梦蝶, 钱程远等. 不同形态氮素对菹草响应Cd胁迫的影响. 生物学杂志, 2021, 38(1): 66-71. DOI:10.3969/j.issn.2095-1736.2021.01.066] |
| [40] |
Liu GL, Guo WW, Yuan SB et al. Occurrence and characterization of CaCO3-P coprecipitation on the leaf surface of Potamogeton crispus in water. Environmental Science and Pollution Research, 2016, 23(22): 23308-23315. DOI:10.1007/s11356-016-7844-1 |
| [41] |
Montastruc L, Azzaro-Pantel C, Biscans B et al. A general framework for pellet reactor modelling: Application to P-recovery. Chemical Engineering Research and Design, 2003, 81(9): 1271-1278. DOI:10.1205/026387603770866498 |
 2024, Vol. 36
2024, Vol. 36 


