(2: 中国科学院南京地理与湖泊研究所鄱阳湖湖泊湿地综合研究站,九江 332899)
(3: 江西省生态文明研究院,南昌 330036)
(4: 中国科学院大学南京学院,南京 211135)
(5: 南京工业大学环境科学与工程学院,南京 211816)
(6: 江西省科学院流域生态研究所,南昌 330096)
(2: Poyang Lake Wetland Research Station, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Jiujiang 332899, P.R.China)
(3: Jiangxi Research Academy of Ecological Civilization, Nanchang 330036, P.R.China)
(4: University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, P.R.China)
(5: School of Environmental Science & Engineering, Nanjing Tech University, Nanjing 211816, P.R.China)
(6: Institute of Watershed Ecology, Jiangxi Academy of Sciences, Nanchang 330096, P.R.China)
湿地兼具陆地生态系统和水域生态系统的属性,在调节气候、促进生物地球化学循环等方面具有重要作用[1-2]。湿地氮循环过程对气候变化较为敏感,同时湿地也是重要的大气氧化亚氮(N2O)排放源,尤其是在气候相对温暖的温带和热带湿地[3-7]。N2O是一种臭氧消耗物质,也是仅次于二氧化碳(CO2)和甲烷(CH4)的第三大温室气体,其在100年尺度上的增温潜势是CO2的265倍[8-9]。相对于湿地CO2和CH4,湿地N2O研究相对欠缺,严重制约了全球和区域尺度上N2O源汇总量的科学估算[10-11]。随着大气氮沉降增加、全球气候变暖等全球变化现象愈演愈烈,湿地氮循环过程随之发生了难以预料的变化,进而增加了湿地N2O收支状态及气候反馈的不确定性[11-12]。
近几十年来,工农业活动飞速发展和化石燃料大量燃烧导致大气中的活性氮含量越来越高,再以氮沉降的方式进入到生态系统中,进而影响湿地氮循环过程[13]。全球氮沉降量高达93.6 Tg/a,相对20世纪80年代增长了8 %,尤其是东亚地区[14]。我国大气氮沉降量自改革开放以来快速增长,当前保持在20.4~21.1 kg/(ha ·a)范围之内[15-16]。自然生态系统通常处于氮限制状态,而大气氮沉降增加打破了原有的生态系统氮平衡,导致土壤氮有效性不断增加,提升了氮循环微生物的功能基因丰度和多样性,促进了硝化作用和反硝化作用的发生,进而刺激大量的N2O释放[17-21]。外源氮输入还能促使生态系统从N2O汇转变为N2O源,在滨海湿地和北方泥炭地均观察到这一现象[22-23]。然而,目前关于氮沉降对N2O排放影响的研究主要集中在森林、草地和农田等生态系统,有关湿地的研究相对较少[19,21,24];部分已开展的湿地N2O排放对氮沉降的响应研究主要分布在泥炭地、高寒沼泽湿地、滨海与河口湿地等,对亚热带和热带湖泊湿地的研究亟需加强[20,22,25-26]。
自工业革命以来,全球气温不断攀升,到21世纪末升温幅度极有可能超过1.5℃[27]。我国地表年平均气温以每十年增加0.26℃的速率显著上升,明显高于同时期的全球平均升温水平[28]。全球分析表明,增温显著增加了陆地生态系统温室气体排放,可能削弱生态系统氮库,并对气候变化产生正反馈作用[29-31]。温度升高可以促进土壤酶活性和微生物代谢,加快土壤氮周转速率,增加有效矿物氮含量,进而影响N2O的产生和排放。虽然气候变暖可以导致北方泥炭地排放更多的N2O[12],但是气候变暖对N2O排放的影响并非总是积极的,在泥炭沼泽、山地苔原、高寒草甸开展的模拟实验均表明增温对N2O排放无显著影响[22,32-33]。这表明气候变暖对区域N2O排放的影响具有很大的不确定性。此外,目前已开展的全球变化模拟实验多为单因子实验,多因子全球变化实验亟需加强[34-35]。多因子交互作用并非是单因子影响效应的简单加和,而可能表现出更为复杂的协同或拮抗作用,所以多因子交互作用对N2O排放影响的不确定性也更大[35-36]。因此,有必要开展大气氮沉降增加与气候变暖交互作用对湿地N2O排放的影响研究。
鄱阳湖是我国最大的洪泛湖泊湿地和亚热带湖泊湿地,也是长江中下游地区的重要生态屏障,具有水情复杂多变、氮循环活跃等鲜明特征。前期针对鄱阳湖湿地温室气体的研究主要关注CO2和CH4,研究结果表明鄱阳湿地CO2和CH4通量具有明显的季节变化特征且空间异质性较大,水体总体表现为碳源,而洲滩湿地总体为碳汇[37-41]。Liu等[42]、Wang等[43]和徐会显等[44]研究了鄱阳湖水体N2O溶存浓度和排放通量的时空变化特征及影响因素;Hu等[45]的研究表明,鄱阳湖灰化薹草湿地是N2O源,而且主要受到湿地植物的影响。然而,大气氮沉降增加与气候变暖对鄱阳湖湿地N2O通量的影响方向及程度尚不清楚。因此,本研究通过在鄱阳湖灰化薹草湿地开展全球变化原位模拟实验,旨在阐明施氮、增温及两者交互作用对鄱阳湖灰化薹草湿地N2O排放的影响。研究结果既可以弥补不同类型湿地N2O排放研究的区域不均衡性,也有利于完善复杂环境变化下的鄱阳湖湿地氮循环关键过程的理论知识。
1 材料与方法 1.1 实验区概况依托江西鄱阳湖湖泊湿地生态系统国家野外科学观测研究站,实验区建立在江西省庐山市星湖湾省级湿地公园(29°27′00″N,116°01′14″E)。该区域位于东亚季风区,属于亚热带温暖湿润气候。年平均降雨量为1387~1795 mm,其中3-8月的降水量约占全年降水量的74 %;年平均气温为16~20℃;无霜期为240~300 d[46]。受鄱阳湖年内高变幅水位的影响,实验区通常在每年5月末或6月初逐渐淹水,到8月末逐渐出露,淹水时长约为3个月。
鄱阳湖湿地植被属于草丛沼泽植被型,洲滩植被主要以莎草科与禾本科为主。实验区以灰化薹草(Carex cinerascens Kukenth.)为单一优势种,伴生种主要包括水田碎米荠(Cardamine lyrata Bunge)、下江委陵菜(Potentilla limprichtii J. Krause)、刚毛荸荠(Eleocharis valleculosa Ohwi)等。群落盖度在90 % 以上,植株高度为40~80 cm。灰化薹草有两个生长期,即秋草生长期和春草生长期。实验区的土壤类型主要为砂质草甸土。根据2019年5月的调查,实验区表层土壤pH为4.87、土壤有机碳(SOC)含量为9.7 g/kg、总氮(TN)含量为0.96 g/kg、铵态氮(NH4+-N)含量为7.4 mg/kg、硝态氮(NO3--N)含量为6.3 mg/kg[47]。
1.2 实验设计为了模拟大气氮沉降增加、气候变暖以及两者交互作用对鄱阳湖灰化薹草湿地N2O通量的影响,本研究采用随机区组实验设计,设置4种不同的处理,包括对照处理(不施氮不增温)、单独施氮处理(施氮不增温)、单独增温处理(不施氮增温)以及施氮和增温处理(施氮增温)。每种处理设置4个重复样地,样地尺寸为2 m × 2 m,样地间隔不小于2 m,区组之间的间隔不小于5 m(图 1)。
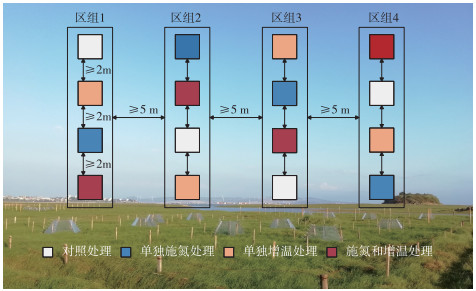
|
图 1 实验设计布局和实验区景观 Fig.1 Layout of the experimental design and landscape of the experimental area |
鄱阳湖流域的大气氮沉降量为2.42~2.83 g/(m2·a),且近几十年呈现显著增加的趋势[15,48]。本研究中的氮添加量为16 g/(m2·a),约为鄱阳湖流域氮沉降量的6倍,在以往类似研究中的氮沉降水平范围之内[20-21]。在秋草生长期初期,将NH4NO3溶液均匀喷洒在施氮实验小区,未施氮实验小区喷洒等量的水。为了避免频繁的氮添加对样地环境造成干扰,本研究仅在秋草生长期初期进行了1次氮添加。根据政府间气候变化专门委员会(IPCC)第六次评估报告的结果,21世纪末全球表面温度可能超过1.5℃(高信度)[27]。本研究采用被动式的开顶箱(open top chamber,OTC)增温装置来模拟增温,该装置可使冠层空气温度平均增加1.56℃,表层土壤温度增加0.35℃[47]。OTC由6块完全相同的透明有机玻璃板拼接而成,呈正六面棱台状,底部面积为2.6 m2,顶部面积为0.6 m2,高度为0.8 m。2018年8月末,OTC安置于实验小区内并不再移动。
1.3 气体样品采集与分析本研究采用静态箱-气相色谱仪法采集和分析N2O。静态箱包括顶箱和底座两部分,由PVC材料加工而成。顶箱呈圆柱状,高度和直径均为0.3 m,箱体外侧用隔热泡沫包裹以免采样过程中箱内温度过快升高;箱体顶部有2个小孔,并用橡胶膜和橡胶塞密封,分别用于抽取气体和插入温度计。底座于实验区淹水前埋于每个小区的中心,埋深为0.1 m;底座上部呈凹槽状,出露地表之上。采集气体样品时,先在底座凹槽内加入适量的水,然后将顶箱置于凹槽内以形成密闭环境,立即用50 mL注射器从箱内抽取气体,此后每隔10 min抽取一次。每个小区的采样时间为30 min,可收集到4份气体样品,采样完成后立即移开顶箱以减少密闭暗环境对箱内生态系统的干扰。气体样品采集周期为2018年9-12月,采集时间为9:00-15:00,采集频率为每月2次。
气体样品采集完成后,立即带回实验室,并在3天内完成分析。通过气相色谱仪(Agilent 7890B, Agilent Technologies, CA, USA)的后检测器(uECD)分析N2O浓度,温度为300℃,尾吹气(Ar与CH4混合气)流量为30 mL/min。在分析采集的气体样品前,先分析6份以上的标准气体,一方面用以检验气相色谱仪运行的稳定性,另一方面用于对分析得到的N2O浓度进行校正。通过R程序包“flux”计算N2O通量[49],并根据归一化均方根误差、决定系数和测量次数对得到的N2O通量进行数据质量控制[50]。N2O通量大于0表示N2O排放,小于0则表示N2O吸收。N2O累积排放通量按照逐月累加的方法进行计算,即通过每月平均N2O通量乘以该月天数得到该月的N2O累积排放通量,然后依次将各月的N2O累积排放通量进行累加得到研究期内的N2O累积排放通量。需要说明的是,在2018年11月1日的对照组样品中,存在一个极端异常值(N2O通量为-104 μg/(m2·h),其余3组N2O通量分别为9.11、4.20、2.34 μg/(m2·h),所以本研究的数据分析中将该异常值删除。
1.4 环境变量监测与分析在采集气体样品的同时,同步记录采样时间和顶箱内的空气温度;使用手持式ProCheck多功能数据采集器和5TE土壤传感器(Decagon Devices Inc., Pullman, WA, USA)监测每个小区的表层土壤温度和土壤水分,在底座附近随机选择3处不同位置进行测量,取3次测量的平均值作为该小区的土壤温度和土壤水分。
由于植物生物量和土壤基本理化性质测量均需要进行破坏性采样,为了尽可能降低对实验小区的干扰,仅在植物成熟时进行采样。在实验小区内随机选择与底座等面积的区域,将植物齐地面刈割后带回实验室,置于烘箱(75℃,运行48 h)中烘干至恒重,称量并换算为植物地上生物量(干重)。采集各实验小区的表层土壤(0~10 cm)样品,用于分析土壤pH、SOC、TN、NH4+-N和NO3--N含量,该实验区的前期相关研究表明,施氮和增温对表层土壤pH、SOC、TN、NH4+-N和NO3--N均无显著影响,详见参考文献[47]。
1.5 统计分析本研究的统计分析在R(version 4.2.0)中完成。采用线性混合效应模型分析施氮、增温、采样日期以及交互作用对N2O通量的影响,其中,施氮、增温和采样日期设为模型固定因子,小区和区组设为模型随机因子,通过R程序包“lme4”进行线性混合效应模型分析[51]。采用单因素方差分析和Scheffe多重比较检验不同处理间的N2O通量、N2O累积排放通量的差异,采用线性回归分析和多元回归分析检验环境变量与N2O通量的相关关系,通过R程序包“stats”进行单因素方差分析和回归分析、R程序包“agricolae”进行多重比较。显著性水平设定为0.05,图表数据按照“平均值±标准误”进行展示。
2 结果 2.1 N2O通量变化在整个研究期间,鄱阳湖灰化薹草湿地总体表现为N2O弱源。N2O通量大体呈现先上升后下降的变化趋势,变化范围为(-1.46±3.27)~(12.67±5.52) μg/(m2·h)(对照处理,图 2)。相对于对照处理,单独施氮处理、单独增温处理以及施氮和增温处理均能增加灰化薹草湿地的N2O排放,3种处理下的N2O通量变化范围分别为(2.58±3.58)~(21.33±4.87) μg/(m2·h)、(0.86±6.56)~(14.91±8.88)μg/(m2·h)、(2.66±4.15)~(49.50±9.61)μg/(m2·h)。总体上,施氮对N2O排放的促进作用强于增温。
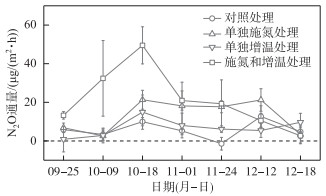
|
图 2 不同处理下N2O通量的时间变化 Fig.2 Temporal variations of N2O flux under different treatments |
方差分析结果表明,相对于对照处理,单独施氮处理与单独增温处理对N2O通量均没有显著影响,而施氮和增温处理可导致N2O通量显著增加3.7倍;相对于单独增温处理,施氮和增温处理可显著增加3.1倍的N2O通量(图 3A)。基于线性混合效应模型揭示N2O通量对施氮与增温效应的综合响应,分析结果表明施氮对N2O通量有显著影响,而增温对N2O通量的影响不显著,且两者之间无显著的交互作用(表 1)。相对于不施氮,施氮导致N2O通量显著增加了2.7倍(图 3B)。采样日期也对N2O通量有显著影响,表明N2O通量的时间变化显著,但施氮效应和增温效应均不随采样日期的变化而变化(表 1)。总体上,施氮可以显著促进鄱阳湖灰化薹草湿地的N2O排放,但增温对N2O排放的影响不显著。
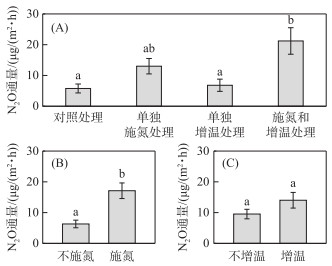
|
图 3 施氮和增温对N2O通量的影响 (不同小写字母表示差异显著(P < 0.05)) Fig.3 Effects of nitrogen application and warming on N2O flux (Different lowercase letters represent significant difference (P < 0.05)) |
| 表 1 线性混合效应模型的统计结果 Tab. 1 Statistical results of the linear mixed-effects model |
在整个研究期间,不同处理下鄱阳湖灰化薹草湿地的N2O累积排放通量如图 4所示。在对照处理下,鄱阳湖灰化薹草湿地在2018年9-12月的N2O累积排放通量为(16.81±3.88) mg/m2。相对于对照处理,施氮和增温处理导致N2O累积排放通量显著增加了3.5倍;相对于单独增温处理,施氮和增温处理导致N2O累积排放通量显著增加了3.3倍(图 4)。施氮、增温对N2O通量及N2O累积排放通量的影响方向和程度基本一致(图 3A和图 4)。
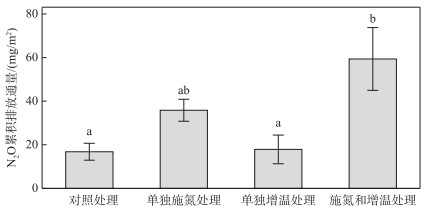
|
图 4 不同处理下的N2O累积排放通量 (不同小写字母表示差异显著(P < 0.05)) Fig.4 Cumulative flux of N2O under different treatments (Different lowercase letters represent significant difference (P < 0.05)) |
N2O通量与环境变量的相关性分析表明,空气温度、土壤温度、土壤水分与N2O通量均无显著相关关系,而地上生物量与N2O通量存在显著的正相关关系(图 5)。这表明鄱阳湖灰化薹草湿地N2O排放过程主要由植物调节,而空气温度、土壤温度、土壤水分等并不是N2O通量的主要影响因素。
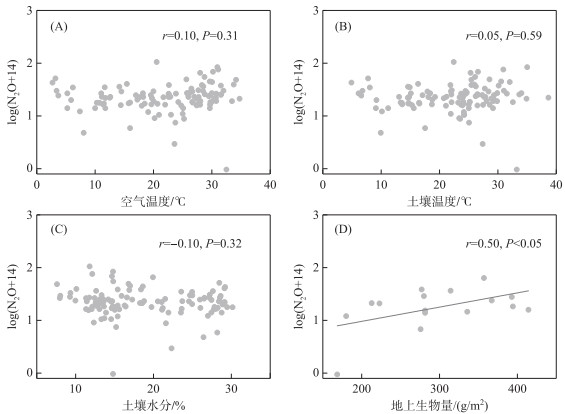
|
图 5 N2O通量与环境变量之间的关系 Fig.5 The relationship between N2O flux and environment variables |
通过多元回归模型分析多种环境变量对N2O通量的潜在综合影响,结果如表 2所示。无论是综合考虑空气温度、土壤温度、土壤水分3个环境变量,还是任何2个环境变量,均对N2O通量无显著影响,进一步强调了空气温度、土壤温度和土壤水分不是调节鄱阳湖灰化薹草湿地N2O通量的限制因素。
| 表 2 多元回归模型的统计分析结果 Tab. 2 Statistical results of the multiple regression model |
本研究表明,鄱阳湖灰化薹草湿地秋草生长期的N2O通量为(-1.46±3.27)~(12.67±5.52) μg/(m2·h),平均值为(5.77±1.45)μg/(m2·h),整体上表现为N2O源。就N2O平均通量而言,鄱阳湖灰化薹草湿地与三江平原薹草湿地(6.16 μg/(m2·h))[52]、小兴安岭薹草湿地(4.00 μg/(m2·h))[53]、长江口潮间带湿地(5.99 μg/(m2·h))[54]等大体相当,但是明显低于苏北滨海湿地(芦苇:17.40 μg/(m2·h);互花米草:15.70 μg/(m2·h))[55]、博斯腾湖芦苇湿地(人工湿地:10.80 μg/(m2·h);天然湿地:7.80 μg/(m2·h))[56]。这些不同类型湿地的N2O通量很可能与湿地植被特征紧密相关:一方面,芦苇具有非常发达的通气组织,更加有利于N2O的传输和排放[56];另一方面,较高的植物生物量通常有利于促进N2O排放[57],而芦苇的生物量明显高于灰化薹草。此外,鄱阳湖南矶山湿地的N2O平均通量为20 μg/(m2·h)[45],明显高于本研究的结果,很可能是因为南矶山湿地的灰化薹草具有更高的生物量。在整个研究期间,鄱阳湖灰化薹草湿地的N2O累积排放通量为(16.81±3.88) mg/m2。根据第二次鄱阳湖综合科学考察数据,鄱阳湖灰化薹草湿地分布面积约为722.65 km2[46],据此可估算出鄱阳湖灰化薹草湿地在2018年9-12月期间共排放了(12.15±2.80) t N2O。受鄱阳湖年内水位变化的影响,不同月份的灰化薹草湿地面积表现出一定范围内的波动,而第二次鄱阳湖综合科学考察给出的灰化薹草分布面积为枯水期最大分布面积,因此可能导致鄱阳湖灰化薹草湿地秋草生长期N2O排放总量的高估。
以往大量研究表明,施氮通常可以促进湿地N2O排放[17,19-21],这与本研究结果一致,即施氮能够显著增加鄱阳湖灰化薹草湿地秋草生长期的N2O排放(表 1和图 3)。与其它大多数陆地生态系统相似,鄱阳湖湿地的灰化薹草生长主要受到氮的限制[58]。适量的氮输入在一定程度上可以缓解生态系统的氮限制,一方面可以有效提升参与氮循环的功能基因丰度和多样性,从而促进N2O的产生[17,19];另一方面也可以促进植物生长,刺激植物根系释放更多的分泌物以及更多的植物凋落物输入到土壤中,以提供参与硝化作用和反硝化作用的反应底物,从而加速N2O的排放[26,59]。最近在鄱阳湖湿地的研究表明,施氮确实可以增加灰化薹草的地上生物量和地下生物量[47,60]。虽然一些基于Meta分析的研究发现,增温显著增加了陆地生态系统的N2O排放[29-30],但是本研究结果表明,增温对鄱阳湖灰化薹草湿地秋草生长期的N2O通量无显著影响,这与北方泥炭沼泽湿地的增温实验结果一致[22,61]。这种不显著的影响一方面可能是气候变暖对氮匮乏的湿地生态系统陆-气界面N2O交换的影响有限[61],另一方面也可能与增温幅度和持续时间有关[29]。尽管秋草生长期的灰化薹草湿地N2O排放对增温的响应不显著,但是增温仍能在一定程度上促进N2O排放(表 1和图 3),并且增温可以显著提升整个洲滩出露期的灰化薹草湿地N2O排放[62]。研究表明,增温可以使得鄱阳湖灰化薹草湿地的冠层空气温度和表层土壤温度分别增加1.56和0.35℃[47],而适宜的升温能够促进硝化细菌和反硝化细菌的活性,从而产生和排放更多的N2O[63]。
湿地土壤N2O的产生主要与硝化作用和反硝化作用有关,硝化细菌在好氧环境下将铵态氮氧化为硝态氮,其中间产物NH2OH分解过程中会产生N2O,而反硝化细菌在厌氧环境下将硝态氮还原为N2的过程中也会产生N2O,这些过程中产生的N2O主要以分子扩散和植物传输的方式排放到大气中 [64-65]。因此,改变N2O产生和传输的因素可能会影响最终的N2O排放,这些因素可以分为非生物因素和生物因素,其中生物因素主要包括与氮循环相关的微生物、植物和土壤动物等,非生物因素主要包括水文气象条件、土壤理化性质等。本研究发现鄱阳湖灰化薹草湿地的N2O通量与空气温度、土壤温度和土壤水分等非生物因素无显著的相关性,而与地上生物量呈显著正相关关系(图 5),Hu等[45]在鄱阳湖南矶山湿地也发现了类似的现象。此外,在巴音布鲁克天鹅湖高寒湿地[66]、三江平原沼泽湿地[67]、闽江河口湿地[68]等不同类型湿地均发现了N2O通量与空气温度、土壤温度或土壤水分无显著相关性。鄱阳湖湿地N2O排放主要来源于土壤反硝化过程,而且主要受周期性、高变幅湖泊水情的影响[69],同时鄱阳湖湿地N2O主要通过湿地植物进行传输[45],以致N2O排放对土壤温度和含水量的敏感性较弱。湿地地上植物和地下生物联动过程对氮循环起着重要的调节作用,可以改变植物凋落物和根系分泌物以及土壤微生物群落结构和土壤酶活性[70],从而影响湿地生态系统N2O的产生和排放。例如,淡水湖滨人工芦苇湿地的N2O通量高于天然芦苇湿地,主要是因为人工芦苇的生物量更大、根系更加发达,可以为参与氮循环的微生物提供更多的物质和能源[56]。此外,植物群落结构和多样性也可能改变施氮对N2O排放的影响,其影响效应通常取决于不同植物群落的氮素有效性[25,71]。湿地生态系统N2O排放实质上是由微生物驱动的硝化作用和反硝化作用共同调节的,一方面施氮可以显著促进硝化速率和反硝化速率,从而刺激N2O排放[17,19];另一方面,NH4+-N和NO3--N的直接输入也会导致土壤酸化和增加土壤毒性,从而抑制微生物活性并导致N2O排放减少[72]。因此,施氮对湿地N2O排放的影响取决于其对氮循环微生物活性促进作用和抑制作用之间的权衡,未来需要加强湿地N2O排放的生物学机制研究,以便更加准确地评估氮沉降增强情景下的湿地N2O排放及其对全球气候变化的反馈。
本研究首次通过野外原位模拟实验开展了鄱阳湖灰化薹草湿地N2O通量对施氮和增温双因子全球变化的响应研究,研究结果为深入理解全球变化背景下的湖泊湿地N2O收支平衡提供了重要实验数据和理论依据。湿地温室气体通量对全球变化的响应可能随着季节和年际变化而改变[21,29],但本研究及以往的许多全球变化模拟实验研究多是基于短期观测得到的结果[73-74],故而需要加强长期连续观测以深刻理解长时间尺度上的响应特征。实际上,气候变暖、大气氮沉降增加、CO2浓度升高、降水改变等全球变化几乎是同时发生的,但是已开展的全球变化模拟实验有80 % 为单因子、19 % 为双因子、1 % 为三个以上因子,加上多因子交互作用可能呈现复杂的拮抗或协同效应,使得以往大多数实验得到的结果具有一定的局限性[34-36]。因此,考虑到未来全球变化的长期性、多样性和复杂性,后续研究需要重点从长期连续观测和多因子耦合实验来探讨湿地氮循环对全球变化的响应机制。
4 结论1) 鄱阳湖灰化薹草湿地在秋草生长期总体上表现为N2O弱源,N2O通量变化范围为(-1.46±3.27)~(12.67±5.52) μg/(m2·h),平均值为(5.77±1.45) μg/(m2·h),与我国其它地区的薹草湿地N2O通量大体相当。
2) 施氮对鄱阳湖灰化薹草湿地N2O通量有显著影响,施氮可显著提升2.7倍的N2O排放通量,而增温及其与施氮的交互作用对N2O通量的影响不显著。
3) 鄱阳湖灰化薹草湿地N2O排放通量主要受到湿地植物的影响,而与空气温度、土壤温度、土壤水分等因素无显著的相关关系。
| [1] |
Peng SS, Xi Y. Spatiotemporal dynamics of wetland extent and its ecological effects. Bulletin of National Natural Science Foundation of China, 2022, 36(3): 383-390. [彭书时, 席毅. 湿地面积时空变化特征及其生态效应. 中国科学基金, 2022, 36(3): 383-390.] |
| [2] |
Hu SJ, Niu ZG, Chen YF et al. Global wetlands: Potential distribution, wetland loss, and status. Science of the Total Environment, 2017, 586: 319-327. DOI:10.1016/j.scitotenv.2017.02.001 |
| [3] |
Li ZL, Zeng ZQ, Song ZP et al. Vital roles of soil microbes in driving terrestrial nitrogen immobilization. Global Change Biology, 2021, 27(9): 1848-1858. DOI:10.1111/gcb.15552 |
| [4] |
Martínez-Espinosa C, Sauvage S, Al Bitar A et al. Denitrification in wetlands: A review towards a quantification at global scale. Science of the Total Environment, 2021, 754: 142398. DOI:10.1016/j.scitotenv.2020.142398 |
| [5] |
Bahram M, Espenberg M, Pärn J et al. Structure and function of the soil microbiome underlying N2O emissions from global wetlands. Nature Communications, 2022, 13(1): 1430. DOI:10.1038/s41467-022-29161-3 |
| [6] |
Buessecker S, Sarno AF, Reynolds MC et al. Coupled abiotic-biotic cycling of nitrous oxide in tropical peatlands. Nature Ecology & Evolution, 2022, 6: 1881-1890. DOI:10.1038/s41559-022-01892-y |
| [7] |
Zheng YJ, Wu S, Xiao SQ et al. Global methane and nitrous oxide emissions from inland waters and estuaries. Global Change Biology, 2022, 28(15): 4713-4725. DOI:10.1111/gcb.16233 |
| [8] |
Tian HQ, Xu RT, Canadell JG et al. A comprehensive quantification of global nitrous oxide sources and sinks. Nature, 2020, 586: 248-256. DOI:10.1038/s41586-020-2780-0 |
| [9] |
Neubauer SC. Global warming potential is not an ecosystem property. Ecosystems, 2021, 24(8): 2079-2089. DOI:10.1007/s10021-021-00631-x |
| [10] |
Chen H, Ju PJ, Zhu QA et al. Carbon and nitrogen cycling on the Qinghai-Tibetan Plateau. Nature Reviews Earth & Environment, 2022, 3(10): 701-716. DOI:10.1038/s43017-022-00344-2 |
| [11] |
Voigt C, Marushchak ME, Abbott BW et al. Nitrous oxide emissions from permafrost-affected soils. Nature Reviews Earth & Environment, 2020, 1(8): 420-434. DOI:10.1038/s43017-020-0063-9 |
| [12] |
Hugelius G, Loisel J, Chadburn S et al. Large stocks of peatland carbon and nitrogen are vulnerable to permafrost thaw. Proceedings of the National Academy of Sciences, 2020, 117(34): 20438-20446. DOI:10.1073/pnas.1916387117 |
| [13] |
Stevens CJ. Nitrogen in the environment. Science, 2019, 363(6427): 578-580. DOI:10.1126/science.aav8215 |
| [14] |
Ackerman D, Millet DB, Chen X. Global estimates of inorganic nitrogen deposition across four decades. Global Biogeochemical Cycles, 2019, 33(1): 100-107. DOI:10.1029/2018GB005990 |
| [15] |
Liu XJ, Zhang Y, Han WX et al. Enhanced nitrogen deposition over China. Nature, 2013, 494: 459-462. DOI:10.1038/nature11917 |
| [16] |
Yu GR, Jia YL, He NP et al. Stabilization of atmospheric nitrogen deposition in China over the past decade. Nature Geoscience, 2019, 12: 424-429. DOI:10.1038/s41561-019-0352-4 |
| [17] |
Song L, Niu SL. Increased soil microbial AOB amoA and narG abundances sustain long-term positive responses of nitrification and denitrification to N deposition. Soil Biology and Biochemistry, 2022, 166: 108539. DOI:10.1016/j.soilbio.2021.108539 |
| [18] |
Li ZL, Zeng ZQ, Tian DS et al. Global variations and controlling factors of soil nitrogen turnover rate. Earth-Science Reviews, 2020, 207: 103250. DOI:10.1016/j.earscirev.2020.103250 |
| [19] |
You LC, Ros GH, Chen YL et al. Global meta-analysis of terrestrial nitrous oxide emissions and associated functional genes under nitrogen addition. Soil Biology and Biochemistry, 2022, 165: 108523. DOI:10.1016/j.soilbio.2021.108523 |
| [20] |
Chen ML, Chang L, Zhang JM et al. Global nitrogen input on wetland ecosystem: The driving mechanism of soil labile carbon and nitrogen on greenhouse gas emissions. Environmental Science and Ecotechnology, 2020, 4: 100063. DOI:10.1016/j.ese.2020.100063 |
| [21] |
Deng L, Huang CB, Kim DG et al. Soil GHG fluxes are altered by N deposition: New data indicate lower N stimulation of the N2O flux and greater stimulation of the calculated C pools. Global Change Biology, 2020, 26(4): 2613-2629. DOI:10.1111/gcb.14970 |
| [22] |
Gong Y, Wu JH, Vogt J et al. Warming reduces the increase in N2O emission under nitrogen fertilization in a boreal peatland. Science of the Total Environment, 2019, 664: 72-78. DOI:10.1016/j.scitotenv.2019.02.012 |
| [23] |
Jassal RS, Black TA, Roy R et al. Effect of nitrogen fertilization on soil CH4 and N2O fluxes, and soil and bole respiration. Geoderma, 2011, 162(1): 182-186. DOI:10.1016/j.geoderma.2011.02.002 |
| [24] |
Liu LL, Greaver TL. A review of nitrogen enrichment effects on three biogenic GHGs: The CO2 sink may be largely offset by stimulated N2O and CH4 emission. Ecology Letters, 2009, 12(10): 1103-1117. DOI:10.1111/j.1461-0248.2009.01351.x |
| [25] |
Mou XJ, Liu XT, Sun ZG et al. Short-term effect of exogenous nitrogen on N2O fluxes from native and invaded tidal marshes in the Min River Estuary, China. Wetlands, 2019, 39(1): 139-148. DOI:10.1007/s13157-018-1060-3 |
| [26] |
Zhang YH, Wang L, Xie XJ et al. Effects of invasion of Spartina alterniflora and exogenous N deposition on N2O emissions in a coastal salt marsh. Ecological Engineering, 2013, 58: 77-83. DOI:10.1016/j.ecoleng.2013.06.011 |
| [27] |
IP CC. Climate change 2023: Synthesis report. Contribution of working groups Ⅰ, Ⅱ and Ⅲ to the sixth assessment report of the Intergovernmental Panel on Climate Change. Geneva: IPCC, 2023. DOI:10.59327/IPCC/AR6-9789291691647
|
| [28] |
中国气象局气候变化中心. 中国气候变化蓝皮书(2022). 北京: 科学出版社, 2022.
|
| [29] |
Yan WM, Zhong YQW, Yang JY et al. Response of soil greenhouse gas fluxes to warming: A global meta-analysis of field studies. Geoderma, 2022, 419: 115865. DOI:10.1016/j.geoderma.2022.115865 |
| [30] |
Yang JY, Jia XY, Ma HZ et al. Effects of warming and precipitation changes on soil GHG fluxes: A meta-analysis. Science of the Total Environment, 2022, 827: 154351. DOI:10.1016/j.scitotenv.2022.154351 |
| [31] |
Liu SW, Zheng YJ, Ma RY et al. Increased soil release of greenhouse gases shrinks terrestrial carbon uptake enhancement under warming. Global Change Biology, 2020, 26(8): 4601-4613. DOI:10.1111/gcb.15156 |
| [32] |
Zhou YM, Hagedorn F, Zhou CL et al. Experimental warming of a mountain tundra increases soil CO2 effluxes and enhances CH4 and N2O uptake at Changbai Mountain, China. Scientific Reports, 2016, 6: 21108. DOI:10.1038/srep21108 |
| [33] |
Zhu XX, Luo CY, Wang SP et al. Effects of warming, grazing/cutting and nitrogen fertilization on greenhouse gas fluxes during growing seasons in an alpine meadow on the Tibetan Plateau. Agricultural and Forest Meteorology, 2015, 214/215: 506-514. DOI:10.1016/j.agrformet.2015.09.008 |
| [34] |
Rillig MC, Ryo M, Lehmann A et al. The role of multiple global change factors in driving soil functions and microbial biodiversity. Science, 2019, 366(6467): 886-890. DOI:10.1126/science.aay2832 |
| [35] |
Song J, Wan SQ, Piao SL et al. A meta-analysis of 1, 119 manipulative experiments on terrestrial carbon-cycling responses to global change. Nature Ecology & Evolution, 2019, 3(9): 1309-1320. DOI:10.1038/s41559-019-0958-3 |
| [36] |
Zhou LY, Zhou XH, Shao JJ et al. Interactive effects of global change factors on soil respiration and its components: A meta-analysis. Global Change Biology, 2016, 22(9): 3157-3169. DOI:10.1111/gcb.13253 |
| [37] |
Hu QW, Wu Q, Yao B et al. Ecosystem respiration and its components from a Carex meadow of Poyang Lake during the drawdown period. Atmospheric Environment, 2015, 100: 124-132. DOI:10.1016/j.atmosenv.2014.10.047 |
| [38] |
Liu LX, Xu M, Li RQ et al. Timescale dependence of environmental controls on methane efflux from Poyang Hu, China. Biogeosciences, 2017, 14(8): 2019-2032. DOI:10.5194/bg-14-2019-2017 |
| [39] |
Wang HZ, Huang R, Li JR et al. Dissolved and emitted methane in the Poyang Lake. Science China Technological Sciences, 2021, 64(1): 203-212. DOI:10.1007/s11431-020-1594-6 |
| [40] |
Wang SY, Gao Y, Jia JJ et al. Determining whether hydrological processes drive carbon source and sink conversion shifts in a large flood-plain-lake system in China. Water Research, 2022, 224: 119105. DOI:10.1016/j.watres.2022.119105 |
| [41] |
Liu S, Chen YW. Variations and impact factors of CO2 fluxes of Carex cinerascens-dominated and Artemisia selengensis-dominated wetland in Lake Poyang during drawdown periods. J Lake Sci, 2017, 29(6): 1412-1420. [刘胜, 陈宇炜. 退水期鄱阳湖薹草(Carex cinerascens)和藜蒿(Artemisia selengensis)洲滩湿地CO2通量变化及其影响因子. 湖泊科学, 2017, 29(6): 1412-1420. DOI:10.18307/2017.0613] |
| [42] |
Liu LX, Xu M, Lin M et al. Spatial variability of greenhouse gas effluxes and their controlling factors in the Poyang Lake in China. Polish Journal of Environmental Studies, 2013, 22: 749-758. |
| [43] |
Wang HX, Zhang L, Yao XL et al. Dissolved nitrous oxide and emission relating to denitrification across the Poyang Lake aquatic continuum. Journal of Environmental Sciences, 2017, 52: 130-140. DOI:10.1016/j.jes.2016.03.021 |
| [44] |
Xu HX, Jiang XY, Yao XL et al. Characteristics of nitrous oxide (N2O) emissions and the related factors in Lake Poyang. J Lake Sci, 2016, 28(5): 972-981. [徐会显, 姜星宇, 姚晓龙等. 鄱阳湖水体氧化亚氮排放特征及影响因素. 湖泊科学, 2016, 28(5): 972-981. DOI:10.18307/2016.0506] |
| [45] |
Hu QW, Cai JY, Yao B et al. Plant-mediated methane and nitrous oxide fluxes from a Carex meadow in Poyang Lake during drawdown periods. Plant and Soil, 2016, 400(1): 367-380. DOI:10.1007/s11104-015-2733-9 |
| [46] |
戴星照, 胡振鹏. 鄱阳湖资源与环境研究. 北京: 科学出版社, 2019.
|
| [47] |
Cheng JX, Xu LG, Wu JH et al. Responses of ecosystem respiration and methane fluxes to warming and nitrogen addition in a subtropical littoral wetland. Catena, 2022, 215: 106335. DOI:10.1016/j.catena.2022.106335 |
| [48] |
Wang SY, Lu Y, Wen XF et al. Long-term effects of nitrogen deposition on carbon assimilation characteristics in the past three decades in a typical subtropical watershed. Agricultural and Forest Meteorology, 2021, 308/309: 108561. DOI:10.1016/j.agrformet.2021.108561 |
| [49] |
Jurasinski G, Koebsch F, Guenther A et al. Flux rate calculation from dynamic closed chamber measurements. R package version 0.3-0.2014.
|
| [50] |
Minke M, Augustin J, Burlo A et al. Water level, vegetation composition, and plant productivity explain greenhouse gas fluxes in temperate cutover fens after inundation. Biogeosciences, 2016, 13(13): 3945-3970. DOI:10.5194/bg-13-3945-2016 |
| [51] |
Bates D, Mächler M, Bolker BM et al. Fitting linear mixed-effects models using lme4. Journal of Statistical Software, 2015, 67(1): 1-48. DOI:10.18637/jss.v067.i01 |
| [52] |
Wang YY, Zheng XH, Song CC et al. N2O flux in typical wetlands of Sanjiang Plain. Chinese Journal of Applied Ecology, 2006, 17(3): 493-497. [王毅勇, 郑循华, 宋长春等. 三江平原典型沼泽湿地氧化亚氮通量. 应用生态学报, 2006, 17(3): 493-497.] |
| [53] |
Mu CC, Shi LY, Sun XX. Fluxes and controls of CO2, CH4 and N2O in a marsh wetland of Xiaoxing'an Mountains, Northeastern China. Chinese Journal of Plant Ecology, 2009, 33(3): 617-623. [牟长城, 石兰英, 孙晓新. 小兴安岭典型草丛沼泽湿地CO2、CH4和N2O的排放动态及其影响因素. 植物生态学报, 2009, 33(3): 617-623. DOI:10.3773/j.issn.1005-264x.2009.03.021] |
| [54] |
Li YJ, Chen ZL, Wang C et al. Exchange fluxes of N2O between intertidal wetlands and atmosphere during the low and high tides in Yangtze estuary. Resources and Environment in the Yangtze Basin, 2015, 24(3): 408-415. [李杨杰, 陈振楼, 王初等. 长江口潮间带湿地涨退潮期N2O的排放通量研究. 长江流域资源与环境, 2015, 24(3): 408-415. DOI:10.11870/cjlyzyyhj201503009] |
| [55] |
Xu XWH, Zou XQ, Liu JR. Temporal and spatial dynamics of greenhouse gas emissions and its controlling factors in a coastal saline wetland in North Jiangsu. Environmental Science, 2016, 37(6): 2383-2392. [许鑫王豪, 邹欣庆, 刘晶茹. 苏北潮滩温室气体排放的时空变化及影响因素. 环境科学, 2016, 37(6): 2383-2392. DOI:10.13227/j.hjkx.2016.06.049] |
| [56] |
Wang JL, Li YH, Li FD. Emission fluxes of CO2, CH4, and N2O from artificial and natural reed wetlands in Bosten Lake, China. Acta Ecologica Sinica, 2018, 38(2): 668-677. [王金龙, 李艳红, 李发东. 博斯腾湖人工和天然芦苇湿地土壤CO2、CH4和N2O排放通量. 生态学报, 2018, 38(2): 668-677. DOI:10.5846/stxb201610302213] |
| [57] |
Li W, Xu QM, Zhou HK et al. Grazing significantly increases N2O emission rates in alpine meadows of the Tibetan Plateau. Frontiers in Environmental Science, 2022, 10: 920154. DOI:10.3389/fenvs.2022.920154 |
| [58] |
Bai XL, Zhou YK, Wang JH et al. Nitrogen and phosphorus concentration, and storage dynamics of Carex cinerascens during the spring growing season in Poyang Lake wetland. Acta Ecologica Sinica, 2018, 38(13): 4752-4760. [白秀玲, 周云凯, 王杰华等. 鄱阳湖湿地灰化苔草生长季氮磷含量与储量的变化. 生态学报, 2018, 38(13): 4752-4760. DOI:10.5846/stxb201707131273] |
| [59] |
Ma YD, Yue K, Heděnec P et al. Global patterns of rhizosphere effects on soil carbon and nitrogen biogeochemical processes. Catena, 2023, 220: 106661. DOI:10.1016/j.catena.2022.106661 |
| [60] |
Wen M, Hu QW, Yang WJ et al. Effects of nitrogen and phosphorus addition on soil nutrients and plant biomass in a typical Poyang Lake marshland. Chinese Journal of Ecology, 2021, 40(6): 1669-1676. [文旻, 胡启武, 阳文静等. 氮、磷添加对鄱阳湖典型苔草湿地土壤养分和植物生物量的影响. 生态学杂志, 2021, 40(6): 1669-1676. DOI:10.13292/j.1000-4890.202106.035] |
| [61] |
Ward SE, Ostle NJ, Oakley S et al. Warming effects on greenhouse gas fluxes in peatlands are modulated by vegetation composition. Ecology Letters, 2013, 16(10): 1285-1293. DOI:10.1111/ele.12167 |
| [62] |
Cheng JX, Xu LG, Jiang ML et al. Warming increases nitrous oxide emission from the littoral zone of Lake Poyang, China. Sustainability, 2020, 12(14): 5674. DOI:10.3390/su12145674 |
| [63] |
Chen XP, Wang GX, Zhang T et al. Effects of warming and nitrogen fertilization on GHG flux in an alpine swamp meadow of a permafrost region. Science of the Total Environment, 2017, 601/602: 1389-1399. DOI:10.1016/j.scitotenv.2017.06.028 |
| [64] |
Yang P, Tong C. Emission paths and measurement methods for greenhouse gas fluxes from freshwater ecosystems: A review. Acta Ecologica Sinica, 2015, 35(20): 6868-6880. [杨平, 仝川. 淡水水生生态系统温室气体排放的主要途径及影响因素研究进展. 生态学报, 2015, 35(20): 6868-6880. DOI:10.5846/stxb201406231298] |
| [65] |
Liu TT, Wang XF, Yuan XZ et al. Review on N2O emission from lakes and reservoirs. J Lake Sci, 2019, 31(2): 319-335. [刘婷婷, 王晓锋, 袁兴中等. 湖、库水体N2O排放研究进展. 湖泊科学, 2019, 31(2): 319-335. DOI:10.18307/2019.0202] |
| [66] |
Shen ZB, Han YG, Wang JL et al. Nitrogen deposition increases N2O emission in an alpine wetland in the arid region of Northwest China. Arid Zone Research, 2022, 39(5): 1655-1662. [申志博, 韩耀光, 王家力等. 氮沉降促进西北干旱区高寒湿地生态系统N2O排放. 干旱区研究, 2022, 39(5): 1655-1662. DOI:10.13866/j.azr.2022.05.29] |
| [67] |
Wang ZF, Zhang ZX, Guo YF et al. Emission of CH4 and N2O from a wetland at different water depths in Sanjiang Plain and its influence factors. Journal of Northeast Forestry University, 2012, 40(5): 102-106. [王振芬, 张忠学, 郭亚芬等. 三江平原沼泽湿地不同水层下CH4、N2O的排放及影响因子. 东北林业大学学报, 2012, 40(5): 102-106.] |
| [68] |
Mou XJ, Liu XT, Tong C et al. Short-term effects of exogenous nitrogen on CH4 and N2O effluxes from Cyperus malaccensis marsh in the Min River estuary. Environmental Science, 2012, 33(7): 2482-2489. [牟晓杰, 刘兴土, 仝川等. 闽江河口短叶茳芏湿地CH4和N2O排放对氮输入的短期响应. 环境科学, 2012, 33(7): 2482-2489. DOI:10.13227/j.hjkx.2012.07.051] |
| [69] |
温展. 水情变化背景下鄱阳湖典型湿地土壤硝化/反硝化在N2O排放中的作用及微生物学机制[学位论文]. 南昌: 南昌大学, 2022.
|
| [70] |
Song CC, Song YY, Wang XW et al. Advance in researches on carbon and nitrogen cycles in wetland ecosystems under climate change. Wetland Science, 2018, 16(3): 424-431. [宋长春, 宋艳宇, 王宪伟等. 气候变化下湿地生态系统碳、氮循环研究进展. 湿地科学, 2018, 16(3): 424-431.] |
| [71] |
Luan JW, Wu JH, Liu SR et al. Soil nitrogen determines greenhouse gas emissions from northern peatlands under concurrent warming and vegetation shifting. Communications Biology, 2019, 2: 132. DOI:10.1038/s42003-019-0370-1 |
| [72] |
Ning QS, Gu Q, Shen JP et al. Effects of nitrogen deposition rates and frequencies on the abundance of soil nitrogen-related functional genes in temperate grassland of Northern China. Journal of Soils and Sediments, 2015, 15(3): 694-704. DOI:10.1007/s11368-015-1061-2 |
| [73] |
Haase P, Frenzel M, Klotz S et al. The long-term ecological research (LTER) network: Relevance, current status, future perspective and examples from marine, freshwater and terrestrial long-term observation. Ecological Indicators, 2016, 65: 1-3. DOI:10.1016/j.ecolind.2016.01.040 |
| [74] |
Yang YH, Zhang DY, Wei B et al. Nonlinear responses of community diversity, carbon and nitrogen cycles of grassland ecosystems to external nitrogen input. Chinese Journal of Plant Ecology, 2023, 47(1): 1-24. [杨元合, 张典业, 魏斌等. 草地群落多样性和生态系统碳氮循环对氮输入的非线性响应及其机制. 植物生态学报, 2023, 47(1): 1-24. DOI:10.17521/cjpe.2022.0107] |
 2024, Vol. 36
2024, Vol. 36 


