(2: 中国科学院南京地理与湖泊研究所, 南京 210008)
(3: 南昌工程学院, 南昌 330099)
(2: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: Nanchang Institute of Technology, Nanchang 330099, P. R. China)
浮游植物是一类个体小且细胞结构简单的光合生物,它们贡献了地球上几乎一半的初级生产力,在水生态系统的物质循环、能量流动和维持生态系统平衡方面发挥着重要作用[1-2]。浮游植物对环境变化敏感,因此常被作为反映水生态系统健康状况的指示生物[3-4]。近几十年来,由于人类活动影响以及全球变暖,湖库水华反复出现,并进一步使淡水系统生物多样性、生态系统完整性以及稳定性迅速丧失[5]。解译水生生态系统中浮游植物群落的构建机制,是有效预防有害藻类繁殖以及科学管理水生态系统的先决条件[6]。
生态位理论认为环境因素(即确定性过程)主导了浮游植物群落的构建,具体包括资源(比如光和营养盐)的“自下而上”影响和浮游动物与鱼类的“自上而下”调控[7]。与此相反,中性理论认为群落内部物种是等同的,种群动态是由物种出生、死亡和扩散等随机变化驱动,其中扩散受到地理距离增加的限制(即随机性过程)[8]。也有研究发现,确定性和随机性过程共同驱动了水生态系统中浮游植物群落的构建[3-4]。这两类因素对浮游植物群落构建的影响往往在不同研究区域中结果不同[9]。目前,大多数研究都致力于分析水库、封闭型湖泊或单一河流中的浮游植物群落构建机制[3, 10-11],而对于河流连通型湖泊却鲜有相关报道。复杂的河湖生态系统相互关联,加强了营养物质和微生物从上游汇流处向下游湖泊的水平迁移[12-13],增加了浮游植物群落构建的复杂性。此外,以往关于浮游植物群落构建机制的研究通常是基于传统形态分类的浮游植物,鲜有基于浮游植物功能群构建机制的报道。浮游植物功能群最早由Reynolds等[14]提出,是指能在相同生境下生长,有着相似生态特征的浮游植物种类。浮游植物功能群的分类能够更加准确地描述浮游植物的生境特征,它的提出弥补了传统分类学方法在水生态学研究的不足。
鄱阳湖是中国最大的淡水湖,是一个过水性吞吐型湖泊,在丰水期是一个典型的河流连通型湖泊,集赣江、抚河、信江、饶河、修水五大河流之水,调蓄后从湖口汇入长江,年内降水量分配不均匀,表现出“高水是湖、低水似河”的特征,对长江中下游水资源、水环境、水生态和水安全具有重要作用,是长江中下游重要的洪水调蓄区和水资源补给区,在全球迁徙候鸟越冬和长江江豚保护上具有重要的国际地位[15]。目前,关于鄱阳湖浮游植物的研究主要集中于物种组成及环境影响因素方面[16-19],而对于鄱阳湖浮游植物群落构建机制尚不清楚。本研究对丰水期鄱阳湖的浮游植物及环境因子进行调查分析,划分研究区域内的浮游植物功能群,基于生态位理论和中性理论揭示鄱阳湖浮游植物群落及功能群构建机制;如果确定性过程占主导,本研究还将进一步对浮游植物群落和功能群与环境和空间因子进行约束性排序分析,以明确驱动该湖泊浮游植物群落结构变化的具体影响因子。本研究旨在为后续有效预防鄱阳湖藻类水华以及科学管理鄱阳湖水生态系统提供重要的科学依据。
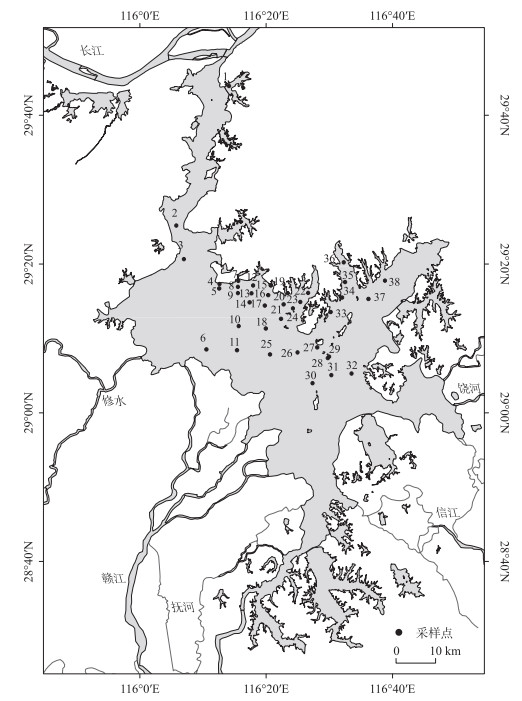
1 材料与方法 1.1 样品采集与分析2020年8月,全湖设置了38个采样点(图 1),包括11个湖湾水域样点(PY01、PY15、PY19、PY22、PY23、PY33~PY38)和27个主航道水域样点(PY02~PY14、PY16~PY18、PY20~PY21、PY24~PY32)。现场使用多参数水质分析仪(EXO2型,YSI公司)测定水体表层的水温(WT)、酸碱度(pH)、电导率(Cond)、溶解氧(DO)、氧化还原电位(ORP)、盐度(Sal)、总溶解性固体(TDS)和浊度(TURB),使用塞氏透明度盘测定水体透明度(SD),使用ZSX-6型流速仪测定水体流速(V),总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝态氮(NO3--N)、正磷酸盐(PO43--P)、高锰酸盐指数(CODMn)和悬浮颗粒物(SS)指标测定参照《湖泊富营养化调查规范》(第二版)[20],叶绿素a(Chl.a)浓度使用热乙醇萃取分光光度计法测定[21]。
|
图 1 鄱阳湖采样点分布(1~38表示采样点PY01~PY38) Fig.1 Distribution of sampling sites in Lake Poyang (1-38 indicate sampling sites PY01-PY38) |
浮游植物定量样品取1 L混合水样,加入1% 的鲁哥试剂进行固定,带回实验室后沉淀浓缩至30 mL,然后在光学显微镜下进行定量计数。浮游植物的鉴定参考《中国淡水藻类:系统、生态及分类》[22]。每个浮游植物样品计数重复3次,最后取其平均值(误差范围±15%)。采用体积转化法估算生物量。参照Reynolds等[14]和Padisák等[23]的方法进行浮游植物功能群的划分。采用Shannon-Wiener多样性指数(H′)[24]、Simpson多样性指数(D)[25]、Pielou均匀度指数(J)[26]和Margalef丰富度指数(d)[27]来分析浮游植物群落多样性。
使用基于距离的Moran特征向量图(distance-based Moran's eigenvector maps, dbMEM)分析方法[28]构建本研究区域的特征空间变量。dbMEM分析使用R语言(4.2.2)“adespatial”包中的dbmen函数进行计算,最后产生6个空间变量,即MEM1、MEM2、MEM3、MEM4、MEM5和MEM6。这些空间变量用于后续的变差分解(variation partitioning)分析和约束性排序(constrained ordination)分析。
1.2 数据处理与分析使用主坐标分析(principal coordinate analysis, PCoA)和相似性分析(analysis of similarities, ANOSIM)识别湖湾水域与主航道水域之间浮游植物及功能群群落结构的差异性。PCoA分析在软件Canoco 5中完成,ANOSIM分析利用R语言“vegan”包来执行anosim函数实现。通过浮游植物群落距离和功能群群落距离(Bray-Curtis距离)分别与地理距离和环境距离(Euclidean距离)之间的关系进行讨论,分析环境异质性(环境距离)和扩散限制(地理距离)对浮游植物群落以及功能群群落构建过程的影响[29-30]。群落Bray-Curtis距离和环境Euclidean距离通过“vegan”包中的vegdist函数实现。基于采样点经纬度,使用R语言“geosphere”包中的distm函数计算地理距离。
通过棋盘得分(checkerboard score, C-score)[31]以及校正随机率(modified stochasticity ratio, MST)[32]分析评估确定性和随机性过程在浮游植物群落以及功能群群落构建中的相对重要性。对于C-score分析,通过比较观测值(observed index)与零模型模拟均值(mean of simulated index)的差异显著性来判断群落构建模式:若二者无显著差异,则随机过程主导群落的构建;若二者存在显著差异,则确定性过程主导群落的构建;此外,C-score分析得到的标准效应量(standardized effect size, SES)可以进一步判断群落中物种共存格局[33]:若SES值>2,则群落表现为竞争性格局;若SES值< -2,则群落表现为促进性格局;若SES值介于-2与2之间,则群落表现为随机性共存格局。对于校正随机率分析,MST值小于和大于0.5分别表示确定性和随机性过程占主导。C-score分析通过使用R语言中“EcoSimR”包实现(30000次随机置换)。校正随机率分析通过使用R语言中“NST”包实现。
运用Canoco 5软件对群落组成与环境以及空间因子进行约束性排序分析。在分析之前,浮游植物和功能群数据均进行Hellinger转化;环境数据除pH以外全部进行lg(x+1)转化;对转化后的环境因子进行共线性分析,删掉方差膨胀因子(variance inflation factors,VIF)大于20的变量。利用Canoco 5软件进行除趋势对应分析(detrended correspondence analysis,DCA),根据分析结果中的第一轴梯度大小确定使用冗余分析还是典范对应分析;然后进行蒙特卡洛检验(499次置换)和前向选择(forward selection)步骤;最后筛选出用来解释浮游植物群落和功能群群落结构变化的驱动因子。运用“vegan”包中的varpart函数比较环境和空间变量对群落(包括浮游植物群落和功能群群落)结构变化的贡献度大小。
2 结果 2.1 浮游植物群落结构特征与多样性 2.1.1 浮游植物种类组成分析本次调查丰水期鄱阳湖共采集到浮游植物91种,隶属于7门59属,其中绿藻门27属46种,占浮游植物总种数的50.5%;硅藻门13属22种,占浮游植物总种数的24.2%;蓝藻门8属11种,占浮游植物总种数的12.1%;甲藻门3属4种,占4.4%;裸藻门和金藻门均为3属3种,均占3.3%;隐藻门种类数最少,仅见2属2种。浮游植物总细胞密度和总生物量范围分别为0.54×106~24.10×106 cells/L和0.11~10.96 mg/L,平均值分别为7.12×106 cells/L和4.43 mg/L(附表Ⅰ)。如附图Ⅰa所示,蓝藻门、绿藻门和硅藻门是浮游植物相对细胞密度较大的3个门类,平均值分别为63.0%、25.6% 和8.8%。这3个门类的细胞密度平均值分别为5.00×106、1.55×106和0.48×106 cells/L(附表Ⅰ)。如附图Ⅰb所示,绿藻门和硅藻门是浮游植物相对生物量较大的两个门类,平均值分别为47.7% 和20.0%。这两个门类的生物量平均值分别为2.29和0.70 mg/L(附表Ⅰ)。
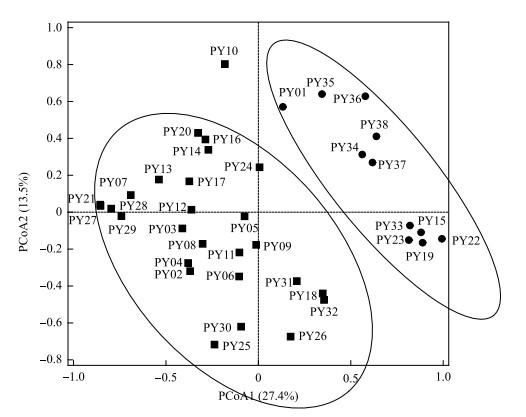
空间上,基于浮游植物群落结构的PCoA结果显示,湖湾水域采样点与主航道水域样点之间呈现分离状态(图 2)。ANOSIM分析显示浮游植物群落结构在湖湾与主航道水域之间差异性显著(r=0.127,P < 0.05)。转板藻(Mougeotia sp.)、假鱼腥藻(Pseudoanabaena sp.)、小球藻(Chlorella vulgaris)、水华长孢藻(Dolichospermum flos-aquae)和巨颤藻(Oscillatoria princes)是湖湾水域浮游植物相对细胞密度排名前5的种类(总和为52.5%),平均值分别为14.2%、12.8%、10.0%、8.5% 和6.9%。而假鱼腥藻和微囊藻(Microcystis sp.)是主航道水域最主要的浮游植物种类(相对细胞密度总和为54.4%),平均值分别为34.5% 和19.9%。主航道水域样点假鱼腥藻相对细胞密度显著高于湖湾样点(Mann-Whitney U test,P < 0.01)。
|
图 2 鄱阳湖浮游植物群落的PCoA排序图(湖湾和主航道样点分别用圆圈和方形表示) Fig.2 PCoA ordination of phytoplankton communities in Lake Poyang (The lake bay and main channel sample sites are represented by circles and squares, respectively) |
鄱阳湖浮游植物的H′值在不同采样点间的变化范围为0.29~2.90,平均值为1.86。空间上,湖湾水域的H′值显著高于主航道水域(Mann-Whitney U test,P < 0.001),湖湾和主航道水域平均值分别为2.21和1.72(表 1)。浮游植物的D值在不同采样点间的变化范围为0.11~0.92,平均值为0.74。空间上,湖湾水域的D值显著高于主航道水域(Mann-Whitney U test,P < 0.001),湖湾和主航道水域平均值分别为0.84和0.70(表 1)。浮游植物的J值在不同采样点间的变化范围为0.16~0.82,平均值为0.60。空间上,湖湾水域的J值显著高于主航道水域(Mann-Whitney U test,P < 0.001),湖湾和主航道水域平均值分别为0.71和0.56(表 1)。浮游植物的d值在不同采样点间的变化范围为0.38~2.22,平均值为1.35。空间上,湖湾水域的d值与主航道水域没有显著性差异(Mann-Whitney U test,P>0.05)(表 1)。上述结果表明,浮游植物物种丰富度在湖湾和主航道两种水域之间没有明显差异,但湖湾浮游植物群落的物种构成要比主航道水域更均匀。
| 表 1 鄱阳湖浮游植物生物多样性指数在不同水域的分布及差异性检验 Tab. 1 Distribution and difference test of phytoplankton diversity indices between different areas in Lake Poyang |
此次调查的鄱阳湖浮游植物可划分为23个功能群,分别为LO、M、S1、MP、H1、E、WS、P、TB、A、B、C、D、X2、Y、W1、W2、G、J、X1、F、T和N。其中,LO、M、S1、MP、H1、P、D、X2、W1、G、J、X1、F和N为常见功能群,出现频率均大于50%;功能群TB、B、C、Y、W2和T仅在适宜的生态环境中出现,出现频率介于20%~50%;E、WS和A为鄱阳湖的偶见或罕见功能群,出现频率仅为5%~8%。
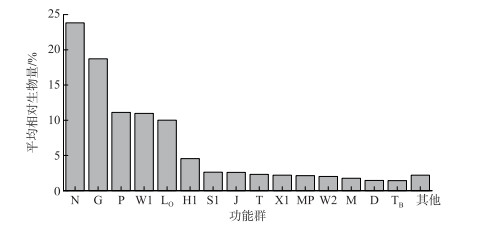
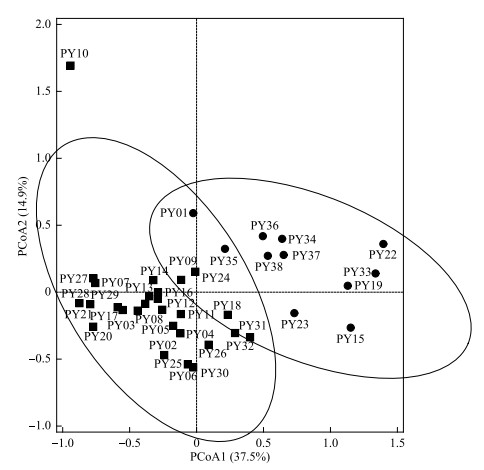
如图 3所示,功能群N、G、P、W1和LO在所有采样点的平均相对生物量均大于5%,为鄱阳湖的优势功能群。其中,功能群N和G的平均相对生物量之和达到43%。功能群N的主要代表性藻属为鼓藻(Cosmarium)、角星鼓藻(Staurastrum)和叉星鼓藻(Staurodesmus)。功能群G的主要代表性藻属为空球藻(Eudorina)和实球藻(Pandorina)。空间上,基于功能群群落结构的PCoA结果显示,湖湾水域与主航道水域采样点之间没有呈现明显分离状态(图 4),ANOSIM分析结果显示,浮游植物功能群结构在湖湾与主航道水域之间没有显著性差异(R=0.052,P>0.05)。
|
图 3 鄱阳湖浮游植物各功能群在所有样点的平均相对生物量 (平均相对生物量 < 1% 的功能群归为其他) Fig.3 Mean relative biomass of each phytoplankton functional group at all sample sites in Lake Poyang (The functional groups at a mean relative biomass of < 1% are included in others) |
|
图 4 鄱阳湖浮游植物功能群群落的PCoA排序图(湖湾和主航道样点分别用圆圈和方形表示) Fig.4 PCoA ordination of phytoplankton functional groups in Lake Poyang (The lake bay and main channel sample sites are represented by circles and squares, respectively) |
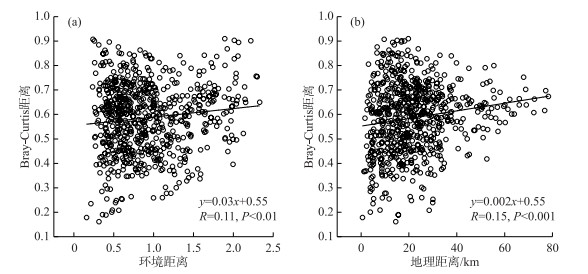
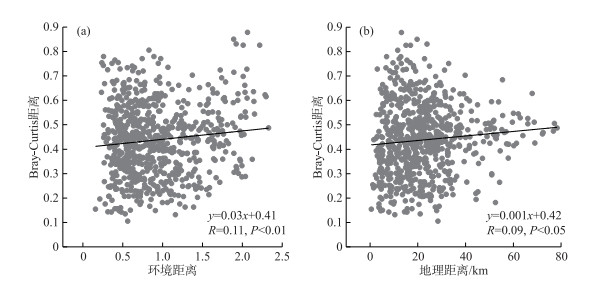
群落Bray-Curtis距离与环境距离(Euclidean距离)的相关关系分析结果(图 5a)表明,丰水期鄱阳湖浮游植物群落差异度随环境距离的增加而显著增加(P < 0.01),即浮游植物群落相似性表现出随环境距离衰减趋势。群落Bray-Curtis距离与地理距离的相关关系分析结果(图 5b)表明,浮游植物群落差异度随地理距离的增加而显著增加(P < 0.001),即浮游植物群落相似性表现出随地理距离衰减趋势。这表明丰水期鄱阳湖浮游植物群落的构建同时受到环境因子和空间距离的影响。与浮游植物群落相同,功能群群落相似性也呈现出随环境距离(P < 0.01)和地理距离(P < 0.05)显著衰减的趋势(图 6),这表明丰水期鄱阳湖浮游植物功能群群落的构建同样受到环境因子和空间距离的共同驱动。
|
图 5 浮游植物群落Bray-Curtis距离与环境距离(a)和地理距离(b)的相关关系 Fig.5 Relationships between Bray-Curtis dissimilarity of phytoplankton community and environmental distance (a) and geographical distance (b) |
|
图 6 浮游植物功能群群落Bray-Curtis距离与环境距离(a)和地理距离(b)的相关关系 Fig.6 Relationships between Bray-Curtis dissimilarity of phytoplankton functional groups and environmental distance (a) and geographical distance (b) |
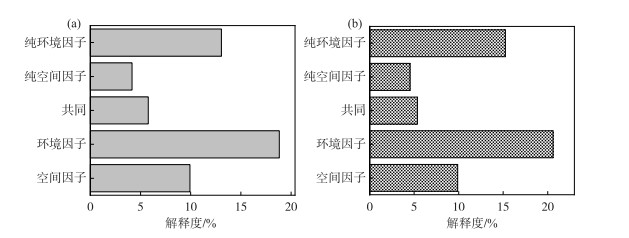
变差分解结果(图 7)显示,丰水期鄱阳湖浮游植物群落和功能群结构受到环境变量和空间变量两类因子的共同影响。单独环境变量和单独空间变量对丰水期鄱阳湖浮游植物群落的解释度分别为13.1% 和4.2%,共同解释度为5.8%,表明环境过滤作用在解释浮游植物群落结构变异中贡献度相对较大。单独环境变量和单独空间变量对丰水期鄱阳湖浮游植物功能群的解释度分别为15.2% 和4.5%,共同解释度为5.4%,表明环境过滤作用在解释功能群群落结构变异中贡献度相对较大。
|
图 7 环境因子与空间因子对浮游植物群落(a)和功能群群落(b)变差分解结果 Fig.7 Variation partitioning results of environmental and spatial factors on the variance of phytoplankton community (a) and functional groups (b) |
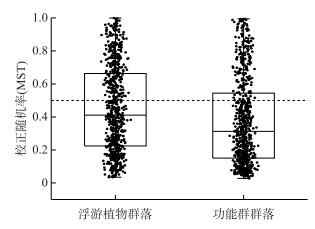
C-score分析结果(表 2)显示,浮游植物群落和功能群群落的观测值均显著高于相对应的零模型模拟均值(P < 0.001),表明确定性过程主导了丰水期鄱阳湖浮游植物群落和功能群群落的构建;标准效应量均大于2,表明丰水期鄱阳湖浮游植物群落和功能群群落均表现出竞争性格局。使用MST量化确定性过程和随机性过程在浮游植物群落和功能群群落构建中的相对重要性。如图 8所示,MST与C-score分析结果相似。对于浮游植物群落,两两样点间校正随机率的平均值为0.45,显著低于0.5阈值线(Wilcoxon test,P < 0.001),这表示丰水期鄱阳湖浮游植物群落构建由确定性过程占主导;对于功能群群落,两两样点间MST的平均值为0.37,显著低于0.5阈值线(Wilcoxon test,P < 0.001),而且低于浮游植物群落,这表示确定性过程主导丰水期鄱阳湖浮游植物功能群群落的构建,并且对功能群群落的影响更大。
| 表 2 鄱阳湖浮游植物群落和功能群群落的C-score分析 Tab. 2 C-score analysis of phytoplankton community and functional groups in Lake Poyang |
|
图 8 鄱阳湖浮游植物群落和功能群群落校正随机率(MST) Fig.8 Modified stochasticity ratio (MST) of phytoplankton community and functional groups in Lake Poyang |
浮游植物细胞密度与环境及空间因子的DCA结果显示,第一轴的长度为2.8,表明使用冗余分析(RDA)能够更加准确地研究浮游植物群落结构变化的驱动因素。基于解释变量的VIF值和前向选择法,最终筛选出4个显著影响因子(Monte Carlo test,P < 0.05)来解释浮游植物群落结构变化,包括环境因子TURB、Cond和CODMn,以及空间因子MEM1(图 9a)。这些因子共解释了20.4% 的浮游植物变化率。将浮游植物主要种类假鱼腥藻、微囊藻、水华长孢藻和小球藻(平均相对细胞密度分别为28.2%、14.2%、10.6% 和6.5%)与上述3个环境影响因子进行Spearman相关性分析,结果显示TURB与假鱼腥藻呈显著正相关(P < 0.05);Cond与微囊藻呈显著正相关(P < 0.05);CODMn与水华长孢藻呈显著正相关(P < 0.05)。
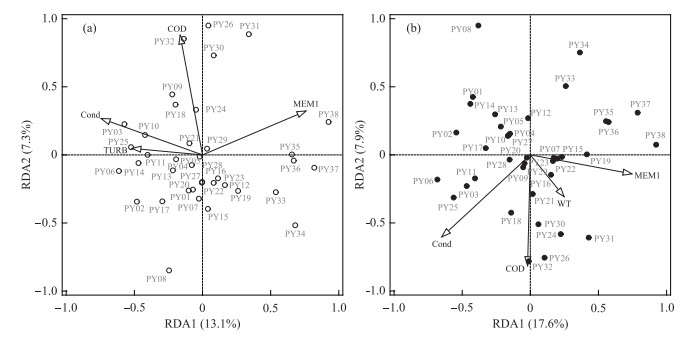
|
图 9 鄱阳湖浮游植物群落(a)和功能群群落(b)与显著影响因子(Monte Carlo test, P < 0.05)的RDA排序图 Fig.9 RDA ordination showing the relationship between the significant variables (Monte Carlo test, P < 0.05) and phytoplankton community (a) and functional groups (b) in Lake Poyang |
功能群细胞密度与环境及空间因子的DCA结果显示,第一轴的长度为2.1,表明使用RDA能够更加准确地研究功能群群落结构变化的驱动因素。基于解释变量的VIF值和前向选择法,最终筛选出4个显著影响因子(Monte Carlo test,P < 0.05)来解释功能群群落结构变化,包括环境因子Cond、CODMn和WT,以及空间因子MEM1(图 9b)。这些因子共解释了25.5% 的功能群变化率。将主要功能群S1、M、H1、X1、P和MP(平均相对细胞密度分别为28.2%、14.2%、13.0%、6.7%、6.6% 和6.1%)与上述3个环境影响因子进行Spearman相关性分析,结果显示Cond与功能群M呈显著正相关(P < 0.05);CODMn与功能群H1和P分别呈显著正相关和负相关(P < 0.05);WT与功能群H1呈显著正相关(P < 0.05)。
3 讨论 3.1 鄱阳湖浮游植物群落结构特征分析本次浮游植物种类组成调查结果与Yu等[16]对鄱阳湖的调查结果一致,共发现7个门类,分别是绿藻门、硅藻门、蓝藻门、甲藻门、裸藻门、金藻门和隐藻门,其中绿藻门、硅藻门和蓝藻门是种类数最多的3个门类。空间上,丰水期鄱阳湖浮游植物群落结构在湖湾与主航道水域之间存在差异,这与Liu等[17]的研究结果类似。本研究结果还显示,两种水华蓝藻(假鱼腥藻和微囊藻)是主航道水域最主要的浮游植物种类,相对细胞密度明显高于湖湾。钱奎梅等[34]的研究发现,在鄱阳湖春季较低水位时水华蓝藻在水流较缓的内湾生长分布,并逐渐形成水华,在夏、秋季高水位时在水流和风的作用下向主航道输移聚集,这可能是导致假鱼腥藻与微囊藻成为主航道水域优势物种的原因之一。多样性分析结果表明,湖湾浮游植物群落的物种构成要比主航道水域更均匀,这可能与丰水期水华蓝藻由湖湾向主航道输移有关[32]。
本次调查发现的21个功能群(LO、M、S1、MP、H1、E、P、A、B、C、D、X2、Y、W1、W2、G、J、X1、F、T和N)都曾在鄱阳湖中被检出[18, 35-36]。此次调查还检出了鄱阳湖2个新功能群,分别是WS和TB,它们曾被发现于金泽水库中[37]。本调查结果还显示,鼓藻、角星鼓藻、叉星鼓藻等构成的功能群N,空球藻、实球藻等构成的功能群G,颗粒沟链藻(Aulacoseira granulata)等构成的功能群P,裸藻(Euglena sp.)等构成的功能群W1和多甲藻(Peridinium sp.)、裸甲藻(Gymnodinium aerucyinosum)等构成的功能群LO为鄱阳湖的优势功能群。它们所指示的生境特征表明鄱阳湖存在富营养化风险。
3.2 鄱阳湖浮游植物群落构建机制分析集合群落(metacommunity)理论认为,环境过滤作用和空间扩散限制作用共同决定了生物群落的构建[38]。地理距离常被用来衡量微生物群落的扩散能力[39]。通过地理距离和环境距离分别与群落构建距离衰减模式,可用于讨论扩散限制作用和环境过滤作用对浮游植物群落构建的影响[40]。在本研究中,浮游植物群落相似性表现出地理和环境距离衰减趋势,这表明环境过滤作用和空间扩散限制作用共同影响了鄱阳湖浮游植物群落的构建,这与Meng等[3]对安徽武昌湖和Xiao等[4]对长江中下游湖泊的调查结果一致。此外,本研究发现鄱阳湖浮游植物功能群群落的构建同样也受到环境过滤作用和空间扩散限制作用的共同驱动,这与Xiao等[4]对长江中下游81个洪泛区湖泊的研究结论一致。
本研究采用变差分解分析、C-score分析和校正随机率分析方法进一步评估确定性(环境过滤作用)和随机性过程(空间扩散限制作用)在鄱阳湖浮游植物群落构建中的相对重要性。上述分析结果均表明确定性过程主导了鄱阳湖浮游植物群落构建,空间扩散限制作用在解释群落结构变化中贡献度相对较小,这与Meng等[3]对雨季武昌湖的调查结果不同。有研究认为,确定性和随机性过程的相对重要性与研究区域尺度有关[41],即在小尺度区域(数千米),浮游植物很容易在不同地点进行迁移扩散,群落构建只受环境因素影响;随着区域尺度的增大,地理距离逐渐成为限制浮游植物扩散的重要因素,与环境因素一起共同影响浮游植物群落构建。与长江中下游洪泛区绝大多数封闭型湖泊不同,鄱阳湖为过水性吞吐型湖泊,年均换水周期为17~19 d[42]。鄱阳湖较短的换水周期预示着浮游植物被动迁移扩散能力更强,这无疑弱化了地理距离的影响。有研究发现,鄱阳湖水环境状况具有较高空间异质性[17],这可能与污染物河流入湖以及鄱阳湖不同区域受人为活动影响大小不同有关。较短的换水周期和较大的环境条件差异可能是导致确定性过程主导鄱阳湖浮游植物群落构建的原因之一。与浮游植物群落研究结果相同的是,本研究发现鄱阳湖浮游植物功能群群落的构建同样是确定性过程占主导地位;不同的是,功能群群落的环境变量解释度(15.2%)高于浮游植物群落(13.1%),且功能群群落的平均校正随机率(0.37)低于浮游植物群落(0.45),这表明确定性过程对浮游植物功能群群落构建的影响更大,其原因可能是:功能群是由一群具有共同生理生态特征的浮游植物构成[14, 23],这使得它们与浮游植物群落相比,对环境变化的敏感性更大。
本研究中,浊度、高锰酸盐指数和电导率是驱动鄱阳湖浮游植物群落结构变化的主要环境因素,这一结果与鄱阳湖的前期研究结果相似[18, 43]。浊度是反映水下光照条件的重要水质参数,它与水生态系统的初级生产力和浮游植物生长密切相关[44]。有研究发现,藻类对低光照条件的适应性存在物种差异,不同藻类的光饱和强度不同[45]。本研究结果显示,浊度与假鱼腥藻的相对细胞密度呈显著正相关(P < 0.05),这与Sun等[46]对独流减河的调查结果一致,表明假鱼腥藻对低光照条件较好的适应性使其具有较高的生长优势。高锰酸盐指数反映了水体有机物浓度,是评估水环境质量状况的重要参数,是鄱阳湖污染物入湖总量中负荷比最高的一类,可达80% 以上[42]。本研究发现高锰酸盐指数与水华长孢藻呈显著正相关(P < 0.05)。长孢藻属是鄱阳湖一类常见水华蓝藻[34]。水体中有机物浓度越高预示着微生物氧化分解产生的可被浮游植物利用的营养盐越多[47]。因此,水华长孢藻的生长可能与微生物分解有机物过程有关。电导率是监测水环境质量的重要指标,与水体营养盐浓度呈正相关[48]。在本研究中,微囊藻与电导率呈显著正相关(P < 0.05),这与Barros等[49]对巴西20个饮用水水库的调查结果一致。目前,关于电导率对微囊藻生长的影响机制还不清楚,有待于结合水体营养盐进一步研究。
温度、电导率和高锰酸盐指数是驱动鄱阳湖浮游植物功能群群落结构变化的主要环境因素,这与我国鄱阳湖、呼伦湖以及巴西饮用水源水库前期调查结果相似[35, 50-51]。温度影响水体营养盐扩散、藻细胞内酶的活性和代谢速率,是控制浮游植物生长繁殖的重要因子[52-53]。在本研究发现,功能群H1与温度呈显著正相关(P < 0.05),这与Ma等[54]对Okeechobee湖(美国)的研究结果相似。本文中功能群H1由隶属于蓝藻门的物种项圈藻(Anabaenopsis sp.)和水华长孢藻构成。有研究表明,蓝藻种类具有喜温习性[55]。在本研究中,电导率和高锰酸盐指数除了影响鄱阳湖浮游植物群落结构,还是驱动其功能群群落结构变化的重要因素。本研究发现电导率与功能群M呈显著正相关(P < 0.05)。功能群M主要由微囊藻组成。Barros等[49]对巴西20个饮用水水库调查结果表明,水体中较高电导率有利于微囊藻增殖。Ma等[51]发现呼伦湖功能群H1与高锰酸盐指数呈正相关,本研究结果与其一致。高锰酸盐指数反映了水体有机物浓度,其值越高说明微生物氧化分解产生的可被浮游植物利用的营养盐越多[47]。因此,功能群H1的增殖可能与水体中微生物分解有机物过程有关。
4 结论1) 鄱阳湖湖湾水域浮游植物群落结构与主航道水域存在明显差异,湖湾浮游植物群落的物种构成比主航道更均匀。
2) 鄱阳湖浮游植物群落及功能群群落的构建过程均同时受到环境过滤作用和空间扩散限制作用的影响,其中环境过滤作用占据主导地位且对功能群群落的构建过程影响更大。
3) 浊度、高锰酸盐指数和电导率是驱动鄱阳湖浮游植物群落结构变化的最重要环境因素。
4) 温度、电导率和高锰酸盐指数是影响鄱阳湖浮游植物功能群群落结构的主要环境因素。
5 附录附表Ⅰ和附图Ⅰ见电子版(DOI: 10.18307/2024.0512)。
| 附表Ⅰ 鄱阳湖浮游植物各类群细胞密度和生物量 Appendix Ⅰ Cell abundance and biomass of different phytoplankton taxa in Lake Poyang |
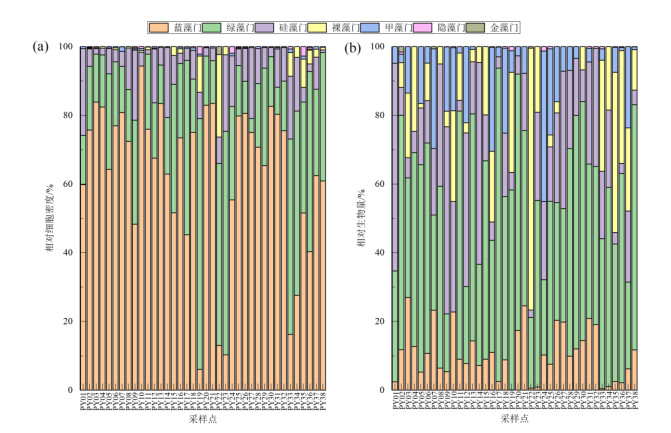
|
附图Ⅰ 鄱阳湖不同采样点浮游植物各类群相对细胞密度与相对生物量 AttachedFig1 Relative cell abundance and relative biomass of different phytoplankton taxa among different sampling sites in Lake Poyang |
致谢: 感谢南昌工程学院陈宇炜教授对本文的修改完善提供的建议。
| [1] |
Cardinale BJ, Palmer MA, Collins SL. Species diversity enhances ecosystem functioning through interspecific facilitation. Nature, 2002, 415: 426-429. DOI:10.1038/415426a |
| [2] |
Field CB, Behrenfeld MJ, Randerson JT et al. Primary production of the biosphere: Integrating terrestrial and oceanic components. Science, 1998, 281(5374): 237-240. DOI:10.1126/science.281.5374.237 |
| [3] |
Meng ZH, Chen K, Hu FF et al. Environmental and spatial factors play different roles in phytoplankton community assembly in different hydrological seasons in Lake Wuchang, China. Frontiers in Ecology and Evolution, 2023, 11: 1154695. DOI:10.3389/fevo.2023.1154695 |
| [4] |
Xiao Z, Li H, Li XC et al. Geographic pattern of phytoplankton community and their drivers in lakes of middle and lower reaches of Yangtze River floodplain, China. Environmental Science and Pollution Research, 2022, 29(55): 83993-84005. DOI:10.1007/s11356-022-21657-1 |
| [5] |
Huisman J, Codd GA, Paerl HW et al. Cyanobacterial blooms. Nature Reviews Microbiology, 2018, 16(8): 471-483. DOI:10.1038/s41579-018-0040-1 |
| [6] |
Wu SH, Dong YZ, Stoeck T et al. Geographic characteristics and environmental variables determine the diversities and assembly of the algal communities in interconnected river-lake system. Water Research, 2023, 233: 119792. DOI:10.1016/j.watres.2023.119792 |
| [7] |
Reynolds CS. Ecology of phytoplankton. Cambridge: Cambridge University Press, 2006.
|
| [8] |
Hubbell SP. A unified neutral theory of biodiversity and biogeography. Princeton: Princeton University Press, 2001.
|
| [9] |
Vilmi A, Tolonen KT, Karjalainen SM et al. Metacommunity structuring in a highly-connected aquatic system: Effects of dispersal, abiotic environment and grazing pressure on microalgal guilds. Hydrobiologia, 2017, 790(1): 125-140. DOI:10.1007/s10750-016-3024-z |
| [10] |
Yang SX, Yang Q, Li XD et al. Deterministic processes dominate the geographic distribution pattern and community assembly of phytoplankton in typical plateau rivers. Biodiversity Science, 2023, 31(7): 43-57. [杨胜娴, 杨清, 李晓东等. 确定性过程主导高原典型河流浮游植物地理分布格局和群落构建. 生物多样性, 2023, 31(7): 43-57. DOI:10.17520/biods.2023092] |
| [11] |
Chen K, Men ZH, Li XM et al. Phytoplankton community structure and driving mechanism of its construction process in autumn in Zhelin Reservoir, Lake Poyang Basin. J Lake Sci, 2022, 34(2): 433-444. [陈康, 孟子豪, 李学梅等. 鄱阳湖流域柘林水库秋季浮游植物群落结构及其构建过程驱动机制. 湖泊科学, 2022, 34(2): 433-444. DOI:10.18307/2022.0206] |
| [12] |
Naselli-Flores L, Termine R, Barone R. Phytoplankton colonization patterns. Is species richness depending on distance among freshwaters and on their connectivity?. Hydrobiologia, 2016, 764(1): 103-113. DOI:10.1007/s10750-015-2283-4 |
| [13] |
Padisák J, Vasas G, Borics G. Phycogeography of freshwater phytoplankton: Traditional knowledge and new molecular tools. Hydrobiologia, 2016, 764(1): 3-27. DOI:10.1007/s10750-015-2259-4 |
| [14] |
Reynolds CS, Huszar V, Kruk C et al. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [15] |
Kou WB, Huang ZY, Zhang J et al. Bacterial community structure and composition in Lake Poyang: A case study in the Songmenshan Region, China. Acta Ecologica Sinica, 2015, 35(23): 7608-7614. [寇文伯, 黄正云, 张杰等. 鄱阳湖湖泊细菌群落组成及结构——以松门山为例. 生态学报, 2015, 35(23): 7608-7614. DOI:10.5846/stxb201405030873] |
| [16] |
Yu XP, Chen YW, Wang JJ et al. Spatio-temporal distribution characteristics and driving factors of phytoplankton community in Duchang Migratory Bird Nature Reserve of Lake Poyang, China: A 9-year study. Environmental Science and Pollution Research, 2023, 30(32): 79376-79385. DOI:10.1007/s11356-023-27407-1 |
| [17] |
Liu X, Qian KM, Chen YW et al. A comparison of factors influencing the summer phytoplankton biomass in China's three largest freshwater lakes: Poyang, Dongting, and Taihu. Hydrobiologia, 2017, 792(1): 283-302. DOI:10.1007/s10750-016-3063-5 |
| [18] |
Liu JF, Chen YW, Li MJ et al. Water-level fluctuations are key for phytoplankton taxonomic communities and functional groups in Poyang Lake. Ecological Indicators, 2019, 104: 470-478. DOI:10.1016/j.ecolind.2019.05.021 |
| [19] |
Xiong LL, Fang SW, Li KY et al. Temporal distribution patterns of phytoplankton and their drivers in Lake Poyang (China)—A monthly study from 2011 to 2019. Ecological Indicators, 2021, 133: 108435. DOI:10.1016/j.ecolind.2021.108435 |
| [20] |
金相灿, 屠清瑛. 湖泊富营养化调查规范: 第二版. 北京: 中国环境科学出版社, 1990.
|
| [21] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法" 及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [22] |
魏印心, 胡鸿钧. 中国淡水藻类: 系统、生态及分类. 北京: 科学出版社, 2006.
|
| [23] |
Padisák J, Crossetti LO, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification: A critical review with updates. Hydrobiologia, 2009, 621(1): 1-19. DOI:10.1007/s10750-008-9645-0 |
| [24] |
Shannon CE, Weaver W, Wiener N. The mathematical theory of communication. Urbana: The University of Illinois Press, 1949.
|
| [25] |
Simpson EH. Measurement of diversity. Nature, 1949, 163: 688. DOI:10.1038/163688a0 |
| [26] |
Margalef R. Information theory in ecology. General System, 1958, 3: 36-71. |
| [27] |
Pielou EC. Species-diversity and pattern-diversity in the study of ecological succession. Journal of Theoretical Biology, 1966, 10(2): 370-383. DOI:10.1016/0022-5193(66)90133-0 |
| [28] |
Daniel B, Francois G, Pierre L. Numerical ecology with R. New York: Springer, 2011.
|
| [29] |
Nekola JC, White PS. The distance decay of similarity in biogeography and ecology. Journal of Biogeography, 1999, 26(4): 867-878. DOI:10.1046/j.1365-2699.1999.00305.x |
| [30] |
Hanson CA, Fuhrman JA, Horner-Devine MC et al. Beyond biogeographic patterns: Processes shaping the microbial landscape. Nature Reviews Microbiology, 2012, 10: 497-506. DOI:10.1038/nrmicro2795 |
| [31] |
Stone L, Roberts A. The checkerboard score and species distributions. Oecologia, 1990, 85(1): 74-79. DOI:10.1007/BF00317345 |
| [32] |
Wang JY, Huo D, Guo CX et al. Vertical distribution characteristics and influencing factors of phytoplankton community structure in Qiandao Lake. Environmental Science, 2022, 43(7): 3575-3586. [王吉毅, 霍翟, 国超旋等. 千岛湖浮游植物群落结构的垂向分布特征及其影响因素. 环境科学, 2022, 43(7): 3575-3586.] |
| [33] |
Ding XF, Hao G, Dong K et al. Effects of pruning Caragana microphylla shrubs on the spatial distribution patterns of neighbouring plant communities. Acta Ecologica Sinica, 2019, 39(11): 4011-4020. [丁新峰, 郝广, 董轲等. 平茬处理对小叶锦鸡儿灌丛邻居植物群落空间格局的影响. 生态学报, 2019, 39(11): 4011-4020. DOI:10.5846/stxb201805161085] |
| [34] |
Qian KM, Liu X, Duan M et al. Distribution and its influencing factors of bloom-forming cyanobacteria in Poyang Lake. China Environmental Science, 2016, 36(1): 261-267. [钱奎梅, 刘霞, 段明等. 鄱阳湖蓝藻分布及其影响因素分析. 中国环境科学, 2016, 36(1): 261-267. DOI:10.3969/j.issn.1000-6923.2016.01.043] |
| [35] |
Qian KM, Liu BG, Chen YW. Long term dynamics of phytoplankton functional groups in Lake Poyang during 2009-2016. J Lake Sci, 2019, 31(4): 1035-1044. [钱奎梅, 刘宝贵, 陈宇炜. 鄱阳湖浮游植物功能群的长期变化特征(2009—2016年). 湖泊科学, 2019, 31(4): 1035-1044. DOI:10.18307/2019.0402] |
| [36] |
Wu Q, Zhu ZG, Chen YW et al. Phytoplankton community structure characteristics and evaluation of water quality health status in dish-shaped lakes in Poyang Lake. Journal of Nanchang Institute of Technology, 2023, 42(4): 12-20, 27. [吴强, 朱志刚, 陈宇炜等. 鄱阳湖碟形湖浮游植物群落结构特征及水质健康状况评价. 南昌工程学院学报, 2023, 42(4): 12-20, 27. DOI:10.3969/j.issn.1006-4869.2023.04.003] |
| [37] |
Zhao D, Wang WT, Chen SY et al. Temporal and spatial variation of phytoplankton functional groups in Jinze Reservoir. Acta Scientiae Circumstantiae, 2022, 42(11): 445-454. [赵丹, 王文婷, 陈诗雨等. 金泽水库浮游植物功能群时空变化特征. 环境科学学报, 2022, 42(11): 445-454. DOI:10.13671/j.hjkxxb.2022.0095] |
| [38] |
Leibold MA, Holyoak M, Mouquet N et al. The metacommunity concept: A framework for multi-scale community ecology. Ecology Letters, 2004, 7(7): 601-613. DOI:10.1111/j.1461-0248.2004.00608.x |
| [39] |
Melo AS, Schneck F, Hepp LU et al. Focusing on variation: Methods and applications of the concept of beta diversity in aquatic ecosystems. Acta Limnologica Brasiliensia, 2012, 23(3): 318-331. DOI:10.1590/s2179-975x2012005000010 |
| [40] |
Sun Y, Li HJ, Wang XC et al. Phytoplankton and microzooplankton community structure and assembly mechanisms in northwestern Pacific Ocean Estuaries with environmental heterogeneity and geographic segregation. Microbiology Spectrum, 2023, 11(2): e0492622. DOI:10.1128/spectrum.04926-22 |
| [41] |
Izaguirre I, Saad JF, Schiaffino MR et al. Drivers of phytoplankton diversity in Patagonian and Antarctic lakes across a latitudinal gradient (2150 km): The importance of spatial and environmental factors. Hydrobiologia, 2016, 764(1): 157-170. DOI:10.1007/s10750-015-2269-2 |
| [42] |
戴星照, 胡振鹏. 鄱阳湖资源与环境研究. 北京: 科学出版社, 2019.
|
| [43] |
Qian KM, Liu X, Chen YW. Effects of water level fluctuation on phytoplankton succession in Poyang Lake, China-A five year study. Ecohydrology & Hydrobiology, 2016, 16(3): 175-184. DOI:10.1016/j.ecohyd.2016.08.001 |
| [44] |
Bilotta GS, Brazier RE. Understanding the influence of suspended solids on water quality and aquatic biota. Water Research, 2008, 42(12): 2849-2861. DOI:10.1016/j.watres.2008.03.018 |
| [45] |
Ye YY, Xiang P, Wang L et al. The structure and distribution of phytoplankton community in the Nanliu River Estuary during spring. Haiyang Xuebao, 2017, 39(10): 111-123. [叶又茵, 项鹏, 王磊等. 南流江河口区春季浮游植物群落结构组成与分布特征. 海洋学报, 2017, 39(10): 111-123.] |
| [46] |
Sun XW, Zhang HY, Wang ZY et al. Phytoplankton community response to environmental factors along a salinity gradient in a seagoing river, Tianjin, China. Microorganisms, 2022, 11(1): 75. DOI:10.3390/microorganisms11010075 |
| [47] |
Li JJ, Liu W, Deng PY. The effects of water quality on epilithic diatom community in different hydrological seasons in Liujiang River Basin. Ecological Science, 2020, 39(1): 10-19. [李佳静, 刘威, 邓培雁. 柳江流域不同水文季节水质对附生硅藻群落的影响研究. 生态科学, 2020, 39(1): 10-19.] |
| [48] |
Chen XJ, Yang J, Hugejiletu H et al. Seasonal dynamics of phytoplankton and its relationship with environmental factors of a Chinese lake. Polish Journal of Environmental Studies, 2016, 25(4): 1427-1433. DOI:10.15244/pjoes/62257 |
| [49] |
Barros MUG, Wilson AE, Leitão JIR et al. Environmental factors associated with toxic cyanobacterial blooms across 20 drinking water reservoirs in a semi-arid region of Brazil. Harmful Algae, 2019, 86: 128-137. DOI:10.1016/j.hal.2019.05.006 |
| [50] |
Amorim CA, do Nascimento Moura A. Habitat templates of phytoplankton functional groups in tropical reservoirs as a tool to understand environmental changes. Hydrobiologia, 2022, 849(5): 1095-1113. DOI:10.1007/s10750-021-04750-3 |
| [51] |
Ma CX, Zhao C, Mwagona PC et al. Bottom-up and top-down effects on phytoplankton functional groups in Hulun Lake, China. Annales De Limnologie - International Journal of Limnology, 2021, 57: 3. DOI:10.1051/limn/2020028 |
| [52] |
Li Y, Xiao LJ, Lin QQ et al. Phytoplankton community in a newly constructed reservoir—Jiantan Reservoir, South China. J Lake Sci, 2010, 22(2): 227-234. [李莹, 肖利娟, 林秋奇等. 一座新建水库——广东剑潭水库浮游植物动态特征. 湖泊科学, 2010, 22(2): 227-234. DOI:10.18307/2010.0212] |
| [53] |
Fang LJ, Liu DF, Yang ZJ et al. Experimental study on the influence of water temperature on phytoplankton community structure. Environmental Science & Technology, 2014, 37(S2): 45-50. [方丽娟, 刘德富, 杨正健等. 水温对浮游植物群落结构的影响实验研究. 环境科学与技术, 2014, 37(S2): 45-50.] |
| [54] |
Ma CX, Li ZY, Mwagona PC et al. Spatial and seasonal dynamics of phytoplankton groups and its relationship with environmental variables in Lake Okeechobee, USA. Journal of Freshwater Ecology, 2022, 37(1): 173-187. DOI:10.1080/02705060.2022.2032852 |
| [55] |
Ma CX, Mwagona PC, Yu HX et al. Spatial and temporal variation of phytoplankton functional groups in extremely alkaline Dali Nur Lake, North China. Journal of Freshwater Ecology, 2019, 34(1): 91-105. DOI:10.1080/02705060.2018.1554545 |
 2024, Vol. 36
2024, Vol. 36 


