(2: 黄河流域内蒙古段生态保护与综合利用自治区协同创新中心, 包头 014010)
(3: 内蒙古自治区乌兰察布市生态环境局凉城县分局, 乌兰察布 013750)
(2: Collaborative Innovation Center of Autonomous Region for Ecological Protection and Comprehensive Utilization in the Inner Mongolia Section of the Yellow River Basin, Baotou 014010, P. R. China)
(3: Liang Cheng County Branch of Ecological Environment Bureau of Ulanqab City, Inner Mongolia Autonomous Region, Ulanqab 013750, P. R. China)
近年来,随着气候环境变化和人为干预,富营养化和生物多样性减少成为我国湖泊普遍面临的问题[1]。湖泊富营养化状态可促进蓝藻大面积增长,进而诱发一系列的水体安全风险[2]。蓝藻作为湖泊重要的初级生产者,比大多数真核生物具有更强的适应性,能在极端环境中生长和繁殖。深入了解蓝藻的生活习性将有助于湖泊治理[3]。目前关于蓝藻的相关研究多集中于东部湖区等温暖的不冻湖区,针对蒙新湖区寒旱区湖泊的研究相对较少,季节性冰封使得寒旱区湖泊水体环境较为复杂,冰封过程对湖泊生态环境造成了显著的影响,随着结冰过程的盐分排出,冰下水体各类营养盐浓度升高,可引发或加剧湖泊富营养化[4-5]。冰封期蓝藻群落特征及自身生长代谢与温暖的不冻湖泊也具有显著差异,研究指出,低温刺激下部分蓝藻生长和代谢会发生改变,从而加剧来年气温回升后蓝藻水华暴发风险和水质恶化程度[6-7]。部分蓝藻在低温条件下仍较为活跃,罕见的低温水华现象也被相继报道,更多证据表明低温环境下蓝藻依旧可为湖泊带来直接或间接隐患[8-9]。近年来有关蓝藻的生物防治措施逐渐被关注,相比于传统的控制内、外源营养盐负荷的方法,生物防治法在长期水华防治上更具备优势,因此,关于蓝藻与其他物种相互作用的相关研究相继开展[10-13]。细菌作为湖泊生态系统的重要参与者与蓝藻具有密切的关系,细菌与蓝藻同源性较高,一些异养细菌通过吸附在蓝藻细胞获取养分。细菌与蓝藻也存在敌对拮抗的关系,部分细菌能够抑制甚至可以裂解藻细胞[12, 14-15]。菌藻之间通过互利共生、竞争抑制及敌对拮抗等方式紧密联系,环境因子通过影响细菌与蓝藻群落组成的变化,进而影响或改变两者之间的相互关系,如细菌可将硝态氮(NO3--N)转化成氨氮(NH3-N)等氮形态,NH3-N则可直接被藻类吸收,进而促进蓝藻生长,而蓝藻大量繁殖所产生的蓝藻毒素会反过来影响一些氮转化菌的群落结构,导致部分细菌群落丰度下降[16-17]。寒旱区湖泊地理位置和气候条件特殊,冬季时冰封水体的营养盐浓度及微生物群落结构均具有一定的典型性及特殊性,因此细菌与蓝藻的相互关系必然会受到影响[18]。然而关于寒旱区湖泊冰封过程中菌藻关系的研究仍偏少,菌藻群落对水环境变化的响应及冰封期时菌藻体系特征也尚不明确,开展该区域的研究对于了解冰封期湖泊生态系统至关重要。乌梁素海、岱海、南海湖均位于蒙新湖区,是典型的寒旱区湖泊,乌梁素海是全球荒漠半荒漠地区极为少见的大型草原湖泊,在维持黄河流域生态平衡中发挥重要作用,是寒旱区大型淡水湖泊代表[19]。岱海是内蒙古第三大内陆湖,与呼伦湖、乌梁素海共同称为“一湖两海”,是我国北疆的重要生态屏障,2015—2020年岱海水体平均盐度达到12.82 ‰,与同纬度湖泊相比盐度处于中高水平,是典型的内陆咸水湖[20-21]。南海湖位于内蒙古包头市,作为小型城市浅水湖泊,受自然和人为双重因素影响,不仅具有寒旱区湖泊特征,也是小型城市湖泊的典型代表[22]。选择3个不同类型湖泊进行对比研究,将有助于更深入全面地探究寒旱区湖泊在冰封期间蓝藻和细菌之间的群落特征及相互关系,揭示冰封期不同类型湖泊水体细菌与蓝藻网络结构的差异性和一致性。细菌与蓝藻是湖泊生态系统结构与功能的重要调控者,继续对其相互关系进行探索对于了解我国北方湖泊冬季细菌与蓝藻群落组成及其生态学功能具有一定的意义,可为寒旱区湖泊生态环境保护和修复提供一定的理论支撑。
1 材料与方法 1.1 研究区概况及采样点布设黄河流域内蒙古段湖泊地处蒙新高原湖区,属于寒旱区湖泊,研究区气候类型为中温带大陆性季风气候,具有季节性明显、冰封期长、紫外线辐射强等特点。本文以内蒙古自治区巴彦淖尔市的乌梁素海(40°36′~41°03′N,108°43′~108°57′E)、内蒙古自治区包头市的南海湖(40°30′~40°33′N,109°59′ ~110°26′E)、内蒙古自治区乌兰察布市的岱海(40°29′~40°37′N,112°33′~112°46′E)为研究对象。该流域3个湖泊均于11月前后进入结冰期,次年1月湖面可完全冰封,3月逐渐进入融冰期[18, 20, 22]。为评价水质的不均匀性,结合相关文献方法及湖泊特点进行现场初步调查,分别设置4、6、5个采样点(图 1),乌梁素海湖区可大致分为进水区(W1)、湖区中部(W2、W3)和出水区(W4)3个部分;南海湖按照功能划分为进水口区(N2)、旅游开发区(N3、N4、N5)、湖心岛区(N1)和水草区(N6);岱海则选取5个采样点以尽量覆盖整片湖域,分别为D3、D1、D2、D4、D5。于2022年1月对3个湖泊开展水质样品及微生物样品采集工作。
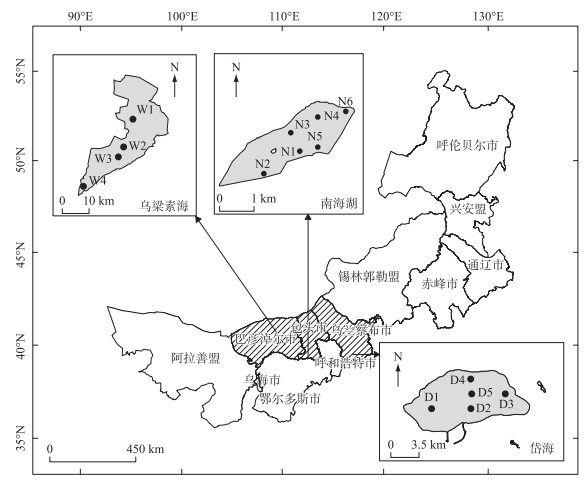
|
图 1 采样点布设 Fig.1 Distribution of sampling sites |
采集冰样时在采样点上方画出40 cm×40 cm正方形区域,利用纯水洗净油锯锯开并取出冰体,随后利用水样采集器进行冰下水样采集[23]。采样现场利用便携式多参数水质分析仪(HACH HQ40d,美国)测定水温T(精度为0.01 ℃)、溶解氧DO(精度为0.01 mg/L)、盐度PSU(精度为0.01 ‰)、pH值(精度为0.01 pH单位)及溶解性总固体TDS(精度为0.1 mg/L)。采集1 L表层水质样品,设置左右间隔1 m作为平行样本[24]。低温运回实验室进行4 ℃冷藏保存,依据《水和废水监测分析方法》(第四版)方法在实验室完成总氮(TN)、NH3-N、NO3--N、亚硝态氮(NO2--N)、总磷(TP)、化学需氧量(CODCr)、叶绿素a(Chl.a)指标的测定[25]。
1.2.2 细菌及蓝藻样本采集及处理本研究根据3个湖泊特征选择具有代表性的点位进行细菌及蓝藻样本采集及处理,乌梁素海、岱海、南海湖送检样品分别为W1、W3、W4,D1、D3、D5,N1、N2、N3、N5。采集表层水体样本置于1 L无菌聚乙烯瓶中,并设置左右间隔1 m作为平行样本,将样品等体积混合后带回实验室。选取0.22 μm孔径的滤膜,使用循环水式多用真空泵(LC-VWP-60A, 上海)抽滤水样,抽滤至滤膜上可见明显覆盖物,收集滤膜置于50 mL的无菌离心管中。重复上述操作预备两个备用滤膜,置于-80 ℃冰箱保存等待送检。将抽滤后的所有样品置于干冰中送至上海美吉生物测序中心用于宏基因测序。为消除实验过程中的潜在外部污染,实验所用玻璃器材均在实验和采样前用1 ∶3硝酸浸泡24 h,并用超纯水(Milli-Q, Millipore, ≥18.2 MΩ ·cm, 重庆)洗净后置于烘干箱(DHG-9240A, 上海)烘干。
1.2.3 宏基因组测序根据上海美吉生物医药科技有限公司提供的质检报告,3个湖泊各样本点风险建库等级均为B级,胶图条带弥散,DNA主带≥3 kb,DNA溶液不粘稠,无色素、悬浊物,无严重RNA、蛋白、糖类等杂质污染,1.7≤OD260/280≤2.1,总量满足一次标准建库需求,可以进行后续实验。宏基因测序可对样本中全部微生物的总DNA进行测序,通过对微生物基因组随机打断,并通过组装将小片段拼接成较长的序列。16S测序分析在物种鉴定具有较高的优势,已成为环境微生物群落的研究的有效工具。采用NEXTFLEXTM Rapid DNA-Seq Kit试剂盒对DNA进行提取,利用1.0 % 的琼脂糖凝胶电泳检测抽提基因组DNA,利用Covaris M220仪器将检测合格并纯化后的片段进行剪切(约400 bp)接头连接,使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集,磁珠回收PCR产物得到最终的文库。完成文库构建后进行桥式PCR和测序序列统计与质控,对结果进行ORF预测。使用MetaGene(http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果中的contig进行ORF预测并将其翻译为氨基酸序列,将所有样品预测出来的基因序列,用CD-HIT软件(http://www.bioinformatics.org/cd-hit/)进行聚类,每个类取最长的基因作为代表序列,构建非冗余基因集。使用SOAPaligner软件分别将每个样品的高质量reads与非冗余基因集进行比对,统计基因在对应样品中的丰度信息。使用DIAMOND软件(http://ab.inf.uni-tuebingen.de/software/diamond/)将非冗余基因集与NR数据库进行比对(比对类型:BLASTP),并通过NR库对应的分类学信息数据库获得物种注释。
1.3 数据处理及分析利用ArcGIS 10.8绘制采样点布设图,环境因子数据及宏基因组送检原始数据通过Excel(2019)进行预处理,构建相应分类学水平上的丰度数,细菌及蓝藻群落柱形图由Origin 2021绘制[26]。进行相关性分析前,采用SPSS 26软件包对数据进行正态性分布检验,对不满足要求的数据进行对数转换处理, 采用Canoco 5.0进行冗余分析(redundancy analysis, RDA),运用蒙特卡罗检验分析非生物因素与微生物群落之间的显著性筛选环境因子,通过冗余分析研究物种和环境因子之间的关系[27]。利用R语言vegan、geosphere、ggplot2包进行细菌和蓝藻群落与环境因子两矩阵之间的Mantel测试分析、主成分分析(PCA)、可视化图绘制、基于Bray-Curtis距离的聚类树图绘制及在OTU水平上进行ANOSIM分析[28-29]。在不同湖泊微生物网络分析前,进行细菌及蓝藻的成对相关性分析,仅保留显著相关(P < 0.05)的细菌及蓝藻,将筛选后的菌藻通过R语言igraph、Hmisc包生成边文件及边的权重,通过Gephi 0.9.3建立相关性网络分析模型,并进行个性化绘图,本研究中将各细菌门进行了颜色区分,正负相关性分别用红绿进行区分[30-31]。随后计算网络的平均节点数、聚类系数、模块性、网络密度及直径等拓扑特征参数,并基于网络核心节点辨别参与网络构建的关键OTUs,并根据边的权重及相关模型参数分析微生物网络复杂性、稳定性及作用强度。
2 结果与分析 2.1 冰封期不同湖泊细菌群落将相对丰度大于1 % 的菌门定义为优势菌门,小于1 % 的菌门归类为其他,绘制细菌门水平群落组成图(图 2a)。图中可知变形菌门(Proteobacteria,乌梁素海=18.96 %,岱海=6.77 %,南海湖=15.43 %)、拟杆菌门(Bacteroidetes,乌梁素海=7.49 %,岱海=4.67 %,南海湖=11.68 %)、放线菌门(Actinobacteria,乌梁素海=4.95 %,岱海=23.24 %,南海湖=8.31 %)在3个湖泊中均为优势菌门。各湖泊细菌群落丰富度呈现南海湖>岱海>乌梁素海。PCA分析(图 2b)可知,3个湖泊样本点各自聚为一类,相同的湖泊样本点菌群在一定程度上相似。
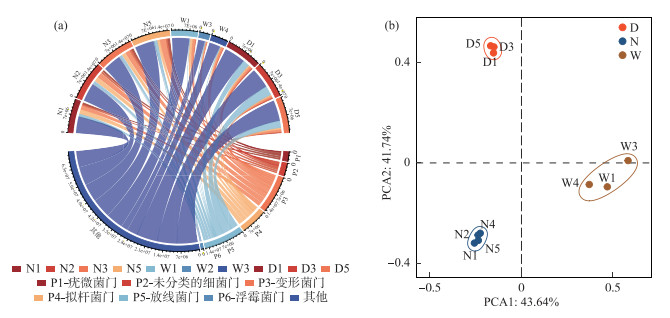
|
图 2 (a) 冰封期门水平乌梁素海(W)、南海湖(N)和岱海(D)的细菌群落组成;(b)各组样本点的主成分分析(PCA) Fig.2 (a) Bacterial community composition of Lake Ulansuhai (W), Lake Nanhai (N) and Lake Daihai (D) at the frozen period gate level; (b) analysis of the principal components (PCA) of the sampling sites in each group) |
通过对冰封期水体中细菌丰度进行筛选质控,共注释到3302个属水平细菌。将未分类细菌统计排除后进行分析,乌梁素海优势属主要为红育菌属(Rhodoferax)、红细菌属(Rhodobacter)、Limnohabitans属等,岱海优势属主要为尹氏菌(Yoonia)、解腈杆菌属(Nitriliruptor)、Ilumatobacter属等,南海湖优势菌属主要为分枝杆菌属(Mycobacterium)、生丝单胞菌属(Hyphomonas)等。根据Bray-Curtis距离绘制聚类树(图 3),3个湖泊水体细菌群落结构被划分为3支。通过ANOSIM分析判断组间及组内差异,结果表明各组之间的差异显著性较为明显(R=0.788, P < 0.05),组间差异大于组内差异, 分组合理[32]。
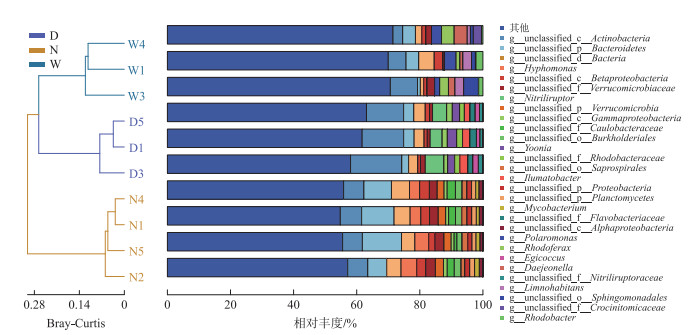
|
图 3 冰封期属水平乌梁素海(W)、南海湖(N)和岱海(D)的细菌群落组成及聚类分析 ( 图中出现的d_、p_、c_、o_、f_、g_分别代表阶元系统中的域、门、纲、目、科、属,下同 ) Fig.3 Bacterial community composition and cluster analysis of the frozen period at the level of Lake Ulansuhai (W), Lake Nanhai (N) and Lake Daihai (D) The symbols d_, p_, c_, o_, f_ and g_ in the image represent domain, phylum, class, order, family and genus orders in the taxonomic system, respectively ) |
通过对蓝藻丰度进行筛选质控,共注释到127个属,以乌梁素海中水体蓝藻丰度最低,其次为岱海,南海湖最高。属水平上,蓝藻群落组成差异显著(图 4)。双色藻属(Cyanobium)、聚球藻属(Synechococcus)在3个湖泊中均为优势蓝藻属,双色藻属在岱海占比最高,达到46.65 %,乌梁素海为2.58 %,南海湖为29.02 %。聚球藻属在乌梁素海中占比为2.84 %,南海湖和岱海中占比相当,分别为16.71 % 和16.76 %。通过Bray-Curtis距离绘制聚类树图(图 4),蓝藻群落结构可分为3大聚类。ANOSIM分析发现,在研究区域内,分组之间的差异显著性较为明显(R=0.884, P < 0.05)。
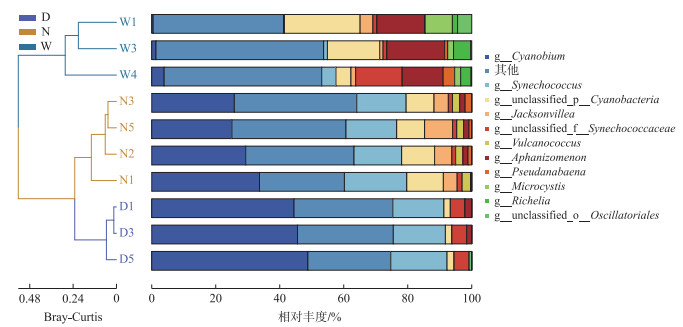
|
图 4 冰封期属水平上乌梁素海(W)、南海湖(N)和岱海(D)蓝藻群落组成及聚类分析 Fig.4 The bacterial community composition and cluster analysis of the frozen period at the level of Lake Ulansuhai (W), Lake Nanhai (N) and Lake Daihai (D) |
各湖泊水质如图 5所示,该时期3个湖泊测定水温范围为0.81~4.03 ℃,乌梁素海与南海湖水温差异较为显著;DO浓度在3个湖泊中差异较小,范围为6.18~14.35 mg/L;pH值范围为7.85~9.42,岱海最高;PSU为1.65 ‰ ~17.00 ‰,岱海明显高于其余两湖;TDS与电导率呈正相关性;TN浓度为1.30~5.22 mg/L,呈现南海>岱海>乌梁素海;NH3-N浓度变化趋势与TN相同,为0.34~2.94 mg/L;NO3--N浓度为0.25~1.67 mg/L;NO2--N浓度为0.01~0.06 mg/L;TP浓度在0.03~0.21 mg/L之间,其中岱海及南海湖浓度相当,乌梁素海浓度较低,各点位均在0.05 mg/L以上;CODCr范围为23.23~193.60 mg/L,南海湖及岱海浓度较高,平均值在100~150 mg/L之间;Chl.a浓度与蓝藻丰度呈正相关,南海湖浓度最高。
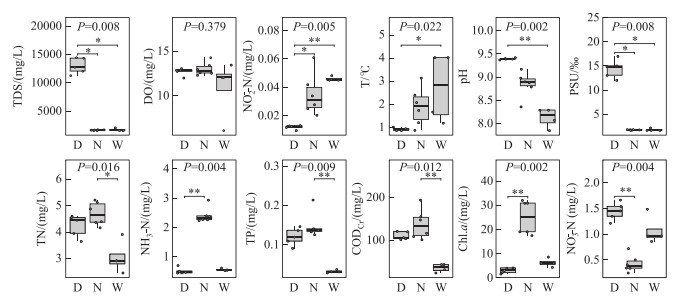
|
图 5 冰封期乌梁素海(W)、南海湖(N)和岱海(D)水质理化指标差异(*表示P≤0.05;**表示P≤0.01) Fig.5 The difference of physical and chemical indexes of water quality in Lake Ulansuhai (W), Lake Nanhai (N) and Lake Daihai (D) during frozen period |
采用冗余分析可更好地了解环境因子对细菌及蓝藻的影响(图 6b)。经过蒙特卡洛检验筛选并根据上述的物种组成分析,选择5个优势细菌门及8个优势蓝藻属与9个环境因子进行RDA分析。结果发现,第一轴物种与非生物因素的相关性为0.9993,第二轴物种与环境的相关性为0.9999,排序结果可靠,RDA1和RDA2解释率分别为68.15 % 和26.89 %,两轴能解释95.04 % 的差异信息,TP、NH3-N、TN对细菌群落组成变异的解释度分别为56.4 %、30.2 %、6.3 % (P≤0.01),是影响3种类型湖泊水体细菌及蓝藻群落的3个主要环境因子,值得注意的是CODCr与多数细菌和蓝藻群落呈正相关但不显著(P>0.1),这可能是由采样点CODCr值与其余环境因子(如TN、TP)相关性较强导致的(图 6a)。代表物种蓝藻属Vulcanococcus、聚球藻属和细菌浮霉菌门与环境因子TN及TP的射线处于同一象限且射线延伸长,夹角小表明三者之间与TN、TP具有极大正相关性。
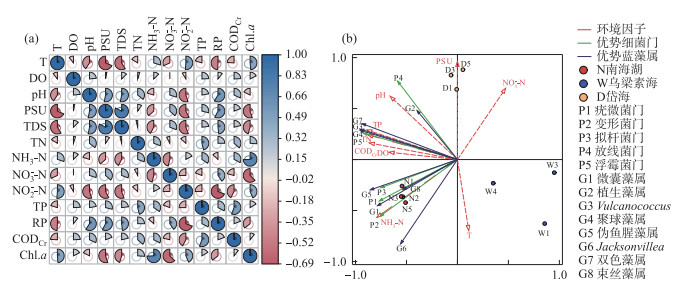
|
图 6 (a) 各环境因子之间的相关性分析;(b) 细菌和蓝藻的RDA分析(图(a)中“*”表示P < 0.05) Fig.6 (a) Correlation analysis among environmental factors, (b) RDA analysis of bacteria and cyanobacteria ("*" in figure (a) represents P < 0.05) |
使用Mantel tests方法进行相关性分析。将测得的环境变量组合进行分析,组合的环境变量与物种丰度距离矩阵分析结果为Mantel statistic r=0.8738, Significance=10-4,可知群落物种组成与环境参数的协同相关性较强。随后进行TN、TP、NH3-N、氮磷比(TN/TP)与蓝藻丰度占比的相关性和回归分析(图 7),结果表明水体蓝藻丰度占比随着TP、TN和NH3-N浓度的升高逐渐升高,随着TN/TP的增大而逐渐降低,4个变量的线性回归中P值均小于0.05。TN和TP整体浓度分布呈南海>岱海>乌梁素海,NH3-N浓度的分布呈现南海>乌梁素海>岱海,TN/TP在乌梁素海远高于南海和岱海,南海与岱海差异不明显。
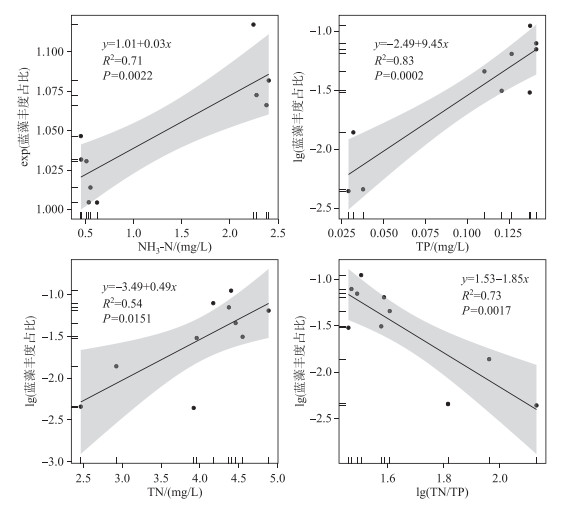
|
图 7 蓝藻生物量占比与环境因子的相关性 Fig.7 Correlation between environmental factors and proportion of cyanobacteria abundance |
利用Pearson相关性分析方法对乌梁素海、南海湖、岱海的蓝藻与细菌相关性关系进行分析,为保证模型的可靠性,仅筛选出部分(P < 0.05)显著相关且具有代表性的菌藻进行相关性网络的绘制。乌梁素海的细菌与蓝藻关系(图 8a)中,双色藻属、微囊藻属(Microcystis)、聚球藻属、植生藻属(Richelia)为重要属水平蓝藻,与优势细菌均显著相关(P < 0.05),其中主要关联的优势菌属为Paraburkholderia、类芽孢杆菌(Paenibacillus)、Candidatus-Endolissoclinum、固氮螺菌属(Azospirillum)、Taibaiella、军团杆菌属(Legionella)、Chakrabartia,除Taibaiella、Chakrabartia与重要蓝藻属呈显著负相关关系外,其余重要蓝藻属的相关菌群均呈显著正相关关系。
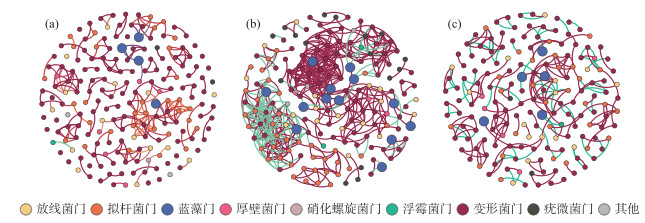
|
图 8 冰封期菌藻相关性网络图:(a)乌梁素海、(b)南海湖、(c)岱海 ( 红线表示正相关性,绿线表示负相关性 ) Fig.8 Network diagram of bacteria and algae correlation during the frozen period: (a) Lake Ulansuhai, (b) Lake Nanhai and (c) Lake Daihai red lines represent positive correlation, green lines represent negative correlation ) |
南海湖(图 8b)中,Chryseobacterium、Luteolibacter、Muricauda等为湖泊网络中关键菌属,其中连接中心度最高为17。与蓝藻相关联的菌群主要属于变形菌门、放线菌门、拟杆菌门、绿菌门等。其中13个细菌属与蓝藻属呈显著负相关关系,其余53个与重要蓝藻属相连菌属均呈显著正相关关系,其中固氮蓝细菌束丝藻属(Aphanizomenon)、念珠藻属(Nostoc)与微囊藻属及假鱼腥藻(Pseudanabaena)呈现正相关关系。
岱海(图 8c)中,束丝藻属、聚球藻属、伪鱼腥藻属(Pseudanabaena)、微囊藻属、双色藻属为与细菌关联显著的蓝藻属,其中主要的关联优势菌属为节杆菌属(Arthrobacter)、鲍特氏菌属(Bordetella)、红小梨形菌属(Rhodopirellula)、氢噬菌属(Hydrogenophaga),它们主要来自放线菌门、变形菌门、浮霉菌门;值得注意的是聚球藻属与双色藻属呈现显著正相关,微囊藻属与其相关联的细菌均呈现负相关关系。
构成3个湖泊细菌和蓝藻网络的主要细菌门类为变形菌门、拟杆菌门及放线菌门,但节点数量有所差异(图 9)。3个湖泊细菌与蓝藻共现网络达到一定的模块化程度,各湖泊网络模块化指数均高于0.7(表 1)。根据网络拓扑特性和可视化评估[30],3个湖泊的网络复杂性为南海湖>岱海>乌梁素海(图 8a~c, 表 1)。乌梁素海模块化程度较高但平均聚类系数及网络密度较低,菌群间连通性较弱(图 8a)。3个湖泊间对比分析可知,岱海模块化程度、平均聚类系数及负权重边占比均较高(图 8b)。南海湖菌藻网络中节点数和边数要高于其他两个湖泊,且具有较高的平均度、网络密度和正权重边个数。
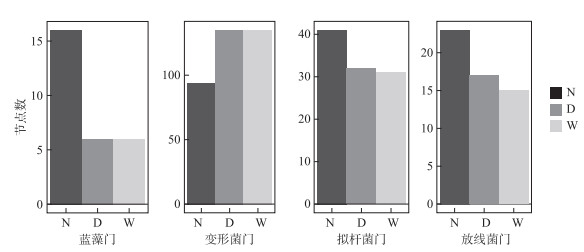
|
图 9 南海湖(N)、岱海(D)和乌梁素海(W)各菌门的节点数量 Fig.9 The number of nodes for each phylum in Lake Nanhai (N), Lake Daihai (D) and Lake Ulansuhai (W) |
| 表 1 3个湖泊细菌-蓝藻网络拓扑特性及权重边占比 Tab. 1 Topological characteristics and weighted edge ratio of bacteria-cyanobacteria networks in the three lakes |
3个湖泊冰下水体中优势菌门构成与多数淡水湖泊水体中的相似[33-34]。变形菌作为湖泊有机物分解及循环的主要参与者,在3个湖泊中均为优势菌门,但存在乌梁素海占比高、岱海占比低的特点(图 2a、图 3)。乌梁素海冰下水体中变形菌门占比最高,与学者2022年[35]开展的相关研究一致。变形菌门作为最庞大的菌门,具有广泛的生理代谢功能,适应多种复杂的环境[36]。在本次研究中,岱海冰下水体放线菌门是绝对优势菌门,这与2018年[37]对岱海细菌的研究结果一致,放线菌在高盐环境中具备有效利用难降解有机物的能力,因此相比于其他细菌更能适应岱海的高盐环境。南海湖的拟杆菌门丰度占比显著高于乌梁素海及岱海(图 2a、图 3),这与2017年[38]南海湖冰封期细菌菌群的研究一致,这可能是拟杆菌与人类活动密切相关导致的。南海湖作为小型城市浅水湖泊,其菌藻群落结构对环境变化和人为干扰反应更敏感。尽管3个湖泊中优势微生物组成占比不同,但放线菌门、变形菌门和拟杆菌门在水环境微生物群落组成上发挥着重要作用,在湖泊物质循环、有机物分解等生态过程中也扮演着重要角色[39]。3个湖泊水体属水平上的细菌及蓝藻群落被划分为3大聚类,各湖泊的优势细菌属及蓝藻属各不相同(图 2、图 3、图 4)。归属于蓝藻门的双色藻属及聚球藻属在3个湖泊中均为优势蓝藻属。值得指出的是,双色藻属作为类胡萝卜素和藻胆蛋白主要生产者,在岱海中丰度占比达到了46.65 %,并且已有学者证明该藻属具有一定耐盐特性并能适应较恶劣的环境[40-41]。双色藻属(0.3~2 μm)及聚球藻属(0.6~2 μm)广泛分布于淡水湖泊及海洋中,两个藻属均属于超微型浮游蓝藻,在水生生态系统,尤其是微食物环中发挥着关键作用,所具备的潜在混合营养代谢功能对浮游细菌种群的调控具有重要意义[42-43]。本研究岱海盐度最高值达到17 ‰,研究指出,岱海由于水位及库容量下降,导致湖水盐容量降低,湖水水质咸化,在样本与环境因子的关系中也能看出盐度与岱海样本点的相关程度较高,其冰下水体优势菌属为尹氏菌和解腈杆菌属,已有研究证明其对高盐适应性较强[44-46]。乌梁素海在冰封期时蓝藻生物量及丰度占比较小,这与TN、TP及NH3-N浓度较低是相关的,南海湖中蓝藻生长旺盛也与营养盐浓度有关,TN/TP较低可能是造成南海湖蓝藻较多的原因之一[47]。环境因子的协同作用对3个湖泊菌群结构的影响也较大,这与以往关于水体微生物与环境因子的研究是一致的[48-49]。当前关于冰封期细菌与蓝藻群落的研究主要集中在单一湖泊,本研究则基于3个具有不同特点的湖泊,探讨了各类湖泊细菌与蓝藻群落结构特征及其相关性。研究结果为寒区湖泊冰封期冰下水体微生物群落结构研究提供了新的视角,并对寒区湖泊水生态领域的研究形成了重要补充,有助于为今后冰下水体细菌与蓝藻群落动态变化、微生物群落结构形成及演替的深入研究提供帮助。
3.2 寒区湖泊水体细菌与蓝藻的互作关系网络模块化程度较高的微生物网络相比模块化较低的网络更稳定,多样和复杂的微生物群落比简单的微生物群落更能抵御环境胁迫。高模块化使得网络结构稳定的机制可理解为,部分微生物在环境波动下会引起较大变化,高模块化使其影响不易扩散到整个网络,从而使得网络相对不易被干扰[30-31]。研究发现,在冰封期时细菌群落以正相关关系为主,且网络具有模块结构,这与周石磊等在白洋淀冰封期开展的研究一致[50]。不同的是,白洋淀冰封期时的网络图中负相关边所占比例只有7.08 %,而在本研究中负相关边占比均大于20 %。较多证据表明,正相关关系在环境波动下群落会做出同步反应,从而产生共同波动的现象,而负相关关系可降低整体网络的聚集性,在一定程度上稳定环境对群落的干扰,因此负相关和弱连接性居多的网络被认为可增加网络在极端环境干扰下的稳定性[31, 51]。本研究中3个寒区湖泊主要构成网络的菌门为放线菌门、变形菌门、拟杆菌门及蓝藻门,这与在太湖夏季水体细菌共线网络中的发现相同,但不同于温暖水体,寒区湖泊的节点数及边数均处于较低水平[52]。长期的低温胁迫对重塑湖泊微生物网络可能发挥重要作用,季节性的冰封使得冬季湖泊冰下水体环境相对恶劣,是造成与白洋淀和太湖研究结果不同的原因之一。寒旱区湖泊冰封条件下水体细菌与蓝藻网络在3个湖泊中均表现出较高的模块化程度及负相关关系,此现象在一定程度上揭示了微生物在应对环境压力及缓解生态网络失稳方面的策略,在山东烟台和青岛3条淡水-海水带的研究中,学者指出随着环境胁迫的影响逐渐升高,模块化程度会有所上升,此时丰富物种在生态网络中的贡献将有所降低,稀有物种的相对重要性将逐渐升高,它们将在维持生态系统功能上发挥重要的作用[53]。本研究中以盐度高为特点的岱海,其模块化程度、平均聚类系数及负权重边占比均较高,相比其他两个湖泊,节点与边数相对较低,一定程度上反映岱海细菌及蓝藻群落关系相较其余两湖泊抗逆性更强,这与Yang等对柴达木盆地6个盐湖进行湖泊水体细菌的网络分析中的发现一致,盐湖水体细菌网络模块化指数均处于较高水平,且盐度增加的网络节点和边数均显著降低[54]。盐度胁迫会使得微生物网络稳定性下降,这个过程中模块化指数会呈现上升趋势,岱海长期的高盐环境改变了微生物群落结构和自身生理特性,这可能是岱海湖泊水体细菌与蓝藻网络表现得更稳定的原因之一[53]。南海湖拥有较高的平均度、网络密度,表明南海湖较其余两湖网络连通性更好,但南海湖相比于其他两湖模块化程度较低,正相关连接较多使得该湖细菌和蓝藻群落相比于另外两湖可能更易受到环境因子的影响,这应与前文提到的南海湖作为城市小型浅水湖泊有关。在细菌与蓝藻相关性研究中,普遍认为固氮细菌与蓝藻可形成共生关系,固氮菌为蓝藻提供无机氮,以换取蓝藻释放的有机物[55]。本研究中与蓝藻显著相关的固氮螺菌属、固氮菌属等均保持显著正相关关系,且部分固氮蓝藻如束丝藻属、念珠藻属与非固氮蓝藻属也呈现正相关关系。非固氮蓝藻在与固氮蓝藻共培养的体系中可获得促进作用,固氮蓝藻因磷限制而受到抑制,乌梁素海固氮丰度较低可能与高氮磷比有关[56-57]。本研究针对3个湖泊冰下水体细菌及蓝藻群落从网络的复杂性和稳定性及显著菌藻的相关性等方面进行了对比分析,然而在自然水生态系统中,细菌与蓝藻关系还可能受到季节更替的影响,在今后研究中针对非冰封期与冰封期细菌与蓝藻关系的差异研究是有必要的,且本文中提到的水体细菌及蓝藻包括颗粒态和悬浮态两种形态,在下一步研究中可将颗粒态与悬浮态网络差异加以考虑。
4 结论1) 乌梁素海、岱海、南海湖细菌和蓝藻群落组成具有明显差异,拟杆菌门、放线菌门、变形菌门是冰封期湖泊水体主要细菌门,双色藻属、聚球藻属是主要蓝藻属,细菌和蓝藻丰度均呈现南海湖>岱海>乌梁素海。不同类型湖泊使得细菌和蓝藻群落组成存在差异,今后的研究中可根据各自区域特征,定向筛选部分耐寒、耐盐菌藻用于解决寒旱区水处理的实际应用中存在的问题。
2) 冰封期影响湖泊水体细菌及蓝藻组成的主要环境因子为TP、TN和NH3-N,RDA分析群落组成变异解释度达92.9 %,其余指标相比于营养盐指标的影响较弱,但环境因子协同作用对群落组成具有显著影响,这与国内大多数湖泊研究一致。在下一步实验中可对原位水样关键酶活性进行测定,以阐明菌-藻-酶体系对营养盐的代谢与削减的作用过程及机理。
3) 冰封期3个湖泊中与蓝藻有显著相关性的主要优势菌门有变形菌门、放线菌门、拟杆菌门、浮霉菌门等,其中放线菌、变形菌所构成的菌藻关系在不同湖泊中均占有主要地位。冰封期湖泊水体细菌和蓝藻网络稳定性较强,3个湖泊模块化程度和负相关性边占比均较高,其中岱海的网络稳定性要高于其余两湖,南海湖中蓝藻与细菌关系更为紧密。在今后实验开展中,可针对细菌与蓝藻网络结构在冻融过程中及非冰封期与冰封期差异方面进行深入研究,在季节上分析蓝藻与细菌的群落动态变化及相互关系,为揭示湖泊生态系统的元素循环过程、深入了解湖泊生态系统功能结构、预防有害蓝藻大量繁殖提供指导。
| [1] |
Wu FC, Meng W, Song YH et al. Research progress in lake water quality criteria in China. Acta Scientiae Circumstantiae, 2008, 28(12): 2385-2393. [吴丰昌, 孟伟, 宋永会等. 中国湖泊水环境基准的研究进展. 环境科学学报, 2008, 28(12): 2385-2393. DOI:10.13671/j.hjkxxb.2008.12.016] |
| [2] |
Shi WQ, Qin BQ. Cyanobacterial blooms in lakes and reservoirs under climate change: Future trend and control strategy. Journal of Hydraulic Engineering, 2023, 54(8): 987-996. [施文卿, 秦伯强. 气候变化下湖库蓝藻水华发展趋势及防控对策. 水利学报, 2023, 54(8): 987-996.] |
| [3] |
Zhang WZ, Liu J, Xiao YX et al. The impact of cyanobacteria blooms on the aquatic environment and human health. Toxins, 2022, 14(10): 658. DOI:10.3390/toxins14100658 |
| [4] |
Wang SH, Zhang S, Wu R et al. Characteristics of phytoplankton in cold and arid areas and their indicator of trophic status. China Environmental Science, 2023, 43(1): 311-320. [王世欢, 张生, 武蓉等. 寒旱区湖泊浮游植物特征及其对营养状态的指示作用. 中国环境科学, 2023, 43(1): 311-320.] |
| [5] |
Zhang C, Huang WF, Li R et al. The effect of salinity on the exclusion of nitrogen and phosphorus nutrients during freezing. J Lake Sci, 2022, 34(4): 1186-1196. [张程, 黄文峰, 李瑞等. 盐度对湖冰冻结过程中氮磷营养盐排出效应的影响. 湖泊科学, 2022, 34(4): 1186-1196. DOI:10.18307/2022.0412] |
| [6] |
Jiang MY, Wang XD, Liu XH et al. Review on phytoplankton research during the frozen period in lakes. Chinese Journal of Ecology, 2023, 42(8): 2010-2019. [江孟宇, 王晓东, 刘晓辉等. 湖泊冰封期浮游植物研究进展. 生态学杂志, 2023, 42(8): 2010-2019. DOI:10.13292/j.1000-4890.202308.019] |
| [7] |
Ming H, Yan G, Zhang X et al. Harsh temperature induces Microcystis aeruginosa growth enhancement and water deterioration during vernalization. Water Research, 2022, 223: 118956. DOI:10.1016/j.watres.2022.118956 |
| [8] |
Reinl KL, Harris TD, North RL et al. Blooms also like it cold. Limnology and Oceanography Letters, 2023, 8(4): 546-564. DOI:10.1002/lol2.10316 |
| [9] |
Song XF, Wu YQ, Fu HL et al. Characteristic analysis of raw water pollution and its removal during low temperature outbreak of cyanobacteria in a water plant in North China. China Water & Wastewater, 2020, 36(19): 46-49. [宋学峰, 吴越强, 付红丽等. 北方某水厂蓝藻低温暴发期原水污染特征分析及去除. 中国给水排水, 2020, 36(19): 46-49. DOI:10.19853/j.zgjsps.1000-4602.2020.19.007] |
| [10] |
Xiao M, Li M, Reynolds CS. Colony formation in the cyanobacterium Microcystis. Biological Reviews of the Cambridge Philosophical Society, 2018, 93(3): 1399-1420. DOI:10.1111/brv.12401 |
| [11] |
Shi XL, Yang JS, Chen KN et al. Review on the control and mitigation strategies of lake cyanobacterial blooms. J Lake Sci, 2022, 34(2): 349-375. [史小丽, 杨瑾晟, 陈开宁等. 湖泊蓝藻水华防控方法综述. 湖泊科学, 2022, 34(2): 349-375. DOI:10.18307/2022.0201] |
| [12] |
Wang M, Liu H, Wang JN et al. Research progress on the biological control of cyanobacterial blooms. Journal of Environmental Engineering Technology, 2022, 12(1): 92-99. [王敏, 刘浩, 王江南等. 生物法治理蓝藻水华研究进展. 环境工程技术学报, 2022, 12(1): 92-99. DOI:10.12153/j.issn.1674-991X.20210094] |
| [13] |
Lezcano MÁ, Velázquez D, Quesada A et al. Diversity and temporal shifts of the bacterial community associated with a toxic cyanobacterial bloom: An interplay between microcystin producers and degraders. Water Research, 2017, 125: 52-61. DOI:10.1016/j.watres.2017.08.025 |
| [14] |
Ramanan R, Kim BH, Cho DH et al. Algae-bacteria interactions: Evolution, ecology and emerging applications. Biotechnology Advances, 2016, 34(1): 14-29. DOI:10.1016/j.biotechadv.2015.12.003 |
| [15] |
Shi JL, Wang WJ, Wang F et al. Efficient inactivation of harmful algae K. mikimotoi by a novel algicidal bacterium via a rare direct contact pathway: Performances and mechanisms. Science of the Total Environment, 2023, 892: 164401. DOI:10.1016/j.scitotenv.2023.164401 |
| [16] |
Chen D, Wei L, Zou ZC et al. Bacterial communities in a novel three-dimensional bioelectrochemical denitrification system: The effects of pH. Applied Microbiology and Biotechnology, 2016, 100(15): 6805-6813. DOI:10.1007/s00253-016-7499-3 |
| [17] |
Mankiewicz-Boczek J, Font-Nájera A. Temporal and functional interrelationships between bacterioplankton communities and the development of a toxigenic Microcystis bloom in a lowland European Reservoir. Scientific Reports, 2022, 12(1): 19332. DOI:10.1038/s41598-022-23671-2 |
| [18] |
Wang SY, Zhang XX, Tian SM et al. Study on phytoplankton community structure characteristics and its influencing factors of lakes in arid regions of the Yellow River basin during ice-sealing period. Journal of Hydraulic Engineering, 2020, 51(9): 1070-1079. [王司阳, 张笑欣, 田世民等. 黄河流域干旱区湖泊冰封期浮游植物群落结构特征及影响因子研究. 水利学报, 2020, 51(9): 1070-1079.] |
| [19] |
Zhang XX, Yao Z, Yang WH et al. Distribution, sources, partition behavior and risk assessment of polycyclic aromatic hydrocarbons (PAHs) in the waters and sediments of Lake Ulansuhai, China. Marine Pollution Bulletin, 2024, 200: 116072. DOI:10.1016/j.marpolbul.2024.116072 |
| [20] |
Yang WH, Zhen Y, Yao Z et al. Characterization for nitrogen metabolism of sediments in highland saline lake. China Environmental Science, 2023, 43(3): 1328-1339. [杨文焕, 甄玉, 姚植等. 高原盐化湖泊沉积物氮代谢特征解析. 中国环境科学, 2023, 43(3): 1328-1339. DOI:10.3969/j.issn.1000-6923.2023.03.034] |
| [21] |
Gao JY, Feng WY, Yang F et al. Effects of water quality and bacterial community composition on dissolved organic matter structure in Daihai Lake and the mechanisms. Environmental Research, 2022, 214: 114109. DOI:10.1016/j.envres.2022.114109 |
| [22] |
Gao JT, Wu FC, He GH et al. Phytoplankton Community characteristics and environmental driving factors of urban lakes in Cold Regions. Environmental Science & Technology, 2021, 44(6): 1-10. [高静湉, 毋凡琛, 何桂豪等. 寒区城市湖泊浮游植物群落特征及环境驱动因子. 环境科学与技术, 2021, 44(6): 1-10.] |
| [23] |
Lu XS, Ding XY, Zhao ZW et al. Distribution and exchange of pollutants during the lcebound season of Ulansuhai Lake. Journal of Hydroecology, 2021, 42(6): 41-48. [卢兴顺, 丁晓宇, 赵子闻等. 乌梁素海冰封期污染物分布及迁移特征研究. 水生态学杂志, 2021, 42(6): 41-48. DOI:10.15928/j.1674-3075.202012280362] |
| [24] |
徐峥. 河口型水库微生物菌群及"菌-藻"体系构成特征的研究[学位论文]. 上海: 上海交通大学, 2020.
|
| [25] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002: 38-47.
|
| [26] |
Liu YH, Lu JP, Zhao SN et al. Water environment change trend and ecological water replenishment of Lake Wuliangsuhai and other key driving factors analysis based on long time series (2011-2020). J Lake Sci, 2023, 35(6): 1939-1948. [刘莹慧, 卢俊平, 赵胜男等. 基于长时间序列乌梁素海水环境变化趋势及生态补水等关键驱动因子分析(2011—2020年). 湖泊科学, 2023, 35(6): 1939-1948. DOI:10.18307/2023.0621] |
| [27] |
Wang C, Ye Q, Jia BY et al. Spatial distribution and influential factors of nutrients in rivers of a typical mountainous city: A case study of the Qingshuixi River in Chongqing. Environmental Science, 2022, 43(3): 1346-1355. [王超, 叶秋, 贾伯阳等. 典型山地城市河流营养元素空间分布特征及影响因素分析: 以重庆市清水溪为例. 环境科学, 2022, 43(3): 1346-1355. DOI:10.13227/j.hjkx.202106209] |
| [28] |
Gu TB, Xiao J, Han LB et al. Plankton community stability and drive factor identification Guizhou Plateau Reservoir. Environmental Science, 2024, 1(16): 1-19. [顾太波, 肖晶, 韩丽彬等. 贵州高原水库浮游生物群落稳定性及其环境驱动因子辨识. 环境科学, 2024, 1(16): 1-19. DOI:10.13227/j.hjkx.202307139] |
| [29] |
Fan XT, Su JQ, Zhou S et al. Plant cultivar determined bacterial community and potential risk of antibiotic resistance gene spread in the phyllosphere. Journal of Environmental Sciences: China, 2023, 127: 508-518. DOI:10.1016/j.jes.2022.06.006 |
| [30] |
Qiu LP, Zhang Q, Zhu HS et al. Erosion reduces soil microbial diversity, network complexity and multifunctionality. The ISME Journal, 2021, 15(8): 2474-2489. DOI:10.1038/s41396-021-00913-1 |
| [31] |
de Vries FT, Griffiths RI, Bailey M et al. Soil bacterial networks are less stable under drought than fungal networks. Nature Communications, 2018, 9(1): 3033. DOI:10.1038/s41467-018-05516-7 |
| [32] |
Keenum I, Williams RK, Ray P et al. Combined effects of composting and antibiotic administration on cattle manure-borne antibiotic resistance genes. Microbiome, 2021, 9(1): 81. DOI:10.1186/s40168-021-01006-z |
| [33] |
Li WB, Yang X, Tian YN et al. Changes in the bacterioplankton community between "lce" and "water" in the Frozen Dali Lake. Environmental Science, 2021, 42(5): 2276-2286. [李文宝, 杨旭, 田雅楠等. 冰封状态下达里湖冰-水中浮游细菌群落结构差异. 环境科学, 2021, 42(5): 2276-2286. DOI:10.13227/j.hjkx.202009218] |
| [34] |
Lauro FM, DeMaere MZ, Yau S et al. An integrative study of a meromictic lake ecosystem in Antarctica. The ISME Journal, 2011, 5(5): 879-895. DOI:10.1038/ismej.2010.185 |
| [35] |
Shi YJ, Li WB, Zhang BY et al. Characteristics of bacterial community structure in Wuliangsu Lake during an lrrigation lnterval in Hetao Plain. Environmental Science, 2022, 43(3): 1424-1433. [史玉娇, 李文宝, 张博尧等. 河套平原灌溉间隙期乌梁素海水体细菌群落结构特征. 环境科学, 2022, 43(3): 1424-1433. DOI:10.13227/j.hjkx.202107108] |
| [36] |
Song ZQ, Wang L, Liu XH et al. The diversities of Proteobacteria in four acidic hot springs in Yunnan. Journal of Henan Agricultural University, 2016, 50(3): 376-382. [宋兆齐, 王莉, 刘秀花等. 云南4处酸性热泉中的变形菌门细菌多样性. 河南农业大学学报, 2016, 50(3): 376-382.] |
| [37] |
Zhang YQ, Shao KQ, Hu Y et al. Bacterial diversity and community composition in lake water and sediment of Lake Daihai. J Lake Sci, 2022, 34(6): 2070-2082. [张雨晴, 邵克强, 胡洋等. 岱海水体及沉积物细菌多样性及群落组成特征. 湖泊科学, 2022, 34(6): 2070-2082. DOI:10.18307/2022.0621] |
| [38] |
Lu L, Wu YX, Zhang WH et al. Distribution and succession pattern of phytoplankton communities in a small urban lake, Sand Lake in Wuhan City, China. Acta Ecologica Sinica, 2017, 37(18): 5993-6004. [鲁蕾, 吴亦潇, 张维昊. 城市小型湖泊浮游植物群落结构特征及演替规律——以武汉沙湖为例. 生态学报, 2017, 37(18): 5993-6004. DOI:10.5846/stxb201606211215] |
| [39] |
Padhy SR, Bhattacharyya P, Nayak SK et al. A unique bacterial and archaeal diversity make mangrove a green production system compared to rice in wetland ecology: A metagenomic approach. Science of the Total Environment, 2021, 781: 146713. DOI:10.1016/j.scitotenv.2021.146713 |
| [40] |
Pagels F, Almeida C, Vasconcelos V et al. Cosmetic potential of pigments extracts from the marine Cyanobacterium Cyanobium sp. Marine Drugs, 2022, 20(8): 481. DOI:10.3390/md20080481 |
| [41] |
Celepli N, Sundh J, Ekman M et al. Meta-omic analyses of Baltic Sea cyanobacteria: Diversity, community structure and salt acclimation. Environmental Microbiology, 2017, 19(2): 673-686. DOI:10.1111/1462-2920.13592 |
| [42] |
Zhang L, Yin W, Wang C et al. Untangling microbiota diversity and assembly patterns in the world's largest water diversion canal. Water Research, 2021, 204: 117617. DOI:10.1016/j.watres.2021.117617 |
| [43] |
Garate L, Alonso-Sáez L, Revilla M et al. Shared and contrasting associations in the dynamic nano- and picoplankton communities of two close but contrasting sites from the Bay of Biscay. Environmental Microbiology, 2022, 24(12): 6052-6070. DOI:10.1111/1462-2920.16153 |
| [44] |
Zhao L, Chen JY, Jiang X et al. Temporal and spatial distribution characteristics and difference analysis of nitrogen and phosphorus in Daihai Lake. Environmental Science, 2020, 41(4): 1676-1683. [赵丽, 陈俊伊, 姜霞等. 岱海水体氮、磷时空分布特征及其差异性分析. 环境科学, 2020, 41(4): 1676-1683. DOI:10.13227/j.hjkx.201909090] |
| [45] |
Wang LF, Zhao SW, Li SS et al. Effect of sodium salt with varied anions on Cd fractions and microbial community in soil. China Environmental Science, 2021, 41(9): 4221-4230. [王立夫, 赵淑雯, 李杉杉等. 不同阴离子钠盐对土壤Cd形态与微生物群落的影响. 中国环境科学, 2021, 41(9): 4221-4230. DOI:10.3969/j.issn.1000-6923.2021.09.029] |
| [46] |
Liu XY, He LH, Zhang XY et al. Bioremediation of petroleum-contaminated saline soil by Acinetobacter baumannii and Talaromyces sp. and functional potential analysis using metagenomic sequencing. Environmental Pollution, 2022, 311: 119970. DOI:10.1016/j.envpol.2022.119970 |
| [47] |
Yang LY, Yang XY, Ren LM et al. Mechanism and control strategy of cyanobacterial bloom in Lake Taihu. J Lake Sci, 2019, 31(1): 18-27. [杨柳燕, 杨欣妍, 任丽曼等. 太湖蓝藻水华暴发机制与控制对策. 湖泊科学, 2019, 31(1): 18-27. DOI:10.18307/2019.0102] |
| [48] |
Li CX, Gao YX, Zhang JQ et al. Structure and community composition of algae attached to different microplastic substrates. China Environmental Science, 2020, 40(8): 3360-3366. [李晨曦, 高雨萱, 张佳祺等. 附着在不同微塑料表面的藻类结构与群落组成. 中国环境科学, 2020, 40(8): 33603366.] |
| [49] |
He Y, Li KX, Wang JW et al. Microbial community structure of waste water treatment plants in different seasons. Environmental Science, 2021, 42(3): 1488-1496. [贺赟, 李魁晓, 王佳伟等. 不同季节城市污水处理厂微生物群落特性. 环境科学, 2021, 42(3): 1488-1496. DOI:10.13227/j.hjkx.202007015] |
| [50] |
Zhou SL, Sun Y, Yue GC et al. Spatial distribution characteristics and driving factors of aerobic denitrification bacterial community structure from Baiyangdian Lake in Xiong'an New Area during the winter freezing period. Environmental Science, 2020, 41(5): 2177-2187. [周石磊, 孙悦, 岳哿丞等. 雄安新区-白洋淀冬季冰封期水体好氧反硝化菌群落空间分布特征及驱动因素. 环境科学, 2020, 41(5): 2177-2187. DOI:10.13227/j.hjkx.201910195] |
| [51] |
Shi SJ, Nuccio EE, Shi ZJ et al. The interconnected rhizosphere: High network complexity dominates rhizosphere assemblages. Ecology Letters, 2016, 19(8): 926-936. DOI:10.1111/ele.12630 |
| [52] |
You BS, Ma SZ, Geng MD et al. Distribution patterns and driving factors of bacterial communities in water and sediment of Lake Taihu. J Lake Sci, 2023, 35(5): 1774-1787. [尤本胜, 马书占, 耿梦蝶等. 太湖水体和沉积物细菌群落分布格局及其驱动因素. 湖泊科学, 2023, 35(5): 1774-1787. DOI:10.18307/2023.0536] |
| [53] |
Li CC, Jin L, Zhang C et al. Destabilized microbial networks with distinct performances of abundant and rare biospheres in maintaining networks under increasing salinity stress. iMeta, 2023, 2(1): 79. DOI:10.1002/imt2.79 |
| [54] |
Yang J, Jiang HC, Sun XX et al. Distinct co-occurrence patterns of prokaryotic community between the waters and sediments in lakes with different salinity. FEMS Microbiology Ecology, 2021, 97(1): fiaa234. DOI:10.1093/femsec/fiaa234 |
| [55] |
Yang CY, Wang Q, Simon PN et al. Distinct network interactions in particle-associated and free-living bacterial communities during a Microcystis aeruginosa bloom in a plateau lake. Frontiers in Microbiology, 2017, 8: 1202. DOI:10.3389/fmicb.2017.01202 |
| [56] |
Yadav S, Anam GB, Ahn YH. Comparative growth characteristics and interspecific competitive interaction of two cyanobacteria, Phormidium autumnale and Nostoc sp. Journal of Environmental Quality, 2022, 51(1): 78-89. DOI:10.1002/jeq2.20305 |
| [57] |
Zhang XD, Cui LJ, Wang JZ et al. Influence from nitrogen-phosphorusration ratio on interspecific relationship between N-fixing and non N-fixing cyanobacterias. Water Resources and Hydropower Engineering, 2017, 48(9): 29-34, 83. [张骁栋, 崔丽娟, 王金枝等. 氮磷比对固氮和非固氮蓝藻种间关系的影响. 水利水电技术, 2017, 48(9): 29-34, 83.] |
 2024, Vol. 36
2024, Vol. 36 


