(2: 中国科学院水生生物多样性与保护重点实验室, 武汉 430072)
(3: 中国长江三峡集团有限公司长江生态环境工程研究中心, 北京 100038)
(4: 中国电建集团成都勘测设计研究院有限公司, 成都 611130)
(5: 水电水利规划设计总院, 北京 100120)
(2: The Key Laboratory of Aquatic Biodiversity and Conservation, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: Research Center for Yangtze River Ecological and Environmental Engineering, China Three Gorges Corporation, Beijing 100038, P. R. China)
(4: POWERCHINA Chengdu Engineering Corporation Limited, Chengdu 611130, P. R. China)
(5: Hydropower and Water Resources Planning & Design General Institute, Beijing 100120, P. R. China)
着生藻类(periphytic algae)也被称为周丛藻类,是附着在水体基质上生活的一类微型藻类,是河流生态系统重要的初级生产者[1]。特别是在山区河流中,着生藻类是裂腹鱼类、高原鳅、白甲鱼以及墨头鱼等种类的主要饵料来源[2-4]。如裂腹鱼属的异齿裂腹鱼和裸裂尻鱼属的拉萨裸裂尻鱼下唇均角质化,为刮食性鱼类,以硅藻等着生藻类为主要食物[2-3];白甲鱼的饵料生物也以丝状硅藻、绿藻等着生藻类为主[4]。随着山区河流城镇化、水电开发等人类活动的加剧,河流环境变化将影响着生藻类多样性和生物量,从而直接或间接影响河流食物网的结构和生态系统功能[5]。揭示着生藻类多样性,分析影响其组成和分布的关键环境因子成为河流生态学研究的重要内容之一[6-7]。
群落构建的相关理论认为,物种的丰度差异由环境因子和空间因子共同作用[7-8]。两者的相对作用因生态系统类型、研究对象和空间尺度的不同而有所差异[9]。例如,温度、pH和溶解氧是塑造拉萨河干流附石藻类群落结构的主要决定因素[10]。在长江流域,干流着生藻类群落的主要优势类群为硅藻门和蓝藻门,支流的主要优势类群为蓝藻门,其分布与溶解氧、总磷、总氮和pH密切相关[11]。在雅砻江及安宁河,水文条件和理化环境,如水温、流速和pH等影响着生藻类多样性及其分布格局[12-14]。另一方面,着生藻类对水体营养物质、有机污染和重金属等环境变化的响应非常敏感,也使其成为河流生态系统健康评价常用的指示生物[15-17]。
金沙江上游河流生态系统地处青藏高原东部和横断山区北部,既是生物多样性的热点区域,也是生态脆弱区和敏感区,为研究环境差异下的生物多样性形成和维持机理提供了理想场所[7, 18]。随着水电工程、川藏铁路等人为活动的持续推进,金沙江上游的生态环境和生物多样性也将发生变化。目前有关着生藻类的相关研究主要集中于长江干流、长江上游库区或者中下游地区,而关于金沙江上游支流着生藻类群落结构特征的研究却未见报道,限制了对金沙江上游流域藻类多样性形成和维持的理解。为此,本研究拟通过对金沙江上游主要支流着生藻类的多样性进行调查分析,探究着生藻类群落结构特征及其与环境因子的相关性,为理解河流生物多样性的维持机制及建立河流生态保护对策提供科技支撑。
1 材料方法 1.1 研究区域与样点设置金沙江上游始于青海省玉树直门达,流经四川、西藏,至云南石鼓镇,全长965 km,流域面积2.6×105 km2。区域内地貌复杂多样,河流水系发达,两岸陡峭,河谷较深,落差较大,水能资源丰富[19]。其中,色曲、赠曲、欧曲和藏曲分布于干流两岸,流程较长,鱼类资源丰富,是流域水电规划背景下具有重要保护价值的河流。
2021年5--6月,在上述支流共设置采样点38个,包括色曲9个、赠曲14个、欧曲8个和藏曲7个(图 1)。色曲河长90 km,天然落差1415 m,流域面积1647 km2,多年平均流量17.2 m3/s;赠曲河长200.5 km,天然落差1823 m,流域面积5490 km2,多年平均流量73.8 m3/s;欧曲河长129 km,天然落差1592 m,流域面积2902 km2,多年平均流量39.1 m3/s;藏曲河长120.5 km,天然落差1620 m,流域面积4600 km2,多年平均流量53.3 m3/s[20]。
|
图 1 金沙江上游主要支流着生藻类采样点 Fig.1 Location of the sampling sites of periphytic algae in major tributaries of the upper Jinsha River |
在采样河段上下100 m范围内随机挑选3块石头,每块石头选取9 cm2(30 mm×30 mm的方形塑料片)的平面,用硬毛牙刷反复刷取后装入50 mL样本瓶中,并立即加入鲁哥氏液固定[13]。参考《中国淡水藻类: 系统、分类及生态》[21]、《中国淡水藻志》[22]以及《中国西藏硅藻》[23]进行着生藻类的种类鉴定和数据记录。每个样品计数2片(0.1 mL浮游植物计数框),每片100个小格,再取其平均值。
采样期间,同步对采样点的河流环境进行了现场测量,利用GPS(Garmin 60 s)记录经纬度和海拔,利用Leica测距仪测量河宽(Wid),利用YSI pro plus多参数水质仪测量水温、溶解氧(DO)、pH值、电导率(Cond)和盐度。同一河段重复测量各环境指标3次,以其均值作为采样点的环境参数纳入后续分析(表 1)。
| 表 1 金沙江上游主要支流着生藻类调查时间及环境参数* Tab. 1 Sampling date and environmental parameters of the major tributaries of the upper Jinsha River |
采用优势度指数来判定优势种的组成,本研究将Y>0.02的物种定为优势种[12]。优势度计算公式如下:
| Y=(Ni/N)Fi | (1) |
式中,Ni为物种i的密度,N为总密度,Fi为物种i在样点中的出现频率。
1.3.2 多样性指数着生藻类物种多样性指数计算如下:
Shannon-Wiener多样性指数:
| H′=−∑Pi(lnPi) | (2) |
Pielou均匀度指数:
| J=H′/lnS | (3) |
Margalef指数:
| D=(S−1)/lnN | (4) |
式中,Pi为物种i的细胞数占总细胞数的比例,N为着生藻类总细胞数,S为群落总物种数[24-26]。
1.3.3 统计分析采用Shapiro-Wilk test对样本进行正态性检验,当P≥0.05时,认为样本总体分布服从正态分布,否则不符合正态分布。采用Levene's test对样本进行方差齐性检验,当P≥0.05时,数据方差齐性,否则数据方差不齐。如果数据服从正态分布,且方差齐性,则选择参数检验;如果数据非正态分布,或方差不齐,则选择非参数检验。经检验,本研究中的水温、电导、密度和生物量等数据不符合正态分布,故采用Kruskal-Wallis非参数检验分析各支流环境因子、着生藻类物种数及密度等在空间上的差异显著性。以上分析在SPSS 26.0软件中完成。
基于各样点着生藻类丰度的Bray-Curtis距离进行非度量多维尺度分析(non-metric multidimensional scaling, NMDS),并采用置换多元方差分析(permutational multivariate analysis of variance, PERMANOVA)进行不同支流的差异性检验。利用指示物种分析识别不同支流着生藻类的指示种或特征种[1, 27]。
对各采样点着生藻类的密度数据进行除趋势对应分析(detrended correspondence analysis, DCA)。根据DCA结果中4个轴中梯度最长值的大小, 选择单峰或者线性模型。如果(最大值)超过4,选择单峰模型典范对应分析(canonical correspondence analysis, CCA)更合适;如果小于3,选择线性模型冗余分析(redundancy analysis, RDA)比较合理;若介于3~4之间,单峰模型和线性模型都是合适的[13, 28]。使用vegan包中“envfit”函数对影响着生藻类群落结构的环境因子进行显著性检验。进行生物-环境关联分析前,对除pH外的水体理化数据进行对数化处理(lg(x+1)),对密度数据进行Hellinger转化。本研究中,着生藻类物种排序轴长度小于3.0,故采用RDA进行后续分析。
NMDS、PERMANOVA、DCA和RDA分析均在R 4.2.2软件中完成,其中NMDS、PERMANOVA、RDA分析采用“vegan”包[29],指示种分析采用“indicspecies”包,作图使用Origin 8.0和R软件中的“ggplot2”包[30]。
2 结果 2.1 河流环境色曲、赠曲、欧曲和藏曲的河流环境特征见表 1。比较显示,色曲水温显著低于欧曲和藏曲,pH、河宽与赠曲和欧曲存在显著差异;赠曲的电导率显著低于色曲和藏曲(Kruskal-Wallis非参数检验,P < 0.05)。不同支流之间的海拔和溶解氧无明显差异。
2.2 着生藻类物种组成及多样性 2.2.1 物种组成及优势种共鉴定出着生藻类3门34属91个分类单元,其中硅藻门22属73种,蓝藻门7属10种,绿藻门5属8种。色曲、赠曲、欧曲和藏曲着生藻类的物种数分别为45、54、55和62种。赠曲、欧曲和藏曲均鉴定到蓝藻、硅藻和绿藻门种类,且硅藻门占比最高,分别为88.89 %、81.13 % 和83.87 %;绿藻门占比最低,分别为3.70 %、9.43 % 和4.84 %。而色曲中仅鉴定到蓝藻和硅藻门种类,其占比分别为91.11 % 和8.89 % (附表Ⅰ)。
不同支流的优势种组成存在明显差异。色曲优势种为半丰鞘丝藻(Lyngbya semiplema)、眉藻未定种(Calothrix sp.)、微型舟形藻(Navicula minima)、极小桥弯藻(Cymbella perpusilla)、纤细桥弯藻(Cymbella gracilis)和极细微曲壳藻(Achnanthes minutissima);赠曲优势种为半丰鞘丝藻、纤细等片藻(Diatoma tenue)、平片针杆藻(Synedra tabulata)、偏肿桥弯藻(Cymbella ventricosa)及胡斯特桥弯藻(Cymbella hustedtii)等;欧曲优势种为半丰鞘丝藻、中型脆杆藻(Fragilaria intermedia)、胡斯特桥弯藻、偏肿桥弯藻及内丝藻未定种(Encyonema sp.)等;藏曲优势种为半丰鞘丝藻、希罗鞘丝藻(Lyngbya hieronymusii)、极小桥弯藻、纤细桥弯藻、橄榄绿异极藻(Gomphonema olivaceum)和谷皮菱形藻(Nitzschia palea)(附表Ⅱ)。
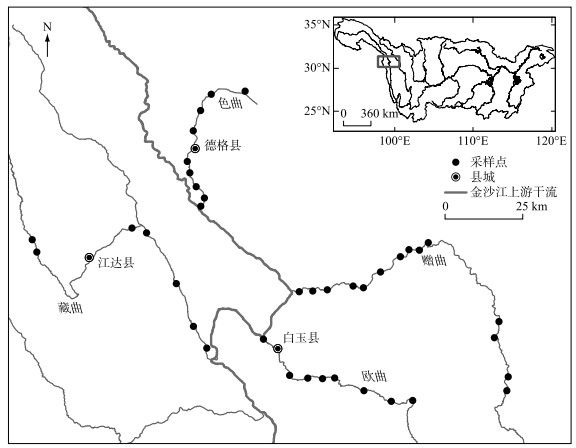
2.2.2 密度和生物量各支流着生藻类密度变化范围为0.02×105~2.43×105 cells/cm2,生物量变化范围为0.3×10-3~1.56 mg/cm2(图 2)。着生藻类的平均密度和平均生物量在色曲分别为0.64×105 cells/cm2和0.041 mg/cm2,在赠曲分别为0.53×105 cells/cm2和0.15 mg/cm2,在欧曲分别为0.43×105 cells/cm2和0.09 mg/cm2,在藏曲分别为0.31×105 cells/cm2和0.02 mg/cm2。Kruskal-Wallis非参数检验结果显示,各支流间着生藻类密度和生物量无显著性差异。
|
图 2 金沙江上游主要支流着生藻类密度和生物量 Fig.2 Density and biomass of periphytic algae communities in major tributaries of the upper Jinsha River |
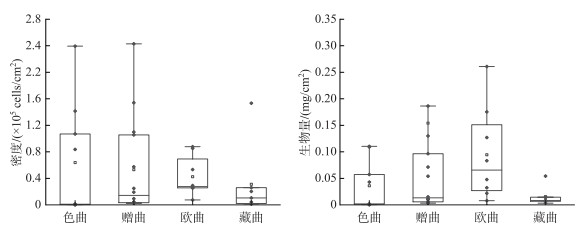
各支流着生藻类Shannon-Wiener多样性指数的变动范围为1.35~2.97,Pielou均匀度指数的变动范围为0.43~0.95,Margalef丰富度指数的变动范围为1.12~3.79(图 3)。Kruskal-Wallis非参数检验结果显示,各支流着生藻类的Shannon-Wiener指数和Pielou均匀度指数不存在显著差异,藏曲着生藻类的Margalef丰富度指数高于色曲和欧曲(P < 0.05)。
|
图 3 金沙江上游主要支流着生藻类物种丰富度、Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)及丰富度指数(D)(*和**分别表示P < 0.05和P < 0.01) Fig.3 Species richness, Shannon-Wiener diversity index (H′), Pielou evenness index (J), and Margalef index (D) of periphytic algae communities in major tributaries of the upper Jinsha River |
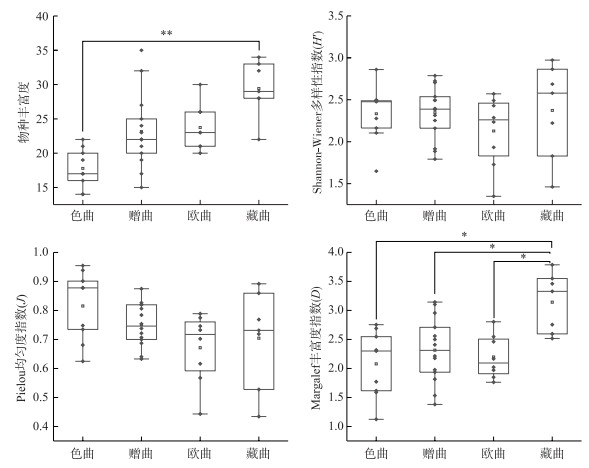
NMDS和PERMANOVA结果表明,着生藻类群落结构总体上存在显著的空间差异(F=2.661, P=0.001)(图 4、附表Ⅲ)。其中,色曲和赠曲的藻类群落存在显著差异(R2=0.134, P=0.024),色曲和欧曲的藻类群落存在显著差异(R2=0.215, P=0.006),欧曲和藏曲之间也存在显著差异(R2=0.182, P=0.018)。
|
图 4 基于Bray-Curtis距离非度量多维尺度(NMDS)分析 Fig.4 Non-metric multidimensional scaling (NMDS) plot based on the periphytic algal abundance |
指示种分析显示,色曲的指示种以极细微曲壳藻、极小桥弯藻和微型舟形藻为主,赠曲的指示种以极细微曲壳藻、极小桥弯藻和谷皮菱形藻为主,欧曲的指示种以谷皮菱形藻、极细微曲壳藻和普通菱形藻为主,藏曲的指示种以希罗鞘丝藻、极小桥弯藻和谷皮菱形藻为主(表 2)。
| 表 2 金沙江上游各支流着生藻类指示种* Tab. 2 Indicator species of periphytic algae in each tributary of the upper Jinsha River |
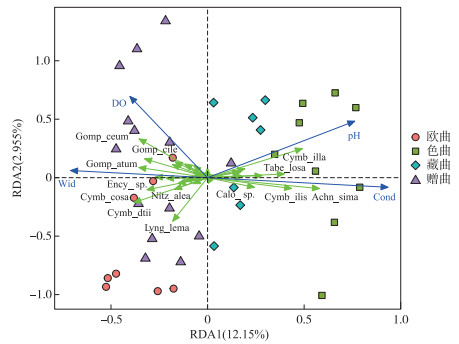
RDA结果表明,第1排序轴和第2排序轴的特征值分别为0.065和0.016,共解释了金沙江上游支流着生藻类群落变异的15.10 % (附表Ⅳ),置换检验结果也证实环境因子显著影响着生藻类的群落结构(F=1.910, P=0.001)。RDA排序图显示,电导率与第1排序轴的正相关性最高,其次为pH;溶解氧和河宽与第1排序轴呈负相关;溶解氧和pH值与第2排序轴呈负相关(图 5、附表Ⅴ)。
|
图 5 着生藻类群落结构与环境因子的RDA排序图 (Cymb_dtii:胡斯特桥弯藻Cymbella hustedtii;Cymb_cosa:偏肿桥弯藻 Cymbella ventricosa;Lyng_lema:半丰鞘丝藻Lyngbya semiplema;Gomp_cile:纤细异极藻Gomphonema gracile;Syne_lata:平片针杆藻Synedra tabulata;Gomp_ceum:橄榄绿异极藻Gomphonema olivaceum;Cymb_illa:极小桥弯藻Cymbella perpusilla;Tabe_losa:绒毛平板藻Tabellaria flocculosa;Cymb_ilis:纤细桥弯藻 Cymbella gracilis;Achn_sima:极细微曲壳藻Achnanthes minutissima ) Fig.5 RDA ordination plot of periphytic algae community structure and environmental factors |
环境因子对金沙江上游各主要支流着生藻类分布的相关性大小为:电导率> pH值>河宽>溶解氧。其中,胡斯特桥弯藻、偏肿桥弯藻、纤细异极藻、平片针杆藻、橄榄绿异极藻与河宽、溶解氧呈正相关,与pH、电导率呈负相关;极小桥弯藻、绒毛平板藻、纤细桥弯藻、极细微曲壳藻与pH值、电导率呈正相关,与河宽、溶解氧呈负相关(图 5)。
3 讨论 3.1 群落组成及结构特征本研究调查结果显示,金沙江上游主要支流着生藻类以硅藻门种类为主,与历史调查结果和邻近水域的研究结果较为相似[7, 31-32]。1976年,中国科学院青藏高原综合科学考察队在金沙江上游的江达县、贡觉县共鉴定到硅藻45个分类单元以及单一水绵(Spirogyra singularis)、近亲水绵(Spirogyra affinia)、巨型螺旋藻(Spirulina major)、中型囊裸藻(Trachelomonas intermedia)、居氏粘球藻(Gloeocapsa kutzingiana)、铅色聚球藻(Synechococcus Slividus)、粗壮席藻(Phormidium valderianum)等种类[23, 33]。近年来,在金沙江上游干流[7]、西藏尼洋河[30]以及邻近的雅砻江大河湾河段[32]也发现硅藻是着生藻类的优势类群。在属级水平上,曲壳藻属(Achnanthes)、卵形藻属(Cocconeis)、桥弯藻属(Cymbella)、脆杆藻属(Fragilaria)、异极藻属(Gomphonema)等是常见的分类单元[32]。
空间上,不同支流着生藻类的组成及群落结构也存在一定的差异。半丰鞘丝藻、纤细等片藻、平片针杆藻、微型舟形藻、胡斯特桥弯藻、偏肿桥弯藻、纤细桥弯藻、箱形桥弯藻、内丝藻、橄榄绿异极藻、谷皮菱形藻等种类分布于60 % 以上的样点,是较常见的物种。克里藻属(Klebsormidium)物种多出现在欧曲和藏曲。藏曲蓝藻的物种数多于其他支流。除物种组成外,藏曲着生藻类的密度和现存量的变幅范围小于其他支流,可能与河道内普遍存在的采石挖沙活动有关。采石挖沙破坏了河道生境原有的异质性,造成底质类型的同质化,从而减小了藏曲各采样点着生藻类的密度和生物量的空间变异[1]。
3.2 群落结构差异的驱动因子及机制藻类多样性及群落结构受多种生态因子的综合影响。已有研究显示,水温、电导率、pH、营养水平等水体理化指标是影响着生藻类群落空间差异的主要因子[34-36]。其中,水温可以通过影响光合作用的酶促反应、呼吸作用强度以及对营养盐吸收速率,进而影响着生藻类的增殖[34]。硅藻的适宜水温一般低于蓝藻和绿藻,在低温环境往往是优势类群。本研究地处青藏高原,冰川融雪是各支流的主要补给,河道水温低于同纬度低海拔水域,整体的河流水温环境使得硅藻成为优势类群。
在山区河流中,电导率也是影响硅藻群落分布的主要因素之一。电导率受水体中游离离子浓度影响,可间接反映水中钙、镁等溶解无机盐离子的浓度,与水体可溶性营养物浓度呈正相关,一定范围内电导率的上升有助于硅藻密度的增加[35, 37]。美国地质调查局(USGS)开展的国家河流水质监测和评价研究也指出,电导率的空间差异可以决定全国范围内河流底栖硅藻群落的空间分布,如胡斯特桥弯藻适宜的电导率较低,均值为254 μS/cm,而曲壳藻属的一些种类则喜好电导率较高的水域,其最适值可达593~1033 μS/cm。我们的研究结果与其较为一致[38]。同样,pH值指示着水体酸碱度的水平,影响着藻类的生理生化活动,如光合作用。不同的藻类对CO2、HCO3-、CO32-等碳源的利用程度不同,具有不同的酸碱度耐受范围,也因此可以划分为嗜酸性、嗜碱性和普适性等类型。金沙江上游支流水体整体呈弱碱性,着生藻类组成以喜弱碱的种类为主。异极藻属等多为偏好弱酸性环境的种类,其种群丰度受到一定影响[39]。在拉萨河流域,异极藻、脆杆藻和曲壳藻等的丰度受pH值影响较大[8]。
除水体理化指标外,河宽等物理形态也是影响着生藻类多样性的主要因子之一。河宽与流速、水深等水文条件和底质类型有关,反映了流量、泥沙携带量和河床组成等要素的多样性[40],也通常与流速呈负相关[41],流速增大可抑制藻类的定植与生长。例如,在三峡库区大宁河汇水区的相关研究表明,在其他条件适宜的情况下,流速是藻类生长的主要抑制因子[42]。本研究中,胡斯特桥弯藻、偏肿桥弯藻、纤细异极藻、平片针杆藻等多以单细胞的形式存在,个体较小,在赠曲的赠科、河坡,欧曲的麻绒、仲学等宽谷河段密度较高。绒毛平板藻壳体常联成“Z”形或星形群体,极细微曲壳藻多联成带状或树状群体,或以壳面着生于基质,或以胶质柄着生于在其他物体上,具有较强的附着能力,可适应流速较快或河道较窄的水域,如色曲。
此外,土地利用[14, 43]和人类活动[44-46]等宏观生态因子也会影响着生藻类的多样性和群落结构。如,在关于不同的土地利用方式对藻类群落结构影响的研究中,森林用地区、森林耕作用地区、耕地区和城市建设用地区的河流硅藻指示种组成具有显著差异[47];人类活动较强的城市区河流的TN、TP等指标会显著高于郊区河流,从而导致两个地区的藻类优势种有明显差异,城镇化导致着生藻类β多样性降低[48-49]。人类活动也可以通过改变水体温度和水动力等因素间接改变藻类的群落结构[50-51]。因此,后续研究应纳入空间距离、土地覆盖/利用等表征空间因子和人类活动的变量,比较分析河段、流域等不同尺度上相关生态变量在金沙江上游着生藻类群落结构时空格局中的相对贡献,以全面理解金沙江上游着生藻类多样性的维持机制。
4 结论金沙江上游支流色曲、赠曲、欧曲和藏曲着生藻类群落均以硅藻门种类为主。各支流着生藻类的群落结构具有明显的空间差异,电导率、溶解氧、pH值等环境因子是着生藻类群落结构的关键驱动因子。金沙江上游是长江流域重要的生态屏障,随着人为活动的加强,河流环境的变化也将改变生藻类多样性的时空格局,建议加强后续监测,建立基于着生藻类的河流健康评价体系,指导金沙江上游河流生态系统的健康管理。
5 附录附表Ⅰ~Ⅴ见电子版(DOI: 10.18307/2024.0515)。
| 附表Ⅰ 金沙江上游主要支流着生藻类名录 Appendix Ⅰ List of periphytic algae communities in each tributary of the upper Jinsha River |
| 附表Ⅱ 金沙江上游支流着生藻类主要优势种及优势度 Appendix Ⅱ Dominant periphytic algae and their dominance of periphytic algae communities in each tributary of the upper Jinsha River |
| 附表Ⅲ 不同支流着生藻类群落结构的PERMANOVA分析结果 Appendix Ⅲ PERMANOVA results of periphytic algal community structure |
| 附表Ⅳ 着生藻类群落结构与环境因子的冗余分析(RDA)结果 Appendix Ⅳ Redundancy analysis (RDA) results of periphytic algae community structure and environmental factors |
| 附表Ⅴ 环境因子与RDA排序轴的的回归拟合分析 Appendix Ⅴ Correlation coefficients between environmental variables and RDA ordination axes |
| [1] |
Sofi MS, Hamid A, Bhat SU et al. Understanding the role of natural and anthropogenic forcings in structuring the periphytic algal assemblages in a regulated river ecosystem. Scientific Reports, 2023, 13: 1882. DOI:10.1038/s41598-023-27773-3 |
| [2] |
Ma BS, Wei KJ, Zhao TY et al. Research progress on the systematic evolution and plateau adaptation of schizothoracine fishes. J Lake Sci, 2023, 35(3): 808-824. [马宝珊, 魏开金, 赵天一等. 裂腹鱼类系统进化及高原适应性研究进展. 湖泊科学, 2023, 35(3): 808-824. DOI:10.18307/2023.0304] |
| [3] |
谢从新, 霍斌, 魏开建. 雅鲁藏布江中游裂腹鱼类生物学与资源保护. 北京: 科学出版社, 2019.
|
| [4] |
Zhou J, Chen XJ, Li MJ. Preliminary study on feeding habits of white turtle. Reservoir Fisheries, 2007, 28(5): 83, 107. [周剑, 陈先均, 李孟均. 白甲鱼食性的初步研究. 水利渔业, 2007, 28(5): 83, 107.] |
| [5] |
DeNicola DM, Kelly M. Role of periphyton in ecological assessment of lakes. Freshwater Science, 2014, 33(2): 619-638. DOI:10.1086/676117 |
| [6] |
Dunck B, Felisberto SA, de Souza Nogueira I. Effects of freshwater eutrophication on species and functional beta diversity of periphytic algae. Hydrobiologia, 2019, 837(1): 195-204. DOI:10.1007/s10750-019-03971-x |
| [7] |
Hu JC, Song ZB, Zhou JC et al. Differences in diversity and community assemblyprocesses between planktonicand benthic diatoms in the upper reach of the Jinsha River, China. Hydrobiologia, 2022, 849(7): 1577-1591. DOI:10.1007/s10750-022-04801-3 |
| [8] |
Soininen J. Environmental and spatial control of freshwater diatoms—A review. Diatom Research, 2007, 22(2): 473-490. DOI:10.1080/0269249x.2007.9705724 |
| [9] |
Potapova MG, Charles DF. Benthic diatoms in USA rivers: Distributions along spatial and environmental gradients. Journal of Biogeography, 2002, 29(2): 167-187. DOI:10.1046/j.1365-2699.2002.00668.x |
| [10] |
Wei JW, Li HR, Wang XZ et al. Structure characteristics and driving variables of epilithic algae community in Lhasa River Basin of Qinghai-Tibet Plateau. Environmental Science, 2021, 42(4): 1879-1888. [魏俊伟, 李鸿然, 汪兴中等. 青藏高原拉萨河流域附石藻类群落结构特征及其驱动因子分析. 环境科学, 2021, 42(4): 1879-1888. DOI:10.13227/j.hjkx.202008142] |
| [11] |
Hu YX, Cao L, Qu RC et al. Community composition and assessment of the aquatic ecosystem of periphytic algae in the Yangtze River Basin. Environmental Science, 2022, 43(8): 3998-4007. [胡愈炘, 曹亮, 屈仁超等. 长江流域着生藻类群落结构的空间格局及其生态评价. 环境科学, 2022, 43(8): 3998-4007. DOI:10.13227/j.hjkx.202111229] |
| [12] |
Ma BS, Xu B, Wei KJ et al. Periphytic algal community and its relation to the environmental conditions in the middle Anning River, China. Freshwater Fisheries, 2020, 50(6): 30-39. [马宝珊, 徐滨, 魏开金等. 安宁河中游着生藻类群落结构及其与环境因子的关系. 淡水渔业, 2020, 50(6): 30-39.] |
| [13] |
Ma BS, Wei KJ, Xu J et al. Diversity and spatial distribution of periphytic algae in the lower reaches of the Yalong River and its main tributary, the Anning River. Journal of Fishery Sciences of China, 2021, 28(12): 1602-1611. [马宝珊, 魏开金, 徐进等. 雅砻江下游及其主要支流安宁河着生藻类多样性与空间分布. 中国水产科学, 2021, 28(12): 1602-1611. DOI:10.12264/JFSC2021-0055] |
| [14] |
Wu NC, Thodsen H, Andersen HE et al. Flow regimes filter species traits of benthic diatom communities and modify the functional features of lowland streams—A nationwide scale study. Science of the Total Environment, 2019, 651(Pt 1): 357-366. DOI:10.1016/j.scitotenv.2018.09.210 |
| [15] |
Pandey LK, Sharma YC, Park J et al. Evaluating features of periphytic diatom communities as biomonitoring tools in fresh, brackish and marine waters. Aquatic Toxicology, 2018, 194: 67-77. DOI:10.1016/j.aquatox.2017.11.003 |
| [16] |
Park J, Bergey EA, Han T et al. Diatoms as indicators of environmental health on Korean Islands. Aquatic Toxicology, 2020, 227: 105594. DOI:10.1016/j.aquatox.2020.105594 |
| [17] |
Algarte VM, Dunck B, Leandrini JA et al. Periphytic diatom ecological guilds in floodplain: Ten years after dam. Ecological Indicators, 2016, 69: 407-414. DOI:10.1016/j.ecolind.2016.04.049 |
| [18] |
孙鸿烈. 长江上游地区生态与环境问题. 北京: 中国环境科学出版社, 2008.
|
| [19] |
宋萌勃, 李太星, 陈吉琴. 金沙江流域降水径流特性初步分析. 长江工程职业技术学院学报, 2012, 29(1): 1-4. |
| [20] |
金沙江上游水电规划环境影响报告书. 中国水电顾问集团成都勘测设计研究院有限公司, 2011.
|
| [21] |
胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态. 北京: 科学出版社, 2006.
|
| [22] |
李家英, 齐雨藻. 中国淡水藻志. 北京: 科学出版社, 2010.
|
| [23] |
朱蕙忠, 陈嘉佑. 中国西藏硅藻. 北京: 科学出版社, 2000: 87-341.
|
| [24] |
Shannon CE. A mathematical theory of communication. Bell System Technical Journal, 1948, 27(3): 379-423. DOI:10.1002/j.1538-7305.1948.tb01338.x |
| [25] |
Pielou EC. An introduction to mathematical ecology. New York: Wiley-Inter-science, 1969.
|
| [26] |
Ulanowicz RE. Information theory in ecology. Computers & Chemistry, 2001, 25(4): 393-399. DOI:10.1016/s0097-8485(01)00073-0 |
| [27] |
Levin SA. Encyclopedia of biodiversity: Second edition. Elsevier Science, 2013, 264-268. DOI:10.1016/B978-0-12-384719-5.00430-5 |
| [28] |
ter Braak CJF. Canonical correspondence analysis: A new eigenvector technique for multivariate direct gradient analysis. Ecology, 1986, 67(5): 1167-1179. DOI:10.2307/1938672 |
| [29] |
Oksanen J, Simpson GL, Blanchet FG et al. Vegan: Community ecology package. https://cran.r-project.org/web/packages/vegan,2022.
|
| [30] |
Wickham H. Ggplot2: Elegant graphics for data analysis. Springer-Verlag New York. https://ggplot2.tidyverse.org.2016.
|
| [31] |
Liu HP, Ye SW, Yang XF et al. Spatio-temporal dynamics of aquatic organism community and their relationships to environment in Niyang River, Tibet: 2.periphytic algae. J Lake Sci, 2013, 25(6): 907-915. [刘海平, 叶少文, 杨雪峰等. 西藏尼洋河水生生物群落时空动态及与环境因子关系: 2.着生藻类. 湖泊科学, 2013, 25(6): 907-915. DOI:10.18307/2013.0615] |
| [32] |
韩佳民. 雅砻江大河湾着生藻类群落研究与河流健康度评价[学位论文]. 重庆: 西南大学, 2022.
|
| [33] |
Li YY. Thermal cyanophytes of the Xizang Plateau and Hengduan Mountain Region. Acta Hydrobiologica Sinica, 1985, 9(3): 264-279. [李尧英. 西藏高原及横断山区的温泉蓝藻. 水生生物学报, 1985, 9(3): 264-279.] |
| [34] |
Li XD, Pan CM, An RZ et al. Niche and interspecific association of dominant phytoplankton species in different hydrological periods in the middle and lower reaches of Lhasa River, Tibet, China. J Lake Sci, 2023, 35(1): 118-130. [李晓东, 潘成梅, 安瑞志等. 西藏拉萨河中下游不同水文期浮游植物优势种生态位及种间联结性. 湖泊科学, 2023, 35(1): 118-130. DOI:10.18307/2023.0107] |
| [35] |
Panahy Mirzahasanlou J, Ramezanpour Z, Nejadsattari T et al. Temporal and spatial distribution of diatom assemblages and their relationship with environmental factors in Balikhli River (NW Iran). Ecohydrology & Hydrobiology, 2020, 20(1): 102-111. DOI:10.1016/j.ecohyd.2019.04.002 |
| [36] |
da Silva CFM, Torgan LC, Schneck F. Temperature and surface runoff affect the community of periphytic diatoms and have distinct effects on functional groups: Evidence of a mesocosms experiment. Hydrobiologia, 2019, 839: 37-50. DOI:10.1007/s10750-019-03992-6 |
| [37] |
Fu JK, Liu L, He XY et al. Dynamics of epilithic algae communities and their relationship with environmental factors during storage and non-storage periods in the Three Gorges Reservoir. Environmental Science, 2019, 40(7): 3099-3107. [付君珂, 刘黎, 贺新宇等. 三峡库区蓄水期和非蓄水期附石藻类群落变化及其影响因子分析. 环境科学, 2019, 40(7): 3099-3107. DOI:10.13227/j.hjkx.201812086] |
| [38] |
Potapova M, Charles DF. Distribution of benthic diatoms in U.S. rivers in relation to conductivity and ionic composition. Freshwater Biology, 2003, 48(8): 1311-1328. DOI:10.1046/j.1365-2427.2003.01080.x |
| [39] |
Andrén C, Jarlman A. Benthic diatoms as indicators of acidity in streams. Fundamental and Applied Limnology, 2009, 173(3): 237-253. DOI:10.1127/1863-9135/2008/0173-0237 |
| [40] |
Finnegan NJ, Roe G, Montgomery DR et al. Controls on the channel width of rivers: Implications for modeling fluvial incision of bedrock. Geology, 2005, 33(3): 229. DOI:10.1130/g21171.1 |
| [41] |
Wang SJ, Wei QW, Tan LH et al. River regime and its variety of the mountainous rivers: Najiang, Lancangjiang and Jinshanjiang Rivers for their reaches in Yunnan Province of China. Journal of Mountain Science, 2009, 27(1): 5-13. [王随继, 魏全伟, 谭利华等. 山地河流的河相关系及其变化趋势——以怒江、澜沧江和金沙江云南河段为例. 山地学报, 2009, 27(1): 5-13. DOI:10.3969/j.issn.1008-2786.2009.01.002] |
| [42] |
Huang C, Zhong CH, Deng CG et al. Preliminary study on correlation between flow velocity and algae along Daning River's backwater region at sluice initial stages in the Three Gorges Reservoir. Journal of Agro-Environment Science, 2006, 25(2): 453-457. [黄程, 钟成华, 邓春光等. 三峡水库蓄水初期大宁河回水区流速与藻类生长关系的初步研究. 农业环境科学学报, 2006, 25(2): 453-457. DOI:10.3321/j.issn:1672-2043.2006.02.038] |
| [43] |
O'Brien PJ, Wehr JD. Periphyton biomass and ecological stoichiometry in streams within an urban to rural land-use gradient. Hydrobiologia, 2010, 657(1): 89-105. DOI:10.1007/s10750-009-9984-5 |
| [44] |
Jia XH, Jiang WX, Li FQ et al. Impacts of large hydropower station on benthic algal communities. Chinese Journal of Applied Ecology, 2009, 20(7): 1731-1738. [贾兴焕, 蒋万祥, 李凤清等. 大型水电站对河流底栖藻类群落的影响. 应用生态学报, 2009, 20(7): 1731-1738.] |
| [45] |
Nicolosi Gelis MM, Cochero J, Sathicq MB et al. Effect of pollution on early diatom colonisation on artificial substrata in urban lowland streams. Marine and Freshwater Research, 2021, 72(3): 365. DOI:10.1071/mf19293 |
| [46] |
Gillett ND, Pan YD, Eli Asarian J et al. Spatial and temporal variability of river periphyton below a hypereutrophic lake and a series of dams. Science of the Total Environment, 2016, 541: 1382-1392. DOI:10.1016/j.scitotenv.2015.10.048 |
| [47] |
MacDougall MJ, Paterson AM, Winter JG et al. Response of periphytic diatom communities to multiple stressors influencing lakes in the Muskoka River Watershed, Ontario, Canada. Freshwater Science, 2017, 36(1): 77-89. DOI:10.1086/690144 |
| [48] |
Liu C, Liu XY, Zhou JC et al. Response of stream benthic algal diversity to urbanization: A case study in Shenzhen. Acta Ecologica Sinica, 2022, 42(24): 10041-10050. [刘婵, 刘心怡, 周佳诚等. 河流着生藻类多样性对城镇化的响应——以深圳市为例. 生态学报, 2022, 42(24): 10041-10050. DOI:10.5846/stxb202105271393] |
| [49] |
PoulíČková A, Duchoslav M, Dokulil M. Littoral diatom assemblages as bioindicators of lake trophic status: A case study from perialpine lakes in Austria. European Journal of Phycology, 2004, 39(2): 143-152. DOI:10.1080/0967026042000201876 |
| [50] |
Thomas KE, Kluke A, Hall RI et al. Assessment of benthic algal biomonitoring protocols to evaluate effects of shoreline development on the nearshore zone of Precambrian Shield lakes in Ontario. Lake and Reservoir Management, 2011, 27(4): 398-413. DOI:10.1080/07438141.2011.633307 |
| [51] |
Liu YY, Chen GJ, Shi HB et al. Responses of a diatom community to human activities and climate changes in Xingyun Lake. Acta Ecologica Sinica, 2016, 36(10): 3063-3073. [刘园园, 陈光杰, 施海彬等. 星云湖硅藻群落响应近现代人类活动与气候变化的过程. 生态学报, 2016, 36(10): 3063-3073. DOI:10.5846/stxb201412122477] |
 2024, Vol. 36
2024, Vol. 36 


