(2: 江西鄱阳湖湿地保护与恢复国家长期科研基地, 江西鄱阳湖湿地生态系统国家定位观测研究站, 南昌 330031)
(3: 江西生态文明研究院, 江西“两山”转化与生态产品价值实现研究示范国家级专家服务基地, 南昌 330031)
(4: 江西省鄱阳湖国家级自然保护区管理局, 南昌 330031)
(2: Jiangxi Poyang Lake Wetland Conservation and Restoration National Permanent Scientific Research Base, National Ecosystem Research Station of Jiangxi Poyang Lake Wetland, Nanchang 330031, P.R.China)
(3: Jiangxi Institute of Ecological Civilization, National Expert Service Base for Research and Demonstration of the "Two Mountains" Transformation and the Eco-products Value Realization in Jiangxi Province, Nanchang 330031, P.R.China)
(4: Administration Bureau of Poyang Lake National Nature Reserve in Jiangxi Province, Nanchang 330031, P.R.China)
土壤是陆地生态系统最大的碳库,其碳储量超过大气和植被碳库的总和[1]。土壤有机碳分解过程是土壤有机碳进入大气的主要途径,每年的CO2通量高达51 Pg C[2],约为化石燃料燃烧释放CO2量的10倍。因此,土壤有机碳分解过程的任何微小变动都可能引起大气中CO2浓度的明显改变,进而影响全球气候变化过程。
温度是影响土壤有机碳分解的关键因子,其作用在全球变暖的大背景下备受关注。温度敏感性(Q10,即温度每提升10 ℃时碳分解速率增加的倍数)是反映土壤有机碳分解对温度变化敏感程度的重要指标。目前的生态系统模型大多采用固定的值来计量土壤有机碳分解的Q10(如Q10=2或1.5)[3]。然而,土壤有机碳分解的Q10值并不是固定的。Schlesinger等[4]于1977年收集分析了全球各种生态系统中的土壤碳分解数据,发现Q10的变化范围为1.3~3.3。2021年王思琦等[5]通过分析全球199个站点的碳通量和气象数据提出,受年均气温、年降雨量和饱和水汽压差等环境变化的影响,全球陆地生态系统中的Q10在0.48~9.95之间波动。许多研究表明,土壤有机碳的质量是调控Q10变化的关键参数[6]。经典的碳质量理论(carbon quality theory, CQT)认为,土壤有机碳分解的温度敏感性由基质质量控制,复杂的有机化合物一般具有较低的分解速度和较高的活化能,因而易分解有机碳的温度敏感性较低,难分解碳的温度敏感性较高。部分研究支持了这一观点。例如,Bosatta等[7]将土壤有机质质量与热力学结合,发现土壤有机质分解的温度敏感性取决于有机质的质量,并指出土壤有机质质量是土壤碳储存和养分矿化速率的主要决定因素。Knorr等[8]将土壤有机质分成3种不同组分,通过数学模型发现难分解组分的Q10要高于易分解组分。但是,还有许多研究的结果并不支持CQT,并且发现Q10与土壤有机碳的质量无关,甚至是负相关。例如,Mellio等[9]对北美中纬度林的土壤升温实验结果表明,土壤中质量较高、易分解碳库的温度敏感性较高,而难分解碳库对温度不敏感。因此,进一步探索Q10与土壤有机质质量的关系对认识土壤有机碳的稳定性具有重要意义。
湿地是地球上的重要碳库,其面积虽然只占全球陆地面积的4%~6%,但是其土壤碳库储存着全球30%以上的土壤碳[10]。为了厘清湿地对气候变暖的响应,科学家们已经尝试在多种湿地生态系统中报道土壤有机碳分解的Q10。例如,赵烨彤等[11]提出北方泥炭地的Q10在1.4~5.0间变化,而微生物群落是影响泥炭土矿化速率温度敏感性的主要原因。但如今大多数研究成果来自极地泥炭地[11]和高原湿地[12]等水文过程不大的湿地生态系统。目前全球湿地水文格局正在剧烈变化,其淹水过程也在明显变化[13]。湿地淹水状态的变化会直接改变土壤pH和厌氧好氧环境,影响生物活性[14],进而影响有机质的生成和有机碳的积累与转化,改变土壤有机碳分解过程的温度敏感性[14]。然而,目前还较少有研究报道淹水变化对湿地土壤Q10的影响。淹水梯度上土壤有机碳质量对Q10的调控规律也不明确。
鄱阳湖湿地位于长江中下游平原,1992年被列入《世界重要湿地名录》。鄱阳湖年内水文波动明显,具有“高水似湖,低水似河”的独特自然地理景观。冬季枯水期,随着水位的降低,不同高程的洲滩依次出露,鄱阳湖湿地呈现出河、湖、滩交错分布的景观特征。因此,鄱阳湖湿地是研究淹水梯度上湿地土壤Q10变化特征的理想地点。本研究以鄱阳湖典型碟形子湖——东湖为研究对象,分析淹水时长梯度上(泥滩带、苔草带和芦苇带)不同深度土壤有机碳分解速率和Q10的变化特征,明确碳质量理论在淹水时长梯度上的有效性,以期为认识全球变暖和水文节律背景下湿地生态系统的碳循环过程提供数据支撑及科学依据。本研究拟解决的科学问题为:(1)洲滩湿地土壤有机碳分解速率及温度敏感性在不同植被带、不同土层深度之间否存在差异?(2)洲滩湿地土壤有机碳分解速率及温度敏感性是否受有机碳质量的影响?本文假设:(1)由于植物碳输入的差异,洲滩湿地土壤有机碳分解速率随着淹水时长减少(从泥滩带到芦苇带)而升高,随着土壤深度的增加而降低。(2)根据碳质量理论,洲滩湿地土壤有机碳分解速率随着淹水时长减少(从泥滩带到芦苇带)而降低,随着土壤深度的增加而升高。
1 材料与方法 1.1 研究区概况鄱阳湖湿地位于江西省北部,是我国最大的淡水湖。鄱阳湖湿地属于典型的亚热带季风气候,具有冬春寒、夏多雨、秋旱的特征,年平均温度为17.9 ℃,年降水量为1450~1550 mm。受五河(赣江、修水、饶河、信江、抚河)及长江来水的共同影响,鄱阳湖水位年内变化明显。在丰水期,湖面面积达到3600 km2。在枯水期,湖面面积缩小至482 km2左右[15]。因此,大量的洲滩湿地在冬季枯水期间出露。随着淹水时长的减少,鄱阳湖洲滩湿地呈现泥滩带(出露天数小于150 d)、湿生植物被带(出露天数约为165~271 d)和挺水植被带(出露天数约为271~305 d)的变化[16]。湿生植被带的主要植被包括苔草(Carex tristachya Thunb)和虉草(Phalaris arundinacea)等。挺水植被带的主要植被为芦苇(Phragmites australis)和南荻(Miscanthus lutarioriparius)等。
1.2 样地设置及样品采集研究区位于鄱阳湖西南角的东湖洲滩湿地(28°56′06″N,116°21′13″E)(图 1)。该湿地的湿生植被带为苔草带,挺水植被带为芦苇带。在2020年11月秋季枯水期,沿高程在泥滩带、苔草带和芦苇带各设置1条平行于湖岸的样线。每条样线约长150 m,在每条样线上建立了8个1 m×1 m的样方,相邻样方的间隔约为20 m。使用直径为7 cm的土钻在每个样方中随机采集3钻土壤样品,取样深度分别为0~10、10~20和20~30 cm。样品当天送回实验室。在实验室中将每个样方的土壤样品均匀地混合,手工去除石块和根系,研磨过2 mm筛。
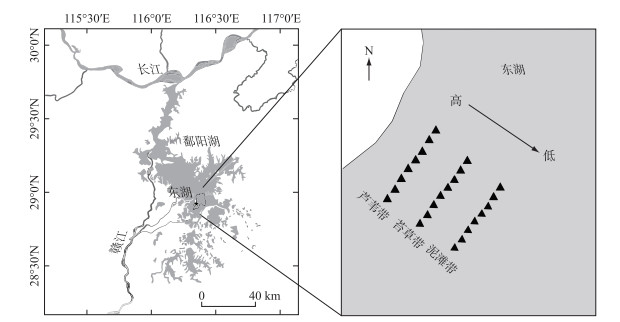
|
图 1 鄱阳湖典型洲滩湿地样线分布 Fig.1 Transect distribution of typical shoal wetlands in Lake Poyang |
土壤有机碳分解速率采用一套土壤培养与CO2通量测定系统测定[17]。称取相当于30 g干重的新鲜土壤放入125 mL玻璃培养瓶中,调节土壤水分使样品统一达到55%的饱和含水量。将培养瓶在室温下静置6 d以消除土壤扰动对实验结果的影响。将培养瓶放入控温系统的样品槽中,在10、15、20、25、30 ℃下通过红外分析仪(Li-820,Licor,USA)测定土壤样品的CO2通量数据(记录3 min的CO2浓度数据,运用后2 min数据计算土壤有机碳分解速率)。该系统采用低温冷却槽对土壤样品槽进行控温(土壤样品可以在2 h内稳定在指定温度),利用温度计测定土壤样品的实际温度。运用R10、R15、R20、R25、R30来表示10、15、20、25、30 ℃下的土壤有机碳分解速率,并运用指数方程拟合土壤有机碳分解的Q10。
土壤有机碳分解速率计算公式为:
| R=(3.6×24×ΔC×V×ρ)/m | (1) |
式中,R为土壤有机碳分解速率(μg/(d·g));ΔC为培养瓶中单位时间CO2交换量(g/s);m为培养土壤质量(g);ρ为CO2标准气体浓度(g/L)。
Q10的拟合公式为:
| R=αeβT | (2) |
| Q10=e10β | (3) |
式中,R为CO2释放速率(μg/(d·g));T为培养温度(℃);α为温度为0 ℃时的净分解速率;β为温度反应系数。
1.4 土壤有机碳含量及组分测定的土壤有机碳含量及组分指标包括土壤有机碳(SOC)、可溶性有机碳(DOC)、微生物生物量碳(MBC)和傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)[18]。SOC含量采用重铬酸钾氧化法测定;DOC采用浸提法(水土比为5∶1)通过总有机碳分析仪(Elementar,Hanau,德国)测定;土壤MBC含量采用底物诱导呼吸法(substrate-induced respiration method,SIR)测定。
土壤FTIR运用Thermo Scientific Nicolet iS20 FTIR仪器测定。土样与KBr比例为1∶100,光谱测定范围为450~4000 cm-1,数据间隔为0.5 cm-1,扫描次数为32。用软件OMNIC对光谱进行基线校正,计算2920、2850、1630、1536和1420 cm-1 5个特征峰(表 1)的面积[19-20]。计算各个特征峰相对面积(rA2920、rA2850、rA1630、rA1536和rA1420),即其中1个特征峰面积占5个特征峰总面积的比例。同时,利用有机质分解指数(DI),即脂肪类特征峰面积与芳香类有机物特征峰面积的比值,作为易分解有机碳与难分解有机碳的比例,计算公式如下:
| DI=rA2920+rA2850rA1630 | (4) |
式中,rA2920为2920 cm-1特征峰的相对面积,rA2850为2850 cm-1特征峰的相对面积,rA1630为1630 cm-1特征峰的相对面积。
1.5 土壤理化参数测定的土壤理化参数包括土壤含水量(SWC)、pH、氧化还原电位(ORP)、总氮(TN)、总磷(TP)、铵态氮(NH4+-N)和硝态氮(NO3--N)。土壤pH和ORP用电位法测定(水土比为2.5∶1);SWC采用烘干恒量法测定;NH4+-N和NO3--N用1 mol/L的KCl溶液浸提(水土比为5∶1),采用连续流动分析仪(Skalar san++,Skalar,荷兰)测定;TN含量采用凯氏定氮法测定;TP含量采用紫外分光光度计,通过钼蓝比色法测定。
1.6 数据处理与分析各个温度下的土壤有机碳分解速率的变化规律具有相似性,所以利用接近鄱阳湖湿地平均温度的R20来指示鄱阳湖湿地土壤有机碳的分解速率。采用双因素方差分析比较植被带和土壤深度对土壤有机碳分解速率、Q10以及土壤理化性质的影响。运用相关分析明确土壤物理化学性质与R20和Q10的相关性。通过结构方程模型(AMOS 24.0)确定各土壤物理化学性质对R20和Q10的综合影响机制,并使用卡方检验(χ2,P>0.05)和近似均方根误差(RMSEA < 0.05,P>0.05)来评估结构方程模型的优度。
2 结果 2.1 土壤有机碳分解速率和温度敏感性土壤有机碳分解速率均随着温度的升高而增长(图 2)。R10、R15、R20、R25和R30的变化范围分别为2.54~166.89、2.58~276.70、6.11~420.57、6.14~623.10和11.28~947.18 μg/(d·g),平均值分别为19.19、31.00、51.67、77.28和109.32 μg/(d·g)。总体上讲,各个温度下3个植被带之间的土壤有机碳分解速率均没有显著差异(P>0.05)(图 2)。但是土壤有机碳分解速率受土壤深度的显著影响(P < 0.05)(图 2)。0~10 cm的土壤有机碳分解速率显著高于10~20 cm(P < 0.001)和20~30 cm(P < 0.001)。此外,植被带和土壤深度对土壤有机碳分解速率具有显著的交互作用(P < 0.05)(图 2)。这是因为在0~10 cm,植被带显著影响土壤有机碳分解速率(R15: P=0.045;R20: P=0.030;R25: P=0.040; R30: P=0.028);但是在10~20 cm和20~30 cm,植被带的影响并不显著(P>0.05)。在0~10 cm,随着淹水时长的减少,从泥滩带、苔草带到芦苇带,R10、R15、R20、R25和R30均有增加的趋势,但只有芦苇带的分解速率显著高于泥滩带(R15: P=0.036;R20: P=0.024;R25: P=0.032; R30: P=0.023)。
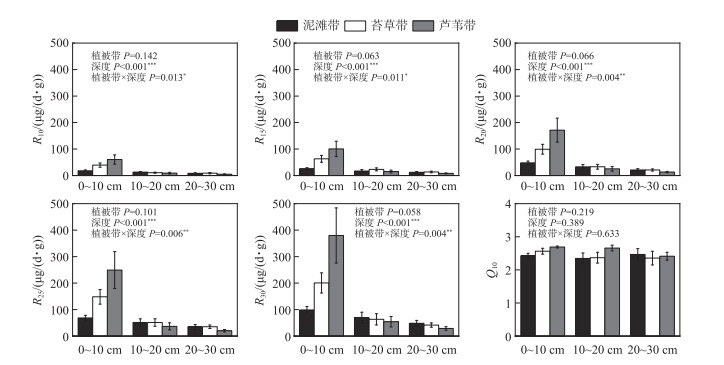
|
图 2 不同温度培养下土壤分解速率及温度敏感性的变化情况 (***表示差异极显著,P < 0.001;**表示差异极显著,P < 0.01;*表示差异显著,P < 0.05。下同) Fig.2 Changes of soil decomposition rate and temperature sensitivity under different temperature cultures |
洲滩湿地Q10值的变化范围为1.45~3.58,平均值为2.48。植被带和土壤深度对洲滩湿地土壤有机碳分解的Q10不存在显著的影响(植被带:P=0.218;深度:P=0.392)(图 2)。两者对Q10的交互作用也不显著(P=0.624)。
2.2 土壤有机碳组分SOC、DOC和MBC三者的变化范围分别为3.38~47.21 g/kg、0.043~0.41 g/kg和32.51~1688.26 mg/kg,平均值分别为14.77 g/kg、0.12 g/kg和575.65 mg/kg。SOC、DOC和MBC均受到植被带和土壤深度的显著影响,但它们的变化规律并不相同。在植被带梯度上,苔草带的SOC显著低于泥滩带(P=0.011)和芦苇带(P=0.046),泥滩带的DOC与苔草带(P < 0.001)和芦苇带(P=0.013)存在显著差异,芦苇带的MBC显著高于泥滩带(P < 0.001)和苔草带(P=0.001)。在土壤深度梯度上,0~10 cm土壤SOC和MBC显著高于10~20 cm和20~30 cm(均P < 0.001),0~10 cm的土壤DOC含量显著高于20~30 cm(P=0.041)。植被带和土壤深度对SOC和DOC均具有显著的交互作用(图 3)。植被带只在0~10和10~20 cm深度显著影响SOC。在0~10、10~20和20~30 cm土壤深度,最大的土壤DOC含量分别出现在芦苇带、苔草带和泥滩带(图 3)。
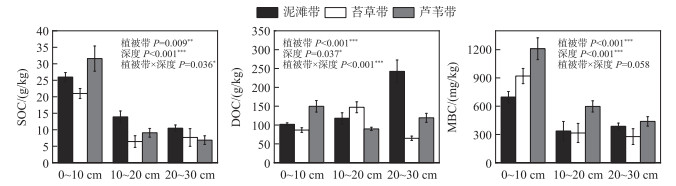
|
图 3 洲滩各植被带不同深度的碳组分含量差异 Fig.3 Carbon component content differences in different depths of vegetation zones on the island beach |
植被带显著影响土壤rA1402(P=0.001)、rA1536(P=0.001)、rA1630(P < 0.001)、rA2920(P=0.006)和DI(P=0.006)(图 4)。泥滩带土壤有机物具有较低的rA1402、rA1536、rA2920和DI,较高的rA1630。土壤深度显著影响rA1402(P=0.020)、rA1630(P < 0.001)、rA2850(P=0.039)、rA2920(P < 0.001)和DI(P < 0.001)。0~10 cm土壤比另两层土壤具有较高的rA1402、rA2850、rA2920和DI,较低的rA1630。植被带和土壤深度对rA1630(P=0.010)、rA2920(P < 0.001)和DI(P < 0.001)有显著的交互作用。植被带只在0~10 cm显著影响rA2920和DI,在0~10和20~30 cm显著影响rA1630。
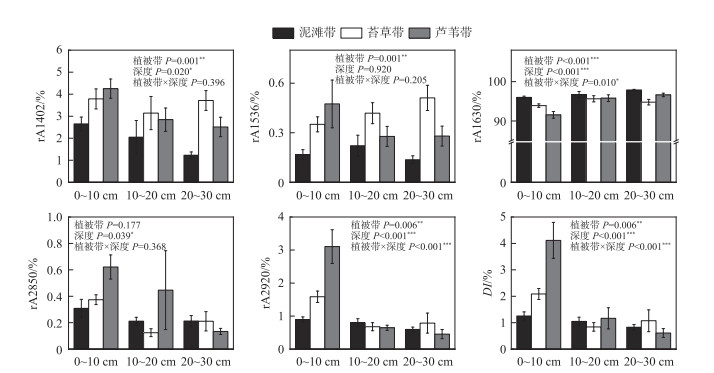
|
图 4 不同碳组分及相关参数变化情况 Fig.4 Changes of different carbon components and related parameters |
植被带显著影响土壤pH、TP、NO3--N和NH4+-N(P < 0.001)(表 2)。芦苇带的土壤pH和NH4+-N显著低于另外两个植被带(均P < 0.001),泥滩带的TP显著高于苔草带(P < 0.001)和芦苇带(P=0.005),苔草带的NO3--N显著低于泥滩带(P=0.004)和芦苇带(P < 0.001)。土壤深度显著影响ORP(P < 0.001)、SWC(P=0.001)、TN(P < 0.001)、TP(P < 0.001)、NO3--N(P < 0.001)和NH4+-N(P < 0.001)(表 2)。表层0~10 cm比另两层土壤具有更高的ORP、SWC、TN、TP、NO3--N和NH4+-N(P < 0.001)。植被带和土壤深度对土壤ORP(P < 0.001)、NO3--N(P < 0.001)和NH4+-N(P=0.008)有显著的交互作用(表 2)。植被带只在10~20和20~30 cm影响ORP,在不同的深度对NO3--N具有不同的影响,只在0~10和10~20 cm影响TP。
| 表 2 洲滩湿地不同植被带及深度的土壤理化性质差异 Tab. 2 Differences of soil physical and chemical properties in different vegetation zones and depths of the shoal wetland |
R20和Q10与土壤有机碳组分和土壤理化性质的相关性在0~10 cm要明显强于10~20 cm和20~30 cm(表 3)。在0~10 cm,R20与SOC、TN、NO3--N、NH4+-N、DOC、MBC、DI、rA2920、rA2850和rA1536呈显著正相关,与pH、SWC和rA1630呈显著负相关。在10~20 cm和20~30 cm,R20主要与SOC、TN和TP呈显著正相关。在10~20 cm,R20还与MBC呈显著正相关。在0~10 cm,Q10与NH4+-N、MBC、DI和rA2920呈显著正相关,与pH和rA1630呈显著负相关。在10~20 cm,Q10与NH4+-N和MBC呈显著正相关,与pH呈显著负相关。在20~30 cm,Q10仅与SWC呈显著负相关。
| 表 3 土壤温度敏感性和分解速率(20 ℃)与土壤理化性质及碳组分的相关分析1) Tab. 3 Correlation analysis of soil temperature sensitivity and decomposition rate (20 ℃) with soil physicochemical properties and carbon components |
结构方程模型分别能解释0~10、10~20、20~30 cm中R20的80%、87%、47%的方差(图 5)。在0~10 cm土壤中R20主要受到SWC、MBC、SOC、DI和NH4+-N的影响,其中SWC(β=-0.65)对R20有显著的负向作用,MBC(β=0.35)、SOC(β=0.23)、DI(β=0.21)和NH4+-N (β=0.14)对R20的影响稍弱。10~20 cm土壤R20主要受到TN、NO3--N、SWC、pH、MBC的影响,其中TN(β=0.67)对R20的影响最大,TN对R20直接产生显著的正向作用,同时还通过影响NO3--N(β=0.45)和MBC(β=0.33)对土壤R20产生间接作用,另外SWC(β=-0.42)和pH(β=0.33)也分别对土壤R20产生负向和正向影响。20~30 cm土壤R20受到pH、SOC、ORP和NH4+-N的影响,其中pH(β=0.74)对R20产生的总影响最大,SOC(β=0.39)次之,pH对R20产生直接的正向影响,同时还显著影响着ORP和NH4+-N。ORP(β=-0.38)和NH4+-N(β=0.24)在pH的间接作用下,分别对R20产生直接负向和正向作用。
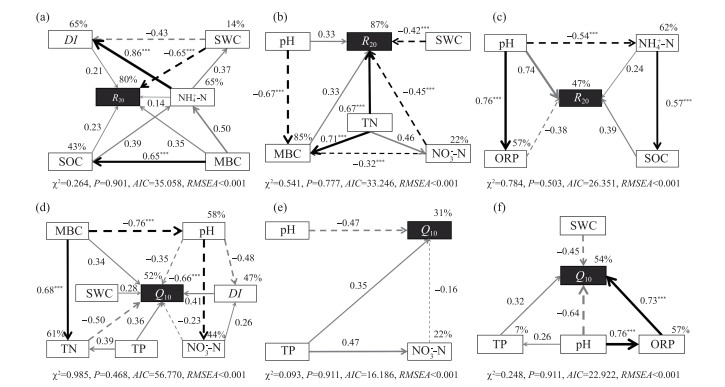
|
图 5 土壤各参数对20 ℃下的土壤有机碳分解速率R20(a:0~10 cm;b:10~20 cm;c:20~30 cm)和土壤有机碳分解的温度敏感性Q10(d:0~10 cm;e:10~20 cm;f:20~30 cm)的直接与间接影响(黑色和灰色箭头分别代表相关性显著和不显著,连续直线和不连续虚线箭头分别代表正向和负向影响关系,路径线的宽度与路径系数呈正相关关系,路径附近的数字表示标准化的路径系数,变量旁边的百分数表示所能解释的因变量的方差,星号表示路径系数的显著性P值:*, P < 0.05;**, P < 0.01;***, P < 0.001) Fig.5 The direct and indirect effects of soil parameters on soil organic carbon decomposition rate R20 (a: 0-10 cm; b: 10-20 cm; c: 20-30 cm) and temperature sensitivity of soil organic carbon decomposition Q10 (d: 0-10 cm; e: 10-20 cm; f: 20-30 cm) |
另外,结构方程模型分别解释了0~10、10~20、20~30 cm土壤Q10值52%、31%、54%的方差(图 5)。SEM分析表明,0~10 cm土壤Q10值受到TN、DI、TP、pH、MBC、SWC和NO3--N的影响,其中TN(β=-0.50)的总影响最大,DI(β=0.41)、TP(β=0.36)和MBC(β=0.34)对Q10值均产生直接的正向作用,pH(β=-0.35)在MBC的作用下对Q10值产生直接的负向影响,同时显著影响着NO3--N和DI。10~20 cm土壤Q10值的变化主要受pH、TP和NO3--N的影响,其中pH(β=-0.47)的影响最大,pH对土壤Q10产生直接的负向作用。TP(β=-0.35)次之,对Q10值产生直接的正向作用,同时还通过间接影响NO3--N(β=-0.16)对Q10产生间接负向作用。20~30 cm土壤Q10值受到ORP、pH、SWC和TP的影响,其中ORP(β=0.73)在pH的影响下对Q10值产生显著的直接正向作用,pH(β=-0.64)与SWC(β=-0.45)均对Q10值存在直接负向影响,TP(β=0.32)对Q10的影响相对较弱。
3 讨论鄱阳湖洲滩湿地土壤有机碳的分解速率呈现明显的空间异质性。土壤深度显著影响土壤有机碳的分解速率,表层0~10 cm土壤有机碳分解速率显著高于10~20 cm和20~30 cm,这一结果与许多前人的结果一致[22-23]。湿地表层土壤可以从植物和沉积物中获得大量的有机碳,从而使土壤微生物具有更高的活性[24]。本研究的数据表明,表层0~10 cm土壤的SOC、MBC和DI显著高于更深层次的土壤,证明表层土壤具有更高的土壤微生物量以及更多且质量更高的有机碳基质。淹水梯度引起的植被带差异对土壤有机碳分解速率的影响与土壤深度有关。在表层0~10 cm,从泥滩带、苔草带到芦苇带,土壤有机碳分解速率显著增加。在洲滩湿地上,淹水梯度引起了明显的植被差异。从泥滩带、苔草带到芦苇带,植被的生物量逐渐增加,微生物能够获得的基质增加,从而使有机碳分解速率升高。然而这种差异在10~20 cm和20~30 cm并不显著。这一结果可能是因为,洲滩湿地上的植被的根系一般都比较浅,植被的影响仅在表层0~10 cm比较显著[25]。本课题组在鄱阳湖洲滩湿地的调查结果显示,苔草群落超过85%的根系重量分布于0~10 cm。相关分析和结构方程模型的结果表明,土壤有机碳的分解速率还受到含水量、微生物生物量、pH和营养盐含量的影响。这些因素可以极大地影响微生物本身的数量和活性,或者改变可供微生物利用的有机质数量。
鄱阳湖湿地土壤有机碳分解的Q10变化范围为1.45~3.58,平均值为2.48,显示鄱阳湖湿地土壤有机碳分解过程对温度变化非常敏感,其Q10大于模型中常用的Q10值(2或1.5)。植被带和土壤深度对Q10的影响均不显著,表明鄱阳湖洲滩湿地土壤有机碳分解对温度的响应不存在显著的空间异质性。赵烨彤等[11]和Sihi等[26]也发现土壤Q10在不同深度之间无显著差异。但这些结果并不支持Q10的碳质量理论。碳质量理论认为难分解有机质化学成分更复杂,促使其发生生化反应所需的能量也增加,因而难分解碳的温度敏感性更高[27]。本研究中FTIR的结果显示,表层0~10 cm土壤比另两层土壤具有较高的rA1402、rA2850、rA2920和DI,较低的rA1630。一般认为土壤中rA2850和rA2920代表土壤中易分解的脂肪类有机质,而rA1630代表土壤中难分解的芳香类物质。随着土壤深度增加,土壤有机碳的质量明显降低,但是Q10并没有明显升高。碳质量理论不成立可能是因为洲滩湿地中土壤有机碳的有效性较低。事实上,本研究发现土壤Q10在0~10 cm的确与FTIR指标呈显著相关。然而,Q10与代表土壤易分解有机质相对含量的rA2920呈正相关,与代表土壤难分解有机质相对含量的rA1630呈负相关,表明土壤Q10与土壤有机碳的有效性相关。当土壤中底物供应不足时,Q10取决于酶促反应过程中底物的数量,而非质量。这与Davidson[28]的观点相符:最大的温度敏感性恰恰决定于易分解组分含量最多的土壤。在以往的文献中,许多科学家也发现了类似的现象。例如,Giardina等[29]和Fang等[30]分别通过土壤长期培育实验、C3/C4系统和数学模型等手段证明了土壤碳分解的温度敏感性与底物有效性之间存在正相关关系。
相关分析和结构方程模型的结果显示,除土壤有机质组分相关的参数外,Q10主要受到pH和TN等因素的影响。这可能是因为土壤有机碳分解的过程是在土壤微生物的参与下进行的,土壤微生物分解有机碳的过程会受到生存环境和营养元素的强烈影响[31]。土壤氮、磷含量的增加能够缓解土壤微生物的营养限制,进而提高微生物活性,促进土壤碳分解的过程[32]。土壤pH与土壤Q10呈现负相关关系,可能是因为土壤pH指示了土壤微生物群落结构和植物群落生物量的变化。洲滩湿地土壤pH与土壤微生物多样性密切相关[33]。Xu等[34]研究表明土壤微生物多样性可以直接影响土壤Q10。此外,在洲滩湿地上,芦苇和苔草等植被带往往具有较低的土壤pH和较高的植物生物量。由于本研究并没有考虑植物的作用,因此土壤pH对土壤Q10的负作用也可能间接反映了植物群落对土壤Q10的作用。
4 结论1) 在10、15、20、25、30 ℃下,鄱阳湖洲滩湿地土壤有机碳分解速率的平均值分别为19.19、31.00、51.67、77.28和109.32 μg/(d·g)。土壤有机碳分解速率随土层深度的增加呈极显著下降(P < 0.001)。植被带只在0~10 cm显著影响土壤有机碳分解速率,表现为芦苇带>苔草带>泥滩带。
2) 土壤Q10的平均值为2.48,变化范围为1.45~3.58,植被带和土壤深度对湿地土壤Q10不存在显著影响。
3) 土壤有机碳分解速率的主要影响因素为含水量、微生物生物量、pH和营养盐含量等。土壤Q10主要受到有机碳组分、pH和总氮等土壤理化因素的重要影响。研究结果显示,表层土壤Q10与易分解碳含量呈正相关,与难分解碳含量呈负相关。
| [1] |
Lal R. Soil carbon sequestration impacts on global climate change and food security. Science, 2004, 304(5677): 1623-1627. DOI:10.1126/science.1097396 |
| [2] |
Hashimoto S, Carvalhais N, Ito A et al. Global spatiotemporal distribution of soil respiration modeled using a global database. Biogeosciences Discussions, 2015, 12(5): 4331-4364. |
| [3] |
Qi Y, Xu M, Wu JG. Temperature sensitivity of soil respiration and its effects on ecosystem carbon budget: Nonlinearity begets surprises. Ecological Modelling, 2002, 153: 131-142. DOI:10.1016/S0304-3800(01)00506-3 |
| [4] |
Schlesinger W. Carbon balance in terrestrial detritus. Annual Review of Ecology, Evolution, and Systematics, 1977, 8: 51-81. DOI:10.1146/ANNUREV.ES.08.110177.000411 |
| [5] |
Wang SQ, Li TS, Fu CS et al. Distribution and influencing factors of ecosystem respiratory temperature sensitivity. Environmental Science and Technology, 2021, 44(9): 167-173. [王思琦, 李团胜, 付丛生等. 生态系统呼吸温度敏感性的分布及影响因素. 环境科学与技术, 2021, 44(9): 167-173.] |
| [6] |
Zhu Z, Xu X, Yang SL et al. A review on the temperature sensitivity of soil organic carbon decomposition in terrestrial ecosystem. Journal of Nanjing Forestry University: Natural Sciences Edition, 2022, 46(1): 33-39. [朱珠, 徐侠, 杨赛兰等. 陆地生态系统土壤有机碳分解温度敏感性研究进展. 南京林业大学学报: 自然科学版, 2022, 46(1): 33-39. DOI:10.12302/j.issn.1000-2006.202002049] |
| [7] |
Bosatta E, Ågren GI. Soil organic matter quality interpreted thermodynamically. Soil Biology and Biochemistry, 1999, 31(13): 1889-1891. DOI:10.1016/S0038-0717(99)00105-4 |
| [8] |
Knorr W, Prentice IC, House JI et al. Long-term sensitivity of soil carbon turnover to warming. Nature, 2005, 433(7023): 298-301. DOI:10.1038/nature03226 |
| [9] |
Melillo, Jerry M. Soil warming and carbon-cycle feedbacks to the climate system-All databases. Ecological Society of America Annual Meeting Abstracts, 2002, 87(210). |
| [10] |
Duan XN, Wang XK, Yin T et al. Research progress on carbon sequestration potential of wetland ecosystems. Ecological Environment, 2006(5): 1091-1095. [段晓男, 王效科, 尹弢等. 湿地生态系统固碳潜力研究进展. 生态环境, 2006(5): 1091-1095. DOI:10.3969/j.issn.1674-5906.2006.05.040] |
| [11] |
Zhao YT, Wang ZC, Xu ZW et al. Study on mineralization rate, temperature sensitivity and influencing factors of peat soil in northern Peatland. Journal of Environmental Science, 2022, 42(7): 478-488. [赵烨彤, 汪祖丞, 徐志伟等. 北方泥炭地泥炭土矿化速率、温度敏感性及其影响因素研究. 环境科学学报, 2022, 42(7): 478-488. DOI:10.13671/j.hJKXXB.2021.0480] |
| [12] |
Yu LF, Wang H, Wang YH et al. Temporal variation in soil respiration and its sensitivity to temperature along a hydrological gradient in an alpine wetland of the Tibetan Plateau. Agricultural and Forest Meteorology, 2020, 282/283: 107854. DOI:10.1016/j.agrformet.2019.107854 |
| [13] |
Pekel JF, Cottam A, Gorelick N et al. High-resolution mapping of global surface water and its long-term changes. Nature, 2016, 540(7633): 418-422. DOI:10.1038/nature20584 |
| [14] |
Pensley, Wu RJ, Zhang X et al. Effects of temperature and moisture on soil microorganisms in cultivated land and grassland in dry-hot valley. Pratacultural Science, 2021, 38(12): 2350-2362. [彭思利, 武仁杰, 张鑫等. 温度和水分对干热河谷耕地和草地土壤微生物的影响. 草业科学, 2021, 38(12): 2350-2362. DOI:10.11829/j.issn.1001-0629.2021-0406] |
| [15] |
Sun FD, Ma RH. Remote sensing monitoring of dynamic changes of hydrological characteristics in Poyang Lake. Acta Geographica Sinica, 2020, 75(3): 544-557. [孙芳蒂, 马荣华. 鄱阳湖水文特征动态变化遥感监测. 地理学报, 2020, 75(3): 544-557. DOI:10.11821/dlxb202003008] |
| [16] |
Hu ZP, Ge G, Liu CL et al. Structure of Poyang Lake wetland plants ecosystem and influence of lake water level for the structure. Resources and Environment in the Yangtze Basin, 2010, 19(6): 597-605. [胡振鹏, 葛刚, 刘成林等. 鄱阳湖湿地植物生态系统结构及湖水位对其影响研究. 长江流域资源与环境, 2010, 19(6): 597-605.] |
| [17] |
Shen RC, Lan ZC, Fang CM et al. The dikes of the sub-lakes change soil carbon cycle in the littoral wetland in Poyang Lake. J Lake Sci, 2018, 30(5): 1260-1270. [沈瑞昌, 兰志春, 方长明等. "堑秋湖"围堤改变鄱阳湖洲滩湿地土壤碳循环过程. 湖泊科学, 2018, 30(5): 1260-1270. DOI:10.18307/2018.0509] |
| [18] |
Parikh SJ, Goyne KW, Margenot AJ et al. Chapter one-Soil chemical insights provided through vibrational spectroscopy. Advances in Agronomy, 2014, 126: 1-148. DOI:10.1016/B978-0-12-800132-5.00001-8 |
| [19] |
Tahiri A, Richel A, Destain J et al. Comprehensive comparison of the chemical and structural characterization of landfill leachate and leonardite humic fractions. Analytical and Bioanalytical Chemistry, 2016, 408(7): 1917-1928. DOI:10.1007/s00216-016-9305-6 |
| [20] |
Aranganathan L, Rajasree SR, Suman T et al. Comparison of molecular characteristics of Type A humic acids derived from fish waste and sugarcane bagasse co-compost influenced by various alkaline extraction protocols. Microchemical Journal, 2019, 149: 104038. DOI:10.1016/j.microc.2019.104038 |
| [21] |
Niemeyer J, Chen Y, Bollag JM. Characterization of humic acids, composts, and peat by diffuse reflectance fourier-transform infrared spectroscopy. Soil Science Society of America Journal, 1992, 56(1): 135-140. DOI:10.2136/sssaj1992.03615995005600010021x |
| [22] |
Tfaily MM, Cooper WT, Kostka JE et al. Organic matter transformation in the peat column at Marcell Experimental Forest: Humification and vertical stratification. Journal of Geophysical Research: Biogeosciences, 2014, 119(4): 661-675. DOI:10.1002/2013JG002492 |
| [23] |
朱丽辉. 若尔盖高原退化泥炭地土壤呼吸及其温度敏感性变化特征[学位论文]. 南充: 西华师范大学, 2020.
|
| [24] |
Lin GH, Rygiewicz PT, Ehleringer JR et al. Time-dependent responses of soil CO2 efflux components to elevated atmospheric[CO2] and temperature in experimental forest mesocosms. Plant and Soil, 2001, 229(2): 259-270. DOI:10.1023/A:1004883221036 |
| [25] |
Liu F, Yang K, Li K et al. Profile distribution of organic carbon of four typical soils in China. Earth Science Frontiers, 2011, 18(6): 20-26. [刘飞, 杨柯, 李括等. 我国四种典型土类有机碳剖面分布特征. 地学前缘, 2011, 18(6): 20-26.] |
| [26] |
Sihi D, Inglett PW, Inglett KS. Carbon quality and nutrient status drive the temperature sensitivity of organic matter decomposition in subtropical peat soils. Biogeochemistry, 2016, 131(1): 103-119. DOI:10.1007/s10533-016-0267-8 |
| [27] |
Agren GI. Temperature dependence of old soil organic matter. AMBIO: A Journal of the Human Environment, 2000, 29(1): 55. DOI:10.1579/0044-7447-29.1.55 |
| [28] |
Davidson EA, Janssens IA. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change. Nature, 2006, 440(7081): 165-173. DOI:10.1038/nature04514 |
| [29] |
Giardina CP, Ryan MG. Evidence that decomposition rates of organic carbon in mineral soil do not vary with temperature. Nature, 2000, 404(6780): 858-861. DOI:10.1038/35009076 |
| [30] |
Fang C, Smith P, Smith JU. Is resistant soil organic matter more sensitive to temperature than the labile organic matter?. Biogeosciences, 2006, 3(1): 65-68. DOI:10.5194/bg-3-65-200610.5194/bgd-2-725-2005 |
| [31] |
Mao R, Cui Q, Zhao Q et al. Soil microbial biomass and activity in relation to stand age of poplar shelterbelts. Chinese Journal of Applied Ecology, 2009, 20(9): 2079-2084. [毛瑢, 崔强, 赵琼等. 不同林龄杨树农田防护林土壤微生物生物量碳、氮和微生物活性. 应用生态学报, 2009, 20(9): 2079-2084.] |
| [32] |
Chen MK, Wang SJ, Chen WQ et al. Effects of ant nesting on soil microbial biomass carbon and quotient in tropical forest of Xishuangbanna. Chinese Journal of Applied Ecology, 2019, 30(9): 2973-2982. [陈闽昆, 王邵军, 陈武强等. 蚂蚁筑巢对西双版纳热带森林土壤微生物生物量碳及熵的影响. 应用生态学报, 2019, 30(9): 2973-2982. DOI:10.13287/j.1001-9332.201909.036] |
| [33] |
Shen RC, Lan ZC, Rinklebe J et al. Flooding variations affect soil bacterial communities at the spatial and inter-annual scales. Science of the Total Environment, 2021, 759: 143471. DOI:10.1016/j.scitotenv.2020.143471 |
| [34] |
Xu M, Li XL, Kuyper TW et al. High microbial diversity stabilizes the responses of soil organic carbon decomposition to warming in the subsoil on the Tibetan Plateau. Global Change Biology, 2021, 27(10): 2061-2075. DOI:10.1111/gcb.15553 |
 2024, Vol. 36
2024, Vol. 36 


