(2: 中国科学院亚热带农业生态研究所, 亚热带农业生态过程重点实验室, 洞庭湖湿地生态系统观测研究站, 长沙 410125)
(3: 湖南省益阳市林业局, 益阳 413000)
(4: 湖南鑫远环境科技股份有限公司, 湖南省环境保护入河湖湿地生态修复工程技术中心, 长沙 410008)
(2: Key Laboratory of Agro-ecological Processes in Subtropical Region, Dongting Lake Station for Wetland Ecosystem Research, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, P. R. China)
(3: Forestry Bureau of Yiyang City, Hunan Province, Yiyang 413000, P. R. China)
(4: Hunan Xinyuan Environment Technology Co., Ltd., Engineering Technology Center for Environmental Protection and Ecological Restoration of River-Lake Wetland in Hunan Province, Changsha 410008, P. R. China)
河流和湖泊湿地中的泥沙淤积主要由水流冲积和泥沙输送作用形成,而水流变化、泥沙来源和地理条件的共同作用也是影响湿地植物生存和生长的重要因素[1-2]。泥沙淤积直接导致植物体部分或全部被掩埋,同时使湿地的土壤理化性质(如机械组成、pH和营养物质含量等)和植物与土壤之间的非生物环境(如光照、温度、土壤通气情况)等发生了一系列的改变[3-4]。有关淤积对湿地植物生长的研究,多集中于个体或种群水平下植物被掩埋部分的深度[5],或淤积物组成变化对植物的影响[6]等方面,如较深的淤积抑制植物的生长,导致植物生物量、相对生长速率和密度等下降[7-8]。
克隆植物是湿地生态系统的优势植物类型,该类植物特有的克隆形态可塑性、克隆整合与分工等克隆性状,使其能够获得比非克隆植物(如主要以种子进行繁殖的一年生草本植物等)更强的扩展能力和适应性[9-10],帮助植物产生更多逃离有害生境的性状[11-12];同时,这些克隆性状可以调节分株间对资源的吸收和分配情况,有选择性地将克隆分株放置到不受限制的生境中[13-15],如通过对间隔子长度和分枝角度进行调整[7, 16],改变生长型,使其由密集型向游击型转变[17-18]等,这些是克隆植物应对淤积压力的有效方法。泥沙淤积的深度由淤积的频率和速率共同决定,但自然水文条件下,关于湖泊湿地克隆植物种群尺度上对淤积速率的响应研究相对较少。
洞庭湖是我国第二大淡水湖泊,是长江中游地区仅存的两个通江湖泊之一。每年洪水季节(5—10月),上游河流所携带的泥沙通过长江“三口”(松滋口、太平口、藕池口)和湖南“四水”(湘江、资江、沅江、澧水)输入洞庭湖,部分经由城陵矶而出注入长江,在河相和湖相沉积的共同作用下造成泥沙淤积[19],多年平均淤积速率约为3~7 cm[1-2]。本研究选择洞庭湖湿地的优势克隆植物短尖薹草(Carex brevicuspis)作为研究对象,通过在野外自然湿地环境下设置不同的淤积速率控制实验,研究不同泥沙淤积条件下植物种群特征和克隆繁殖策略,探讨克隆植物短尖薹草种群对淤积速率变化的适应机制。
1 材料与方法 1.1 实验材料短尖薹草为一种具有多年生根状茎的莎草科植物,是洞庭湖湿地的主要优势物种之一[20],地上部分主要包括叶鞘和叶构成的三棱形假秆,高约20~55 cm;苞片短叶状、具长鞘、渐窄;地下部分包括短粗的根状茎和根[21]。受洞庭湖区域每年春夏季的洪水影响,短尖薹草群落常需要经历2—5个月的洪水淹没,地上部分在被淹没后逐渐分解,自洪水过后的秋季(10或11月)开始迅速萌发,至次年一月左右因低温的影响而逐渐枯萎,在接下来的春季开始迅速生长,并在下次洪水来临前(次年4月或5月)开花结果,完成生活史过程[22]。在洞庭湖湿地中,短尖薹草主要由地下根状茎产生的无性克隆分株进行繁殖,根状茎可分为母株基部形成的短根茎(< 1 cm)和长根茎(≥1 cm)两种,并由此对应密集型和游击型两种克隆生长策略[17]。
1.2 实验设计控制实验采用单因素随机区组设计,设置淤积速率为影响因素,包含4个处理:0、2、4、6 cm/a,分别对应对照组,低、中和高淤积速率组。实验于中国科学院洞庭湖湿地生态系统观测研究站的野外综合观测场实验区(29°30′N,112°48′E,图 1)进行。短尖薹草群落为该处主要群落类型之一,附近水系主要为东洞庭湖的小西湖,湿地环境随湖泊水文过程出露或淹没,在洞庭湖的枯水期和洪水期发生干湿交替的周期性变化,具有典型的洲滩湿地特征。在该区域选择一块无人为干扰、分布均匀、高程一致的典型短尖薹草群落,面积约15 m×15 m,在其中按照4×5阵列设置方格:每个方格边长为2 m×2 m,即每个处理内的面积为4 m2;按洪水来向设置5个区组,每个区组包含1个重复,随机设置区组内的4个处理,即每个处理5个重复,共设置20个样方。方格间距设置为20 cm,同时在方格间及整个场地外围使用砖块建设围护结构,地下深度15 cm,地上高度20 cm,以维持淤积深度、避免处理间的干扰和方便样本的采集(图 1)。
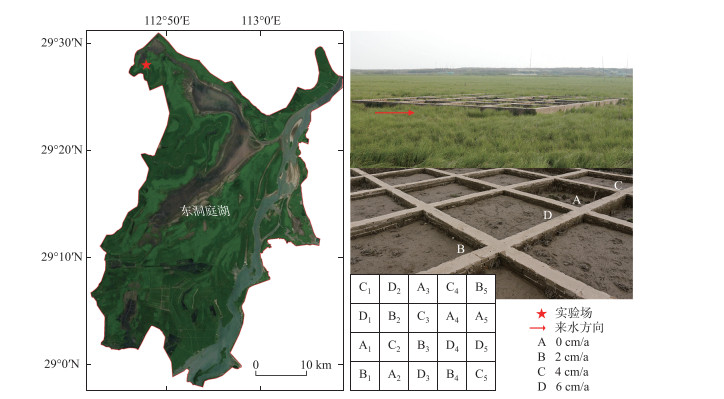
|
图 1 淤积速率实验方案及原位布设 Fig.1 Design and field layout of the sedimentation rate experiment |
实验于2011年开始布设并进行第一次泥沙淤积处理,此后每年进行一次性淤积速率增加处理。由于洪水期短尖薹草的地上部分常在水力和淤积的共同作用下逐渐分解,而植物往往在洪水未完全退去前已开始萌发,因此淤积处理时间设置为每年洞庭湖夏季洪水来临前(4—5月,由城陵矶的水位动态决定)。处理时依照实验方案(图 1),在围护结构的内壁和细竹棍(插入近中心)上做好标记,然后人工添加相应高度的淤积泥沙(0、2、4和6 cm),淤积泥沙来自短尖薹草群落,有机质、总氮和总磷含量分别为12.0、1.1和0.6 g/kg。各处理在洪水的作用下淤积高度均匀,在洪水过后的实地观测中发现,均能维持相应的淤积高度(图 1)。
1.3 取样和测量短尖薹草群落和种群特征的调查在实验开始后的每年4月进行一次,共进行了3年的连续跟踪调查(2012—2014年),群落特征调查主要包括每个样方内的物种组成情况、盖度、丰富度指数(样方中的物种数),种群数量特征包括密度、高度和生物量等。调查时,在每个处理中利用样方框随机设置一个小样方(25 cm×25 cm),标记好位置后统计其中的植物个体数量,并使用精度为0.1 cm的卷尺测量植物地上部分的平均高度,然后将样方框内的植物地上绿色部分收割装袋,同时采集样方框范围内的植物地下部分(深度20 cm),然后将所有样本带回实验室[22]。对地下部分进行清洗后,将植物的地上和地下部分置于85 ℃的烘箱烘48 h后称取生物量。生物量分配以地下部分生物量比例计算,即地下部分生物量/总生物量。
植物地下部分特征及克隆生长特征测量于第3次调查时进行,将收取的植物地下部分土柱带回实验室仔细清洗,并注意保持植物地下部分之间的连接。使用精度为0.1 cm的直尺测量根系和间隔子(根状茎)的长度。计算根系的平均长度,以根长将根系分为长根(≥10 cm)和短根(<10 cm),并计算两类根系的数量比例。以间隔子长度分为短根茎(<1 cm)和长根茎(≥1 cm),并计算克隆生长特征,包括长根茎的平均长度、分枝强度(单位面积内长根茎的数量)和游击型克隆分株(由长根茎形成)的比例[7, 17]。
1.4 统计分析数据统计分析采用SPSS 17.0 for Windows(SPSS Inc.,Chicago,IL,USA) 软件进行。正态分布检验使用D'Agostino-Pearson综合测试方法,采用平方根或对数转换方法使数据满足方差分析的正态性要求。差异显著性检验采用Tukey检验进行,显著性级别设定为0.05,数据的表示形式为平均值±标准误。对3次取样中的种群特征做重复测量方差分析(repeat-measure ANOVA),同时将区组设置为协变量以消除实验区组对实验结果对比的影响。
2 结果分析 2.1 群落物种组成和盖度在连续开展3年的野外调查中发现,建群种短尖薹草在所有的样方中均为优势种,在群落中占据绝对优势(表 1)。除短尖薹草外的其他物种多以一年生草本植物为主,较为矮小,且多以种子进行繁殖,在不同的处理中偶有随机出现(样方数量≤2),株数极少(≤3),如碎米荠、菵草和拉拉藤等,这些植物未对群落中占优势的短尖薹草种群产生明显的影响。群落丰富度指数和总盖度的变化如图 2所示,对照处理中的丰富度指数(1.40~1.60)和总盖度(92.80%~95.00%)高于淤积处理中的丰富度指数(1.00~1.20)和总盖度(88.20%~89.20%)。
| 表 1 短尖薹草群落物种组成* Tab. 1 Composition of plant species in the C. brevicuspis community |
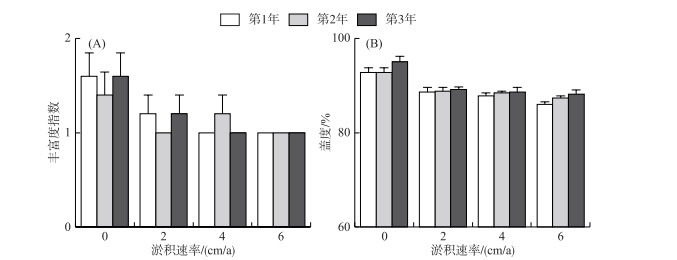
|
图 2 不同淤积速率下的植物群落丰富度指数和盖度(误差线代表标准误) Fig.2 Richness and coverage of plant community growing under different sedimentation rates |
以不同淤积速率、采样时间和区组对短尖薹草种群的密度与株高进行重复测量方差分析(附表Ⅰ)发现,淤积速率对密度的影响极显著(P < 0.01),高度的差异主要是受采样时间的影响(P < 0.001)。对照处理的密度在第1年和第3年显著高于淤积处理(P < 0.05,图 3A),对照处理在第3年的密度最高((1654.4±28.89)株/m2,P < 0.05),高淤积速率(6 cm/a)处理在第1年的密度最低((1097.6±25.6)株/m2,P < 0.05)。中淤积速率(4 cm/a)和高淤积速率(6 cm/a)处理的密度在年际间差异显著(P < 0.05),且均在淤积处理后的第1年最低(图 3A),随着淤积速率的增加而呈明显的下降趋势,对照处理和低淤积速率(2 cm/a)的密度在年际间无显著差异(P>0.05)。各淤积速率下植物种群的株高在同一调查年份中差异不显著(P>0.05,图 3B),但在不同的年份差异显著,淤积处理后的第3年各处理的株高(71.8~74.2 cm)显著低于前两年(94.38~101.8 cm,P < 0.05)。
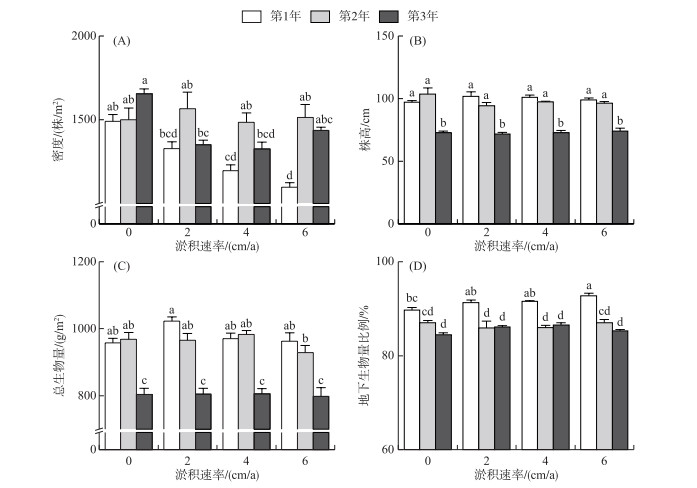
|
图 3 不同淤积速率下的种群密度、株高、生物量和生物量分配 (不同小写字母代表处理间显著差异(α=0.05),误差线代表标准误;下同) Fig.3 Density, height, biomass accumulation and biomass allocation of C. brevicuspis population growing under different sedimentation rates |
重复测量方差分析结果(附表Ⅰ)表明,不同的淤积速率对总生物量和地下生物量比例的影响差异不显著(P>0.05),总生物量和地下生物量比例在不同的年份间存在显著差异(P < 0.01)。总生物量的最大值出现在第1年的低淤积速率处理中((1023.17±12.11)g/m2),第3年各淤积速率下的生物量最低(798.01~806.08 g/m2,P < 0.05,图 3C)。高淤积速率下第1年植物的地下生物量比例最高(92.74%±0.56%),且各处理的地下生物量比例在第1年显著高于后续年份(84.45%~87.04%,P < 0.05,图 3D)。
2.3 不同淤积速率下植物地下部分特征 2.3.1 根系长度与数量4个淤积速率下短尖薹草分株的平均根长(图 4A)、根系数量(图 4B)没有显著差异(P >0.05),不同淤积速率下分株平均根长的范围为13.38~15.63 cm。在所有处理中(图 4C),短根(< 10 cm)的数量比例均高于长根(≥10 cm),淤积处理下的短根系比例(95.10%~97.95%)显著高于对照处理(76.07%,P < 0.05,图 4C),而长根系比例显著低于对照处理(P < 0.05),但在3种不同淤积速率下根系比例没有显著差异(P>0.05)。
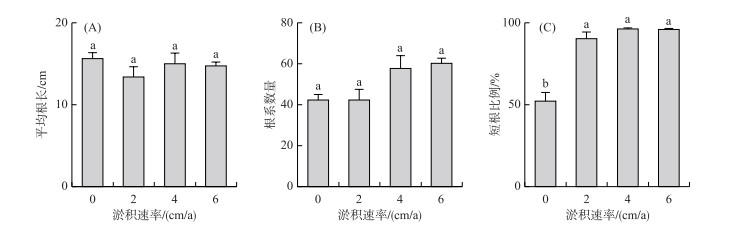
|
图 4 不同淤积速率下根系形态特征(第3年) Fig.4 Root morphology of the plants growing under different sedimentation rates (the third year) |
不同淤积处理的长根茎平均长度随淤积速率的增加而增加(图 5A),高淤积速率下的长根茎长度最长((5.55±0.06) cm,P < 0.05)。所有处理中的密集型分株比例均高于游击型,对照处理的分枝强度((54.4±3.92) 个/m2)和游击型分株比例(3.28%±1.26%)显著低于淤积处理(P < 0.05, 图 5B、C),低淤积速率产生了相对较多的长根茎((332.8±21.70) 个/m2)和游击型分株(24.58%±1.26%)。随着淤积速率的增加,分枝强度和游击型分株的比例逐渐降低,高淤积速率下的分枝强度和游击型分株比例显著低于低和中淤积速率下(P < 0.05,图 5B、C)。
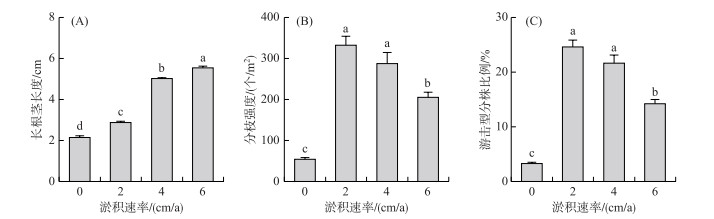
|
图 5 不同淤积速率下克隆生长特征(第3年) Fig.5 Clonal morphology of the plants growing under different sedimentation rates (the third year) |
湿地植物的生长发育、繁殖与分布直接受到湿地水文情势变化的影响,其中水文因素和泥沙淤积是其中最主要的两个方面[23-24]。实验结果表明,淤积速率对密度的影响极显著(P < 0.01),且采样时间(不同的年份)对不同淤积处理下的短尖薹草种群特征(密度、高度、生物量和生物量分配差异)影响显著(P < 0.05)。有研究发现,当洪水和淤积两种胁迫同时存在时,洪水在调节植物生长方面占主导地位[23]。洞庭湖区域的洪水在年内的波动具有一定的规律性,由于实验中各处理设置的海拔高程和面积一致,各处理在相同年份也会经历相同的水文过程变化(如来水日期、淹水的时长和水位等)。因此,有必要考虑实验过程中洞庭湖区域水文因素的年际波动对种群特征变化的影响。
以实验区域高程(约24 m)与洞庭湖城陵矶水位关系计算水文情势特征[24]可知:实验过程中第一年水情总体偏枯,淹水时长约85天,退水日期在9月初。由于短尖薹草在洪水过后即开始迅速萌发[22],退水时间的早晚与植物生长期的长度直接相关[25],退水日期提前则植物生长期增加。因此在相对较短的淹水时间和较早的退水时间情况下,第1年种群密度的变化受泥沙淤积影响的趋势较为明显。而在实验的后两年,淹水时长长达195天左右,退水日期分别推迟到了10月下旬和10月上旬,较长时间的淹水与实验中设置的淤积胁迫相比,可能对植物种群的恢复产生了更加明显的抑制作用[23]。而退水时间的延后不仅导致生长期缩短,秋冬季的低温也会减缓植物的生长过程。因此,种群特征的年际变化可能是泥沙淤积和水文特征的变化共同作用的结果。
3.2 短尖薹草种群对不同泥沙淤积速率的生长响应对种群特征的调查发现,不同的淤积速率对种群密度有显著影响,尤其是在第一年,密度随着淤积速率的增加而呈明显的下降趋势。由于短尖薹草的地上部分(主要为叶)在洪水的作用下逐渐分解,而植物在洪水过后的恢复过程主要通过地下部分的根状茎产生克隆分株[17]。在淤积处理下,植物的恢复生长过程相较于对照处理首先需要摆脱被埋所产生的胁迫,研究中也发现淤积处理的游击型分株(由长根茎产生)比例高于对照处理;而随着淤积速率的增加,长根茎的平均长度增加,分枝强度和游击型分株的比例下降,这些生长响应可能消耗了更多的能量,导致恢复生长中克隆分株的数量减少,进而引起了植物密度的下降。不同的淤积速率未影响到短尖薹草种群的高度,说明在种群尺度上设置的淤积速率(0~6 cm/a)对植物的叶长无显著影响,这与之前的研究结果一致[6]。
在第1年调查时发现,总生物量在低淤积速率下最高,这可能是浅埋对植物生长产生的刺激作用所致[1, 5],而地下生物量比例在高淤积速率下最高,说明植物可通过表型可塑性的调节以应对较高的淤积压力和资源竞争[26]的影响,导致了植物地下部分的生物量增加。但在淤积压力的持续影响下,密度和生物量分配的调节作用在不同处理间不显著,这说明不同淤积速率下的植物可能已经产生了相应的适应策略以应对即将到来的淤积压力[18, 27],特别是克隆植物中存在的克隆亲体效应,可以有效地将表观遗传变异传递给子株,使其产生预适应过程[28]。
被掩埋的部分产生新的不定根是植物适应淤积胁迫的主要方式之一[26],这些不定根的长度和其在土壤中分布的位置体现了植物不同的适应策略[23]。实验中发现,不同处理的根系数量没有显著差异(P>0.05),而淤积处理的短根比例(95.10%~97.95%)均显著高于对照处理(76.07%,P < 0.05),因此淤积处理下短尖薹草种群形成了相对更多的短根,这种改变使根系分布在氧气相对充足的土壤表层,有利于减缓淤积导致的缺氧胁迫[29]。产生较多的短根也可以帮助植物减少掩埋状态下氧气和水分的损失,有利于植物水分和养分的吸收和运输[26, 30],对维持植物种群在淤积状态下的快速恢复生长有重要作用。
3.3 不同泥沙淤积条件下的植物克隆生长策略研究中发现,不同淤积处理的长根茎长度随淤积速率的增加而显著增加,不同淤积速率下的长根茎平均长度接近淤积处理的深度。对间隔子的长度、分支角度等进行的调整[8, 29]是克隆植物应对淤积胁迫的有效手段,能帮助植物迅速逃离高强度的淤积环境[12, 31]。淤积处理提高了短尖薹草分枝强度,进而导致更多游击型克隆分株的产生,这可能体现了植物在淤积条件下提升了克隆生长能量分配并形成了更多克隆整合[14, 17],这种克隆整合结构具有储藏功能[10, 15],可以促进植物对受到淤积限制的资源进行获取和利用,也可以通过分工继续对资源进行获取以维持生长[14, 32],有利于克隆植物的扩张过程,帮助植物摆脱淤积的影响[17]。高淤积速率组长根茎长度最长,但其分枝强度与低和中淤积速率组相比较低,这种长度和数量上的变化可能是植物为应对淤积带来的资源限制[27]所进行的生长与克隆繁殖之间的平衡[18, 33]。在所有淤积处理中,密集型分株比例均高于游击型分株比例,这与在短尖薹草种群中的研究结果类似[8],即大的克隆分株种群能提供足够的资源以逃避淤积压力[34],而高淤积速率下的游击型分株比例显著低于低和中淤积速率下,也可能体现了克隆植物在不同淤积条件下发生的觅食行为变化[12]。因此,通过克隆整合、分工和资源分配以及克隆生长策略的调整,植物可以对受到淤积胁迫所限制的各类资源进行有效的利用,同时通过克隆生长以逃离不利的生境,有效地应对淤积对其生长和生存所造成的不利影响。
4 结论本研究基于连续3年的野外控制实验观测,探讨了不同淤积速率对短尖薹草种群特征和克隆生长的影响。结果表明,泥沙淤积速率的增加减少了种群密度,高淤积速率导致了更多的生物量分配到植物的地下部分。同时,泥沙淤积促进了植物产生更多的短根,高淤积速率的根系数量较多。与对照处理相比,淤积导致了较多数量的长根茎和游击型分株的出现,长根茎长度随淤积速率的增加而增加,高淤积速率下的长根茎数量较低,但其长度最长,表明短尖薹草种群的克隆生长策略由密集型向游击型转变。因此,通过对密度、生物量分配、根系和克隆生长策略进行调节,短尖薹草种群可以有效地利用受淤积胁迫所限制的各类资源,通过克隆生长逃离不利的生境,以应对不同泥沙淤积速率的影响,维持种群的相对稳定。
5 附录附表Ⅰ见电子版(DOI: 10.18307/2024.0533)。
| 附表Ⅰ 不同淤积速率下短尖薹草种群特征的重复测量方差分析 Appendix Ⅰ Summary of repeat-measure ANOVA analysis in the characteristic of C. brevicuspis population under different sedimentation rates |
| [1] |
Li F, Pan Y, Xie YH et al. Different roles of three emergent macrophytes in promoting sedimentation in Dongting Lake, China. Aquatic Sciences, 2016, 78(1): 159-169. DOI:10.1007/s00027-015-0415-6 |
| [2] |
Zheng JM, Wang LY, Li SY et al. Relationship between community type of wetland plants and site elevation on sandbars of the East Dongting Lake, China. Forestry Studies in China, 2009, 11(1): 44-48. DOI:10.1007/s11632-009-0010-9 |
| [3] |
Pan Y, Zhang H, Li X et al. Effects of sedimentation on soil physical and chemical properties and vegetation characteristics in sand dunes at the Southern Dongting Lake Region, China. Scientific Reports, 2016, 6: 36300. DOI:10.1038/srep36300 |
| [4] |
Madsen JD, Chambers PA, James WF et al. The interaction between water movement, sediment dynamics and submersed macrophytes. Hydrobiologia, 2001, 444(1): 71-84. DOI:10.1023/A:1017520800568 |
| [5] |
Gilbert ME, Ripley BS. Resolving the differences in plant burial responses. Austral Ecology, 2010, 35(1): 53-59. DOI:10.1111/j.1442-9993.2009.02011.x |
| [6] |
Chen XS, Liao YL, Xie YH et al. Concurrent effects of sediment accretion and nutrient availability on the clonal growth strategy of Carex brevicuspis—A wetland sedge that produces both spreading and clumping ramets. Frontiers in Plant Science, 2017, 8: 1685. DOI:10.3389/fpls.2017.01685 |
| [7] |
Li F, Xie YH. Spacer elongation and plagiotropic growth are the primary clonal strategies used by Vallisneria spiralis to acclimate to sedimentation. Aquatic Botany, 2009, 91(3): 219-223. DOI:10.1016/j.aquabot.2009.06.005 |
| [8] |
Pan BH, Xie YH, Li F et al. Responses to sedimentation in ramet populations of the clonal plant Carex brevicuspis. Frontiers in Plant Science, 2018, 9: 512. DOI:10.3389/fpls.2018.00512 |
| [9] |
Wan JZ, Wang CJ, Yu FH. Large-scale environmental niche variation between clonal and non-clonal plant species: Roles of clonal growth organs and ecoregions. Science of the Total Environment, 2019, 652: 1071-1076. DOI:10.1016/j.scitotenv.2018.10.280 |
| [10] |
Wang JY, Xu TT, Wang Y et al. A meta-analysis of effects of physiological integration in clonal plants under homogeneous vs. heterogeneous environments. Functional Ecology, 2021, 35(3): 578-589. DOI:10.1111/1365-2435.13732 |
| [11] |
Wang P, Li H, Pang XY et al. Clonal integration increases tolerance of a phalanx clonal plant to defoliation. Science of the Total Environment, 2017, 593/594: 2336-241. DOI:10.1016/j.scitotenv.2017.03.172 |
| [12] |
Liu FH, Liu J, Dong M. Ecological consequences of clonal integration in plants. Frontiers in Plant Science, 2016, 7: 770. DOI:10.3389/fpls.2016.00770 |
| [13] |
Lopp J, Sammul M. Benefits of clonal propagation: Impact of imported assimilates from connected ramets. Plant Ecology, 2016, 217(3): 315-329. DOI:10.1007/s11258-016-0573-1 |
| [14] |
Roiloa SR, Hutchings MJ. The effects of physiological integration on biomass partitioning in plant modules: An experimental study with the stoloniferous herb Glechoma hederacea. Plant Ecology, 2013, 214(4): 521-530. DOI:10.1007/s11258-013-0186-x |
| [15] |
Yu FH, Dong M, Krüsi B. Clonal integration helps Psammochloa villosa survive sand burial in an inland dune. New Phytologist, 2004, 162(3): 697-704. DOI:10.1111/j.1469-8137.2004.01073.x |
| [16] |
Xie XF, Song YB, Zhang YL et al. Phylogenetic meta-analysis of the functional traits of clonal plants foraging in changing environments. PLoS One, 2014, 9(9): e107114. DOI:10.1371/journal.pone.0107114 |
| [17] |
Chen XS, Xie YH, Deng ZM et al. A change from phalanx to guerrilla growth form is an effective strategy to acclimate to sedimentation in a wetland sedge species Carex brevicuspis (Cyperaceae). Flora-Morphology, Distribution, Functional Ecology of Plants, 2011, 206(4): 347-350. DOI:10.1016/j.flora.2010.07.006 |
| [18] |
Geremew A, Stiers I, Sierens T et al. Clonal growth strategy, diversity and structure: A spatiotemporal response to sedimentation in tropical Cyperus papyrus swamps. PLoS One, 2018, 13(1): e0190810. DOI:10.1371/journal.pone.0190810 |
| [19] |
Huang W, Wang WD. Effects of Three Gorges Dam Project on Dongting Lake Wetlands. Acta Ecologica Sinica, 2016, 36(20). [黄维, 王为东. 三峡工程运行后对洞庭湖湿地的影响. 生态学报, 2016, 36(20): 6345-6352. DOI:10.5846/stxb201503300611] |
| [20] |
Hou ZY, Xie YH, Gao DL et al. The life form and environment factors of typical plant communities in the Dongting Lake wetlands. Chinese Journal of Applied and Environmental Biology, 2016, 22(6): 993-999. [侯志勇, 谢永宏, 高大立等. 洞庭湖湿地典型植物群落生活型构成及其环境影响因子. 应用与环境生物学报, 2016, 22(6): 993-999. DOI:10.3724/SP.J.1145.2016.01003] |
| [21] |
Wu Z, Raven PH, Hong D et al. Flora of China: Vol. 23. Beijing: Science Press; St. Louis: Missouri Botanical Garden Press, 2010.
|
| [22] |
Chen XS, Deng ZM, Xie YH et al. Demography of Carex brevicuspis (Cyperaceae) rhizome populations: A wetland sedge that produces both elongated and shortened rhizomes. Nordic Journal of Botany, 2014, 32(2): 251-256. DOI:10.1111/j.1756-1051.2013.00094.x |
| [23] |
Pan Y, Xie YH, Chen XS et al. Effects of flooding and sedimentation on the growth and physiology of two emergent macrophytes from Dongting Lake wetlands. Aquatic Botany, 2012, 100: 35-40. DOI:10.1016/j.aquabot.2012.03.008 |
| [24] |
Hu JY, Xie YH, Tang Y et al. Changes of vegetation distribution in the East Dongting Lake after the operation of the Three Gorges Dam, China. Frontiers in Plant Science, 2018, 9: 582. DOI:10.3389/fpls.2018.00582 |
| [25] |
Huang Y, Chen XS, Zou YA et al. Exploring the relative contribution of flood regimes and climatic factors to Carex phenology in a Yangtze River-connected floodplain wetland. Science of the Total Environment, 2022, 847: 157568. DOI:10.1016/j.scitotenv.2022.157568 |
| [26] |
Dech JP, Maun MA. Adventitious root production and plastic resource allocation to biomass determine burial tolerance in woody plants from central Canadian coastal dunes. Annals of Botany, 2006, 98(5): 1095-1105. DOI:10.1093/aob/mcl196 |
| [27] |
Goldberg DE, Batzer E, Elgersma K et al. Allocation to clonal growth: Critical questions and protocols to answer them. Perspectives in Plant Ecology, Evolution and Systematics, 2020, 43: 125511. DOI:10.1016/j.ppees.2020.125511 |
| [28] |
Luo FL, Wang MZ, Dong BC et al. Clonal and sexual parental effects and their mechanisms. Acta Ecologica Sinica, 2022, 42(16): 6474-6486. [罗芳丽, 王沫竹, 董必成等. 克隆和有性亲体效应及其调控机制. 生态学报, 2022, 42(16): 6474-6486. DOI:10.5846/stxb202107211968] |
| [29] |
Xie YH, Deng W, Wang JD. Growth and root distribution of Vallisneria natans in heterogeneous sediment environments. Aquatic Botany, 2007, 86(1): 9-13. DOI:10.1016/j.aquabot.2006.08.002 |
| [30] |
Pan Y, Jin L, Wei ZH et al. Experimental evidence that water-exchange unevenness affects individual characteristics of two wetland macrophytes Phalaris arundinacea and Polygonum hydropiper. Ecological Indicators, 2019, 107: 105617. DOI:10.1016/j.ecolind.2019.105617 |
| [31] |
Sammul M. Length of the spacer rather than its plasticity relates to species distribution in various natural habitats. Folia Geobotanica, 2011, 46(2): 137-153. DOI:10.1007/s12224-010-9097-y |
| [32] |
Chen JS, Lei NF, Dong M. Clonal integration improves the tolerance of Carex praeclara to sand burial by compensatory response. Acta Oecologica, 2010, 36(1): 23-28. DOI:10.1016/j.actao.2009.09.006 |
| [33] |
Shen N, Liu CH, Yu HW et al. Effects of resource heterogeneity and environmental disturbance on the growth performance and interspecific competition of wetland clonal plants. Global Ecology and Conservation, 2020, 22: e00914. DOI:10.1016/j.gecco.2020.e00914 |
| [34] |
Luo WC, Zhao WZ. Burial depth and diameter of the rhizome fragments affect the regenerative capacity of a clonal shrub. Ecological Complexity, 2015, 23: 34-40. DOI:10.1016/j.ecocom.2015.05.004 |
 2024, Vol. 36
2024, Vol. 36 


