(2: 武汉中科瑞华生态科技股份有限公司, 武汉 430063)
(3: 雅安市农业农村局, 雅安 625000)
(2: Wuhan Sinoeco Ecological Science & Technology Co., Ltd, Wuhan 430063, P. R. China)
(3: Yaan Agriculture and Rural Bureau, Yaan 625000, P. R. China)
了解生物多样性格局及其驱动机制对生物多样性保护、生态系统的管理和恢复以及环境监测及评价均具有重要意义[1],因此阐明群落组成的驱动机制以及多样性格局的研究一直以来都是生态学家关注的热点问题[2-3]。对此,生态学家们提出多种理论,经典的生态位理论认为自然群落是区域中的物种经过多层环境过滤作用和种间相互作用下共存而构建的[4-5]。过去,生态位理论在解释群落组成的驱动机制及多样性格局时一直占据主要地位。然而,后续研究中科学家逐渐发现某些群落中的物种共存并不受生态位分化的限制,在一些研究案例中生态位理论也无法有效预测群落变化[6-7]。在这一背景下,Hubbell[6]在分子进化中性理论的基础上提出了群落中性理论,该理论认为扩散限制和随机漂变是影响物种共存的主导因子[8]。群落中性理论以其简约性和预测能力对群落组成的驱动机制研究产生了重大影响,但由于该理论的物种生态等价性假设往往与研究结果不一致,并且该理论对群落变化的预测只限于少数生态系统(如热带雨林生态系统),因而在提出初期饱受争议[8-9]。随着相关研究的不断深入,生态学家们逐渐认识到,群落组成的驱动因素是生态学过程和进化历史等因素的有机结合[10-11]。因此,Leibold等[12]根据集合种群概念、岛屿生物地理学和景观生态学理论提出了集合群落理论[13-14]。该理论将集合群落定义为由多个通过扩散联系起来的局域生物群落的集合。集合群落理论认为群落组成受环境和扩散过程共同作用,其研究的核心问题是环境和空间因子(如扩散限制)在群落组成中的相对作用,其研究结果对群落生态学和生物多样性管理及保护具有重要意义[15-16]。
传统研究仅注重物种多样性维度,通过基于物种数和相对丰度的一系列指数(如Shannon-Wiener多样性指数、Simpson多样性指数)来反映生物群落的组成和时空格局[17]。物种多样性根据物种分类信息,将物种看作完全相同的单元,因此计算相对简单,在研究中得到了广泛的应用,也促进了人类对物种多样性与群落动态、生态系统功能和人类福祉之间关系的认识[18]。然而,由于不同物种在生理、生态、形态特征、功能、进化关系等方面存在极大的差异,它们在群落构建和生态系统功能的过程中起到的作用不尽相同[19]。因此,物种多样性指标难以全面地反映生物多样性在生态系统过程中所起的重要作用[20]。
近20年来,随着系统发育多样性和功能多样性概念的提出,越来越多的学者提出在生物多样性研究中应将物种多样性与这二者整合起来开展研究[21-22]。功能多样性指在生物群落中,不同物种所扮演的功能角色的多样性,它不仅考虑了不同物种的功能特征差异,还反映了这些功能特征在群落层级上的组合和分布[23]。系统发育多样性基于物种的遗传和系统发育关系来衡量其在群落中的进化关系,可反映群落的构建过程及物种的进化历程[24]。它为群落的研究提供了新的维度,使得研究人员可以从物种的亲缘关系来分析群落组成[24]。因此,开展功能多样性和系统发育多样性研究能更好地揭示群落组成的驱动机制[25]。
大型底栖无脊椎动物(简称底栖动物)是溪流生态系统的重要类群,它们是指在全部或大部分生命周期中,生活在水体底部或附着在底质和植被表面的水生无脊椎动物群[26]。底栖动物大多迁移能力弱,活动范围相对较小,具有很高的多样性,不同种类对环境的敏感性差异大,受影响后群落组成的变化通常可以预测。因此,底栖动物常被用作了解溪流生态状况的生物指示器[27]。目前,国外运用集合群落理论对底栖动物多样性的研究较多,研究区域和时间跨度更大[25, 28]。尽管近年来国内有一些学者运用集合群落理论对底栖动物多样性格局及驱动机制开展了一些研究[29-30],但这些研究较少从不同的维度分析多样性格局,虽然对国内群落机制的研究有重要的推动作用,但多样性维度的局限性限制了研究结论的推广,所以难以在此基础上形成普适性规律,更无法对河流生态系统管理和保护等提供合理的指导。
本研究选取四川省天全县境内的一条典型山区溪流——天全河进行调查,研究底栖动物物种、功能和系统发育alpha多样性对环境和空间因子的响应,甄别关键的环境和空间因子,同时分析环境和空间因子对各个多样性指数的相对贡献率。本研究旨在阐明天全河底栖动物不同维度多样性的时空分布格局及驱动机制,研究结果有利于促进对亚热带高山溪流水生生物多样性的认识,从而为高山溪流生态系统的管理和保护提供科学基础和理论依据。
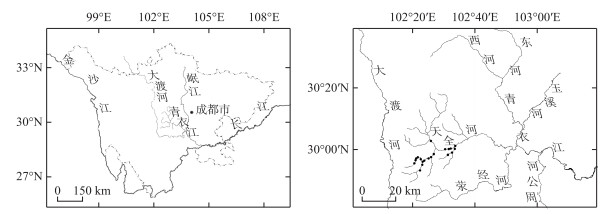
1 材料与方法 1.1 研究区域概况及采样点布置本研究中的底栖动物群落和环境因子数据来源于作者之前发表的文章[30]。天全河(29°49′~30°21′N,102°16′~102°56′E)位于四川省天全县境内,是岷江一级支流青衣江的源头区[31]。天全河全长109 km,流域面积4001 km2,年平均降雨量为1732 mm[32]。该流域是四川盆地与川西高山峡谷区的过渡地带,因此在动物类群组成上亦具有明显的过渡特征。流域内生物多样性丰富,有高等植物100余种,脊椎动物200余种,包括国家一级保护动物川陕哲罗鲑,特有珍稀鱼类天全鮡等,于2003年4月,在此建立了天全河珍稀鱼类自然保护区[33]。天全河流速变化大,两岸多原始森林,溶解氧浓度高,河流底质类型多样,河床结构复杂,为底栖动物等水生生物类群的生存提供了非常适宜的条件[34],也为探究底栖动物不同维度多样性格局及其驱动因子提供了理想的研究条件。
1.2 底栖动物样品的采集和鉴定2018年4月和10月对天全河上游20个样点的底栖动物样品进行采集(图 1)。天全河上游水位较浅,属于可涉水河段,使用索伯网(Surber sampler,孔径420 μm,30 cm×30 cm)选取流速、水深和底质组成及生境均有代表性的河段进行样本采集,每个样点均采集3个重复样。采集的泥样经450 μm的铜筛洗干净后,在白色解剖盘中将动物标本拣出,随后保存在75%的乙醇中。在实验室中将标本鉴定至尽可能低的分类单元(大多数鉴定到属或种),然后计数和称重。底栖动物的鉴定工作依据相关书籍和资料进行[35-40]。
|
图 1 四川天全河采样点分布 Fig.1 Distribution of sampling sites in Tianquan River, Sichuan Province |
对底栖动物采样的同时,对20个样点的现场环境数据进行了测量。使用Unistrong MG721W system测量海拔和经纬度。在河段断面上使用Ranger激光探测仪测量河宽,用FP111流速仪测量水深和流速。采用多参数水质探空仪(YSI 556Pro)现场测量水温(WT)、pH、溶解氧(DO)和电导率。采用便携式浊度仪Orbeco-Helliage 996测量浊度。将底质由大到小划分为5大类:大石(>256 mm)、卵石(64~256 mm)、小圆石(粒径32~64 mm)、砾石(粒径2~32 mm) 和沙(粒径<2 mm),在每一采样点目测估算每一种底质类型的占比[41]。在水下30 cm处使用聚乙烯瓶采集水样,加入硫酸调整至pH<2,并低温保存。在实验室中按照《水和废水监测分析方法》测定总氮、氨氮、硝态氮、亚硝态氮、总磷、正磷酸盐和化学需氧量7个水化参数[42]。
1.3.2 空间变量的测定采用邻体矩阵主坐标分析(PCNM)来获取空间因子。PCNM是基于任意两点间距离的一种空间变量分析模型,可对任何类型的空间结构进行建模,并适用于任何取样设计[43]。本研究分别计算了两组距离矩阵,以模拟生物扩散的两种途径:一种基于地理途径,即任意两采样点间的欧氏距离;另一种基于河网途径,即任意两采样点间沿河道最短距离。随后,基于这两种途径构建了包含20个采样点的两个空间模型,分别模拟了底栖动物的陆地扩散和沿河道扩散的空间过程[30]。PCNM分析使用R软件包中vegan程序包的“pcnm”函数完成,最终获得了8个基于地理途径和11个基于河网途径的PCNM轴[30, 44]。需要指出的是,随着PCNM轴的增加,所代表的空间因子尺度减小,故本文将地理途径PCNM1~3、PCNM4~6和PCNM7~8依次划分为大、中和小尺度空间因子;将河网途径PCNM1~4、PCNM5~8和PCNM9~11依次划分为大、中和小尺度空间因子[43]。
1.4 多样性指数的度量 1.4.1 物种多样性指数的测定物种多样性用物种丰富度指数、均匀度指数、Shannon-Wiener多样性指数和Simpson多样性指数代表,具体计算公式如下。
物种丰富度指数:
| Richness=S | (1) |
均匀度指数:
| J=H′/lnS | (2) |
Shannon-Wiener多样性指数:
| H′=−s∑i=1PilnPi | (3) |
Simpson多样性指数:
| D=1−s∑i=1P2i | (4) |
式中,Richness为物种丰富度指数,S为物种数,J为均匀度指数,H′为Shannon-Wiener多样性指数,Pi为物种i在样本中的相对丰度,D为Simpson多样性指数。
1.4.2 系统发育多样性指数的测定由于缺少物种的DNA数据,本研究使用林奈分类学等级替代系统发育树。以“种、属、科、目、纲、门、界”7个分类阶元作为基准,计算出分类学多样性(Delta)、分类学差异性(Delta*)、平均分类学差异性(Delta+)和分类学差异性变异(Lambda+)[45],各指数计算公式为:
| Delta=[ΣΣi<j ωij⋅xi⋅xj]/[N(N−1)] | (5) |
| Delta∗=[ΣΣi<j ωij⋅xi⋅xj]/[ΣΣi<j xi⋅xj] | (6) |
| Delta+=[ΣΣi<j ωij]/[S(S−1)/2] | (7) |
| Lambda+=[ΣΣi<j(ωij−Delta+)2]/[S(S−1)/2] | (8) |
式中,xi和xj分别代表第i种和第j种密度,N为样本中个体总数,ωij为每对个体之间的分类学距离。
1.4.3 功能多样性指数的测定底栖动物的功能性状根据相关书籍和文献确定[46]。根据当地生境状况和生物类群的特征,选择化性、漂移性、游泳能力、最大攀爬速率、扩散能力、防御物、身体形状、呼吸方式、个体大小、流态偏好、生活型、功能摄食类群12个功能性状纳入分析(附表Ⅰ)。功能多样性方面选用功能丰富度、功能均匀度、功能趋异度和Rao的二次熵来表征,各指数的计算公式如下。
功能丰富度表示群落中物种的功能多样性程度,是所有物种在功能空间内所占据的总体积,可以理解为物种对功能空间的填充程度。
| FRic=SFciRc | (9) |
式中,FRic为功能丰富度,SFci为群落中物种占据的生态位空间,Rc为所有群落中性状c占据的生态位空间。
功能均匀度表示群落中物种功能的均匀程度,即所有物种在功能空间内所占据体积的均匀程度,可以理解为物种在功能空间内分布的平均程度。
| FEve=S−1∑L=1min | (10) |
| P E W_L=\frac{E W_L}{\sum\limits_{L=1}^{S-1} E W_L} | (11) |
| E W_L=\frac{d_{i j}}{w_i+w_j} | (12) |
式中,FEve为功能均匀度,EWL为均匀度权重,dij为物种i和j的欧式距离,wi为物种i的相对丰富度,L为分支长,PEWL为分支长权重。
功能趋异度表示群落中物种功能的差异程度,即所有物种在功能空间内分布的离散程度,可以理解为物种在功能空间内分布的不同程度。
| g_k=\frac{1}{S} \cdot \sum\limits_{i=1}^s x_{i k} | (13) |
| d G_i=\sqrt{\sum\limits_{k=1}^T\left(x_{i k}-g_k\right)^2} | (14) |
| \overline{d G}=\frac{1}{S} \sum\limits_{i=1}^s d G_i | (15) |
| \Delta d=\sum\limits_{i=1}^s W_i \cdot\left(d G_i-\overline{d G}\right) | (16) |
| \Delta|d|=\sum\limits_{i=1}^s W_i \cdot\left|d G_i-\overline{d G}\right| | (17) |
| F D i v=\frac{\Delta d+\overline{d G}}{\Delta|d|+\overline{d G}} | (18) |
式中,xik为物种i性状k的值,gk为性状k的重心,T为性状数,dGi为每一个S种到重心的欧式距离,dG为物种i与重心的平均距离,d为以多度为权重的离散度,Δ|d|为物种i与重心的平均距离,Wi为物种i的多度,FDiv为功能趋异度。
Rao的二次熵表示群落中物种功能多样性的整体分布情况,通过计算所有物种在功能空间内距离的平均值和方差来衡量群落内物种的分布状态。
| \operatorname{Rao} Q=\sum\limits_{i=1}^{S-1} \sum\limits_{i=i+1}^s d_{i j} \cdot p_i \cdot p_j | (19) |
式中,RaoQ为Rao的二次熵,dij为物种i和物种j的性状值概率密度函数的重叠,pi和pj分别为物种i和物种j在样本中的相对丰度。
1.5 数据处理首先,为了检验采样点两季度底栖动物的物种、系统发育和功能alpha多样性指数是否存在季节差异,对所有多样性指数进行配对样本t检验。其次,三维度alpha多样性与驱动因子间的关系采用基于距离的线性模型(DistLM)分析。在DistLM分析中,基于欧式距离构建各多样性指数的距离矩阵,之后用前选法(基于最高的adjusted R2,P<0.05)进行9999次置换确定对底栖动物多样性具有重要且独立作用的最少变量组合。为了优化DistLM分析,分析前检验环境因子之间的Pearson相关性,并根据结果剔除了与海拔高度相关的(Pearson's r >0.80)水温。最后,使用变差分解分析(VPA)评估环境和空间因子对3个维度多样性指数变异的相对贡献率。通过VPA分析将模型的解释率划分为环境因子单独作用解释量、空间因子单独作用解释量、两种因子共同作用解释量和未解释量4个部分。
在SPSS statistical programs(20.0版)中进行相关性分析和配对样本t检验,在R软件包中使用vegan程序包进行PCNM、DistLM和VPA分析[47-48]。
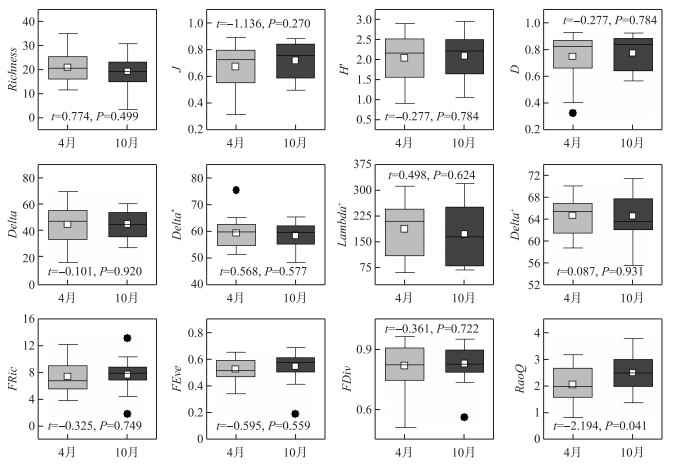
2 结果与分析配对样本t检验的结果表示,两季度间底栖动物3个维度alpha多样性指数大多无显著变化(P>0.05),仅有功能多样性的RaoQ指数(t=-2.194,P=0.041)表现出秋季低于夏季(图 2)。
|
图 2 4月和10月底栖动物的物种、系统发育和功能多样性指数箱线图 (箱体表示25%~75%的分布范围,箱体中的横线代表中位数,白色正方形代表平均值,箱体上下两端短横线分别代表最大和最小值,黑点表示极端值) Fig.2 Boxplot of taxonomic, phylogenetic diversity and functional diversity indices of benthic macroinvertebrates in April and October |
DistLM分析显示,不同维度的多样性指数对环境和空间因子的响应存在明显区别,但均符合集合群落理论框架下的范式[12]。对物种多样性指数而言,海拔是影响4个物种多样性指数最为关键的环境因子,流速对物种数也有显著影响(表 1)。影响物种多样性的空间因子主要为地理途径中尺度(PCNM4~6)的空间因子,河网途径中仅有PCNM2对Shannon-Wiener多样性指数有显著影响(表 1)。变差分解分析显示,模型对4个物种多样性的解释率在21.0%~34.5%之间(表 1),环境因子单独解释的变异(0.6%~21.5%)与空间因子(0.2%~16.6%)大体相当(表 1)。环境因子与空间因子共同解释的物种多样性变异在1.2%~20.9%之间。
| 表 1 底栖动物的物种、系统发育和功能的alpha多样性与关键变量的DistLM分析结果* Tab. 1 Results of DistLM analyses for taxonomic, phylogenetic and functional alpha diversity of benthic macroinvertebrate with critical variables |
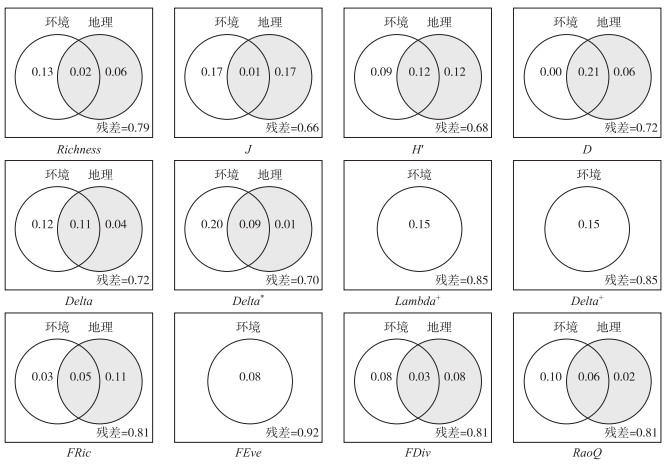
在系统发育多样性方面,大石、卵石、小圆石和砾石4种底质类型占比是系统发育多样性的主导因素,海拔、流速和水深也是影响系统发育多样性的重要因子(表 1)。空间因子中有地理途径PCNM5对Delta,地理途径PCNM7和河网途径的PCNM4对Delta*影响显著。环境和空间因子单独及协同作用共解释了15.3%~36.2%的多样性变化(图 3)。变差分解分析结果表明,环境因子对系统发育多样性指数变异的单独解释率(12.1%~23.3%)均高于空间因子(0~6.9%)(表 1)。
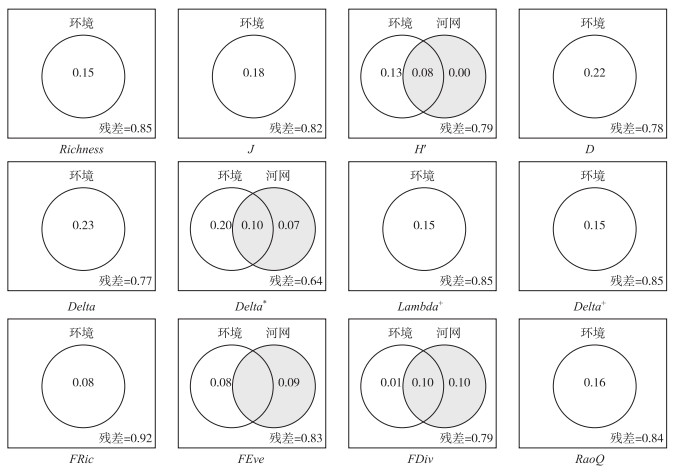
从功能多样性来说,底质类型对FRic、FEve和RaoQ有显著影响,而硝态氮和浊度分别对FDiv和RaoQ有显著影响(表 1)。值得注意的是,空间因子同样对功能多样性起着重要作用,如地理途径的中小尺度空间因子(PCNM6~8)对FRic、FDiv和RaoQ均有显著影响(图 3),河网途径的PCNM6和PCNM3分别对FEve和RaoQ有显著影响(图 4)。变差分解结果显示,模型对功能多样性的解释率在17.0%~21.1%之间,环境因子(1.3%~16.3%)与空间因子(2.4%~11.1%)单独作用对多样性变异的解释率大体相当(表 1)。
|
图 3 底栖动物的物种、系统发育和功能多样性指数对环境因子和基于地理途径空间因子的变差分解分析的韦恩图 Fig.3 Venn-diagrams illustrating the variation partitioning analysis results of how taxonomic, phylogenetic and functional diversity indices of benthic macroinvertebrates respond to environmental factors and spatial factorsbased on overland distance |
|
图 4 底栖动物的物种、系统发育和功能多样性指数对环境因子和基于河网途径空间因子的变差分解分析的韦恩图(解释率<0时不显示) Fig.4 Venn-diagrams illustrating the variation partitioning analysis results of how taxonomic, phylogenetic and functional diversity indices of benthic macroinvertebrates respond to environmental factors and spatial factors based on watercourse distance |
在集合群落的理论框架下,群落的聚合和驱动机制受到环境过滤和扩散限制的共同影响。本研究发现,环境因子和空间因子都对天全河上游底栖动物alpha多样性指数的变异有显著影响,但影响物种、系统发育和功能等不同维度多样性指数的具体环境和空间因子及其各自的贡献率却均有较大的差异。
3.1 影响底栖动物alpha多样性的关键环境因子海拔、底质类型、流速、浊度和硝态氮等环境因子是影响天全河底栖动物群落多样性的重要因子。国外[49-50]和国内[51]都有研究表明,海拔是综合影响底栖动物物种多样性格局的重要因子。在本研究中,从上游到下游随着海拔的降低,不同样点间溶解氧、水温、光照、河宽、植被覆盖率等一系列环境条件发生变化[49],这些环境因子的综合作用影响着底栖动物的多样性格局。另外,天全河上游的海拔梯度较大,天然落差约1000 m,然而底栖动物大多迁移能力弱,所以这种情况下海拔可能会成为影响物种分布的天然屏障[31]。底质类型亦是影响底栖动物系统发育和功能多样性格局的重要环境因子,它是底栖动物直接栖息、生活和繁殖的场所,同时也是其应对扰动的避难所[52-53]。大量研究发现,底质的粒径、异质性和密实性直接影响生境的复杂性,而生境的复杂性与底栖动物多样性呈正相关关系[52, 54]。粗颗粒底质通常较为松散,其中存在大量夹缝和间隙,形成较高的生境异质性,为溪流生物尤其是底栖动物提供了适宜的活动场所,有利于形成高的生物多样性[54]。此外,相比于泥沙等细碎底质,粗颗粒底质稳定性更高,可以更好地抵御洪水等外力干扰。天全河的底质类型有大石、卵石、小圆石和砾石等多种粒径大小的石块,不仅异质性高而且石块粒径偏大,可为大部分底栖动物提供适宜的生存场所,有利于提高底栖动物的系统发育和功能多样性[52]。流速也是影响底栖动物的重要因子。生境中流速不同通常导致底栖动物分布的差异,溪流的急流水域中含氧量往往达到饱和,适宜喜氧型底栖动物生存,而在流速缓慢的水域中含氧量较低,更适宜需氧量较低的底栖动物生存[55]。浊度在底栖动物的群落分布中起重要作用,它表示水体中悬浮物对光线透过时的阻碍程度,通过光照透射率来影响藻类的生长,最终影响以此为食的底栖动物[56]。有研究表明,水体中较高的浊度对底栖动物的多样性不利[57]。悬浮物摄食食性的底栖动物从水中摄取有机颗粒,而高浓度的悬浮颗粒物可能阻塞它们的滤食器官,从而干扰它们的生长[58]。硝态氮浓度也可能会通过影响水体中着生藻类和水生植物的生长而进一步影响底栖动物的生长和繁殖[59]。
3.2 影响底栖动物alpha多样性的关键空间因子本研究结果显示,对底栖动物多样性指数的变异起到重要作用的空间因素主要为基于地理途径的中尺度(PCNM 4~6影响物种alpha多样性)或中小尺度(PCNM 6~8影响功能alpha多样性)的空间因子,仅有基于河网途径的PCNM3对功能alpha多样性有显著影响。本次研究区域位于天全河上游,通常情况下,在河网上游溪流中,对水生生物的作用会更加显著。这是因为上游河源区域多处于河流网络结构的边缘,相对于中下游,上游溪流的水体连通度通常较低,会限制物种的迁移、扩散和基因交流[60]。之前的研究表明,中小尺度的空间因子是影响底栖动物群落物种多样性的关键因素之一[61],而功能多样性则受小尺度空间因素的影响较大[62]。在较大空间尺度下,扩散限制往往对物种分布起重要作用,其重要性随空间尺度的减小而降低[63]。但是随着空间尺度缩小到小尺度,物种间的交流会更加频繁,甚至超过环境过滤的作用,即通常所说的“群块效应”[63]。功能多样性格局可能是由多个环境变量在地理途径小尺度的空间因子上共同作用的结果[62]。河网途径中较大尺度的空间因子也在功能多样性格局的形成中占重要地位,表示沿河网途径的扩散限制具有显著影响或是生境和功能性状组成发生变异。在较大的空间尺度下,扩散限制往往是控制功能多样性格局的重要因素[63]。
3.3 环境和空间因子对三维度alpha多样性的相对重要性环境因子和空间因子对天全河底栖动物的影响程度在3个多样性维度间有明显的差异。对物种alpha多样性指数而言,环境和空间两组因子对变异的解释率相当(0.6%~21.5%vs. 0.2%~16.6%)。研究表明,环境过滤在驱动底栖动物物种多样性格局方面有重要作用[28, 30]。水环境中如底质组成、水温、溶解氧、营养盐浓度等环境因子的变化都会影响特定种类的生长繁衍,进而影响物种多样性格局。此外,物种多样性指数均受空间因子的影响,这主要与底栖动物的扩散过程有关,个体可以由生境条件较好的“源位点”不断向较差的“汇位点”扩散,使得后者的种群增大,即源汇效应[29, 64]。另外,底栖动物未出现在某些位点可能是由于当地生境的筛选作用,也可能是因为物种并未扩散至此区域[6, 29]。因此,天全河上游环境因子的改变、源汇效应和物种扩散能力可能共同影响物种的分布格局,使得物种alpha多样性受环境因子和空间因子的作用相当。
本研究中空间因子对天全河底栖动物的功能alpha多样性指数影响程度与环境因子大体相当,这一结果是令人较为惊讶的。一般认为,环境因子对功能多样性格局的重要性高于空间因子,根据生境模板理论[65]和景观过滤假说[66]等经典理论,不同尺度的环境因子对区域内具有特定性状的物种具有筛选作用,使其共存于群落之中。然而,近期也有学者发现环境和空间因子在底栖动物群落组成的驱动中存在一种权衡关系,即环境过滤作用和空间作用的相对重要性取决于空间尺度上环境因子的变异性[63]。另外,功能冗余也可能影响功能多样性指数对环境变化的敏感性,功能冗余反映群落内部功能生态位的重叠程度,高重叠程度表示群落内不同物种可能具有相似甚至同等的功能特征[67-68]。天全河上游自然环境适宜,有较高的生物多样性(共有底栖动物123个分类单元),群落内一些物种可能有相似的性状特征,因而功能冗余性也较高。较高的功能冗余性使得天全河底栖动物群落在应对环境变化时具有一定的抵抗力和恢复力,这可能是造成环境过滤作用未在功能多样性指数驱动过程中占据绝对主导地位的原因。功能多样性指数受空间因子的影响并非个例,例如,Li等对汉江上游[29]和Wang等[69]对赤水河流域底栖动物的相关研究发现,空间因子对功能多样性指数具有影响显著,甚至对一些指数的影响程度超过环境因子。Tolonen等[70]对芬兰北部湖泊底栖动物的研究也得出了相似的结论。
值得注意的是,Lambda+和Delta+仅受到环境因子的影响,而不受空间因子的影响,此结果表明这两个指数在高山溪流环境评价中可不受区域的限制而有较好的应用前景,也说明底栖动物集合群落在这两个指数上主要展现物种筛选范式,在此范式中扩散是充分的,环境过滤作用对群落聚合及其驱动机制的相对重要性更高。由于DNA数据的缺乏,本研究使用分类学差异性指数表示系统发育性。分类学差异性指数被认为是监测海洋生态系统环境变化的有效指标之一[71]。然而,在淡水生态系统中,该组指数在环境评价中的有效性却存在争议,不同的研究中结果差异较大。例如,Jiang等[72]对长江中下游湖群底栖动物以及Heino和Tolonen[28]在对芬兰北部湖泊底栖动物的研究中都发现分类学差异性指数可以有效反映人为干扰所引起的环境变化;然而,在Heino等[73]对芬兰溪流底栖动物以及Abellán等[74]对伊比利亚半岛水生甲虫的研究中,发现分类学差异性指数对人为干扰的敏感度较低。这可能是因为,分类学差异性指数受到当地物种组成、环境数据和气候特征等诸多因素的影响,这些因素可能会对分类学差异性指数的驱动机制产生干扰[75]。在本研究中,分类学差异性指数对自然引起的环境变化有良好的响应,可能是因为天全河受人为干扰的影响较小。在未来的淡水生态系统研究中,分类学差异性指数可能对监测人为干扰引起的环境变化具有潜在的应用价值。然而,在利用该指数进行监测时,可能需要考虑如何排除自然环境变化对结果的影响。本研究为分类学差异性指数在环境评价和监测中的适用性增加了新的案例。
本研究中所选取的环境和空间因子只能解释部分多样性变化,这可能是因为研究中所构建的模型不能充分解释大型无脊椎动物扩散过程对群落组成的影响。在未来的研究需要考虑更多的变量,如土地利用、气候因素、生物因素(如凋落物、附着藻类)等,以更全面地了解亚热带高山溪流底栖动物群落变化的驱动机制。另外,本研究中所选取的解释率为校正后R2值,通常比未校正的R2值更低[28]。
4 结论综上所述,天全河底栖动物群落的多样性在两个季度间变化不大。底栖动物的物种、系统发育和功能多样性对环境和空间因子的响应存在显著差异。海拔、底质类型、流速、浊度和硝态氮等环境因子对底栖动物的物种、系统发育和功能多样性具有重要影响。地理途径PCNM 4~6的空间因子对物种多样性格局有显著影响,而地理途径PCNM 6~8和河网途径PCNM 3的空间因子是驱动功能多样性格局的重要因素。环境因子在系统发育多样性格局形成中起主导作用,作为系统发育多样性指数的替代,分类学差异性指数可以有效反映环境因子所引起的系统发育多样性格局的变化。本次对亚热带高山溪流底栖动物物种、系统发育和功能alpha多样性及其驱动因子的研究补充了国内相关研究,将有助于未来制定高山溪流生态系统的保护策略,促进生物多样性的维护和恢复。
5 附录附表Ⅰ见电子版(DOI: 10.18307/2024.0535)。
| 附表Ⅰ 本研究中使用的性状及其类别和编码 Appendix Ⅰ Biological traits and their categories used in this study |
| [1] |
Cardinale BJ, Duffy JE, Gonzalez A et al. Biodiversity loss and its impact on humanity. Nature, 2012, 486: 59-67. DOI:10.1038/nature11148 |
| [2] |
Pavoine S, Bonsall MB. Measuring biodiversity to explain community assembly: A unified approach. Biological Reviews of the Cambridge Philosophical Society, 2011, 86(4): 792-812. DOI:10.1111/j.1469-185X.2010.00171.x |
| [3] |
Zhang XA, Zhao L, Kang L. Evolutionary mechanism of species coexistence in ecological communities. Biodiversity Science, 2001, 9(1): 8-17. [张晓爱, 赵亮, 康玲. 生态群落物种共存的进化机制. 生物多样性, 2001, 9(1): 8-17. DOI:10.17520/biods.2001002] |
| [4] |
MacArthur RH, Wilson EO. The theory of island biogeography. Princeton: Princeton University Press, 1967.
|
| [5] |
Wilson JB, Gitay H. Community structure and assembly rules in a dune slack: Variance in richness, guild proportionality, biomass constancy and dominance/diversity relations. Vegetatio, 1995, 116(2): 93-106. DOI:10.1007/BF00045301 |
| [6] |
Hubbell SP. The unified neutral theory of biodiversity and biogeography (MPB-32). Princeton: Princeton University Press, 2011.
|
| [7] |
Bell G. The distribution of abundance in neutral communities. The American Naturalist, 2000, 155(5): 606-617. DOI:10.1086/303345 |
| [8] |
Niu KC, Liu ZN, Shen ZH et al. Community assembly: The relative importance of neutral theory and niche theory. Biodiversity Science, 2009, 17(6): 579-593. [牛克昌, 刘怿宁, 沈泽昊等. 群落构建的中性理论和生态位理论. 生物多样性, 2009, 17(6): 579-593. DOI:10.3724/SP.J.1003.2009.09142] |
| [9] |
Kraft NJB, Adler PB, Godoy O et al. Community assembly, coexistence and the environmental filtering metaphor. Functional Ecology, 2015, 29(5): 592-599. DOI:10.1111/1365-2435.12345 |
| [10] |
Zisenis M. The international platform on biodiversity and ecosystem services gets profile. Biodiversity and Conservation, 2015, 24(1): 199-203. DOI:10.1007/s10531-014-0797-0 |
| [11] |
Chase JM. Towards a really unified theory for metacommunities. Functional Ecology, 2005, 19(1): 182-186. DOI:10.1111/j.0269-8463.2005.00937.x |
| [12] |
Leibold MA, Holyoak M, Mouquet N et al. The metacommunity concept: A framework for multi-scale community ecology. Ecology Letters, 2004, 7(7): 601-613. DOI:10.1111/j.1461-0248.2004.00608.x |
| [13] |
Grönroos M, Heino J, Siqueira T et al. Metacommunity structuring in stream networks: Roles of dispersal mode, distance type, and regional environmental context. Ecology and Evolution, 2013, 3(13): 4473-4487. DOI:10.1002/ece3.834 |
| [14] |
Levins R. Some demographic and genetic consequences of environmental heterogeneity for biological control. Bulletin of the ESA, 1969, 15(3): 237-240. DOI:10.1093/besa/15.3.237 |
| [15] |
Heino J. A macroecological perspective of diversity patterns in the freshwater realm. Freshwater Biology, 2011, 56(9): 1703-1722. DOI:10.1111/j.1365-2427.2011.02610.x |
| [16] |
Mouquet N, Loreau M. Coexistence in metacommunities: The regional similarity hypothesis. The American Naturalist, 2002, 159(4): 420-426. DOI:10.1086/338996 |
| [17] |
Heino J, Soininen J, Alahuhta J et al. Metacommunity ecology meets biogeography: Effects of geographical region, spatial dynamics and environmental filtering on community structure in aquatic organisms. Oecologia, 2017, 183(1): 121-137. DOI:10.1007/s00442-016-3750-y |
| [18] |
Ma KP, Liu YM. Measurement of biotic community diversity I & Agr; diversity (Part 1). Biodiversity Science, 1994(4): 231-239. [马克平, 刘玉明. 生物群落多样性的测度方法Ⅰα多样性的测度方法(下). 生物多样性, 1994(4): 231-239. DOI:10.17520/biods.1994027] |
| [19] |
Saito VS, Siqueira T, Fonseca-Gessner AA. Should phylogenetic and functional diversity metrics compose macroinvertebrate multimetric indices for stream biomonitoring?. Hydrobiologia, 2015, 745(1): 167-179. DOI:10.1007/s10750-014-2102-3 |
| [20] |
Stuart-Smith RD, Bates AE, Lefcheck JS et al. Integrating abundance and functional traits reveals new global hotspots of fish diversity. Nature, 2013, 501: 539-542. DOI:10.1038/nature12529 |
| [21] |
Flynn DFB, Mirotchnick N, Jain M et al. Functional and phylogenetic diversity as predictors of biodiversity—ecosystem-function relationships. Ecology, 2011, 92(8): 1573-1581. DOI:10.1890/10-1245.1 |
| [22] |
Arnan X, Cerdá X, Retana J. Relationships among taxonomic, functional, and phylogenetic ant diversity across the biogeographic regions of Europe. Ecography, 2017, 40(3): 448-457. DOI:10.1111/ecog.01938 |
| [23] |
Petchey OL, Gaston KJ. Functional diversity: Back to basics and looking forward. Ecology Letters, 2006, 9(6): 741-758. DOI:10.1111/j.1461-0248.2006.00924.x |
| [24] |
Cadotte MW, Jonathan Davies T, Regetz J et al. Phylogenetic diversity metrics for ecological communities: Integrating species richness, abundance and evolutionary history. Ecology Letters, 2010, 13(1): 96-105. DOI:10.1111/j.1461-0248.2009.01405.x |
| [25] |
Göthe E, Baattrup-Pedersen A, Wiberg-Larsen P et al. Environmental and spatial controls of taxonomic versus trait composition of stream biota. Freshwater Biology, 2017, 62(2): 397-413. DOI:10.1111/fwb.12875 |
| [26] |
Jacobsen D, Cressa C, Mathooko JM et al. Macroinvertebrates: composition, life histories and production. Tropical Stream Ecology. Amsterdam: Elsevier, 2008: 65-105. DOI: 10.1016/b978-012088449-0.50006-6.
|
| [27] |
Shu FY, Wang HJ, Cui YD et al. Diversity and distribution pattern of freshwater molluscs in the Yangtze River Basin. Acta Hydrobiologica Sinica, 2014, 38(1): 19-26. [舒凤月, 王海军, 崔永德等. 长江流域淡水软体动物物种多样性及其分布格局. 水生生物学报, 2014, 38(1): 19-26. DOI:10.7541/2014.03] |
| [28] |
Heino J, Tolonen Kimmo T. Ecological drivers of multiple facets of beta diversity in a lentic macroinvertebrate metacommunity. Limnology and Oceanography, 2017, 62(6): 2431-2444. DOI:10.1002/lno.10577 |
| [29] |
Li ZF, Liu ZY, Heino J et al. Discriminating the effects of local stressors from climatic factors and dispersal processes on multiple biodiversity dimensions of macroinvertebrate communities across subtropical drainage basins. Science of the Total Environment, 2020, 711: 134750. DOI:10.1016/j.scitotenv.2019.134750 |
| [30] |
Jiang XM, Xu X, Tao M et al. The effects of dispersal ability on metacommunity structure of macroinvertebrates in subtropical Chinese high-mountain streams: Seasonal shifts in relative contribution of local environment and spatial processes. Environmental Science and Pollution Research, 2021, 28(29): 38573-38583. DOI:10.1007/s11356-021-13281-2 |
| [31] |
Yang L, He Y, Lu JY et al. Spatial distribution of soil nitrogen and its influencing factors in the Tianquan Rever Basin. Journal of Sichuan Agricultural University, 2012, 30(3): 326-331. [杨玲, 何勇, 卢俊宇等. 天全河流域土壤氮素的空间分布特征及其影响因素分析. 四川农业大学学报, 2012, 30(3): 326-331. DOI:10.3969/j.issn.1000-2650.2012.03.011] |
| [32] |
Wang DK, Yu KN. Discussion on characteristics of rainfall and runoff in Tianquan River Basin. Sichuan Water Resources, 1999, 20(2): 16-18. [王德康, 于康宁. 天全河流域降雨径流特性探讨. 四川水利, 1999, 20(2): 16-18.] |
| [33] |
Wang LL, Xu HG, Jiang MK. Biodiversity of Tianquanhe River rare fish nature resever and its sustainable development strategies. Sichuan Environment, 2004, 23(5): 4. [王连龙, 徐海根, 蒋明康. 天全河珍稀鱼类自然保护区的生物多样性和可持续发展对策. 四川环境, 2004, 23(5): 4.] |
| [34] |
Sheng HY, Yu ZM, Han YC et al. Phytoplankton community and its relationship with environmental factors of a large riverine reservoir, Fuchunjiang Reservoir in subtropical China. J Lake Sci, 2010, 22(2): 235-243. [盛海燕, 虞左明, 韩轶才等. 亚热带大型河流型水库——富春江水库浮游植物群落及其与环境因子的关系. 湖泊科学, 2010, 22(2): 235-243. DOI:10.18307/2010.0213] |
| [35] |
Brinkhurst RO. Guide to the freshwater aquatic microdrile oligochaetes of North America. Spec Publ Fish Aquat Sci, 1986, 84: 1-259. |
| [36] |
刘月英. 中国经济动物志. 北京: 科学出版社, 1979.
|
| [37] |
Dudgeon D. Tropical Asian streams: Zoobenthos, ecology and conservation. Hong Kong: Hong Kong University Press, 1999.
|
| [38] |
Epler JH. Identification manual for the larval Chironomidae (Diptera) of North and South Carolina. 2001.
|
| [39] |
Wiggins GB. Larvae of the North American caddisfly genera (Trichoptera): 2nd ed. Toronto: University of Toronto Press, 1996.
|
| [40] |
Dong L, Peng L, Changfa Z. Larval key to families of Ephemeroptera from China (Insecta). Nanjing: Journal of Natural Science Nanjing Normal University, 2005, 7.
|
| [41] |
Barbour M, Gerritsen J, Snyder B et al. Rapid bioassessment for use in streams and wadeable rivers: Periphyton, benthic macroinvertebrates and fish. Washington DC: Environment Protection Agency, Office of Water, 1999.
|
| [42] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.
|
| [43] |
Borcard D, Legendre P. All-scale spatial analysis of ecological data by means of principal coordinates of neighbour matrices. Ecological Modelling, 2002, 153(1): 51-68. |
| [44] |
Gilbert B, Bennett JR. Partitioning variation in ecological communities: Do the numbers add up?. Journal of Applied Ecology, 2010, 47(5): 1071-1082. DOI:10.1111/j.1365-2664.2010.01861.x |
| [45] |
Heino J, Alahuhta J, Fattorini S. Phylogenetic diversity of regional beetle faunas at high latitudes: Patterns, drivers and chance along ecological gradients. Biodiversity and Conservation, 2015, 24(11): 2751-2767. DOI:10.1007/s10531-015-0963-z |
| [46] |
Poff NL, Olden JD, Vieira NKM et al. Functional trait niches of North American lotic insects: Traits-based ecological applications in light of phylogenetic relationships. Journal of the North American Benthological Society, 2006, 25(4): 730-755. DOI:10.1899/0887-3593(2006)025[0730:FTNONA]2.0.CO;2 |
| [47] |
Legendre P, Legendre L. Numerical ecology. Elsevier, 2012.
|
| [48] |
Anderson MJ, Gorley RN, Clarke KS et al. PERMANOVA+ for PRIMER: Guide to software and statistical methods. Primer-E Limited, 2008. |
| [49] |
Loayza-Muro RA, Elías-Letts R, Marticorena-Ruíz JK et al. Metal-induced shifts in benthic macroinvertebrate community composition in Andean high altitude streams. Environmental Toxicology and Chemistry, 2010, 29(12): 2761-2768. DOI:10.1002/etc.327 |
| [50] |
Carvalho LK, Farias RL, Medeiros ESF. Benthic invertebrates and the habitat structure in an intermittent river of the semi-arid region of Brazil. Neotropical Biology and Conservation, 2013, 8(2): 57-67. DOI:10.4013/nbc.2013.82.01 |
| [51] |
Qu XD, Cao M, Shao ML et al. Macrobenthos in Jinping reach of Yalongjiang River and its main tributaries. Chinese Journal of Applied Ecology, 2007, 18(1): 158-162. DOI: http://ir.ihb.ac.cn/handle/152342/864. [渠晓东, 曹明, 邵美玲等. 雅砻江(锦屏段) 及其主要支流的大型底栖动物, 应用生态学报, 2007, 18(1): 158-162. ]
|
| [52] |
Li YF, Du FY, Wang LG et al. Effects of the sediment type on ecological functions of macrobenthos in the intertidal zones of Sanya Bay. Journal of Fisheries of China, 2018, 42(10): 1559-1571. [李亚芳, 杜飞雁, 王亮根等. 底质类型对三亚湾潮间带大型底栖动物生态功能的影响. 水产学报, 2018, 42(10): 1559-1571. DOI:10.11964/jfc.20170810938] |
| [53] |
Ormerod SJ, Edwards RW. The ordination and classification of macroinvertebrate assemblages in the catchment of the River Wye in relation to environmental factors. Freshwater Biology, 1987, 17(3): 533-546. DOI:10.1111/j.1365-2427.1987.tb01074.x |
| [54] |
Duan XH, Wang ZY, Cheng DS. Benthic macroinvertebrates communities and biodiversity in various stream substrata. Acta Ecologica Sinica, 2007, 27(4): 1664-1672. [段学花, 王兆印, 程东升. 典型河床底质组成中底栖动物群落及多样性. 生态学报, 2007, 27(4): 1664-1672. DOI:10.3321/j.issn:1000-0933.2007.04.047] |
| [55] |
Ren HQ, Yuan XZ, Liu H et al. The effects of environment factors on community structure of benthic invertebrate in rivers. Acta Ecologica Sinica, 2015, 35(10): 3148-3156. DOI:10.5846/stxb201306241759 |
| [56] |
Shao ML, Han XQ, Xie ZC et al. Comparative study on macroinvertebrate communities along a reservoir cascade in Xiangxi River Basin. Acta Ecologica Sinica, 2007, 27(12): 4963-4971. DOI:10.1016/s1872-2032(08)60012-8 |
| [57] |
Nicholls PE, Hewitt JE, Halliday JM. Effects of suspended sediment concentrations on suspension and deposit feeding marine macrofauna. Auckland Regional Council, 2003. |
| [58] |
Akoumianaki I, Nicolaidou A. Spatial variability and dynamics of macrobenthos in a Mediterranean delta front area: The role of physical processes. Journal of Sea Research, 2007, 57(1): 47-64. DOI:10.1016/j.seares.2006.07.003 |
| [59] |
Chen C, Zheng CQ, Wang MM et al. Low concentration nitrate-nitrogen improves polyphosphate accumulation in Microcystis. J Lake Sci, 2022, 34(3): 766-776. [陈成, 郑超群, 王梦梦等. 低浓度硝态氮促进微囊藻累积多聚磷酸盐. 湖泊科学, 2022, 34(3): 766-776. DOI:10.18307/2022.0306] |
| [60] |
Tonkin JD, Altermatt F, Finn DS et al. The role of dispersal in river network metacommunities: Patterns, processes, and pathways. Freshwater Biology, 2018, 63(1): 141-163. DOI:10.1111/fwb.13037 |
| [61] |
Leibold MA, Chase JM. Metacommunity ecology. Volume 59. Princeton: Princeton University Press, 2017. DOI:10.2307/j.ctt1wf4d24
|
| [62] |
Schmera D, Erös T, Heino J. Habitat filtering determines spatial variation of macroinvertebrate community traits in northern headwater streams. Community Ecology, 2013, 14(1): 77-88. DOI:10.1556/ComEc.14.2013.1.9 |
| [63] |
Heino J, Melo AS, Siqueira T et al. Metacommunity organisation, spatial extent and dispersal in aquatic systems: Patterns, processes and prospects. Freshwater Biology, 2015, 60(5): 845-869. DOI:10.1111/fwb.12533 |
| [64] |
Cottenie K, Michels E, Nuytten N et al. Zooplankton metacommunity structure: Regional vs. local processes in highly interconnected ponds. Ecology, 2003, 84(4): 991-1000. DOI:10.1890/0012-9658(2003)084[0991:zmsrvl]2.0.co;2 |
| [65] |
Southwood TRE. Habitat, the templet for ecological strategies?. The Journal of Animal Ecology, 1977, 46(2): 336. DOI:10.2307/3817 |
| [66] |
Poff NL. Landscape filters and species traits: Towards mechanistic understanding and prediction in stream ecology. Journal of the North American Benthological Society, 1997, 16(2): 391-409. DOI:10.2307/1468026 |
| [67] |
Alahuhta J, Aroviita J. Quantifying the relative importance of natural variables, human disturbance and spatial processes in ecological status indicators of boreal lakes. Ecological Indicators, 2016, 63: 240-248. DOI:10.1016/j.ecolind.2015.12.003 |
| [68] |
McLean M, Auber A, Graham NAJ et al. Trait structure and redundancy determine sensitivity to disturbance in marine fish communities. Global Change Biology, 2019, 25(10): 3424-3437. DOI:10.1111/gcb.14662 |
| [69] |
Wang J, Hu JC, Tang T et al. Seasonal shifts in the assembly dynamics of benthic macroinvertebrate and diatom communities in a subtropical river. Ecology and Evolution, 2020, 10(2): 692-704. DOI:10.1002/ece3.5904 |
| [70] |
Tolonen K, Vilmi A, Karjalainen S et al. Ignoring spatial effects results in inadequate models for variation in littoral macroinvertebrate diversity. Oikos, 2017, 126: 852-862. DOI:10.1111/OIK.03587 |
| [71] |
Clarke KR, Warwick RM. A further biodiversity index applicable to species lists: Variation in taxonomic distinctness. Marine Ecology Progress Series, 2001, 216: 265-278. |
| [72] |
Jiang XM, Sun X, Alahuhta J et al. Responses of multiple facets of macroinvertebrate alpha diversity to eutrophication in floodplain lakes. Environmental Pollution, 2022, 306: 119410. DOI:10.1016/j.envpol.2022.119410 |
| [73] |
Heino J, Mykrä H, Heikki Håmålåinen et al. Responses of taxonomic distinctness and species diversity indices to anthropogenic impacts and natural environmental gradients in stream macroinvertebrates. Freshwater Biology, 2007, 52(9): 1846-1861. |
| [74] |
Abellán P, Bilton DT, Millan A et al. Can taxonomic distinctness assess anthropogenic impacts in inland waters? A case study from a Mediterranean River Basin. Freshwater Biology, 2006, 51(9): 1744-1756. |
| [75] |
Leira M, Chen G, Dalton C et al. Patterns in freshwater diatom taxonomic distinctness along an eutrophication gradient. Freshwater Biology, 2009, 54(1): 1-14. |
 2024, Vol. 36
2024, Vol. 36 


