(2: 中国科学院成都生物研究所, 成都 610041)
(3: 四川大学生命科学学院, 成都 610065)
(4: 重庆师范大学地理与旅游学院, 重庆 400047)
(2: Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, P. R. China)
(3: School of Life Sciences, Sichuan University, Chengdu 610065, P. R. China)
(4: College of Geography and Tourism, Chongqing Normal University, Chongqing 400047, P. R. China)
小微湿地是指全年或季节性含水,面积小于8 hm2的自然或人工小湖泊、池塘,以及长度小于5 km、宽度小于10 m的溪流等多种微型湿地系统[1-3]。小微湿地分布广,具有较高的周长/面积比、空间异质性与物质交换频率[4-5],在涵养生物多样性、调洪调微气候、提供生物迁移脚踏石等生态功能方面发挥着重要的作用,是链接大型湿地网络中的关键节点[1, 6]。而当前的研究显示,部分地区小微湿地斑块数量和总面积都有所减少,生态健康受到威胁,生态功能退化[7-10]。与此同时,湿地生态系统中不可或缺的生物多样性部分也会有所降低[11-13],研究小微湿地微生物群落的地理分布格局对维持湿地生物多样性具有重要的理论意义。
现有对小微湿地微生物的研究中,学者们更多地关注永久性小湖泊[14-17]与季节性池塘[18-20],对作为连接陆地与内陆湿地关键纽带的溪流型小微湿地微生物群落结构的研究较少[21-23]。空间尺度上,海拔梯度的变化能够在相对小的空间距离内产生较大的气候、水文、土壤等一系列微生物生境的综合变化,进而显著影响微生物的群落组成及分布格局[24-25]。学者们对溪流型小微湿地微生物群落结构海拔分布格局的研究更多的是关注细菌与真菌群落[26-32],对古菌群落的研究较少。作为三大微生物类群之一的古菌群落,在生物多样性和地球化学循环中扮演着重要的生态角色[33],其群落组成和分布受多种环境因子的影响,对环境变化具有高度敏感性。因此,研究溪流型小微湿地古菌群落的海拔分布格局,有利于更全面地理解小微湿地微生物群落的海拔分布模式及其生态功能。
青藏高原东部及东南部河流遍布[34],是研究溪流型小微湿地微生物海拔分布模式的较佳地点。其中,岷江上游地区作为这一区域的重要组成部分,拥有丰富的溪流资源。对小微湿地而言,水体较浅,沉积物中的微生物群落更能反映溪流微生物多样性的长期状况[35]。综上,本研究通过高通量测序分析以及统计学的方法,研究了青藏高原东缘岷江上游不同海拔溪流型小微湿地沉积物中古菌群落分布格局及影响因素,以期达到以下目标:(1)探究不同海拔梯度上溪流型小微湿地沉积物中古菌群落多样性及群落组成的海拔分布模式;(2)明确岷江上游不同海拔溪流型小微湿地沉积物中古菌群落地理分布格局的驱动因素。
1 材料与方法 1.1 研究区域概况岷江上游地处青藏高原东缘、四川盆地西北部,位于31°26′~33°16′N,102°59′~104°14′E之间,岷江上游河段属峡谷型河流,地形复杂,岭谷相间,两岸耕地、人口分布少[36];主要区域位于阿坝藏族羌族自治州,流经汶川、茂县、理县、松潘、黑水地区,对成都平原与长江中下游的水资源、生物物种起到重要的调节作用,是重要的天然生态屏障[37]。
2023年4月于岷江上游流域,根据实地采样典型性与可操作相结合的原则,在5个海拔梯度上(1000、1600、2000、2700和3200 m)均选择一条具有代表性(远离市区、一级支流、大小基本一致及两侧均为自然环境)的小溪流进行样本采集与各项基础指标测定。每条溪流每个样点间隔200 m(依实际情况做适当调整,每条溪流5个采样点),5条溪流型小微湿地的地理位置见附表Ⅰ。
1.2 样品采集与指标测定每个样点沉积物样品均采集于有上覆水的底泥。具体步骤如下,用底泥采样器对0~5 cm左右的沉积物进行采集,每个采样点采集3个沉积物平行样后均匀混合,并用自封袋进行封装后装入放有冰袋的冷藏箱,每条溪流样品采集后立即放入装有干冰的保温箱,运往实验室进行DNA提取,共采集25个沉积物样品。同时,每个采样点采集500 mL水样,用于水体理化指标测定。使用GPS现场测定各采样点的经纬度与海拔;使用多参数水质分析仪(YSI professional plus,美国维赛公司)现场测定各采样点的水温(WT)、溶解氧(DO)、电导率(EC)、pH;使用便携式多普勒超声波流量计(DX-LSX-2,北京信德元素)现场测定各采样点的水深(WD)、流速(FR);使用皮尺测量各采样点的溪流宽度(SW);使用手持荧光测定仪(Aquafluor,美国特纳公司)现场测定各采样点的叶绿素a(Chl.a)和浊度(FTU);使用总有机碳分析仪(TOC 2000,上海元析)测定水体总碳(TC)、总无机碳(TIC)、总有机碳(TOC)、溶解性有机碳(DOC);使用流动注射仪(iFIA7,北京吉天)测定水体总氮(TN)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、氨氮(NH3-N)、溶解态总氮(DTN)以及总磷(TP)、溶解性总磷(DTP),总无机氮(TIN)为NH3-N和NO3--N之和;使用离子色谱仪(CIC-D120,青岛盛瀚)测定水体硫酸根(SO42-);采用紫外分光光度法测定水体磷酸根(PO43-)。
1.3 DNA提取与高通量测序根据E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek,美国)使用说明书,进行微生物群落总DNA抽提,每个样品提取3个平行,在1%琼脂糖凝胶上测定DNA浓度和纯度[38]。使用引物524F10extF(5′-TGYCAGCCGCCGCGGTAA-3′)和Arch958RmodR(5′-YCCGGCGTTGAVTCCAATT-3′)扩增古菌群落16S rRNA基因的V4~V5区[39]。扩增后使用2%凝胶电泳,再通过可视化评估PCR产物的扩增子质量,然后使用QIAquick凝胶提取试剂盒(Qiagen,美国)纯化。使用定量荧光TM-ST(Promega,美国)对每个样品3个PCR进行合并和定量。参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega,美国)进行检测定量。通过PCR将Illumina官方接头序列添加至目标区域外端,使用凝胶回收试剂盒切胶回收PCR产物制备测序文库。采用Illumina公司的Miseq PE300平台进行高通量测序。
Miseq测序得到的PE reads首先根据overlap关系使用Flash软件进行拼接,同时使用Fastp软件对序列质量进行质控和过滤,使用Uparse软件,根据97%的相似度阈值对序列进行分类单元(OTU)聚类并剔除嵌合体。为了得到每个OTU对应的物种分类信息,基于Qiime平台(http://qiime.org/2000 mripts/assign_taxonomy.html)、Silva 16S rRNA数据库(Release138)采用RDP classifier贝叶斯算法(version 2.11, http://sourceforge.net/projects/rdp-classifier/),置信度阈值为0.7,对97%相似水平的OTU代表序列进行分类学分析,并分别在各个分类学水平:域、界、门、纲、目、科、属、种统计各样本的群落物种组成。
1.4 数据分析本研究中,各海拔溪流型小微湿地沉积物中古菌群落的稀释曲线均趋于平缓,表明当前测序深度几乎涵盖了样本中的所有物种(附图Ⅰ),具有统计意义。
基于美吉生物云平台(www.majorbio.com)和R(4.2.1)进行以下统计分析:coverage稀释曲线由云平台分析所得;使用“EasyStat”(https://github.com/taowenmicro/EasyStat)程序包对环境因子进行差异性检验及可视化;OTU水平上,Venn图显示各溪流沉积物中古菌群落OTU组成差异。门属水平上,使用堆叠柱形图对各样本中物种组成进行解析,获得各溪流沉积物中优势物种的组成及相对丰度变化;云平台分析得到Shannon、Simpson等α多样性指数后,使用“EasyStat”程序包(https://github.com/taowenmicro/EasyStat)对α多样性指数(Shannon、Simpsion)进行差异性检验及可视化;使用“vegan”包(https://cran.rstudio.com/bin/windows/Rtools/)分析α多样性与环境因子的相关性;OTU水平上,基于Bray-Curtis距离计算古菌群落的β多样性,并通过主坐标分析(PCoA)可视化不同溪流间古菌群落结构的分布,用999次排列的ANOSIM方法来评估每个采样点之间的群落相似性;属水平上,使用“vegan”程序包计算古菌群落间物种组成的相异度Bray-curtis距离指数与环境因子的差异性欧氏距离指数的关系[40];属水平上,采用冗余分析(RDA)分析环境因子与物种丰度间的关系;属水平上,使用方差分解分析(VPA)定量评估环境因子变量对微古菌群落的单独解释度和共同解释度。
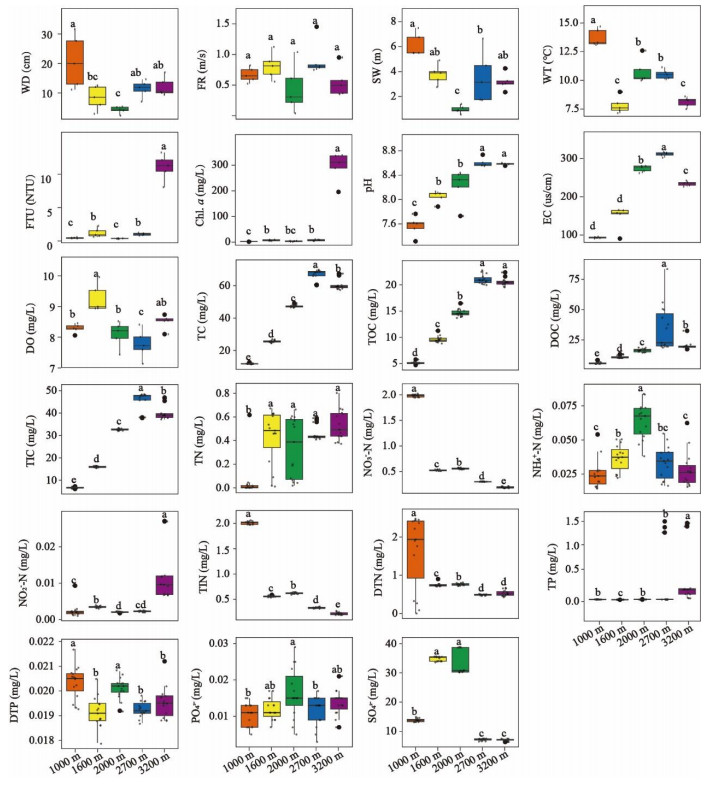
2 结果与讨论 2.1 岷江上游不同海拔溪流型小微湿地水文及水体理化因子的空间分布特征岷江上游海拔1000 m处溪流型小微湿地水深为11.15~31.7 cm,海拔2700 m处水深为7.05~14.65 cm,海拔3200 m处水深为9.39~13.65 cm,海拔1600 m处水深为2.90~12.55 cm,海拔2000 m处水深最浅(2.30~5.35 cm);5条溪流的流速(FR)在0.0385~1.4545 m/s之间,无显著差异;溪流宽度(SW)在海拔1000 m处最宽(5.50~6.75 m),随后是海拔1600 m(2.75~4.00 m)、2700 m(1.7~6.65 m)、3200 m(2.35~4.255 m)处,2000 m处最窄(0.55~1.40 m);上覆水水温沿海拔升高整体呈下降趋势(7.15~14.70 ℃),1600 m处水温较低是由于采样期间有小雨,其他海拔采样期间天气晴朗;浊度在海拔1000、1600、2000、2700 m处均较低,3200 m处较高,这与采样时的水体状况一致,3200 m处水较为浑浊(附图Ⅱ,附表Ⅱ)。
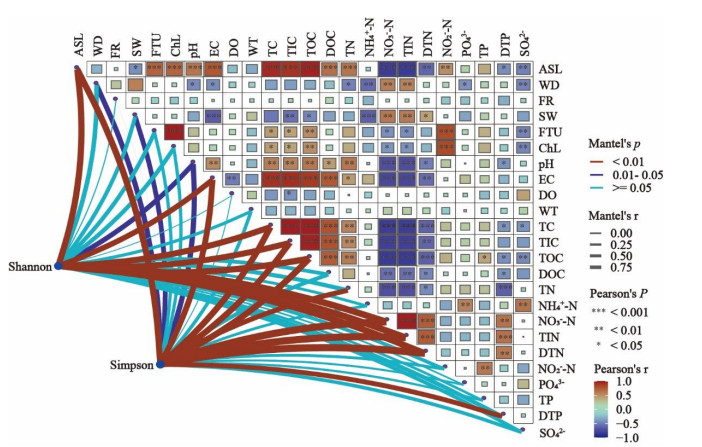
水体Chl.a浓度在海拔1000、1600、2000、2700 m处均较低,海拔3200 m处的检测值偏高可能是受浊度的影响;5条溪流pH由弱碱性过渡为碱性(7.315~8.735),电导率也逐渐增加(90.7~317.1 μS/cm),但海拔3200 m处电导率显著低于海拔2000、2700 m处,可能是由于海拔3200 m为放牧区,水体有机质浓度较高,离子浓度低;DO浓度总体上随海拔升高而降低,这与氧分压有关。微生物生源要素碳(TC、TOC、DOC、TIC)浓度总体上随海拔升高而升高;氮浓度中,TN变化不大,但NO3--N、TIN、DTN均随海拔升高而降低,而NH3-N(先升高再降低)与NO2--N(先降低再升高)变化相反;磷(PO43-、TP、DTP)浓度总体变化不大;SO42-浓度在海拔1600 m((34.8427±0.844) mg/L)、2000 m((33.7687±4.5407) mg/L)处较高,而海拔1000、2700及3200 m处均较低(附图Ⅱ,附表Ⅱ)。Pearson相关性分析显示,浊度、Chl.a、pH、EC、TC、TIC、TOC、DOC、TN、NO3--N、TIN等均与海拔具有极显著相关性(P<0.001),DTN、NO2--N、SO42-等与海拔具有显著相关性(P<0.01)(附图Ⅴ)。因此,随海拔的升高,古菌群落的生境具有显著差异性。
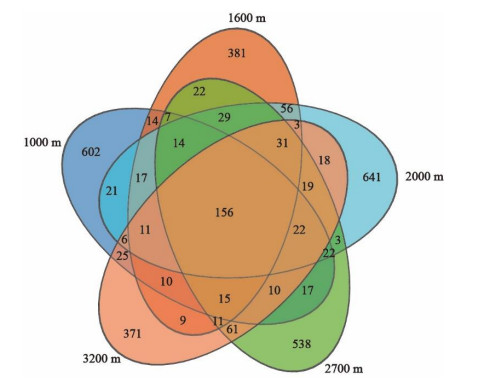
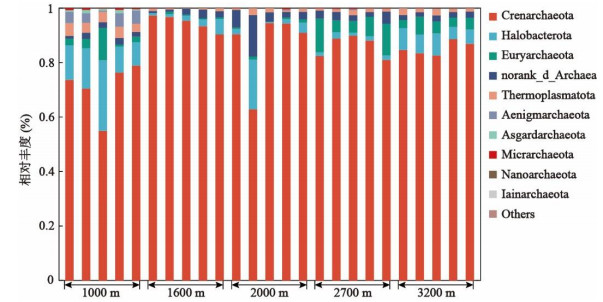
2.2 岷江上游溪流型小微湿地沉积物古菌群落组成岷江上游溪流型小微湿地沉积物中群落组成存在差异。Venn图显示,有156个OTU均存在于5条溪流中,海拔2000 m处特有OTU数量最多(641个),海拔1000 m处特有OTU有602个,海拔2700 m处有538个,而海拔1600与3200 m处特有OTU较少,分别为381与371个(附图Ⅲ)。门水平上,古菌群落优势菌为泉古菌门(Crenarchaeota)(相对丰度为54.92%~97.28%)(附图Ⅳ),在青藏高原多年冻土剖面古细菌群落中优势菌也是泉古菌门[41]。随海拔升高Crenarchaeota相对丰度具有先升高再降低的趋势,1000、3200 m处相对丰度较高的还有古细菌门(Halobacterota)(4.46%~25.96%),而2700 m处相对丰度较高的还有广古菌门(Euryarchaeota)(4.33%~12.40%)(附图Ⅳ)。可见,门水平上,岷江上游溪流型小微湿地沉积物古菌群落的组成具有一定的海拔演替规律。属水平上,古菌群落大多为与氮循环相关的菌(图 1),这与水体较浅的小微湖泊、池塘等湿地为亚硝化热点区域的研究结果相契合,小微湿地在氮元素的地球化学循环中发挥着重要作用[2, 42-43]。亚硝化古菌属(Nitrosarchaeum)在海拔1000 m处占主导地位,平均相对丰度为48.92%,其在海拔1600、2000、2700及3200 m处相对丰度较低;未分类的亚硝化球菌科(norank_f_Nitrososphaeraceae)在海拔1600、2000、2700及3200 m处占主导地位(平均相对丰度为56.62%~60.28%)(图 2),该菌对群落间相互关系的维持至关重要[44];土壤硝化菌(Candidatus_Nitrocosmicus)在海拔1600、2000、2700及3200 m处相对丰度较高(平均相对丰度为7.82%~20.04%),且随海拔升高相对丰度降低(图 1)。对于其他相对丰度超过5%物种,甲烷八叠球菌属(Methanosarcina)在海拔1000 m的平均相对丰度为9.79%,未分类的深海古菌(norank_c_Bathyarchaeia)在海拔1000和3200 m的平均相对丰度分别为7.86%和12.65%,亚硝化球形菌属(Candidatus_Nitrososphaera)在海拔1600和2700 m的平均相对丰度分别为8.76%和7.03%,未分类的古菌(norank_d_Archaea)在海拔2000 m中平均相对丰度为5.96%,随海拔升高其相对丰度总体上呈现出先升高再降低的趋势(图 1)。此外,在海拔2700 m处,从上游至下游甲烷短杆菌属(Methanobrevibacter)相对丰度升高(图 1)。从生态功能的角度看,群落组成的变化会改变群落功能[37]。因此推测,本研究中群落组成的变化是通过生态位互补来响应海拔梯度上的生境差异。
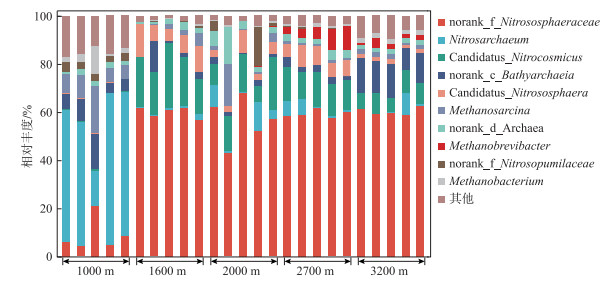
|
图 1 岷江上游溪流型小微湿地沉积物古菌属水平群落组成 Fig.1 Genus-level composition of archaeal communities in the small streams sediments of the upper Minjiang River |
本研究中,岷江上游溪流型小微湿地沉积物古菌群落α多样性随海拔升高而显著增加。具体表现为Shannon指数(2.08~3.44)随海拔升高而升高(图 2a);Simpson指数(值越小,α多样性越高)(0.06~0.39)随海拔升高而降低(图 2b)。这与前人对古菌群落α多样性海拔分布模式的研究结果一致[45-46]。对青藏高原高寒草原的研究表明,土壤微生物的功能多样性及与碳降解、氮循环、甲烷生成等有关的基因随着海拔的升高而增加[47]。而本研究中古菌群落α多样性也随海拔升高而显著增加,且古菌群落优势菌主要为硝化菌和亚硝化菌(图 1,图 2a)。因此,海拔梯度上岷江上游溪流型小微湿地温室气体N2O的排放值得深入研究。在山地生态系统的研究中古菌群落α多样性随海拔升高还呈现出单峰或“凹”模式[48-49],对农田生态系统的研究中古菌群落α多样性随海拔升高而降低[50]。由此可见,不同生态系统中由于生境的差异性古菌群落的α多样性海拔分布模式不同。Mantel相关性检验显示,岷江上游溪流型小微湿地沉积物中古菌群落多样性主要受海拔、电导率与营养物质碳氮的影响(P<0.001)(附图Ⅴ)。
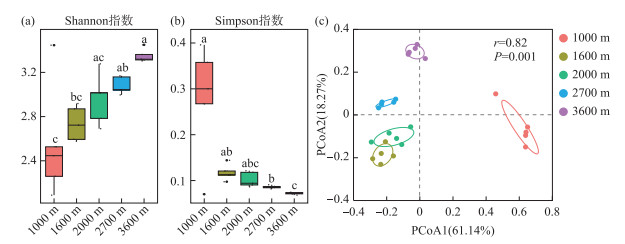
|
图 2 岷江上游溪流型小微湿地沉积物中古菌群落多样性:(a)Shannon指数; (b)Simpson指数; (c)β多样性(主坐标分析,PCoA) Fig.2 Diversity of archaeal communities in the small streams sediments of the upper Minjiang River: (a) Shannon index; (b) Simpson index; (c) β-diversity (principal co-ordinates analysis, PCoA) |
PCoA分析显示,岷江上游溪流型小微湿地沉积物中古菌群落沿海拔梯度分布。古菌群落的β多样性特征在排序轴上存在明显的分异(r=0.82,P=0.001),PC1上,海拔1000 m处的古菌群落与另外4个海拔处的古菌群落分布较远,PC2上,海拔1600、2000、2700、3200 m处的古菌群落从下至上分布(图 2c)。这表明岷江上游溪流型小微湿地沉积物中古菌群落β多样性在海拔梯度上差异显著,其中的驱动因素需更深入的分析探究。
2.4 海拔梯度上岷江上游溪流型小微湿地沉积物中古菌群落分布格局的驱动因素距离衰减分析显示,沉积物中古菌群落差异性随着海拔距离的增加显著升高(r=0.60,P=0.001)(图 3a),这表明古菌群落的时空分布极大地受到海拔的影响。同时,地理距离(r=0.45,P=0.001)和水体理化距离(r=0.41,P=0.001)与沉积物中古菌群落相似性也有较强的衰减关系,而水文距离(r=0.32,P=0.001)与沉积物中古菌群落差异性的相关性最低(图 3a)。海拔距离与古菌群落Bray-Curtis异质性的相关性高于地理距离,这可能是因为随海拔变化所改变的环境因素类型与数量较多,如两岸物质的输移与地质环境的差异[51]。海拔对古菌群落分布的影响主要是通过环境因子,如温度、pH、土壤有机质含量等的变化[52]。因此还需详细分析各环境因子对群落的影响。
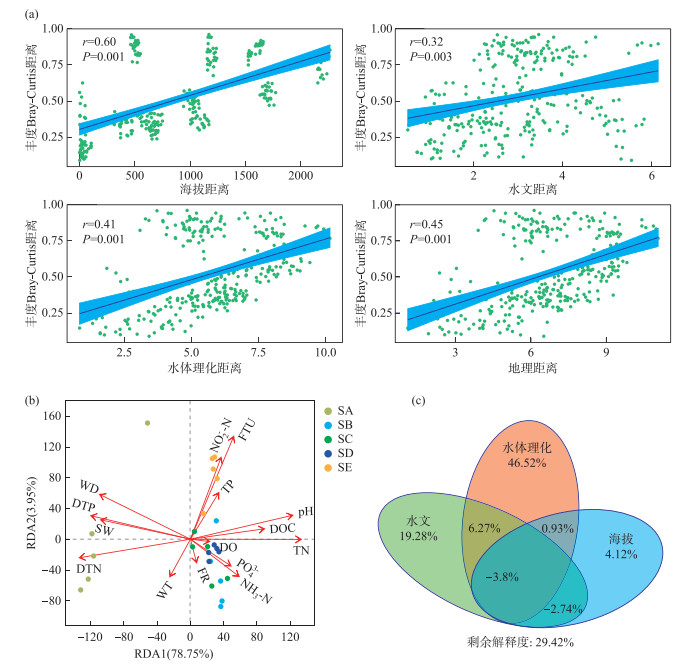
|
图 3 岷江上游溪流型小微湿地沉积物中古菌群落对环境因子变化的响应:(a)古菌群落Bray-Curtis异质性与环境因子(地理距离是海拔、水文及水体理化的综合距离)欧氏距离的衰减关系;(b)冗余分析(RDA);(c)方差分解分析(VPA) Fig.3 Response of archaeal communities to environmental factors in the small streams sediments of the upper Minjiang River: (a) The distance-decay relationship between Bray-Curtis heterogeneity of archaeal communities and Euclidean distance of environmental factors (geographic distance is a combination of elevation, hydrologic and water body physicochemical distances); (b) Redundancy analysis (RDA); (c) Variance partitioning analysis (VPA) |
RDA用于分析属水平上古菌群落与环境因子间的关系。由于许多环境因子间存在着较强的共线性,采用VIF分析过滤掉VIF值大于10的环境因子[53](附表Ⅲ)。RDA中,第1排序轴与第2排序轴对岷江上游溪流型小微湿地沉积物古菌群落结构的解释度分别为78.75%和3.95%(图 3b)。环境因子向量的长短代表其对于古菌群落影响的大小,FTU、DTN、TN、DTP、WD、pH、DOC等对古菌群落结构有显著影响(图 3b)。较高的浊度通常会提供更多的有机物质,如有机酸和蛋白质,这些有机物质为微生物参与生物地球化学循环提供碳源和能源[54]。各形态氮对群落结构的影响与群落组成相呼应,5条溪流的优势属大多为亚硝化菌和硝化菌(图 1),进一步印证了它们在氮循环中发挥了一定的作用。已有研究表明,磷的有效性可以显著改变微生物对碳和氮的获取[55],本研究中,TP与NO2--N具有显著正相关性,DTP与NO3--N、TIN、DTN有显著正相关性,PO43-与NH3-N呈显著正相关(附图Ⅴ),因此未来对微生物土壤养分利用的研究在考虑碳氮耦合的基础上可加强对磷元素的关注。pH通过调节酶活性影响微生物生长代谢的同时,也调节土壤中离子交换平衡,从而调节土壤养分的有效性,如影响土壤中硝酸盐和铵根离子的平衡,进而影响细菌群落组成[56]。综上,浊度、pH及碳氮(如DOC、DTN、TN等)等是驱动岷江上游溪流型小微湿地沉积物中古菌群落分布格局的重要环境因素。VPA可用于定量评估多组(2~4组)环境因子变量对响应变量(如微生物群落差异)的单独解释度和共同解释度。本研究将环境因子分为3组:海拔、水文(WT、FTU、WD、FR、SW)和水体理化(pH、EC、DO、Chl.a、TC、TIC、TOC、DOC、TN、NH3-N、NO3--N、TIN、DTN、NO2--N、PO43-、TP、DTP、SO42-),以量化不同类型因子对古菌群落结构的影响,分析中使用VIF值小于10的环境因子(附表Ⅲ)。结果表明,29.42%的群落变化不能被以上因子所解释(图 3c),这说明岷江上游溪流型小微湿地沉积物中古菌的空间格局还受到其他因素影响。其中,对群落结构解释率最高的是水体理化,解释了46.52%的群落差异,其次是水文(19.28%)、海拔(4.12%)(图 3c)。此外,海拔对群落结构的驱动往往与其他环境因素相互作用,这导致了VPA分析中海拔对古菌群落结构的单独解释能力较低。而距离衰减分析中更注重分析对象的差异性,海拔作为一个空间因素距离明显,因此对古菌群落差异显示出更为直接的影响。
3 结论本研究将16S rRNA基因高通量测序技术与生物信息手段结合,分析了岷江上游溪流型小微湿地古菌群落的海拔分布格局及影响因素。沉积物中古菌群落主要为硝化、亚硝化相关的菌。随海拔升高,群落组成差异显著,古菌群落α多样性与群落相异性均升高。溶解性总氮、总氮、溶解性总磷及pH是影响古菌群落结构的主要水体理化因素,浊度和水深是影响古菌群落结构的主要水文因素。本研究结果不仅有助于了解局部小微湿地海拔尺度上的古菌群落分布格局,也为揭示湿地微生物的海拔分布格局提供了科学依据。
4 附录附图Ⅰ~Ⅴ和附表Ⅰ~Ⅲ见电子版(DOI: 10.18307/2024.0536)。
|
附图Ⅰ 岷江上游溪流型小微湿地沉积物中古菌群落稀释曲线 AttachedFigI Dilution curves of archaeal communities in the small streams sediments of the upper Minjiang River |
|
附图Ⅱ 岷江上游溪流型小微湿地水文与水体理化信息 AttachedFigII Hydrological and physicochemical information of the small streams of the upper Minjiang River |
|
附图Ⅲ 岷江上游溪流型小微湿地沉积物中古菌群落OTU水平Venn图 AttachedFigIII OTU level Venn plot of archaeal communities in the small streams sediments of the upper Minjiang River |
|
附图Ⅳ 岷江上游溪流型小微湿地沉积物中古菌群落门水平相对丰度 AttachedFigIV Relative abundance of archaeal community phylum levels in the small streams sediments of the upper Minjiang River |
|
附图Ⅴ 岷江上游溪流型小微湿地沉积物中古菌群落α多样性与环境因子间的Mantel相关性检验 AttachedFigV Mantel correlation test between α-diversity of archaeal communities and environmental factors in the small streams sediments of the upper Minjiang River |
| 附表Ⅰ 岷江上游溪流型小微湿地采样点位置 Appendix Ⅰ Location of sampling sites for small streams in the upper Minjiang River |
| 附表Ⅱ 岷江上游溪流型小微湿地水文与水体理化 Appendix Ⅱ Hydrology and water physicochemistry of small streams in the upper Minjiang River |
| 附表Ⅲ 筛选后的环境因子VIF值(去除VIF大于10的环境因子) Appendix Ⅲ Screened environmental factor VIF values (removing environmental factors with a VIF greater than 10) |
| [1] |
Cui LJ, Lei YR, Zhang MY et al. Review on small wetlands: Definition,typology and ecological services. Acta Ecologica Sinica, 2021, 41(5): 2077-2085. [崔丽娟, 雷茵茹, 张曼胤等. 小微湿地研究综述: 定义、类型及生态系统服务. 生态学报, 2021, 41(5): 2077-2085. DOI:10.5846/stxb202003260699] |
| [2] |
He YX, Jiang HB, Zhang YC et al. Bibliometric analysis of micro-wetlands based on CiteSpace. Acta Ecologica Sinica, 2022, 42(13): 5516-5530. [何奕忻, 蒋海波, 张运春等. 基于CiteSpace的小微湿地文献计量分析. 生态学报, 2022, 42(13): 5516-5530. DOI:10.5846/stxb202106251695] |
| [3] |
Hu M, Jiang QB, Gao L et al. Ecological restoration of small and micro wetlands in mountainous areas: A case study of terrace pond micro wetland in Lieshen Village of Liangping District. Ecology and Environmental Monitoring of Three Gorges, 2021, 6(1): 46-52. [胡敏, 蒋启波, 高磊等. 山地小微湿地生态修复探讨——以梁平区猎神村梯塘小微湿地为例. 三峡生态环境监测, 2021, 6(1): 46-52.] |
| [4] |
Cohen MJ, Creed IF, Alexander L et al. Do geographically isolated wetlands influence landscape functions?. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(8): 1978-1986. DOI:10.1073/pnas.1512650113 |
| [5] |
Downing JA. Emerging global role of small lakes and ponds: Little things mean a lot. Limnetica, 2010, 29(1): 9-24. DOI:10.23818/limn.29.02 |
| [6] |
Yuan ZX, Li ZH, Jiang QB et al. An oerview and research proress of the vemal pool ecosvstem. Acta Ecoogica Sinica, 2023, 43(13): 5235-5250. [袁兴中, 李祖慧, 蒋启波等. 春沼生态系统概述及其研究进展. 生态学报, 2023, 43(13): 5235-5250. DOI:10.5846/stxb202206051586] |
| [7] |
Liu P, He YX, Zhong B et al. Effects of urbanization on plankton community structure in small and micro wetlands. Chin J Appl Environ Biol, 2023, 29(6): 1346-1355. [刘鹏, 何奕忻, 仲波等. 城市化对小微湿地浮游生物群落结构的影响. 应用与环境生物学报, 2023, 29(6): 1346-1355.] |
| [8] |
Ling Y, Zou YH, Zhu T et al. Distribution, quantity and areas of small and micro wetlands in Yantai city in 2009, 2015 and 2020. Wetland Science, 2022, 20(4): 548-553. [凌越, 邹雨函, 朱涛等. 2009年、2015年和2020年烟台市小微湿地的分布、数量和面积. 湿地科学, 2022, 20(4): 548-553.] |
| [9] |
Nicolet P, Biggs J, Fox G et al. The wetland plant and macroinvertebrate assemblages of temporary ponds in England and Wales. Biological Conservation, 2004, 120(2): 261-278. DOI:10.1016/j.biocon.2004.03.010 |
| [10] |
Sinnathamby S, Minucci JM, Denton DL et al. A sensitivity analysis of pesticide concentrations in California Central Valley vernal pools. Environmental Pollution, 2020, 257: 113486. DOI:10.1016/j.envpol.2019.113486 |
| [11] |
Gibbs JP. Importance of small wetlands for the persistence of local populations of wetland-associated animals. Wetlands, 1993, 13(1): 25-31. DOI:10.1007/BF03160862 |
| [12] |
Semlitsch RD, Bodie JR. Are small, isolated wetlands expendable?. Conservation Biology, 1998, 12(5): 1129-1133. DOI:10.1046/j.1523-1739.1998.98166.x |
| [13] |
Richardson SJ, Clayton R, Rance BD et al. Small wetlands are critical for safeguarding rare and threatened plant species. Applied Vegetation Science, 2015, 18(2): 230-241. DOI:10.1111/avsc.12144 |
| [14] |
Li HB, Zeng J, Ren LJ et al. Contrasting patterns of diversity of abundant and rare bacterioplankton in freshwater lakes along an elevation gradient. Limnology and Oceanography, 2017, 62(4): 1570-1585. DOI:10.1002/lno.10518 |
| [15] |
Peng C, Li PP. Abiotic and biotic effects on microbial diversity of small water bodies in and around towns. Sustainability, 2023, 15(10): 8151. DOI:10.3390/su15108151 |
| [16] |
Bastidas NM. Large differences in bacterial community composition of nearby shallow lakes surrounded by Nothofagus pumilio forest in Patagonia (Argentina). Journal of Plankton Research, 2022, 44(3): 350-364. DOI:10.1093/plankt/fbac018 |
| [17] |
Tian JQ, Zhu D, Wang JZ et al. Environmental factors driving fungal distribution in freshwater lake sediments across the headwater region of the Yellow River, China. Scientific Reports, 2018, 8: 3768. DOI:10.1038/s41598-018-21995-6 |
| [18] |
Loewen CJG, Jackson DA, Gilbert B. Biodiversity patterns diverge along geographic temperature gradients. Global Change Biology, 2023, 29(3): 603-617. DOI:10.1111/gcb.16457 |
| [19] |
Yi YJ, Lin CQ, Wang WJ et al. Habitat and seasonal variations in bacterial community structure and diversity in sediments of a shallow lake. Ecological Indicators, 2021, 120: 106959. DOI:10.1016/j.ecolind.2020.106959 |
| [20] |
Freiry RF, Pires MM, Gouvea A et al. Ecological correlates of the alpha and beta diversity of zooplankton hatchling communities in seasonal subtropical ponds. Ecological Research, 2021, 36(3): 464-477. DOI:10.1111/1440-1703.12213 |
| [21] |
Čačković A, Kajan K, Selak L等. Hydrochemical and seasonally conditioned changes of microbial communities in the tufa-forming freshwater network ecosystem. mSphere, 2023, 8(3): e0060222. DOI:10.1128/msphere.00602-22 |
| [22] |
Liu BR, Wang YC, Zhang HG et al. The variations of microbial diversity and community structure along different stream orders in Wuyi Mountains. Microbial Ecology, 2023, 86(4): 2330-2343. DOI:10.1007/s00248-023-02240-8 |
| [23] |
Bier RL, Mosher JJ, Kaplan LA et al. Spatial scale impacts microbial community composition and distribution within and across stream ecosystems in north and central America. Environmental Microbiology, 2023, 25(10): 1860-1874. DOI:10.1111/1462-2920.16396 |
| [24] |
Xiang QS, Zhang DS, Sun K et al. Analysis of soil microbial community structure and diversity in Berberis vernae habitat at different altitudes in alpine region. Acta Botanica Boreali-Occidentalia Sinica, 2021, 41(6): 1036-1050. [向前胜, 张登山, 孙奎等. 高寒地区不同海拔梯度西北小檗生境土壤微生物群落结构及多样性分析. 西北植物学报, 2021, 41(6): 1036-1050. DOI:10.7606/j.issn.1000-4025.2021.06.1036] |
| [25] |
Wang SJ, Chen YP, Chen F et al. Responses of radial growth of Pinus yunnanensis to climatic and hydrological factors at different altitudes in Western Yunnan, China. Chinese Journal of Applied Ecology, 2021, 32(10): 3557-3566. [王世杰, 陈友平, 陈峰等. 滇西不同海拔云南松径向生长对气候水文要素的响应. 应用生态学报, 2021, 32(10): 3557-3566. DOI:10.13287/j.1001-9332.202110.016] |
| [26] |
Werry LP, Bundschuh M, Mitrovic SM et al. Leaf litter breakdown along an elevational gradient in Australian alpine streams. Ecology and Evolution, 2022, 12(10): e9433. DOI:10.1002/ece3.9433 |
| [27] |
Liu JW, Zhao WQ, Ren ML et al. Contrasting elevational patterns and underlying drivers of stream bacteria and fungi at the regional scale on the Tibetan Plateau. FEMS Microbiology Ecology, 2022, 98(6): fiac050. DOI:10.1093/femsec/fiac050 |
| [28] |
Guo ZX, Su R, Zeng J et al. NosZI microbial community determined the potential of denitrification and nitrous oxide emission in river sediments of Qinghai-Tibetan Plateau. Environmental Research, 2022, 214(4): 114138. DOI:10.1016/j.envres.2022.114138 |
| [29] |
Picazo F, Vilmi A, Aalto J et al. Climate mediates continental scale patterns of stream microbial functional diversity. Microbiome, 2020, 8(1): 92. DOI:10.1186/s40168-020-00873-2 |
| [30] |
Liu KS, Yao TD, Liu YQ et al. Elevational patterns of abundant and rare bacterial diversity and composition in mountain streams in the southeast of the Tibetan Plateau. Science China Earth Sciences, 2019, 62(5): 853-862. DOI:10.1007/s11430-018-9316-6 |
| [31] |
Li MJ, Wu KY, Meng FF et al. Beta diversity of stream bacteria in Hengduan Mountains: The effects of climatic and environmental variables. Biodiversity Science, 2020, 28(12): 1570-1580. [李明家, 吴凯媛, 孟凡凡等. 西藏横断山区溪流细菌beta多样性组分对气候和水体环境的响应. 生物多样性, 2020, 28(12): 1570-1580. DOI:10.17520/biods.2019390] |
| [32] |
Wang JJ, Legendre P, Soininen J et al. Temperature drives local contributions to beta diversity in mountain streams: Stochastic and deterministic processes. Global Ecology and Biogeography, 2020, 29(3): 420-432. DOI:10.1111/geb.13035 |
| [33] |
van Wolferen M, Pulschen AA, Baum B et al. The cell biology of archaea. Nature Microbiology, 2022, 7: 1744-1755. DOI:10.1038/s41564-022-01215-8 |
| [34] |
Xing YK, Liu J, Wang W et al. Longitudinal profile analysis of rivers draining edges of the Tibetan Plateau and its geomorphology implications. Geological Bulletin of China, 2023, 42(1): 107-121. [邢宇堃, 刘静, 王伟等. 青藏高原周缘的河流纵剖面特征及其对构造地貌演化的启示. 地质通报, 2023, 42(1): 107-121. DOI:10.12097/j.issn.1671-2552.2023.01.010] |
| [35] |
Gao ZY, Shi YX, Mao ZG et al. Current hot topics and advances of fluvial sedimentology: A summary from 11th international conference on fluvial sedimentology. Acta Sedimentologica Sinica, 2017, 35(6): 1097-1109. [高志勇, 石雨昕, 毛治国等. 河流沉积学研究热点与进展——第11届国际河流沉积学大会综述. 沉积学报, 2017, 35(6): 1097-1109.] |
| [36] |
秦嘉励. 岷江上游不同土地利用方式下土壤生态系统服务价值评估研究[学位论文]. 成都: 四川农业大学, 2009.
|
| [37] |
Chen YY, Xia WY, Zhao H et al. Effects of deep vertical rotary tillage on soil enzyme activity, microbial community structure and functional diversity of cultivated land. Acta Ecologica Sinica, 2022, 42(12): 5009-5021. [陈彦云, 夏皖豫, 赵辉等. 粉垄耕作对耕地土壤酶活性、微生物群落结构和功能多样性的影响. 生态学报, 2022, 42(12): 5009-5021. DOI:10.5846/stxb202106241676] |
| [38] |
Li J, Zhang XF, Zhang HW et al. Effects of salt stress on bacterial community composition and diversity in rhizosphere soil of Bletilla striata. Chinese Journal of Applied Ecology, 2024, 35(1): 219-228. [李菁, 张小飞, 张惠雯等. 盐胁迫对白及根际细菌群落组成及多样性的影响. 应用生态学报, 2024, 35(1): 219-228. DOI:10.13287/j.1001-9332.202401.010] |
| [39] |
Liu C, Li H, Zhang YY et al. Evolution of microbial community along with increasing solid concentration during high-solids anaerobic digestion of sewage sludge. Bioresource Technology, 2016, 216: 87-94. DOI:10.1016/j.biortech.2016.05.048 |
| [40] |
Dixon P. VEGAN, a package of R functions for community ecology. Journal of Vegetation Science, 2003, 14(6): 927. DOI:10.1658/1100-9233(2003)014[0927:vaporf]2.0.co;2 |
| [41] |
Wei SP, Cui HP, He H et al. Diversity and distribution of Archaea community along a stratigraphic permafrost profile from Qinghai-Tibetan Plateau, China. Archaea, 2014, 2014: 240817. DOI:10.1155/2014/240817 |
| [42] |
Wray HE, Bayley SE. Denitrification rates in marsh fringes and fens in two boreal peatlands in Alberta, Canada. Wetlands, 2007, 27(4): 1036-1045. DOI:10.1672/0277-5212(2007)27[1036:DRIMFA]2.0.CO;2 |
| [43] |
Capps KA, Rancatti R, Tomczyk N et al. Biogeochemical hotspots in forested landscapes: The role of vernal pools in denitrification and organic matter processing. Ecosystems, 2014, 17(8): 1455-1468. DOI:10.1007/s10021-014-9807-z |
| [44] |
Cheng YY, Jin ZJ, Yuan W et al. Archaeal and bacterial communities co-occurrence pattern in Huixian Karst wetland. Journal of Guilin University of Technology, 2021, 41(1): 183-192. [程跃扬, 靳振江, 袁武等. 会仙岩溶湿地古菌和细菌群落的共现性. 桂林理工大学学报, 2021, 41(1): 183-192. DOI:10.3969/j.issn.1674-9057.2021.01.023] |
| [45] |
Guerra CA, Berdugo M, Eldridge DJ et al. Global hotspots for soil nature conservation. Nature, 2022, 610: 693-698. DOI:10.1038/s41586-022-05292-x |
| [46] |
Duan YL, Lian J, Wang LL et al. Variation in soil microbial communities along an elevational gradient in alpine meadows of the Qilian Mountains, China. Frontiers in Microbiology, 2021, 12: 684386. DOI:10.3389/fmicb.2021.684386 |
| [47] |
Qi Q, Zhao MX, Wang SP et al. The biogeographic pattern of microbial functional genes along an altitudinal gradient of the Tibetan pasture. Frontiers in Microbiology, 2017, 8: 976. DOI:10.3389/fmicb.2017.00976 |
| [48] |
Singh D, Takahashi K, Adams JM. Elevational patterns in archaeal diversity on Mt. Fuji. PLoS One, 2012, 7(9): e44494. DOI:10.1371/journal.pone.0044494 |
| [49] |
Wu ZF, Shi YW, Lou K et al. Archaeal diversity along vertical natural belt in the northern slope of Tianshain Mountain. Xinjiang Agricultural Sciences, 2012, 49(3): 488-495. [吴尊凤, 史应武, 娄恺等. 天山北坡垂直自然带土壤古菌多样性分析. 新疆农业科学, 2012, 49(3): 488-495. DOI:10.6048/j.issn.1001-4330.2012.03.014] |
| [50] |
Zhang Q, Li Y, Xing JJ et al. Soil available phosphorus content drives the spatial distribution of archaeal communities along elevation in acidic terrace paddy soils. Science of the Total Environment, 2019, 658: 723-731. DOI:10.1016/j.scitotenv.2018.12.144 |
| [51] |
Wang XF, Yuan XZ, Chen H et al. Review of CO2 and CH4 emissions from rivers. Enviromental Science, 2017, 38(12): 5352-5366. [王晓锋, 袁兴中, 陈槐等. 河流CO2与CH4排放研究进展. 环境科学, 2017, 38(12): 5352-5366. DOI:10.13227/j.hjkx.201701049] |
| [52] |
Soininen J, McDonald R, Hillebrand H. The distance decay of similarity in ecological communities. Ecography, 2007, 30(1): 3-12. DOI:10.1111/j.2006.0906-7590.04817.x |
| [53] |
Zhu ZJ, Chen M, Xue SM et al. Nitrogen and phosphorusas major factors shaping microbial community structures in surface sediments in Xiangxi River, Three Gorges Reservoir. J Lake Sci, 2023, 35(2): 473-486. [朱智杰, 陈默, 薛思敏等. 氮和磷是影响三峡库区香溪河表层沉积物中微生物群落结构的主要因素. 湖泊科学, 2023, 35(2): 473-486. DOI:10.18307/2023.0208] |
| [54] |
Roussel EG, Sauvadet AL, Allard J et al. Archaeal methane cycling communities associated with gassy subsurface sediments of Marennes-Oléron bay (France). Geomicrobiology Journal, 2009, 26(1): 31-43. DOI:10.1080/01490450802599284 |
| [55] |
Qin WK, Feng JG, Zhang QF et al. Nitrogen and phosphorus addition mediate soil priming effects via affecting microbial stoichiometric balance in an alpine meadow. Science of the Total Environment, 2024, 908: 168350. DOI:10.1016/j.scitotenv.2023.168350 |
| [56] |
Wang Z, Liu Y, Wang F. Spatial patterns of soil bacterial communities and n-cycling functional groups along an elevation gradient in Datong River Basin. Environmental Scienc, 2024, 45(6): 3614-3626. [王竹, 刘扬, 王芳. 大通河流域土壤细菌及氮循环功能菌群沿海拔的空间分布. 环境科学, 2024, 45(6): 3614-3626. DOI:10.13227/j.hjkx.202307161] |
 2024, Vol. 36
2024, Vol. 36 


