(2: 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院大学, 北京 100049)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
磷(P)是湖泊生态系统中物质循环的重要生源要素,其形态及含量对湖泊生态系统中微生物、藻类和植物等生物的群落结构和新陈代谢活动有显著影响,是整个湖泊生态系统中的基础和关键[1-2]。水环境中磷主要包括无机磷和有机磷两大类,以溶解态或颗粒态形式存在。无机还原态磷(inorganic reduced phosphorus, IRP)是指氧化态低于+Ⅴ的无机磷[3],主要包括亚磷酸盐(phosphite, P+Ⅲ)、次磷酸盐(hypophosphite, P+Ⅰ)和磷化氢(phosphine, P-Ⅲ)。P-Ⅲ是自然界中磷循环的重要物质形态和气相载体,通常以气体自由态磷化氢(FGP, free gaseous phosphine)和基质结合态磷化氢(MBP, matrix bound phosphine)的形式广泛存在于水体上空、水体和沉积物中[4-6]。P+Ⅲ则是IRP中价态最高的磷形态,也是P-Ⅲ和P+Ⅴ相互转化过程的重要中间体[7]。在天然水体中,P+Ⅲ浓度通常在μmol/L级别[8],但其浓度仅次于正磷酸盐(phosphate, P+Ⅴ),最高时可占到水环境中总可溶性磷(TDP)的33%[9]。P+Ⅰ易溶于热水、乙醇、乙醚,可溶于冷水,性质活泼,受热易分解为P-Ⅲ和P+Ⅴ[10]。当前,IRP在水环境中被广泛检出,且被证实是构成磷氧化还原循环的关键环节,并在维持生态系统平衡和元素循环等方面具有重要作用。然而,长期以来受限于理论和分析方法的不足,迄今为止对IRP的研究十分薄弱。
1.2 IRP参与的水环境生物地球化学循环水生态系统中IRP主导的磷氧化还原循环是调控全球生态体系中磷循环以及影响气候变化的重要因素,也是全球生态系统生存和演化的重要驱动力[11]。如图 1所示,外源IRP通过大气沉降、地表径流及污染输入等途径进入水体,然后在沉积物、水体和生物体间进行迁移和转化[12-14]。水体中的IRP可以通过沉积物颗粒的吸附作用向沉积物迁移[15],也可被生物吸收存储在体内,并通过食物链传递、水生动物的排泄、水生动植物的衰亡分解等途径重新释放到水环境。沉积物中的IRP部分会被氧化成生物可以直接利用的P+Ⅴ形式,另外一部分则转化为P-Ⅲ的形式,释放到上层水体或者进入大气环境中[16]。据统计,每年约有4万t P-Ⅲ被释放到大气中,在紫外线和氧气的条件下,大部分的P-Ⅲ会被氧化成P+Ⅰ、P+Ⅲ、P+Ⅴ的形式,沉积在云或雨水中,最终通过大气干、湿沉降重新返回湖泊或陆地[6]。
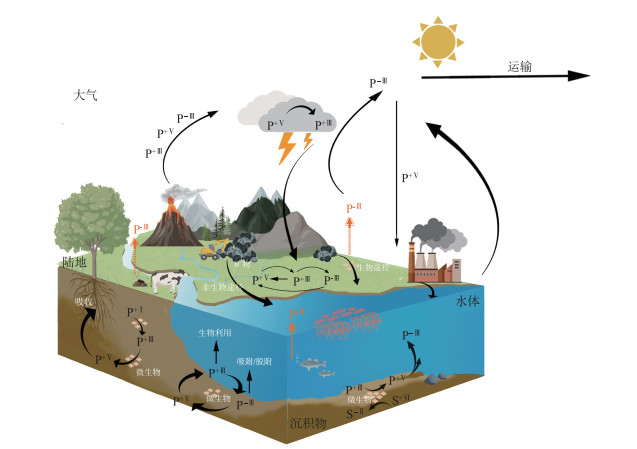
|
图 1 水生态系统中IRP参与的磷循环过程 Fig.1 The cycle of inorganic reduced phosphorus in aquatic ecosystems |
迄今为止,国内外学者已经在厌氧还原性的水体、湖泊和海洋沉积物等环境中广泛检测到了IRP的存在[17-19],这些水环境中的IRP主要来源于自然和人为两种途径。其中,自然来源的IRP主要源自沉积物中惰性含磷物质(如磷灰石、磷铁矿石和有机磷等)的转化反应[20]。此外,光化学反应、宇宙坠落(陨星和宇宙尘埃)、金属腐蚀、闪电、火山爆发、微生物活动等也被认为是IRP的重要来源[21]。而人为来源的IRP主要由农业生产[22]、工业生产[23]以及稻田耕作、堆肥过程、垃圾填埋等人类活动产生[10],这些IRP通过大气沉降、径流、排放等方式进入水环境中。
关于IRP的产生机制,学术界早有研究,但至今仍存在诸多争议。Tsubota等[24]认为IRP是通过微生物厌氧还原作用产生的,并成功从土壤中分离出能将P+Ⅴ还原成IRP的磷酸盐还原菌。但该观点引起了不少质疑,Roels和Verstraete[25]从热力学角度解释P+Ⅴ还原是无法自主实现的,只有在强还原剂的辅助下才能实现这一过程,并推测IRP主要是由有机物厌氧发酵过程释放的酸性物质与含磷化合物反应间接产生或者是含有C-P键的有机磷化合物厌氧分解释放直接产生。此外,一些学者研究指出P+Ⅴ还原需要特定的酶和微生物的参与,如碱性磷酸酶活性与MBP产量呈显著正相关[26];脱氢酶活性与P+Ⅴ还原高度正相关[27];在厌氧条件下,甲酸脱氢酶可能是P+I生成P-Ⅲ的催化剂[28]。
同样,也有学者认为IRP的产生主要与含磷矿物在厌氧条件下非生物化学反应密切相关,如电化学腐蚀生成机理[25]、火花放电的化学还原过程[16]、P+Ⅲ的歧化反应[29]以及地球化学和宇宙化学还原机制等[30]。尽管IRP产生机制尚未明确,但厌氧还原环境被普遍认为是IRP产生和释放最有利的环境因素,据报道,富营养化湖泊(高磷、厌氧、硫酸盐/二氧化碳缺乏)是磷还原的极佳场所[14]。
2 水环境中IRP的检测方法与分布 2.1 IRP的检测方法除传统磷循环理论“缺失”外,环境中IRP具有强还原性、浓度低和难分离等特性,这使得当前普遍采用的磷检测方法难以对各形态IRP进行精确表征。而明确湖泊IRP形态组成进而对其定量分析是深化IRP相关研究的重要前提。目前IRP的分析方法主要分为3种(表 1)。(1)化学检测法:如碘量法[31]、氧化法[32]等,虽然此类方法适用于多数实验室且成本较低,但是操作过程相对复杂、耗时长、检测限高,无法满足对天然水体中IRP的检测要求。(2)精密仪器检测法:如离子色谱(IC)[33]、高效液相色谱(HPLC)[34]、核磁共振(NMR)[35]等,此类方法普遍具有高灵敏度、高选择性的优点,但仪器成本高昂、对样品的前处理较复杂。(3)原位传感器技术:如间隙水扩散平衡技术(Peeper)、薄膜扩散平衡技术(DET)和薄膜梯度扩散技术(DGT)[36]等,此类方法突破了传统的样品异位收集、保存和前处理等流程所造成的样品污染限制,实现了实时、高分辨率监测,是水环境中IRP监测领域未来发展的重点方向。
| 表 1 环境中IRP检测方法 Tab. 1 Detection method of inorganic reduced phosphorus in environment |
IRP在现代地球环境中分布广泛且具有高度的代表性,如图 2所示[6, 11, 14, 19, 34, 43-58]。在众多IRP形态中,P-Ⅲ和P+Ⅲ尤为关注,目前已在稻田[59-61]、湖泊[50-51, 62]、沼泽[4, 59, 63]、沉积物[49, 52, 56, 62]和海洋[47, 53-63]等多种水环境介质中成功检测出来。
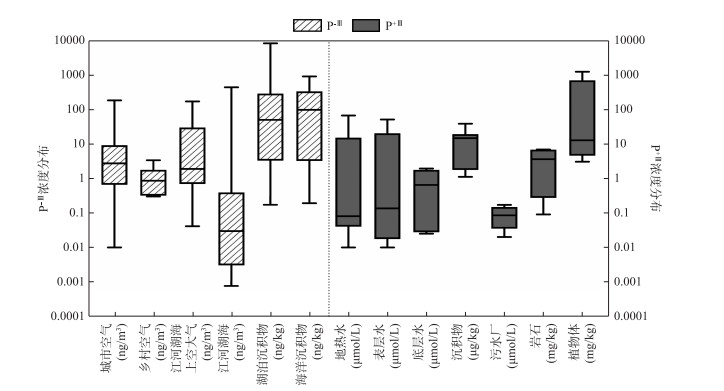
|
图 2 典型IRP在自然界中的分布情况 Fig.2 Distribution of inorganic reduced phosphorus in the natural environment |
(1) 水上空IRP的空间分布规律
P-Ⅲ是磷循环的气相载体,P-Ⅲ的空间分布随着区域环境的不同存在显著差异,主要有3个特点:(1)水域环境(水稻田、水库、海洋等)上空气态P-Ⅲ浓度(0~900 ng/m3)显著高于陆地环境(城市、乡村等)上空气态P-Ⅲ浓度(0.04~2.03 ng/m3)(P < 0.01)[19, 29, 34, 43, 47, 55-63]。(2)人工扰动环境下P-Ⅲ浓度普遍高于自然环境,即在海洋、水稻田、沼泽、湖泊、海滨湿地等不同水体上空的P-Ⅲ浓度依次呈现出降低的趋势[21, 55, 59-60]。(3)近岸海洋大气上空P-Ⅲ浓度通常高于远岸区域,这可能与许多因素的联合作用有关[29, 45, 56, 64]:①近岸区域易受到工业污染排放影响; ②人类活动的影响; ③陆地上空的P-Ⅲ通过风的水平输送到海洋上空; ④水体中微生物的活动以及沉积物的释放。
(2) 水中IRP的空间分布规律
天然水中可被检测到的IRP浓度通常在μmol/L级别,但最高可占水中总可溶性磷(TDP)的50 %,甚至超过水中P+Ⅴ浓度[12, 65]。P-Ⅲ主要以基质结合态的形式吸附于水体颗粒物中,存在于水域中的溶解自由态P-Ⅲ浓度较低且在水中分布均匀[62];而P+Ⅲ表现出随着深度的增加,氧化还原电位不断降低,其浓度在水中有明显的垂直上升特征,即底层水 < 上覆水 < 表层底泥间隙水 < 深层底泥间隙水,这一特征表明上层水中P+Ⅲ浓度可由下层水通过浓度梯度扩散作用控制[12]。
(3) 沉积物中IRP的空间分布规律
沉积物中磷的释放是湖泊水体中磷的重要来源之一,而厌氧环境的沉积物被认为是IRP的重要来源[6, 14, 66],海洋沉积物中P-Ⅲ含量通常高于淡水沉积物(图 2)。其中,海洋沉积物中的P-Ⅲ含量表现出以下特征:海洋底层沉积物中P-Ⅲ含量通常高于表层沉积物,这可能与海洋中的生物活动丰富、沉积物组成复杂、营养盐输入途径多样有关[29, 47];近岸沉积物中的P-Ⅲ含量较高,在近海养殖区沉积物中P-Ⅲ含量高达685 ng/kg[56, 66];入海口上游沉积物的P-Ⅲ含量要高于下游[29, 67]。而淡水沉积物中的IRP含量往往与样品的污染程度呈正比,如富营养化严重的北太湖地区P+Ⅲ含量((2.60±6.86) μg/kg)是水质良好的中部((0.28±0.26) μg/kg)和南部((0.38±0.63) μg/kg)区域的10倍[11]。因此,IRP浓度与沉积环境和与沉积物的受污染程度有关。
事实上,IRP含量与沉积物中的总磷、有机磷、无机磷有正相关性[49, 64, 66];有机质含量高的沉积物能促进微生物对IRP的转化和释放[68];粒径较细的沉积物能吸附更多的IRP;而较低的氧化还原电位有利于P-Ⅲ的产生[69];水体剧烈的扰动会导致沉积物中IRP的释放和被氧化,从而使沉积物中IRP含量较低[70]。
因此,沉积物中IRP含量受沉积物内在性质和外部环境条件共同控制,其中,沉积物内在性质包括磷含量、有机质含量、粒径、氧化还原电位、pH等,而外部环境条件包括沉积环境、污染程度、水动力学特征等因素[71-73]。
2.2.2 IRP的时间分布规律(1) 水上空IRP的时间分布规律
水上空IRP浓度随温度表现出明显的季节变化特征:夏季水环境上空中P-Ⅲ浓度普遍高于冬、春季[21],是因为高温环境促进了微生物的生长、活动,使得水体和沉积物中的IRP大量转化为气态的P-Ⅲ[74]。在光照的影响下,IRP浓度表现出明显的日变化特征:白天水体上空P-Ⅲ浓度显著低于夜晚[19, 75],并在中午前后达到最低,这是由于白天太阳光中的紫外线诱导产生的羟基自由基能够引发P-Ⅲ分子中P-H键的断裂(PH3→PH2·+ H ·),从而使大气中的P-Ⅲ被氧化去除[76]。以太湖梅梁湾湖区为例,夜间大气中P+Ⅲ浓度((37.05±22.74) ng/m3)显著高于白天((7.39±7.00) ng/m3),其中最大值出现在凌晨5:00((67.48±9.78) ng/m3),最小值出现在中午11:00((0.15±0.23) ng/m3)[70]。
(2) 水中IRP的时间分布规律
水中IRP浓度随光氧化作用表现出明显的季节变化特征:春季>冬季>秋季>夏季[12, 69],这与冬春季节水温较低、微生物活动被抑制,导致水体中的P+Ⅲ浓度较高有关。
(3) 沉积物中IRP的时间分布规律
沉积物中IRP含量随沉积环境表现出不同季节分布规律:在太湖沉积物中,垂直方向上不同深度的IRP表现出相似的分布特征,春季>秋季>夏季>冬季[55];而在长江入海口沉积物中,秋季P-Ⅲ含量则高于春季和冬季,这与之前在丰水期携带的较多污染物的沉淀有关[66-67]。
3 IRP环境行为与效应 3.1 IRP迁移性P+Ⅲ具有较高的溶解性,其溶解度是P+Ⅴ的1000倍[77-79];P+Ⅲ还具有很强的移动性,在进入水体7天后,90%以上的P+Ⅴ被沉积物吸附固定,而仅约有35%的P+Ⅲ会被吸附[80]。因此,P+Ⅲ被认为是加速水生态系统磷循环的最有效形式[54, 81]。不同于环境中的P+Ⅴ和P-Ⅲ从底泥释放到水中,P+Ⅲ多从水体迁移到沉积物,因此,沉积物被视作P+Ⅲ的“汇”[12]。在这一过程中,底泥颗粒的吸附、微生物的吸收转化和底泥中其他物质的氧化还原作用都可能促进水中P+Ⅲ向底泥的迁移[6, 65, 82]。
P-Ⅲ在沉积物和水体中表现出不同的迁移转化特性。沉积物中的P-Ⅲ以吸附态的形式存在,可在适宜的水环境因子作用下大量迁移至氧化还原电位高的表层水面,并在阳光照射下极易被氧化成P+I、P+Ⅲ、P+Ⅴ[21];水体中的P-Ⅲ以吸附在悬浮颗粒上或以溶解态的形式存在,从而随水体进行迁移,其迁移性与水温、溶解氧、pH、无机磷含量呈正相关[83-84]。
3.2 IRP的氧化还原反应IRP是磷发生氧化和还原反应的重要参与者,同时也是P+Ⅴ的还原产物。在自然环境中,IRP可以通过还原硫酸盐使自身氧化(图 3方程⑩)[85],也可以通过一系列复杂的歧化连锁反应氧化为P+Ⅴ(图 3方程④⑤⑥⑦)[86-88]。
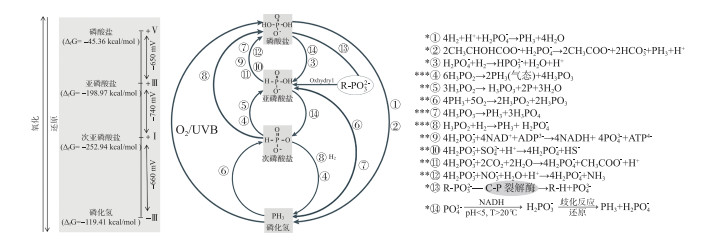
|
图 3 IRP的化学氧化还原路径 (*表示还原反应,**表示氧化反应,***表示歧化反应和归中反应) Fig.3 The oxidation-reduction path of inorganic reduced phosphorus (The reactions involve reduction(*), oxidation(**) and disproportionation and comproportionation(***)) |
对于P-Ⅲ,即使很弱的氧化剂也会将其彻底氧化为P+Ⅴ。P+Ⅲ在水溶液中的热力学很不稳定,但在海洋中P+Ⅲ的半衰期长达108~1010年[3]。因P+Ⅲ氧化反应速率主要受到P-H键(≈370 kJ)断裂速度的限制,P+Ⅲ仅在强氧化剂或催化剂存在时,才易被氧化为P+Ⅴ或有机磷化合物。其中,光催化氧化是影响水环境中IRP转化的重要因素之一[13]:在光照条件下,水体中具有光化学活性的硝酸根离子光解后产生大量强氧化性的羟基自由基(·OH),该物质攻击P+Ⅲ中的P-H键,使其断裂并进一步反应生成P+Ⅴ[61]。P+Ⅲ的光催化氧化过程除受光照条件和光敏物质的影响外,还受环境参数的影响[89]。如酸性条件更有利于P+Ⅲ的光催化氧化,而碱性或中性条件抑制P+Ⅲ的光催化氧化。一些无机阴离子(如SO42-、Cl-、HCO3-)和金属阳离子(如Mn2+)会抑制P+Ⅲ光催化氧化速率,而有的金属阳离子(如Fe3+)会加快P+Ⅲ的光催化氧化速率[65]。P+Ⅲ除发生光催化氧化外,磷铁镍陨石((Fe, Ni)3P)腐蚀过程也可将P+Ⅲ氧化为P+Ⅴ或有机磷化合物[90]。
通过计算IRP还原过程中可能达到的氧化还原电位,发现还原过程中没有一个典型的氧化剂,P+Ⅲ还原为P+I比P+Ⅲ还原为P-Ⅲ更为困难[91]。从热力学的角度上,P+Ⅴ还原为IRP是吸能反应,估算P+Ⅴ还原为P-Ⅲ所需的能量约为1100 kcal/mol,虽然这一反应几乎无法自然发生[92],但可以通过加热等途径将P+Ⅲ分解成P+I和P-Ⅲ(图 3方程④⑦⑧)。
3.2.2 IRP生物氧化还原反应自然界中约1%的微生物具有利用IRP(作为其单一的磷源)并氧化成P+Ⅴ的能力,因在磷饥饿条件下会诱发相应的基因表达[93]。目前,已知P+Ⅲ的生物氧化途径包括合成代谢亚磷酸盐氧化(anabolic phosphite oxidation, APO)途径和异化亚磷酸盐氧化(dissimilatory phosphite oxidation,DPO)途径[94]。APO途径的微生物可通过体内的酶[95](如C-P裂解酶、碱性磷酸酶、ptxD基因编码的亚磷酸盐脱氢酶等)将P+Ⅲ氧化为P+Ⅴ,并将P+Ⅴ作为细胞摄取的磷源;DPO途径的微生物(如硫酸盐还原菌株FiPS-3、异化亚磷酸酯氧化型细菌)可利用P+Ⅲ作为其生长和碳固定时的电子供体和能源。P+I在氧化过程中受到14个基因序列编码(htxABCDEFGHIJKLMN)调控[96],htxA基因编码的磷酸双加氧酶将P+I氧化成P+Ⅲ。
IRP的还原反应是一个复杂且涉及多个步骤的生物化学反应。Bains等[7]提出,P+Ⅴ还原为P-Ⅲ的过程可以分为两步,第一步是在厌氧环境下,由特定的微生物(如磷酸盐还原菌)将P+Ⅴ还原为P+Ⅲ,第二步是在温度较高、pH较低的环境中通过另一种特定的微生物群体将P+Ⅲ还原为P-Ⅲ。尽管目前普遍认为IRP的还原过程中微生物起着关键作用,但对IRP生物还原的机理还不清楚,尚未见有关IRP还原的生物化学酶和代谢途径的报道。
3.3 IRP的生物有效性传统观点认为生物只利用稳定的P+Ⅴ满足其细胞的新陈代谢活动[81, 97],而事实上,IRP也可为生物提供能量或电子供体参与其新陈代谢[98]。在极端缺氧的早期地球环境中,IRP作为主导磷形态被生物优先利用,因此IRP也被认为是古代地球生命的助推器[9, 99],即使在现代地球环境中仍活跃着大量异养细菌、蓝细菌、古生菌甚至某些浮游植物可以吸收利用IRP[100]。此外,IRP可以对生物的细胞膜、膜活性和基因表达等产生抑制作用,对部分生物具有较强的毒性效应[101]。
3.3.1 IRP对植物的影响P+Ⅲ可以作为一种缓释P肥为植物提供营养,这主要归因于P+Ⅲ强移动性,不易被土壤吸附固定,并且可以缓慢氧化成P+Ⅴ(大约需要4个月)被植物吸收[78]。此外,与P+Ⅴ只能在植物木质部运输不同,P+Ⅲ可在植株体内的木质部和韧皮部进行双渠道运输,这加快了植物吸收速度,也具有很好的促根、促花、促果作用[102]。当前部分研究证实,P+Ⅲ在提高陆生植物如草莓、黄瓜、马铃薯[103]等作物开花、产量、果实大小及可溶性物质含量等方面表现出显著的肥效。尽管P+Ⅲ在陆地植物上表现出色,但关于IRP对水生植物影响的研究却鲜有报道,王宝莹研究发现P+Ⅲ会对水生植物的生长产生胁迫作用[104],抑制其叶片与根系的伸长。实质上水生和陆生植物本身不能代谢P+Ⅲ,在P+Ⅲ胁迫下会表现出初生根生长受阻,幼叶叶片变黄,老叶花青素的斑片状积累等现象。这可能是由于IRP胁迫下导致水生植物受到磷代谢干扰、光合作用抑制、酶活性抑制以及氧化应激等多方面共同影响,未来仍需要进一步的研究和探索。
3.3.2 IRP对藻类的影响IRP对藻类的影响与藻种和环境条件有关。Van Mooy[53]发现寡营养水体优势藻种固氮蓝藻束毛藻可利用P+Ⅲ作为磷源并参与其固氮活动。国内学者[6, 29, 83]研究表明,IRP能够刺激部分微囊藻、海藻(如赤潮异弯藻(Heterosigma akashiwo)、中肋骨条藻(Skeletonema costatum)和伪矮海链藻(Thalassiosira pseudonana)等)细胞转运蛋白基因表达并促进对P+Ⅴ的吸收, 进而加速藻类的生长, 因而可以维持甚至加剧水体富营养化进程。然而,也有部分研究发现IRP不能作为藻类的磷源,且表现出强毒性效应。例如,Han等前期研究证实较高浓度的P+Ⅲ(0.01~0.7 mg/L)会诱导富营养优势藻种如铜绿微囊藻(Microcystis aeruginosa)、蛋白核小球藻(Chlorella pyrenoidesa)和小环藻(Cyclotella sp.)在形态结构和光合生理方面发生显著变化,对其生长产生明显胁迫并加速其衰亡过程[105]。目前IRP毒性机理研究多认为,IRP可以通过干扰藻细胞对P+Ⅴ的转运吸收、调控生物体内细胞色素氧化酶和过氧化氢酶等酶的活性,进而对藻类生长繁殖产生胁迫。
3.3.3 IRP对动物的影响大部分IRP在适量的情况下不会对动物产生直接的毒害作用,然而有研究表明P-Ⅲ和P+Ⅲ等IRP具有较强的毒性,会通过抑制细胞色素C氧化酶、干扰线粒体形态、诱导体内活性氧(ROS)含量升高等途径使生物机体中毒[21, 69]。尽管目前关于IRP对水生动物的具体影响尚未有报道,但考虑到IRP在水环境中广泛存在,未来研究可以重点关注IRP对底栖动物和浮游动物的影响,这将有助于揭示IRP在水生生态系统中的潜在风险,并为保障水生生物的安全提供重要的科学依据。
3.3.4 IRP对微生物的影响据微生物学领域和生命起源的最新研究表明,IRP是益生元合成含磷化合物(第一生物的前体)的来源[54]。国内外学者从水体沉积物中发现并分离出多种能够利用IRP的微生物。Schink和Friedrich从水体沉积物中分离出来一株硫酸盐还原菌(Desulfotignum phosphitoxidans),该菌能够以P+Ⅲ为唯一电子供体[106]。曹瑞香从太湖沉积物中筛选出能以P+Ⅲ为唯一磷源的微生物,间接证明P+Ⅲ在太湖底泥中的存在[107]。本课题组也在抚仙湖、星云湖等湖泊沉积物中分离并鉴定得到几株以P+Ⅲ为磷源的微生物,如绿脓杆菌(Pseudomonas sp.)、德维希肠杆菌(Enterobacter ludwigi)、芽孢杆菌(Bacillus sp.)。
4 总结与展望磷循环是整个生物圈物质能量循环的重要基础。尽管水体中IRP浓度较低,但越来越多的研究表明IRP主导的磷氧化还原循环过程可加快沉积物埋藏磷的再生进而驱动磷在固—液—气多相介质间的迁移转化过程,并且直接参与水环境中的微生物或藻类的生物利用和合成等过程,在维持水生态系统磷素的生物地球化学循环方面具有不可替代的作用,因此具有重要的生态学意义。除此之外,水环境中IRP主导的磷循环与气候变化存在复杂相互作用,尤其是P-Ⅲ作为一种潜在的温室气体,与甲烷以及一氧化氮等温室气体竞争消耗自由基,直接影响温室气体在大气中的化学清除速率,引发间接温室效应(即耦合效应)。这表明IRP参与的磷氧化还原循环不仅调控全球生态系统中的磷循环,而且会对全球气候变化产生深远影响。目前国内外已针对水环境中IRP赋存形态、组成和分布特征、迁移转化过程以及生物可利用性和产生机制等方面进行初步探索,然而针对水环境中IRP的具体来源和源汇通量变化规律、多介质以及跨界面输移过程与影响因素,潜在的生态环境效应以及管控策略等方面仍然不甚清楚,亟需深入研究。综合现有的相关研究进展和发展态势,未来水环境IRP研究领域应聚焦于以下几个方面:
1) 加强对新型IRP检测方法的开发与应用:首先要重点突破传统分析的局限性,发展新型原位、高灵敏度、高分辨率和稳定的IRP形态分离和检测方法。实现对IRP各形态浓度的精确表征,从而深化对水环境中IRP分布、迁移转化和生态环境效应的研究深度。其次,可基于稳定同位素示踪法原理,通过给特定的IRP形态标记的同位素,量化分析IRP来源和转化途径,从而更深入地理解磷的生物地球化学循环以及与生态系统之间的复杂关系。
2) 重点关注全球变化大背景下的磷循环模式和效应:当前人类活动加剧和全球气候变暖双重作用叠加正导致富营养化和水体持续厌氧等水生态环境问题,这也势必会促进湖泊中的IRP大量产生和蓄积,进而将显著影响水环境中磷形态转化和循环模式,因此IRP在湖泊磷循环中的作用及其对生态系统的影响将愈发显著。未来研究需要重点关注全球变化背景下水环境磷循环模式的响应特征,尤其是IRP主导的磷的氧化还原循环过程及其在全球环境中磷循环中的贡献。还需进一步深入探讨不同形态的磷对藻类生长的影响,以明确IRP在水体富营养化中的作用。此外,IRP也会对碳、氮元素的生物地球化学循环过程有重要影响,但相关研究比较匮乏,未来同样需要加强全球变化下IRP与碳、氮循环之间的相互作用、反馈机制及生态系统影响等研究。
3) 完善水生态环境风险评价体系并制定IRP管控策略:水环境中IRP广泛存在并表现出高活性,但传统的水质水生态评价体系并未将IRP形态纳入考虑范围,IRP对生态系统的潜在风险不容忽视。未来需要重点关注IRP以及其与其他环境污染物的单一/复合污染效应对水生生态系统的长期影响,包括其对水生生物种群结构、生物多样性和生态系统服务功能的潜在影响。因此需要加强对热点水环境,如工农业废水、污水处理厂以及黑臭厌氧水体中IRP产生和排放过程的监管并研发不同修复措施降低IRP的生态风险。
| [1] |
Kuang B, Xiao R, Hu YP et al. Metagenomics reveals biogeochemical processes carried out by sediment microbial communities in a shallow eutrophic freshwater lake. Frontiers in Microbiology, 2023, 13: 1112669. DOI:10.3389/fmicb.2022.1112669 |
| [2] |
Zheng L, Ren ML, Xie E et al. Roles of phosphorus sources in microbial community assembly for the removal of organic matters and ammonia in activated sludge. Frontiers in Microbiology, 2019, 10: 1023. DOI:10.3389/fmicb.2019.01023 |
| [3] |
Hanrahan G, Salmassi TM, Khachikian CS et al. Reduced inorganic phosphorus in the natural environment: Significance, speciation and determination. Talanta, 2005, 66(2): 435-444. DOI:10.1016/j.talanta.2004.10.004 |
| [4] |
Wang HJ. The non-negligible phosphorus form-reduced phosphorus in water. Sustainable Development, 2011, 1(2): 59-64. DOI:10.12677/sd.2011.12010 |
| [5] |
Gassmann G, Glindemann D. Phosphane(PH3) in the biosphere. Angewandte Chemie International Edition in English, 1993, 32(5): 761-763. DOI:10.1002/anie.199307611 |
| [6] |
Fu WY, Zhang XH. Global phosphorus dynamics in terms of phosphine. NPJ Climate and Atmospheric Science, 2020, 3: 51. DOI:10.1038/s41612-020-00154-7 |
| [7] |
Bains W, Petkowski JJ, Sousa-Silva C et al. New environmental model for thermodynamic ecology of biological phosphine production. Science of the Total Environment, 2019, 658: 521-536. DOI:10.1016/j.scitotenv.2018.12.086 |
| [8] |
Han C, Geng JJ, Zhang J et al. Phosphine migration at the water-air interface in Lake Taihu, China. Chemosphere, 2011, 82(6): 935-939. DOI:10.1016/j.chemosphere.2010.09.067 |
| [9] |
Pasek MA, Sampson JM, Atlas Z. Redox chemistry in the phosphorus biogeochemical cycle. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(43): 15468-15473. DOI:10.1073/pnas.1408134111 |
| [10] |
Rhodehamel EJ, Pierson MD, Leifer AM. Hypophosphite: A review. Journal of Food Protection, 1990, 53(6): 513-518. DOI:10.4315/0362-028x-53.6.513 |
| [11] |
Kehler A, Haygarth P, Tamburini F et al. Cycling of reduced phosphorus compounds in soil and potential impacts of climate change. European Journal of Soil Science, 2021, 72(6): 2517-2537. DOI:10.1111/ejss.13121 |
| [12] |
韩超. 太湖代表性低价磷的分布特征及光氧化过程研究[学位论文]. 南京: 南京大学, 2013.
|
| [13] |
Qiu HM, Geng JJ, Ren HQ et al. Phosphite flux at the sediment-water interface in northern Lake Taihu. Science of the Total Environment, 2016, 543(Pt A): 67-74. DOI:10.1016/j.scitotenv.2015.10.136 |
| [14] |
Liu W, Zhang YL, Yu MQ et al. Role of phosphite in the environmental phosphorus cycle. Science of the Total Environment, 2023, 881: 163463. DOI:10.1016/j.scitotenv.2023.163463 |
| [15] |
Fang HW, Chen MH, Chen ZH et al. Effects of sediment particle morphology on adsorption of phosphorus elements. International Journal of Sediment Research, 2013, 28(2): 246-253. DOI:10.1016/s1001-6279(13)60035-9 |
| [16] |
Glindemann D, Edwards M, Schrems O. Phosphine and methylphosphine production by simulated lightning—A study for the volatile phosphorus cycle and cloud formation in the earth atmosphere. Atmospheric Environment, 2004, 38(39): 6867-6874. DOI:10.1016/j.atmosenv.2004.09.002 |
| [17] |
Liang S, Zheng WX, Zhu LY et al. One-step treatment of phosphite-laden wastewater: A single electrochemical reactor integrating superoxide radical-induced oxidation and electrocoagulation. Environmental Science & Technology, 2019, 53(9): 5328-5336. DOI:10.1021/acs.est.9b00841 |
| [18] |
Gassmann G. Phosphine in the fluvial and marine hydrosphere. Marine Chemistry, 1994, 45(3): 197-205. DOI:10.1016/0304-4203(94)90003-5 |
| [19] |
Zhu RB, Kong DM, Sun LG et al. The first determination of atmospheric phosphine in Antarctica. Chinese Science Bulletin, 2007, 52(1): 131-135. DOI:10.1007/s11434-007-0010-x |
| [20] |
Pech H, Vazquez MG, Van Buren J et al. Elucidating the redox cycle of environmental phosphorus using ion chromatography. Journal of Chromatographic Science, 2011, 49(8): 573-581. DOI:10.1093/chrsci/49.8.573 |
| [21] |
Liu SG, Li T, Ning P et al. Research progress of the release, distribution and transformation of phosphine in environment. Chemical Industry and Engineering Progress, 2019, 38(2): 1085-1096. [刘树根, 李婷, 宁平等. 环境中磷化氢的产生、分布及转化研究进展. 化工进展, 2019, 38(2): 1085-1096. DOI:10.16085/j.issn.1000-6613.2018-2042] |
| [22] |
Nader W, Zahm A, Jaschik J. Phosphonic acid in plant-based food and feed products—Where does it come from?. Food Control, 2023, 150: 109701. DOI:10.1016/j.foodcont.2023.109701 |
| [23] |
Rott E, Steinmetz H, Metzger JW. Organophosphonates: A review on environmental relevance, biodegradability and removal in wastewater treatment plants. Science of the Total Environment, 2018, 615: 1176-1191. DOI:10.1016/j.scitotenv.2017.09.223 |
| [24] |
Tsubota G. Phosphate reduction in the paddy field Ⅰ. Soil Science and Plant Nutrition, 1959, 5(1): 10-15. DOI:10.1080/00380768.1959.10430888 |
| [25] |
Roels J, Verstraete W. Occurrence and origin of phosphine in landfill gas. Science of the Total Environment, 2004, 327(1/2/3): 185-196. DOI:10.1016/j.scitotenv.2003.11.016 |
| [26] |
Cao JP, Zhang CS, Zhao LM et al. Relationships of inorganic phosphorus sources and enzymes activities to phosphine production from anaerobic activated sludge. China Water & Wastewater, 2017, 33(1): 110-113. [曹建平, 张朝升, 赵丽敏等. 无机磷源及酶活性与厌氧污泥产磷化氢的关系. 中国给水排水, 2017, 33(1): 110-113. DOI:10.19853/j.zgjsps.1000-4602.2017.01.025] |
| [27] |
郑虹雨. 铁碳微电解强化厌氧生物除磷的过程及机理[学位论文]. 昆明: 昆明理工大学, 2022.
|
| [28] |
Jenkins RO, Morris TA, Craig PJ et al. Phosphine generation by mixed- and monoseptic-cultures of anaerobic bacteria. Science of the Total Environment, 2000, 250(1/2/3): 73-81. DOI:10.1016/s0048-9697(00)00368-5 |
| [29] |
冯志华. 海洋沉积物中磷化氢的分布、释放与转化研究[学位论文]. 青岛: 中国科学院海洋研究所, 2008.
|
| [30] |
Nishida N, Kimata M, Arakawa Y. Native zinc, copper, and brass in the red-clouded anorthite megacryst as probes of the arc-magmatic process. Naturwissenschaften, 1994, 81(11): 498-502. DOI:10.1007/BF01132681 |
| [31] |
Barco RA, Patil DG, Xu WH et al. The development of iodide-based methods for batch and on-line determinations of phosphite in aqueous samples. Talanta, 2006, 69(5): 1292-1299. DOI:10.1016/j.talanta.2006.02.060 |
| [32] |
Zhang R, Geng JJ, Qian H et al. Novel determination methods of phosphine with trace content. Chemical Industry Times, 2008, 22(6): 58-61. [张蕤, 耿金菊, 钱卉等. 痕量磷化氢检测方法进展. 化工时刊, 2008, 22(6): 58-61.] |
| [33] |
Qiu HM, Geng JJ, Han C et al. Determination of phosphite, phosphate, glyphosate and aminomethylphosphonic acid by two-dimensional ion chromatography system coupled with capillary ion chromatography. Chinese Journal of Analytical Chemistry, 2013, 41(12): 1910-1914. DOI:10.1016/s1872-2040(13)60700-8 |
| [34] |
Roos GHP, Loane C, Dell B et al. Facile high performance ion chromatographic analysis of phosphite and phosphate in plant samples. Communications in Soil Science and Plant Analysis, 1999, 30(17/18): 2323-2329. DOI:10.1080/00103629909370376 |
| [35] |
Pasek M, Block K. Lightning-induced reduction of phosphorus oxidation state. Nature Geoscience, 2009, 2: 553-556. DOI:10.1038/ngeo580 |
| [36] |
Han C, Williams PN, Ren JH et al. In situ sampling and speciation method for measuring dissolved phosphite at ultratrace concentrations in the natural environment. Water Research, 2018, 137: 281-289. DOI:10.1016/j.watres.2018.03.031 |
| [37] |
Zheng N, Zhou JH, Chen HX et al. Study on a new method for determination of hypophosphorous acid. Inorganic Chemicals Industry, 2021, 53(10): 114-118. [郑娜, 周骏宏, 陈杭馨等. 次亚磷酸含量测定新方法的研究. 无机盐工业, 2021, 53(10): 114-118. DOI:10.19964/j.issn.1006-4990.2021-0007] |
| [38] |
Smillie RH, Grant B, Cribbes RL. Determination of phosphate and phosphite in plant material by gas chromatography-mass spectrometry and ion chromatography. Journal of Chromatography A, 1988, 455: 253-261. DOI:10.1016/s0021-9673(01)82123-3 |
| [39] |
Morton SC, Glindemann D, Wang XR et al. Analysis of reduced phosphorus in samples of environmental interest. Environmental Science & Technology, 2005, 39(12): 4369-4376. DOI:10.1021/es0401038 |
| [40] |
Wang H, Song SH, Zhang JY et al. Research advance in soil phosphorus fractionations and their characterization by chemical sequential methods and 31P-NMR techniques. Journal of Plant Nutrition and Fertilizer, 2017, 23(2): 512-523. [汪洪, 宋书会, 张金尧等. 土壤磷形态组分分级及31P-NMR技术应用研究进展. 植物营养与肥料学报, 2017, 23(2): 512-523. DOI:10.11674/zwyf.16066] |
| [41] |
Oliveira EM, Rogero M, Ferreira EC et al. Simultaneous determination of phosphite and phosphate in fertilizers by Raman spectroscopy. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy, 2021, 246: 119025. DOI:10.1016/j.saa.2020.119025 |
| [42] |
王紫艳. UiO系列MOFs构建无机酸根离子电化学传感器的研究[学位论文]. 福州: 福建师范大学, 2019.
|
| [43] |
Liu JA, Cao HF, Zhuang YH et al. Phosphine in the urban air of Beijing and its possible sources. Water Air and Soil Pollution, 1999, 116(3): 597-604. DOI:10.1023/A:1005120814668 |
| [44] |
李建兵. 中国沿海部分区域磷化氢的生物地球化学研究[学位论文]. 青岛: 中国海洋大学, 2009.
|
| [45] |
母清林. 磷化氢在胶州湾沉积物中的分布特征及其转化与释放[学位论文]. 青岛: 中国科学院海洋研究所, 2005.
|
| [46] |
Glindemann D, Stottmeister U, Bergmann A. Free phosphine from the anaerobic biosphere. Environmental Science and Pollution Research, 1996, 3(1): 17-19. DOI:10.1007/BF02986806 |
| [47] |
Hong YN, Geng JJ, Qiao S et al. Distribution of phosphine in the offshore area of the Southwest Yellow Sea, East Asia. Marine Chemistry, 2010, 118(1/2): 67-74. DOI:10.1016/j.marchem.2009.10.005 |
| [48] |
Glindemann D, Edwards M, Kuschk P. Phosphine gas in the upper troposphere. Atmospheric Environment, 2003, 37(18): 2429-2433. DOI:10.1016/s1352-2310(03)00202-4 |
| [49] |
Song XX, Morrison RJ, Feng ZH et al. Matrix-bound phosphine in sediments from Lake Illawarra, New South Wales, Australia. Marine Pollution Bulletin, 2011, 62(8): 1744-1750. DOI:10.1016/j.marpolbul.2011.05.025 |
| [50] |
Han C, Geng JJ, Ren HQ et al. Phosphite in sedimentary interstitial water of Lake Taihu, a large eutrophic shallow lake in China. Environmental Science & Technology, 2013, 47(11): 5679-5685. DOI:10.1021/es305297y |
| [51] |
Han C, Geng JJ, Xie XC et al. Determination of phosphite in a eutrophic freshwater lake by suppressed conductivity ion chromatography. Environmental Science & Technology, 2012, 46(19): 10667-10674. DOI:10.1021/es300771a |
| [52] |
Tapia-Torres Y, Rodríguez-Torres MD, Elser JJ et al. How to live with phosphorus scarcity in soil and sediment: Lessons from bacteria. Applied and Environmental Microbiology, 2016, 82(15): 4652-4662. DOI:10.1128/AEM.00160-16 |
| [53] |
Van Mooy BAS, Krupke A, Dyhrman ST et al. Phosphorus cycling. Major role of planktonic phosphate reduction in the marine phosphorus redox cycle. Science, 2015, 348(6236): 783-785. DOI:10.1126/science.aaa8181 |
| [54] |
Karl DM. Microbially mediated transformations of phosphorus in the sea: New views of an old cycle. Annual Review of Marine Science, 2014, 6: 279-337. DOI:10.1146/annurev-marine-010213-135046 |
| [55] |
Zhu RB, Glindemann D, Kong DM et al. Phosphine in the marine atmosphere along a hemispheric course from China to Antarctica. Atmospheric Environment, 2007, 41(7): 1567-1573. DOI:10.1016/j.atmosenv.2006.10.035 |
| [56] |
Yu ZM, Song XX. Matrix-bound phosphine: A new form of phosphorus found in sediment of Jiaozhou Bay. Chinese Science Bulletin, 2003, 48(1): 31-35. DOI:10.1007/BF03183329 |
| [57] |
Feng ZH, Song XX, Yu ZM. Distribution characteristics of matrix-bound phosphine along the coast of China and possible environmental controls. Chemosphere, 2008, 73(4): 519-525. DOI:10.1016/j.chemosphere.2008.06.018 |
| [58] |
Li JB, Zhang GL, Zhang J et al. Matrix bound phosphine in sediments of the Yellow Sea and its coastal areas. Continental Shelf Research, 2010, 30(7): 743-751. DOI:10.1016/j.csr.2010.01.008 |
| [59] |
Han C, Geng JJ, Hong YN et al. Free atmospheric phosphine concentrations and fluxes in different wetland ecosystems, China. Environmental Pollution, 2011, 159(2): 630-635. DOI:10.1016/j.envpol.2010.09.030 |
| [60] |
Niu XJ, Wei AS, Li YD et al. Phosphine in paddy fields and the effects of environmental factors. Chemosphere, 2013, 93(9): 1942-1947. DOI:10.1016/j.chemosphere.2013.06.078 |
| [61] |
Niu XJ, Wang JF, Wu H et al. Matrix-bound phosphine in the paddy soils of South China and its relationship to environmental factors and bacterial composition. Journal of Soils and Sediments, 2016, 16(2): 592-604. DOI:10.1007/s11368-015-1258-4 |
| [62] |
Niu XJ, Geng JJ, Wang XR. Temporal and spatial distributions of phosphine in Taihu Lake. Acta Scientiae Circumstantiae, 2004, 24(2): 255-259. [牛晓君, 耿金菊, 王晓蓉. 太湖水域PH3的时空变化特征. 环境科学学报, 2004, 24(2): 255-259. DOI:10.13671/j.hjkxxb.2004.02.014] |
| [63] |
Devai I, Delaune RD. Evidence for phosphine production and emission from Louisiana and Florida marsh soils. Organic Geochemistry, 1995, 23(3): 277-279. DOI:10.1016/0146-6380(95)00021-6 |
| [64] |
樊仪旻. 厌氧消化微生物产磷化氢的机理研究[学位论文]. 广州: 华南理工大学, 2023.
|
| [65] |
邱慧敏. 亚磷酸盐在北太湖沉积物—水界面的迁移及其光转化特征研究[学位论文]. 南京: 南京大学, 2016.
|
| [66] |
Feng ZH, Song XX, Yu ZM. Seasonal and spatial distribution of matrix-bound phosphine and its relationship with the environment in the Changjiang River Estuary, China. Marine Pollution Bulletin, 2008, 56(9): 1630-1636. DOI:10.1016/j.marpolbul.2008.05.017 |
| [67] |
He K, Huang KH, Ye LM et al. Enhanced oxidation and recovery of phosphorous from hypophosphite wastewater: Key role of heterogeneous E-Fenton system with MOFs derived hierarchical Mn-Fe@PC modified cathode. Surfaces and Interfaces, 2023, 39: 102957. DOI:10.1016/j.surfin.2023.102957 |
| [68] |
Liu ZP, Jia SF, Wang BJ et al. Differences in phosphine contents of various environment samples and the effecting factors. Acta Scientiae Circumstantiae, 2004, 24(5): 852-857. [刘志培, 贾省芬, 王保军等. 环境中磷化氢的含量差异及其影响因素. 环境科学学报, 2004, 24(5): 852-857.] |
| [69] |
李婷. 气化除磷系统微生物群落结构及作用机理[学位论文]. 沈阳: 沈阳建筑大学, 2020.
|
| [70] |
Han C, Geng JJ, Zhang J et al. Diurnal variation of phosphine concentration and flux in Meiliang Bay, Lake Taihu. Environmental Chemistry, 2010, 29(3): 347-351. [韩超, 耿金菊, 张娟等. 太湖梅梁湾磷化氢气体浓度和通量日变化. 环境化学, 2010, 29(3): 347-351.] |
| [71] |
Geng JJ, Jin XC, Wang Q et al. Matrix bound phosphine formation and depletion in eutrophic lake sediment fermentation-simulation of different environmental factors. Anaerobe, 2005, 11(5): 273-279. DOI:10.1016/j.anaerobe.2005.04.003 |
| [72] |
Zhu RB, Ma DW, Ding W et al. Occurrence of matrix-bound phosphine in polar ornithogenic tundra ecosystems: Effects of alkaline phosphatase activity and environmental variables. Science of the Total Environment, 2011, 409(19): 3789-3800. DOI:10.1016/j.scitotenv.2011.06.034 |
| [73] |
Feng ZH, Fang T, Li Y et al. Emission of phosphine in intertidal zone for aquaculture along the northern Jiangsu coast and its influencing factors. Acta Ecologica Sinica, 2014, 34(15): 4167-4174. [冯志华, 方涛, 李玉等. 苏北沿海滩涂养殖湿地磷化氢的释放及其影响因素. 生态学报, 2014, 34(15): 4167-4174. DOI:10.5846/stxb201301060039] |
| [74] |
Wang Q, Geng JJ, Jin HM et al. Temporal and spatial distributions of microbes and phosphine in Lake Taihu sediments. China Environmental Science, 2006, 26(3): 350-354. [王强, 耿金菊, 金红梅等. 太湖沉积物中微生物和磷化氢的时空分布及关系. 中国环境科学, 2006, 26(3): 350-354. DOI:10.1016/S0379-4172(06)60102-9] |
| [75] |
Glindemann D, Bergmann A, Stottmeister U et al. Phosphine in the lower terrestrial troposphere. Naturwissenschaften, 1996, 83(3): 131-133. DOI:10.1007/BF01142179 |
| [76] |
秦媛媛. 主要环境因子对海水中磷化氢转化的影响研究[学位论文]. 青岛: 中国科学院海洋研究所, 2010.
|
| [77] |
Guan W, Sun GG, Yin L et al. Ti4O7/g-C3N4 visible light photocatalytic performance on hypophosphite oxidation: Effect of annealing temperature. Frontiers in Chemistry, 2018, 6: 37. DOI:10.3389/fchem.2018.00037 |
| [78] |
McDonald AE, Grant BR, Plaxton WC. Phosphite(phosphorous acid): Its relevance in the environment and agriculture and influence on plant phosphate starvation response. Journal of Plant Nutrition, 2001, 24(10): 1505-1519. DOI:10.1081/pln-100106017 |
| [79] |
Glindemann D, de Graaf RM, Schwartz AW. Chemical reduction of phosphate on the primitive earth. Origins of Life and Evolution of the Biosphere, 1999, 29(6): 555-561. DOI:10.1023/A:1006622900660 |
| [80] |
de Boer JLM, Kohlmeyer U, Breugem PM et al. Determination of total dissolved phosphorus in water samples by axial inductively coupled plasma atomic emission spectrometry. Fresenius' Journal of Analytical Chemistry, 1998, 360(1): 132-136. DOI:10.1007/s002160050660 |
| [81] |
Benitez-Nelson C. Ocean chemistry. The missing link in oceanic phosphorus cycling?. Science, 2015, 348(6236): 759-760. DOI:10.1126/science.aab2801 |
| [82] |
李毓佳. 深水水库内源磷化氢释放迁移及环境效应研究[学位论文]. 北京: 中国地质大学(北京), 2017.
|
| [83] |
盛鸿. 大气CO2浓度升高下蓝藻对湖泊中磷化氢的生理生化响应研究[学位论文]. 广州: 华南理工大学, 2020.
|
| [84] |
Wang XR, Ding LL, Niu XJ et al. Roles of phosphine in the biogeochemical cycling of phosphorus in lake. Environmental Chemistry, 2003, 22(5): 485-489. [王晓蓉, 丁丽丽, 牛晓君等. 磷化氢在湖泊磷生物地球化学循环中的作用. 环境化学, 2003, 22(5): 485-489. DOI:10.3321/j.issn:0254-6108.2003.05.014] |
| [85] |
Morton SC, Glindemann D, Edwards MA. Phosphates, phosphites, and phosphides in environmental samples. Environmental Science & Technology, 2003, 37(6): 1169-1174. DOI:10.1021/es020738b |
| [86] |
Liu DP, Wang AJ, Liu CG et al. Ni2P/Al2O3 hydrodesulfurization catalysts prepared by separating the nickel compound and hypophosphite. Catalysis Today, 2017, 292: 133-142. DOI:10.1016/j.cattod.2016.09.019 |
| [87] |
Jiang N, Shi SJ, Cui YY et al. Effect of phosphorization temperature on the structure and hydrogen evolution reaction performance of nickel cobalt phosphide electrocatalysts. Catalysis Communications, 2022, 171: 106507. DOI:10.1016/j.catcom.2022.106507 |
| [88] |
Sheng Q, Li X, Prins R et al. Understanding the reduction of transition-metal phosphates to transition-metal phosphides by combining temperature-programmed reduction and infrared spectroscopy. Angewandte Chemie International Edition, 2021, 60(20): 11180-11183. DOI:10.1002/anie.202100767 |
| [89] |
Qiu HM, Geng JJ, Han C et al. Photooxidation process and its influencing factors of phosphite in nitrate solution. China Environmental Science, 2016, 36(5): 1442-1448. DOI: 0.3969/j.issn.1000-6923. [邱慧敏, 耿金菊, 韩超等. 亚磷酸盐在硝酸根溶液中的光氧化过程及影响因素. 中国环境科学, 2016, 36(5): 1442-1448. ]
|
| [90] |
Pasek MA, Dworkin JP, Lauretta DS. A radical pathway for organic phosphorylation during schreibersite corrosion with implications for the origin of life. Geochimica et Cosmochimica Acta, 2007, 71(7): 1721-1736. DOI:10.1016/j.gca.2006.12.018 |
| [91] |
Roels J, Verstraete W. Biological formation of volatile phosphorus compounds. Bioresource Technology, 2001, 79(3): 243-250. DOI:10.1016/s0960-8524(01)00032-3 |
| [92] |
刘云龙. 零价铁耦合生物磷酸盐还原除磷及微生物种群结构研究[学位论文]. 沈阳: 沈阳建筑大学, 2023.
|
| [93] |
Wojciechowski K, Malecki A. Mechanism and kinetics of hypophosphite oxidation by permanganate ion. International Journal of Chemical Kinetics, 1999, 31(10): 737-743. DOI:10.1002/(SICI)1097-4601(1999)31:10737:AID-JCK7>3.0.CO;2-I |
| [94] |
Figueroa IA, Coates JD. Microbial phosphite oxidation and its potential role in the global phosphorus and carbon cycles. Advances in Applied Microbiology, 2017, 98: 93-117. DOI:10.1016/bs.aambs.2016.09.004 |
| [95] |
Costas AM, White AK, Metcalf WW. Purification and characterization of a novel phosphorus-oxidizing enzyme from Pseudomonas stutzeri WM88. Journal of Biological Chemistry, 2001, 276(20): 17429-17436. DOI:10.1074/jbc.M011764200 |
| [96] |
White AK, Metcalf WW. Two C-P lyase operons in Pseudomonas stutzeri and their roles in the oxidation of phosphonates, phosphite, and hypophosphite. Journal of Bacteriology, 2004, 186(14): 4730-4739. DOI:10.1128/JB.186.14.4730-4739.2004 |
| [97] |
Wang SL, Li JS, Zhang B et al. Trophic state assessment of global inland waters using a MODIS-derived Forel-Ule index. Remote Sensing of Environment, 2018, 217: 444-460. DOI:10.1016/j.rse.2018.08.026 |
| [98] |
Pasek M. A role for phosphorus redox in emerging and modern biochemistry. Current Opinion in Chemical Biology, 2019, 49: 53-58. DOI:10.1016/j.cbpa.2018.09.018 |
| [99] |
Poehlein A, Daniel R, Schink B et al. Life based on phosphite: A genome-guided analysis of Desulfotignum phosphitoxidans. BMC Genomics, 2013, 14(1): 753. DOI:10.1186/1471-2164-14-753 |
| [100] |
White AK, Metcalf WW. Microbial metabolism of reduced phosphorus compounds. Annual Review of Microbiology, 2007, 61: 379-400. DOI:10.1146/annurev.micro.61.080706.093357 |
| [101] |
Cao Y, Song Y, Suan GY et al. Review of toxicology on phosphine. Journal of Zhengzhou Institute of Technology, 2002(2): 84-89. [曹阳, 宋翼, 孙冠英等. 磷化氢毒理学研究综述. 郑州工程学院学报, 2002(2): 84-89.] |
| [102] |
Li BY, Gao MJ, Gao CY et al. Research advances in application and mechanism of phosphites in agriculture. Journal of Nanjing Agricultural University, 2017, 40(6): 949-956. [李宝玉, 高明杰, 高春雨等. 亚磷酸盐在农业上的应用及机制研究进展. 南京农业大学学报, 2017, 40(6): 949-956. DOI:10.7685/jnau.201704002] |
| [103] |
Constán-Aguilar C, Sánchez-Rodríguez E, Rubio-Wilhelmi MM et al. Physiological and nutritional evaluation of the application of phosphite as a phosphorus source in cucumber plants. Communications in Soil Science and Plant Analysis, 2014, 45(2): 204-222. DOI:10.1080/00103624.2013.854374 |
| [104] |
王宝莹. 典型水生生物对低价磷的适应特征研究[学位论文]. 西安: 西安工业大学, 2021.
|
| [105] |
Han C, Ren JH, Wang BY et al. Ignored effects of phosphite(P+Ⅲ) on the growth responses of three typical algae species. Environmental Pollution, 2022, 294: 118672. DOI:10.1016/j.envpol.2021.118672 |
| [106] |
Schink B, Friedrich M. Phosphite oxidation by sulphate reduction. Nature, 2000, 406: 37. DOI:10.1038/35017644 |
| [107] |
曹瑞香. 太湖底泥中利用低价磷酸盐的微生物筛选和鉴定[学位论文]. 南京: 南京大学, 2011.
|
 2024, Vol. 36
2024, Vol. 36 


