(2: 中国科学院南京地理与湖泊研究所, 湖泊与流域水安全重点实验室, 南京 210008)
(3: 江苏省江都水利工程管理处, 扬州 225200)
(4: 长江水利委员会水文局, 武汉 430010)
(2: Key Laboratory of Lake and Watershed Science for Water Security, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R. China)
(3: Jiangdu Water Conservancy Project Management Office of Jiangsu Province, Yangzhou 225200, P.R. China)
(4: Bureau of Hydrology, Changjiang Water Resources Commission, Wuhan 430010, P.R. China)
沉水植物作为水生态系统中主要的初级生产者[1],能够加快水体悬浮物沉降,降解有机物,吸收水体中重金属、氮磷等营养物质,在提高水体质量、恢复湖泊生态系统功能等方面具有重要作用[2-3]。菹草(Potamogeton crispus)作为冬、春季节沉水植物的优势种,按照生长特征和对环境的适应,其生长衰亡大致可分为5个阶段:萌发期(10-11月)、幼苗生长期(12-1月)、返青期(2-4月)、指数生长期(4-5月)、植株衰亡期(6-8月)[4]。菹草生长吸收利用水体中的营养物质,起到净化水质的效果。菹草在春末夏初大量死亡后,植株腐烂分解会对水环境造成较大程度的污染。首先,较直观的影响体现为水中溶解氧浓度和透明度降低,另外,菹草中的有机物(如蛋白质和有机酸)和矿物质由于腐烂分解会快速释放到水体中,这个过程导致植物中碳、氮、磷元素大量损失,使水体中氮、磷营养盐及有机物浓度升高,水质变差,同时会引发藻类暴发[5]。
高邮湖地处江苏省中部,是淮河入江主要通道,在流域生态系统中扮演着极其重要的角色,作为南水北调东线工程的重要调蓄湖泊,其能满足南水北调供水及湖周边地区农业、生活、城市用水等[6-7]。由于长期受到流域人类活动影响以及湖区高强度开发利用,高邮湖水质处于轻度富营养状态[8],湖泊生态系统结构退化严重、水环境问题突出[9-10],导致沉水植物多样性低,优势种单一化,菹草在湖体分布区域逐步扩张,由伴生种逐渐演变为绝对优势种[11],春季菹草占绝对优势,夏季分布面积锐减。沉水植物死亡后营养物质释放,导致水质下降,严重威胁高邮湖生物多样性和生态系统的平衡稳定[8]。
目前关于菹草的研究主要集中在围隔模拟实验,很少在湖泊原位条件下研究菹草生长衰亡对水质及藻类的影响。王文林等[12]在富营养化湖泊的围隔中引种菹草,发现菹草在春季对水体营养盐有较高的去除效果。徐伟伟等[13]通过围隔实验发现菹草在暴发后会对水体功能产生不利的影响。贺峰等[14]发现东湖种植了菹草的围隔内浮游植物密度明显低于无菹草分布的敞水区,而将围隔内的菹草进行收割打捞后,浮游植物密度明显升高,说明菹草对浮游植物有一定的抑制作用。然而,在菹草生长衰亡期间湖泊生态环境效应机制尚不清晰, 菹草生长衰亡过程对水环境影响的科学认识不足。因此,本文以苏北高邮湖为例,针对菹草暴发问题开展系统研究,探究菹草生长衰亡过程对水环境、水生态的影响机制,以期为存在菹草暴发问题的浅水湖泊生态环境保护和水资源管理提供科学支撑。
1 材料与方法 1.1 研究区概括及样点设置高邮湖(32°42′~33°41′N,119°06′~119°25′E)地处江苏省中部,是长江、淮河下游内陆水域。高邮湖属浅水型湖泊,位于南北气候过渡地带,气候温和,日照充足,雨量充沛。高邮湖周围众多河滩分布,地形以平原为主。
采样点位布置遵循均匀性、代表性原则,并结合高邮湖菹草分布空间差异,最终选择布设10个采样点位(图 1),在每个点位采集水样、浮游植物和菹草。根据菹草生长衰亡周期,采样时间分别为菹草生长期(2021年12月和2022年1、2、5月,其中2022年3月和4月受疫情影响未采样)和衰亡期(2022年6、7、8月)。
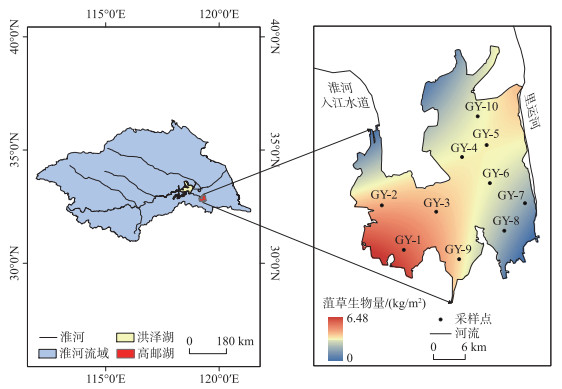
|
图 1 高邮湖区位及采样点分布 Fig.1 Location of Lake Gaoyou and the distribution of sampling sites |
使用YSI多参数水质分析仪现场记录水深(WD)、水温(WT)、溶解氧(DO)、电导率(EC)、pH,使用塞氏盘对透明度(SD)进行测定,利用5 L采水器取表层和底层水样,混匀后取1 L水样冷藏保存带回实验室。采用GF/F膜过滤水样,用热乙醇萃取分光光度法测定叶绿素a(Chl.a)浓度;硝态氮(NO3--N)浓度采用紫外分光光度法测定[15];高锰酸盐指数(CODMn)采用酸性高锰酸盐法测定[15];总氮(TN)浓度采用碱性过硫酸钾消解-紫外分光光度法测定[15];总磷(TP)浓度采用钼酸铵分光光度法测定[15];氨氮(NH3-N)浓度采用纳氏试剂比色法测定[15]。
1.2.2 浮游植物使用5 L采水器在水下0.5 m及1 m处各采水1次,混合均匀后取1 L混合水样加入10~15 mL鲁哥试剂固定,低温保存运回实验室,水样静置24 h后,采用虹吸法吸掉上清液浓缩定容至50 mL左右,再静置24 h后使用移液枪吸取上清液定容至30 mL。摇匀浓缩液,取0.1 mL样品放入浮游生物计数框中全片计数。浮游植物种类鉴定主要参考《中国淡水藻类——系统、分类及生态》[16]和《中国淡水生物图谱》[17]。
1.2.3 菹草采样工具为带网铁夹,铁夹是由可开合的钢筋组成的长方形框架,尺寸为0.4 m×0.5 m。使用铁夹抓取菹草,将采集到的菹草洗净表面泥沙,带回实验室,用吸水纸吸去菹草表面水分,使用电子天平称量植株鲜重,根据单位面积内的植株质量计算得到菹草生物量。
1.3 数据分析 1.3.1 水质营养状态应用综合营养状态指数(TLI(Σ))评价水体营养状态,计算公式为:
| TLI( Chl. a)=10(2.5+1.086ln Chl. a) | (1) |
| TLI(TP)=10(9.436+1.624lnTP) | (2) |
| TLI(TN)=10(5.453+1.694lnTN) | (3) |
| TLI(SD)=10(5.188−1.94lnSD) | (4) |
| TLI(CODMn)=10(0.109+2.661lnCODMn) | (5) |
| TLI(Σ)=n∑j=1Wj⋅TLIj | (6) |
式中,Wj为第j种参数的营养状态指数相关权重(Chl.a、TP、TN、SD、CODMn的Wj值依次为0.2663、0.1879、0.1790、0.1834、0.1834);TLIj为第j种参数的营养状态指数。其中TLI(Σ) < 30为贫营养,30≤TLI(Σ)≤50为中营养,50 < TLI(Σ)≤60为轻度富营养,60 < TLI(Σ)≤70为中度富营养,TLI(Σ)> 70为重度富营养[18]。
1.3.2 浮游植物优势度与多样性指数浮游植物优势度采用Mchaughton优势度指数公式计算:
| Y=(ni/N)fi | (7) |
式中,Y为优势度,ni和N分别为第i种个体数和样品中所有物种个体总数,fi为第i种浮游植物在各采样点中出现的频率。Y≥0.02的物种为优势种。
采用Shannon-Wiener多样性指数(H′)[19]、Simpson多样性指数(D)[20]和Pielou均匀度指数(J)[21]分析浮游植物群落结构特征,并评价水质健康状态,计算公式如下:
| H′=−N∑i=1(Ni/N)ln(Ni/N) | (8) |
| D=1−S∑i=1(Ni/N)2 | (9) |
| J=H′/lnS | (10) |
式中,S为物种总数,Ni为第i种的个体数,N为所有种类的总个体数。各指数评价标准[22]见表 1。
| 表 1 基于浮游植物多样性指数的水质评价标准[22] Tab. 1 Criteria of water quality assessment based on diversity indices of phytoplankton[22] |
采样点位图使用ArcGIS 10.8绘制,使用克里金插值法对高邮湖5月菹草生物量进行空间插值。通过Excel和Origin 2022软件对浮游植物多样性指数进行计算并绘图。应用IBM SPSS Statistics 26进行单因素方差分析(One-way ANOVA),在方差分析前数据均通过正态分布和方差齐性检验,用Pearson相关性分析菹草生长过程中生物量差异与水质指标的关系。为消除极值影响,先对环境因子数据(pH除外)进行lg(x+1)转换,根据去趋势分析(detrended correspondence analysis,DCA)的结果,选择冗余分析(redundancy analysis, RDA)来探讨菹草生长衰亡期浮游植物群落密度与环境因子的关系。利用广义线性模型(GLM)筛选环境因子,然后构建分段结构方程模型(piecewise SEM)来分析菹草生长期对浮游植物的影响机制。通过R语言vegan包进行RDA分析,用MuMIn包进行GLM模型的因子筛选,用piecewise SEM包进行结构方程模型的构建。
2 结果与分析 2.1 高邮湖菹草分布及生长过程菹草生物量在5月前后达到峰值,10个采样点菹草平均生物量为2.84 kg/m2。高邮湖5月菹草空间分布特征(图 1)表现为湖体西南部生物量较高、北部与湖体中心附近生物量适中、湖体东南部生物量较低。由于高邮湖不同区域菹草生物量分布不同,通过菹草生长盛期(5月)各点位生物量的差异将其分为高、中、低3种梯度。低生物量区主要位于湖体东南部,点位为GY-5、GY-7、GY-8(生物量在0~2 kg/m2之间);中生物量区位于湖体中部,点位为GY-3、GY-4、GY-6、GY-9、GY-10(生物量在2~4 kg/m2之间);高生物量区位于湖体西部,点位为GY-1、GY-2(生物量>4 kg/m2)。
2.2 水质时空变化特征 2.2.1 菹草生长衰亡过程水质变化对高邮湖水质指标进行单因素方差分析,结果表明高邮湖各水质指标在菹草不同生长期差异显著(P < 0.05)。总体上,氮磷营养盐、高锰酸盐指数以及Chl.a浓度均呈下降趋势,生长期内有关指标浓度较低,衰亡期时浓度升高且长期处于较高水平(表 2)。TN浓度变化范围为0.94~1.92 mg/L,其中5月TN浓度最低,为0.94 mg/L,显著低于其他月份(P < 0.05)。TP浓度变化范围为0.051~0.161 mg/L,菹草生长期平均浓度为0.058 mg/L,衰亡期平均浓度为0.147 mg/L。CODMn在菹草生长期平均浓度为4.16 mg/L,衰亡期平均浓度为5.26 mg/L。Chl.a在菹草生长期和衰亡期均值分别为15.35和45.62 μg/L,衰亡期水体中Chl.a浓度远高于湖泊可接受阈值(20 μg/L)。生长期内DO浓度呈波动上升趋势且浓度较高,衰亡期DO浓度变化趋势为初期急剧下降、后期缓慢下降,显著低于生长期。在菹草生长过程中pH变化不明显,衰亡初期pH下降至7.45,而衰亡中后期pH有所回升。
| 表 2 菹草生长衰亡过程水质指标变化* Tab. 2 Changes in water quality parameters during the growth and decomposition period of Potamogeton crispus |
在菹草生长期,TN、TP和CODMn浓度均表现为高生物量区浓度下降最明显,SD和DO在各生物量区差异不明显(图 2)。水质随菹草的生长有改善趋势,且菹草生物量越高,水质改善越明显。在菹草衰亡期,TN和TP浓度呈现出高、中生物量区高于低生物量区的差异,SD在衰亡期呈现出高、中生物量区小于低生物量区的差异,CODMn、DO浓度在不同生物量区未呈现出明显差异。菹草分布越茂密的区域氮、磷营养盐以及Chl.a浓度越高,同时水体透明度越低,水质越差。
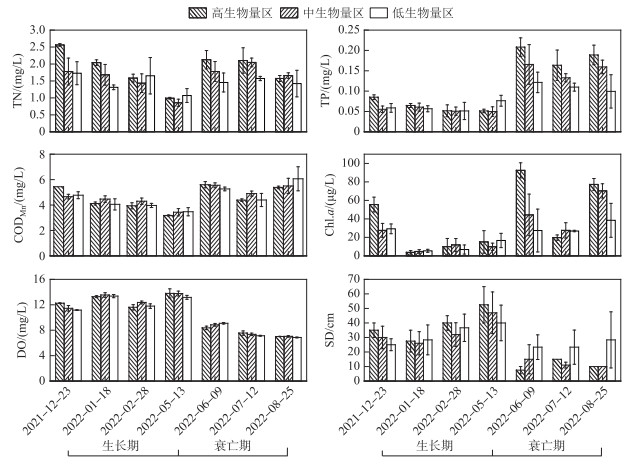
|
图 2 菹草生长衰亡期不同生物量下水质变化情况 Fig.2 Changes of water quality parameters at different biomass during the growth and decomposition period of Potamogeton crispus |
基于TLI(Σ)对高邮湖水质进行评价。评价结果(图 3a)显示,在菹草生长期,水体TLI(Σ)的变化范围为40.02~54.81,高邮湖菹草生长期水体处于轻度富营养水平(TLI(Σ)=53.47±4.80),且随着菹草的生长,水体营养水平逐渐下降,5月份接近中营养水平(TLI(Σ)=50.32±3.31),但6月份菹草大面积衰败腐烂,衰亡期水体迅速升至中度富营养水平(TLI(Σ)=64.98±4.47)且持续这一状态较长时间。结果表明高邮湖在菹草生长期的水质优于衰亡期。
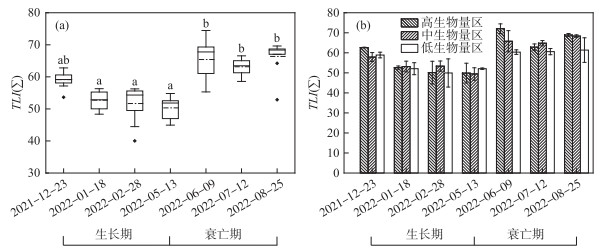
|
图 3 菹草生长衰亡过程中水体营养状态的时空变化 Fig.3 Temporal and spatial variations of TLI(Σ) during the growth and decomposition period of Potamogeton crispus |
TLI(Σ)在菹草生长期不同生物量梯度下的变化趋势为:在菹草生长期,高生物量区下降趋势高于中、低生物量区(图 3b),其中高、中、低生物量区TLI(Σ)均值分别为53.81±5.20、53.46±2.99、53.25±3.38,均属于轻度富营养水平。TLI(Σ)在菹草衰亡期体现为菹草高、中生物量区明显高于低生物量区,其中菹草高、中、低生物量区TLI(Σ)均值分别为67.93±3.82、66.32±1.50、60.78±0.43,均属于中度富营养水平。从结果可以看出,在菹草生长期生物量越高,水质越优,而在菹草衰亡期生物量越高,水体受到污染的程度越高。
采用线性回归进一步分析菹草生长衰亡过程中生物量差异与水质指标的关系,结果显示,菹草生长期生物量与TN、NO3--N浓度均呈显著负相关(P < 0.01),与DO和SD呈显著正相关(P < 0.01),与TLI(Σ)呈显著负相关(P < 0.01)。衰亡期菹草生物量与TN、TP及Chl.a浓度均呈显著正相关关系(P < 0.05),与SD呈显著负相关(P < 0.05),与TLI(Σ)呈显著正相关(P < 0.01)(图 4)。结果进一步验证了菹草在生长期对水质的净化效果,此时菹草生物量越高,对水质的净化效果越好,而在衰亡期菹草生物量越高,水质越差。
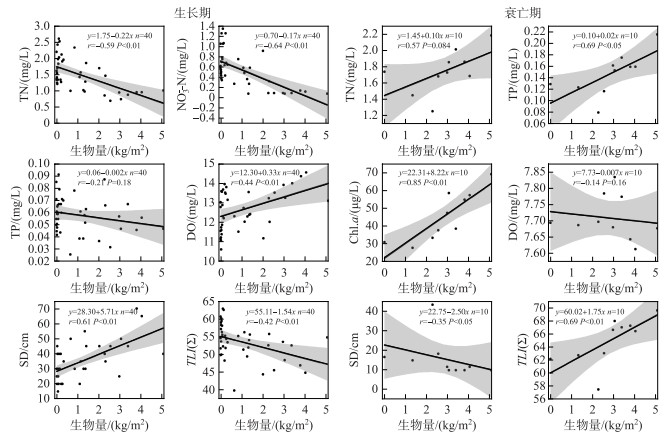
|
图 4 菹草生物量与水质指标的线性回归分析 Fig.4 Linear regression analysis of Potamogeton crispus biomass and water quality parameters |
7次调查共鉴定出浮游植物105种,隶属7门48属。种类最多的是绿藻门46种(43.8%),其次是硅藻门29种(27.6%)、蓝藻门16种(15.2%),其他门类种类数较少:裸藻门5种(4.76%)、隐藻门4种(3.8%)、甲藻门4种(3.8%)、金藻门1种(0.95%)。高邮湖菹草生长期与衰亡期浮游植物总属(种)数差异不显著,生长期和衰亡期浮游植物优势类群均为硅藻门、蓝藻门和绿藻门。
2.3.2 优势种变化菹草生长期的优势种类数多于衰亡期,各时期优势种均以蓝藻门为主(表 3)。生长期优势种主要为假鱼腥藻(Pseudoanabaena sp.)和长孢藻(Dolichospermum sp.),衰亡期优势种主要为浮丝藻(Planktothrix sp.)、平裂藻(Merismopedia sp.)和微囊藻(Microcystis sp.),衰亡后期微囊藻是绝对优势种群。
| 表 3 菹草生长衰亡过程浮游植物优势种及优势度 Tab. 3 Dominant species and dominance of phytoplankton during the growth and decomposition period of Potamogeton crispus |
在调查期内浮游植物密度表现为衰亡期远高于生长期(图 5),其中衰亡期平均密度为2.19×108 cells/L,生长期平均密度为0.58×108 cells/L。从密度上看,蓝藻门为绝对优势类群,其次是硅藻门。浮游植物的生物量变化情况与密度类似,生长期平均生物量为13.47 mg/L,衰亡期平均生物量为36.20 mg/L。从浮游植物密度、生物量动态变化上可以看出,菹草在生长期对浮游植物生长繁殖具有一定的抑制作用。
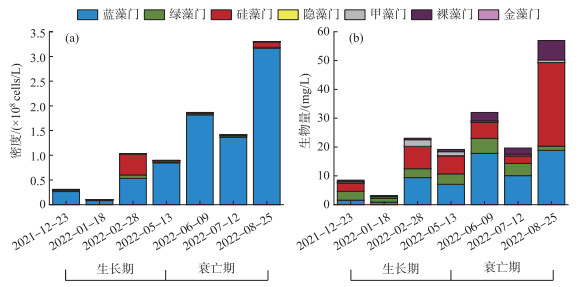
|
图 5 菹草生长衰亡过程中浮游植物密度和生物量动态变化 Fig.5 Dynamics of phytoplankton density and biomass during the growth and decomposition period of Potamogeton crispus |
对比菹草生长期与衰亡期不同生物量下浮游植物密度与生物量差异可以看出,生长期浮游植物密度随菹草生物量的增加而降低,高、中、低生物量区浮游植物密度分别为0.72×108、0.45×108、0.23×108 cells/L。菹草生长期浮游植物生物量差异梯度表现为高生物量区 < 低生物量区 < 中生物量区,生物量分别为9.83、13.93、15.14 mg/L。菹草衰亡期浮游植物密度梯度表现与生长期相反,高、中、低生物量区密度分别为2.96×108、1.71×108、1.02×108 cells/L。菹草衰亡期浮游植物生物量梯度表现与密度梯度趋势一致,高、中、低区生物量分别为48.01、31.79、19.31 mg/L。
2.4 浮游植物多样性与水质相关性分析高邮湖浮游植物H′、D与J均呈现出生长期高于衰亡期的趋势,且衰亡期内持续下降,通过浮游植物多样性指数对水环境状况进行评价:对于H′,生长期在2.28~2.61之间,水体处于轻度污染状态;衰亡期在1.27~1.98之间,水体处于中度污染状态。对于D,生长期在0.66~0.74之间,衰亡期在0.33~0.63之间。对于J,生长期在0.52~0.66之间,处于轻度污染至中度污染状态,衰亡期在0.28~0.45之间,处于中度污染至重度污染状态。总体上菹草生长期的水环境优于菹草衰亡期。H′、D、J均呈现出生长期高于衰亡期的趋势,表明菹草生长期的浮游植物群落比衰亡期的更加稳定与均匀,而菹草衰亡期的浮游植物群落物种多样性与均匀度有所降低,说明衰亡期浮游植物优势种趋于单一化。
各水质指标与浮游植物密度、生物量和多样性指数的相关性分析结果显示(表 4),DO、SD与浮游植物密度、生物量均呈显著负相关(P < 0.01),TP、CODMn、DOC以及TLI(Σ)均与浮游植物密度和生物量呈显著正相关关系(P < 0.01)。DO与H′、D、J均呈显著正相关关系(P < 0.05),TP、DOC、TLI(Σ)与H′、D、J呈显著负相关(P < 0.01)。
| 表 4 水质指标与浮游植物密度、生物量和多样性指数的Pearson相关性分析 Tab. 4 Pearson correlation analysis of water quality indicators with phytoplankton density, biomass and diversity indices |
分别对菹草不同生物量区生长期与衰亡期的浮游植物群落数据进行去趋势分析(DCA),得出排序轴最大梯度长度为2.574和3.192,因此选择RDA进行约束性排序。RDA结果显示(图 6),在菹草生长期,浮游植物群落主要受DO、NH3-N、NO3--N、CODMn的影响,前两轴累计解释了82.86%的物种与环境之间的关系。在菹草衰亡期,浮游植物群落主要受pH、TP、NO3--N、CODMn、DO、NH3-N的影响,前两轴累计解释了80.25%的物种与环境之间的关系。
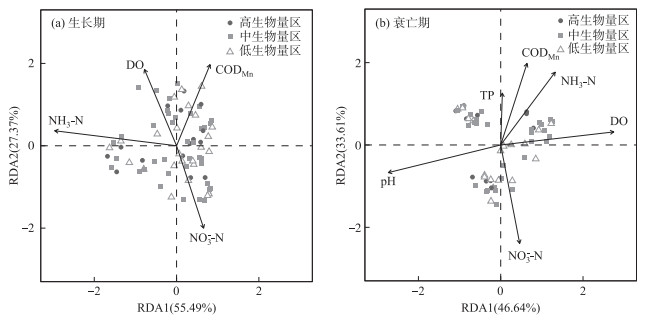
|
图 6 菹草生长衰亡期浮游植物与环境因子的RDA分析 Fig.6 RDA analysis of phytoplankton community density during growth and decomposition period of Potamogeton crispus |
利用GLM筛选出菹草生物量、TN、NH3-N、Chl.a对浮游植物生物量有影响。采用分段结构方程模型分析菹草生长期如何影响浮游植物群落。从图 7可以看出,在菹草生长期,菹草生物量对TN、Chl.a以及浮游植物生物量有负影响,对NH3-N有正影响,而NH3-N和Chl.a对浮游植物生物量有显著正影响,TN对浮游植物生物量有显著负影响。菹草生长可以通过自身生物量的变化以及改变水体营养盐等方式影响浮游植物群落结构。
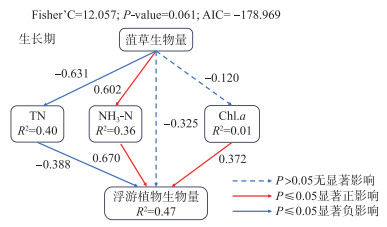
|
图 7 菹草生长期分段结构方程模型 Fig.7 Piecewise structural equation of growth of Potamogeton crispus |
本研究结果显示,在菹草生长衰亡过程中,水体TN、TP表现为生长期内浓度较低,总体呈下降趋势,衰亡期时浓度急剧升高。研究表明,水生植物在生长期对氮、磷营养盐和有机质有较好的去除净化效果[23-24]。在生长前期,菹草会不断从水体中吸收氮,而菹草的衰亡释放大量氮导致水体TN和硝态氮浓度升高。生长期菹草对内源磷释放表现为抑制作用,且随着菹草密度升高其对内源氮、磷的抑制作用增强[25]。在菹草衰亡分解过程中,植株分解形成的有机碎屑及可溶性磷导致水体TP浓度升高。
研究表明,菹草在生长期间有提高水体透明度的作用[26]。本研究发现在菹草生长期水体透明度随着菹草的生长逐步提高。菹草其繁茂的根系在水中还可以形成紧密的过滤层,植物的茎和叶还可以一定程度地减缓水流速度,以达到沉淀泥沙和有机颗粒物的作用,从而提高水体透明度[27]。而在菹草衰亡期,菹草植株的衰亡降解造成水体透明度下降,同时浮游植物快速生长导致水体浑浊,此外植物体碎屑在分解阶段一部分在水体悬浮,导致湖体透明度显著下降,悬浮颗粒物增多,甚至会引起湖泛导致水色浑浊[28-29]。由于水生植物光合作用放氧及生长期水体较少的有机物分解耗氧[30],水体DO浓度于生长期处于较高水平。而在菹草衰亡期,植株根茎叶腐烂分解消耗水体DO,造成水体DO浓度降低。低DO浓度可以抑制底泥-水体界面的硝化作用,促进底泥磷酸盐的释放,调控底泥氮、磷释放过程,进而影响水体中氮、磷浓度[31],菹草死亡分解时可能通过降低湖体底部溶解氧的方式来促进内源氮、磷营养盐的释放,这也可能是水体中TN、TP浓度升高的主要原因[32]。在本研究中,在菹草生长过程中pH变化不明显,变化范围在8.42~8.77之间,衰亡初期pH显著下降至7.45。衰亡初期pH显著下降的原因可能是,在菹草腐烂分解初期会产生一定有机酸,导致上覆水pH下降,而衰亡中后期pH有所回升,可能是大量的藻类通过光合作用吸收了水中的CO2,引起水体碱度升高,pH值上升,此外菹草残体还会释放含氮有机物,被微生物作用生成氨气和氨类物质,也会导致pH值的上升[33]。
在菹草生长期,水质随菹草的生长有改善的趋势,且这一趋势在菹草高、中生物量区较低生物量区更明显,高生物量区水体SD最高且TN、TP浓度下降最明显。康丽娟等[34]对比春季菹草生长区(有草区)和无草区发现,春季有草区水体SD显著高于无草区。杨文斌等[35]研究发现南京玄武湖菹草分布密集的区域TN浓度低于无草区。李印霞等[36]研究巢湖菹草生长期对水质的影响发现有菹草区域水体中TN、TP浓度明显较低。汪欣等[37]探究水生植物对水质改善效果得出:示范区水体透明度改善效果明显,比敞水区提高30%,示范区水体TN、NH3-N和TP去除效果明显,比敞水区分别降低32%、28%和28%,其结果与本研究结果相似,进一步说明水生植物对湖体水质净化效果明显。由衰亡期菹草不同生物量下水质指标差异可以初步看出,菹草分布茂密的湖区氮、磷营养盐以及Chl.a浓度均较高,同时溶解氧浓度和透明度较低。王晓栋 [38]通过室内模拟水生植物的腐烂过程,得出水生植物生物量越高,对水质的影响越大这一结论。水生植物生物量越高,衰亡腐解所释放的污染物质浓度越高,微生物分解植物残体耗氧量就越大,水质恶化程度就越高。
3.2 菹草生长衰亡过程对浮游植物的影响本研究结果显示,在菹草生长衰亡过程中浮游植物物种组成、密度、生物量、优势种均表现出明显的时空差异性。从时间尺度上看,浮游植物群落组成由绿藻-硅藻型向硅藻-蓝藻型转变。菹草生长期浮游植物密度、生物量低于衰亡期。在空间尺度上,生长期菹草生物量较高的区域浮游植物密度显著低于生物量较低的区域,衰亡期菹草生物量较高的区域浮游植物密度高于生物量较低的区域。
菹草生长衰亡过程会导致水体环境因子发生变化,而环境因子是影响浮游植物群落分布的主要因素,水体的透明度、TN、TP等环境因子都会对浮游植物群落结构产生影响[39]。由RDA分析结果可知,菹草生长期和衰亡期浮游植物的环境影响因子略有差异,在菹草生长期DO、CODMn、NH3-N、NO3--N是浮游植物的主要环境影响因子,而在菹草衰亡期浮游植物群落的主要影响因子为DO、CODMn、NH3-N、NO3--N、TP和pH。在菹草衰亡期,菹草植株的腐烂降解以及藻类的暴发都会造成水体pH的显著变化。刘兵钦等[40]发现菹草衰亡降解过程中水体磷浓度显著上升,有研究表明磷元素是湖泊水体中浮游植物群落和密度的第一限制营养元素[41],菹草衰亡导致TP浓度的升高,使得浮游植物密度与生物量均显著提高。
分段结构方程模型表明,在菹草生长期,菹草生物量对浮游植物生物量有负影响,这是由于菹草生长期间与水体中浮游植物存在竞争关系且占据优势,对浮游植物具有良好的控制作用。Pakdel等[42]发现菹草生长能释放化感物质,抑制藻类的生长,同时菹草主要影响水体中氮浓度进而抑制浮游植物的生长。王晓光等[43]通过对照实验发现在春季种植菹草的实验组TN去除率高于对照组。尹传宝等[44]通过室内模拟实验研究菹草生长过程对水体各种形态氮的作用效果,表明在菹草生长前期,菹草会吸收水体中的氮。康丽娟等[34]发现春季有草区TN浓度低于无草区,且有草区的蓝藻生物量显著低于无草区,而在夏季有草区的蓝藻生物量高于无草区,本研究得到的结果与其一致。在菹草衰亡期,菹草衰亡分解释放大量营养盐,同时菹草衰亡腐烂时会使植物体中的有机质大量释放,为藻类生长提供碳源,加之气温等因素的影响,导致藻类暴发[45]。
4 结论高邮湖菹草在生长期对改善水质有一定的效果,可以降低水中氮、磷营养盐浓度,提高水体透明度,抑制浮游植物生长;但菹草的衰亡和腐烂分解会释放营养盐,促进浮游植物生长,降低水体透明度,对水体生态环境产生不利影响。因此,要加强对高邮湖中菹草的控制与管理,在菹草生长盛期进行选择性收割,既要有效发挥生长期净水作用,又要降低衰亡期对水质的危害。本研究揭示了高邮湖菹草生长衰亡期对水环境、水生态的影响机制,可为菹草占优的浅水湖泊水质管理与保护提供参考。
| [1] |
Jia FC, Wu YB, Zhao JY et al. Research progress on the growth habits and control methods of submerged plant Potamogeton crispus. Pearl River, 2021, 42(6): 47-51. [贾凤聪, 吴亚斌, 赵进勇等. 沉水植物菹草生长习性与治理方法研究进展. 人民珠江, 2021, 42(6): 47-51. DOI:10.3969/j.1001-9235.2021.06.008] |
| [2] |
Wu DH, Chen FF, Meng XC et al. Research progress on the growth habits and control methods of submerged plant Potamogeton crispus. China Environmental Science, 2023, 43(4): 1834-1843. [吴东浩, 陈芳斐, 孟晓辰等. 基于沉水植物的太湖适宜生态水位研究. 中国环境科学, 2023, 43(4): 1834-1843.] |
| [3] |
Xiang SL, Zhu MY, Zhu GW et al. Influence of macrophytes on water quality in the eastern bays of Lake Taihu, China. China Environmental Science, 2014, 34(11): 2881-2887. [向速林, 朱梦圆, 朱广伟等. 太湖东部湖湾大型水生植物分布对水质的影响. 中国环境科学, 2014, 34(11): 2881-2887.] |
| [4] |
陈小峰. 不同光照环境条件下菹草(Potamogeton crispus)生物学特征, 形态解剖及其生理特性研究[学位论文]. 南京: 南京农业大学, 2006.
|
| [5] |
Hua ZL, Zhu X, Shen J et al. Response of water quality to different growth periods of Potamogeton crispus in Luoma Lake. Water Resources Protection, 2019, 35(2): 25-31. [华祖林, 朱翔, 沈健等. 骆马湖水质对菹草不同生长期的响应研究. 水资源保护, 2019, 35(2): 25-31. DOI:10.3880/j.issn.1004-6933.2019.02.004] |
| [6] |
Ma HJ, Li RM, Tang SK et al. Analysis of rotifer community structure and evaluation of water quality ecology in Gaoyou Lake. Jiangsu Agricultural Sciences, 2021, 49(1): 192-197. [马会娟, 李茹梦, 唐晟凯等. 高邮湖轮虫群落结构分析及水质生态学评价. 江苏农业科学, 2021, 49(1): 192-197. DOI:10.15889/j.issn.1002-1302.2021.01.035] |
| [7] |
Wu D, Zhao D, Zhu X et al. Sedimentology and seismic geomorphology of a lacustrine depositional system from the deep zone of the Gaoyou Sag, Subei Basin, Eastern China. Australian Journal of Earth Sciences, 2017, 64(2): 265-282. DOI:10.1080/08120099.2017.1279213 |
| [8] |
Cai P, Liu RK, Gao MY et al. Spatial temporal changes and driving factors of water quality in Gaoyou Lake from 2009 to 2021. Jiangsu Water Resources, 2023(5): 4-9. [蔡平, 刘荣坤, 高鸣远等. 2009-2021年高邮湖水质时空变化与驱动因素. 江苏水利, 2023(5): 4-9.] |
| [9] |
Qu X, Chen YS, Liu H et al. A holistic assessment of water quality condition and spatiotemporal patterns in impounded lakes along the eastern route of China's South-to-North Water Diversion Project. Water Research, 2020, 185: 116275. DOI:10.1016/j.watres.2020.116275 |
| [10] |
Guan YY, Yu GL, Han RM et al. Changes in water area of Gaoyou Lake(including Shaobo Lake) and the influencing factors in the past 30 years. Research of Environmental Sciences, 2019, 32(12): 2057-2064. [管玉莹, 虞功亮, 韩睿明等. 近30年来高邮湖(含邵伯湖)自然水域面积变化及其影响因素. 环境科学研究, 2019, 32(12): 2057-2064. DOI:10.13198/j.issn.1001-6929.2019.06.27] |
| [11] |
Tian CC, Guo CB, Wu XQ. Distribution of submerged plants and its relationship with environmental factors in Gaoyou Lake. Acta Hydrobiologica Sinica, 2019, 43(2): 423-430. [田翠翠, 郭传波, 吴幸强. 高邮湖沉水植物分布格局及其与水环境因子的关系. 水生生物学报, 2019, 43(2): 423-430. DOI:10.7541/2019.052] |
| [12] |
Wang WL, Wang GX, Li Q et al. Purification effect of Potamogeton crispus - Elodea nuttallii community on eutrophic water body quality. Journal of Nanjing Normal University: Natural Science, 2006, 29(4): 111-116. [王文林, 王国祥, 李强等. 菹草伊乐藻群落对富营养化水体水质的净化效果. 南京师大学报: 自然科学版, 2006, 29(4): 111-116. DOI:10.3969/j.issn.1001-4616.2006.04.025] |
| [13] |
Xu WW, Hu WP, Deng JC et al. Influence of harvesting Potamogeton crispus in a submerged plant community on the growth of submerged aquatic plants and their effects on water quality. Ecology and Environmental Sciences, 2015, 24(7): 1222-1227. [徐伟伟, 胡维平, 邓建才等. 菹草生物量控制对群落中沉水植物生长及水质的影响. 生态环境学报, 2015, 24(7): 1222-1227.] |
| [14] |
He F, Wu ZB, Qiu DR. Allelopathic effects between aquatic plant(Potamogeton crispus) and algae(Scenedesmus obliquus) in the enclosures at Donghu Lake. Acta Hydrobiologica Sinica, 2002, 26(4): 421-424. [贺锋, 吴振斌, 邱东茹. 东湖围隔中菹草与藻类生化他感作用的初步研究. 水生生物学报, 2002, 26(4): 421-424.] |
| [15] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第4版). 北京: 中国环境科学出版社, 2002.
|
| [16] |
胡鸿钧, 李尧英, 魏印心. 中国淡水藻类——系统、分类及生态. 上海: 上海科学技术出版社, 1980.
|
| [17] |
韩茂森, 束蕴芳. 中国淡水生物图谱. 北京: 海洋出版社, 1995.
|
| [18] |
Wang MC, Liu XQ, Zhang JH. Evaluate method and classification standard on lake eutrophication. Environmental Monitoring in China, 2002, 18(5): 47-49. [王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47-49. DOI:10.19316/j.issn.1002-6002.2002.05.023] |
| [19] |
Oberauer K, Weidenfeld A, Höring R. The quarterly journal of experimental psychology. Quarterly Journal of Experimental Psychology, 2008, 63(1): 147-159. DOI:10.1080/17470210902853522 |
| [20] |
Simpson EH. Measurement of diversity. Nature, 1949, 163(4148): 688. DOI:10.1038/163688a0 |
| [21] |
Pielou EC. Species-diversity and pattern-diversity in the study of ecological succession. Journal of Theoretical Biology, 1966, 10(2): 370-383. DOI:10.1016/0022-5193(66)90133-0 |
| [22] |
Li G, Lin ML, Chen C et al. Autumn and winter characteristics of phytoplankton community structure and its relationship with environmental factors in the northern Jiangsu section of grang canal. Journal of Hydroecology, 2021, 42(5): 119-126. [李港, 林妙丽, 陈诚等. 京杭运河苏北段秋冬季浮游植物群落结构特征及其与环境因子的关系. 水生态学杂志, 2021, 42(5): 119-126. DOI:10.15928/j.1674-3075.202105250164] |
| [23] |
Liu CL, Yuan XF, Li YQ et al. Hydrophyte debris induced sedimentary phosphorus release in Tuojiang Rivers, China. Bulletin of Environmental Contamination and Toxicology, 2023, 110(6): 103. DOI:10.1007/s00128-023-03744-2 |
| [24] |
Li XF, Zhang XY, Chen XW et al. Study on effect of nutrient salt in Fuyang River by 3 aquatic plants. Yangtze River, 2019, 50(4): 48-52. [李秀芳, 张潇月, 陈晓蔚等. 3组水生植物对滏阳河营养盐去除效果研究. 人民黄河, 2019, 50(4): 48-52.] |
| [25] |
Dong B, Wang LZ, Song HL et al. Denitrification hotspots existed in the epiphytic biofilms on submerged macrophyte Potamogeton crispus during explosive growing stage in urban river. J Lake Sci, 2023, 35(1): 145-154. [董彬, 王立志, 宋红丽等. 暴发生长期菹草(Potamogeton crispus)附着生物膜成为城市河流反硝化作用热点. 湖泊科学, 2023, 35(1): 145-154. DOI:10.18307/2023.0109] |
| [26] |
Qiu DR, Wu ZB, Liu BY et al. The restoration of aquatic macrophytes for improving water quality in a hypertrophic shallow lake in Hubei Province, China. Ecological Engineering, 2001, 18(2): 147-156. DOI:10.1016/s0925-8574(01)00074-x |
| [27] |
Guo JJ, Cai GJ, Chen YQ et al. Effect of sediment type and species abundance on modularization growth and root development of submerged macrophytes. J Lake Sci, 2023, 35(5): 1562-1577. [郭晶晶, 蔡国俊, 陈瑶琪等. 基质类型和物种丰度对沉水植物模块化生长及根系发育的影响. 湖泊科学, 2023, 35(5): 1562-1577. DOI:10.18307/2023.0515] |
| [28] |
Cao Y, Ye YT, Zhao HL et al. Remote sensing of total suspended matter concentration and turbidity in a macrophytic lake. Journal of Remote Sensing, 2019, 23(6): 1253-1268. [曹引, 冶运涛, 赵红莉等. 草型湖泊总悬浮物浓度和浊度遥感监测. 遥感学报, 2019, 23(6): 1253-1268. DOI:10.11834/jrs.20198144] |
| [29] |
Lu X, Liu C, Yin HB et al. The main sulfur-containing odorous compounds and their forming mechanisms in waters during bio-induced black bloom. J Lake Sci, 2015, 27(4): 583-590. [卢信, 刘成, 尹洪斌等. 生源性湖泛水体主要含硫致臭物及其产生机制. 湖泊科学, 2015, 27(4): 583-590. DOI:10.18307/2015.0404] |
| [30] |
Wang JQ, Song YZ. Effect of UV-b radiation on morphological plasticity, foraging responses and turion of Potamogeton crispus. Applied Ecology and Environmental Research, 2023, 21(2): 1389-1407. DOI:10.15666/aeer/2102_13891407 |
| [31] |
Hu MC, Zhu T, Jiang QS et al. Simulation study on nitrogen and phosphorus reycling response of changing dissolved oxygen concentration in Lake Dianchi. Acta Scientiarum Naturalium Universitatis Pekinensis, 2021, 57(3): 481-488. [胡梦辰, 朱滔, 蒋青松等. 滇池溶解氧浓度变化的氮磷循环响应模拟研究. 北京大学学报: 自然科学版, 2021, 57(3): 481-488. DOI:10.13209/j.0479-8023.2021.024] |
| [32] |
Chen HS, Ye C, Li CH et al. Simulation study on decomposition and release of nutrients from aquatic macrophyte communities in confluence area between lake and river. Journal of Environmental Engineering Technology, 2020, 10(2): 220-228. [陈洪森, 叶春, 李春华等. 入湖河口区水生植物群落衰亡分解释放营养盐过程模拟研究. 环境工程技术学报, 2020, 10(2): 220-228. DOI:10.12153/j.issn.1674-991X.20190108] |
| [33] |
Zhu QC, Yang WD, Cheng H. Test of Potamogeton crispus decomposing in water. Modern Agricultural Science and Technology, 2013(23): 224-226, 229. [朱庆川, 杨卫东, 程红. 菹草在水体中腐烂分解试验研究. 现代农业科技, 2013(23): 224-226, 229.] |
| [34] |
Kang LJ, Xu H, Zou W et al. Influence of Potamogeton crispus on lake water environment and phytoplankton community structure. Environmental Science, 2020, 41(9): 4053-4061. [康丽娟, 许海, 邹伟等. 菹草对湖泊水质及浮游植物群落结构的影响. 环境科学, 2020, 41(9): 4053-4061. DOI:10.13227/j.hjkx.202002006] |
| [35] |
Yang WB, Wang GX. Environmental effects of Potamogeton crispus population in Lake Xuanwu, Nanjing. J Lake Sci, 2007, 19(5): 572-576. [杨文斌, 王国祥. 南京玄武湖菹草种群的环境效应. 湖泊科学, 2007, 19(5): 572-576. DOI:10.18307/2007.0512] |
| [36] |
Li YX, Liu BB, Cao ZL et al. Studies on environmental impact of Potamogeton crispus on sediment and overburden water of Chaohu Lake. Transactions of Oceanology and Limnology, 2020(3): 127-132. [李印霞, 刘碧波, 曹志林等. 菹草对巢湖底泥及上覆水环境影响的研究. 海洋湖沼通报, 2020(3): 127-132.] |
| [37] |
Wang X, He SW, Pan JZ et al. Effects of aquatic plant restoration on water quality and microbial functional diversity of Wanshan Lake. Journal of Ecology and Rural Environment, 2021, 37(10): 1352-1360. [汪欣, 何尚卫, 潘继征等. 水生植物恢复对宛山荡水质及水体微生物代谢功能多样性的影响. 生态与农村环境学报, 2021, 37(10): 1352-1360. DOI:10.19741/j.issn.1673-4831.2020.0913] |
| [38] |
王晓栋. 南四湖主要水生植物腐烂过程及污染释放通量研究[学位论文]. 山东: 山东建筑大学, 2019.
|
| [39] |
Zhang YL, Qin BQ, Chen WM et al. Chlorophyll a content and primary productivity of phytoplankton in Meiliang Bay of Taihu Lake. Chinese Journal of Applied Ecology, 2004, 15(11): 2127-2131. [张运林, 秦伯强, 陈伟民等. 太湖梅梁湾浮游植物叶绿素a和初级生产力. 应用生态学报, 2004, 15(11): 2127-2131. DOI:10.13287/j.1001-9332.2004.0439] |
| [40] |
Liu BQ, Wang WX, Song CL et al. Influences of Potamogeton crispus L. on phosphorus status in lake sediments. Journal of Wuhan Botanical Research, 2004, 22(5): 394-399. [刘兵钦, 王万贤, 宋春雷等. 菹草对湖泊沉积物磷状态的影响. 武汉植物学研究, 2004, 22(5): 394-399.] |
| [41] |
Redfield AC. The influence of organisms on the composition of sea-water. Sea, 1963, 40(6): 640-644. |
| [42] |
Pakdel FM, Sim L, Beardall J et al. Allelopathic inhibition of microalgae by the freshwater stonewort, Chara australis, and a submerged angiosperm, Potamogeton crispus. Aquatic Botany, 2013, 110: 24-30. DOI:10.1016/j.aquabot.2013.04.005 |
| [43] |
Wang XG, Li XP, Liu JT et al. Study on the water purification of Potamogeton crispus in different habitats in water. Environment Pollution & Control, 2012, 34(3): 30-34. [王华光, 李小平, 刘剑彤等. 冬季不同生境下菹草的水质净化效果研究. 环境污染与防治, 2012, 34(3): 30-34.] |
| [44] |
Yin CB, Wang L, Zhang CY et al. Effect of Potamogeton crispus on different species of nitrogen in spring. China Rural Water and Hydropower, 2014(3): 9-11, 15. [尹传宝, 王龙, 张翠英等. 春季菹草对水体中各形态氮的作用效果研究. 中国农村水利水电, 2014(3): 9-11, 15. DOI:10.3969/j.issn.1007-2284.2014.03.003] |
| [45] |
Ejgemann F, Rahav E, Grossart HP et al. Phytoplankton producer species and transformation of released compounds over time define bacterial communities following phytoplankton dissolved organic matter pulses. Applied and Environmental Microbiology, 2023, 89(7). DOI:10.1128/aem.00539-23 |
 2024, Vol. 36
2024, Vol. 36 


