(2: 上海市青浦区水文勘测队, 上海 201799)
(3: 上海师范大学, 上海长三角城市湿地生态系统国家野外科学观测研究站, 上海 200234)
(2: Shanghai Qingpu Hydrological Investgation Team, Shanghai 201799, P.R. China)
(3: Yangtze River Delta Urban Wetland Ecosystem National Field Observation and Research Station, Shanghai Normal University, Shanghai 200234, P.R. China)
营养程度与水体的健康状况和质量密切相关,如何准确地反映出水体的营养程度是普遍关注的问题。理化指标的测定与评价方法简单便捷,在实现自动化监测后能够实现长期监测。生物监测不仅能够反映污染物的累积效应、协同效应[1],还可以反映生态系统的健康状况[2]。通过比较一段时间内生物多样性指数或群落结构特征的变化,可以了解水体营养状态的改变对水生生物的影响程度,从而帮助管理者在不利因素达到生态系统容纳量之前进行干预[3-4]。因此生物监测在水环境监测中具有不可替代的作用。
上海经济发展活跃,高密度的人口和频繁的开发活动给生态环境带来了巨大的压力。景观水体是城市水体的主要组成部分,为人们提供着美学价值,并常常在本地和景观尺度上提供了宝贵的生物多样性来源[5]。然而景观水体封闭性强、流动性差。营养盐容易蓄积,造成水华的暴发。如何准确地反映出水体富营养的变化一直以来是大家都关注的问题。
浮游动物是水生态监测中重点关注的类群之一,轮虫由于种类多、数量大,是浮游动物的重要组成部分,从而受到诸多重视。轮虫在淡水生态系统中扮演着重要的角色:作为初级消费者,它们以更微小的藻类、细菌、碎屑为食物[6];同时其又被鱼类及其他高等级消费者所捕食,是连接微食物网和经典食物网的重要环节。轮虫种类多,生命周期短,种群重建快,能对环境变化做出迅速的反应[7]。鉴于此,轮虫常被用作水环境监测和评价的重要生物类群[8-9],在评价水质和生态环境健康状态中具有重要的作用。国内外常将轮虫作为指示水体污染情况和营养状态的指示生物[10],最早可见于Kolkwitz和Marsson(1902年、1909年)的研究[11-12],表明有18种轮虫对各污生带具有指示作用。在研究湖泊富营养化时人们发现随着水体营养状态的改变,轮虫的群落结构发生了明显的变化。Karabin[13]归纳出指示水体贫营养或富营养状态的轮虫种类,继而通过轮虫的优势种或通过指示富营养与指示贫营养种类的比值等方法进行水体营养状态的判断[10, 13-15]。然而这些方法在实践过程中遇到了很多问题,例如,评价结果与理化评价结果有较大出入[16];在同一营养等级下,不同的生物评价方法结果不一致[16-18];指示种及指示值缺失无法评价[19-20];污生生物系统与富营养化概念混用[21-22]等情况。
因此,为了更好地将轮虫运用于水生态监测中,如何正确使用轮虫来评价水体的营养状态、哪些情况下用轮虫评价水质状况效果好是值得探究的问题。目前已有一些学者对此进行了初步探究,例如Liang等[23-24]的研究认为,QB/T指数在我国华南地区盐度低于34%的半咸水中具有指示营养状态的作用,但是在没有盐度的中南部河湖中QB/T指示作用不佳;Jurczak等[25]的研究认为TSIROT指数不适用于水体营养状态过高、轮虫密度受限的水体;Gutkowska等[26]的研究认为TSIROT指数在评价半咸水时效果不佳。本研究对上海市及其周边水体进行了采样调查,旨在进一步探究轮虫密度、生物量和α多样性指数(Shannon指数、Simpson指数、Pielou指数)与水体营养状态的关系。此外,选择3种轮虫指数(QB/T指数、E/O指数、TSIROT指数)[15-16, 23, 25, 27-38]探究其评价水体营养状态的效果,以期提高轮虫指示水体营养状态的有效性,为深入探究轮虫在指示水体营养状态的改变对水生生物的影响程度,以及将轮虫相关指标融入生态健康评价提供参考,同时也为生态环境监测中使用轮虫指示水体营养状态提供参考建议。
1 材料方法 1.1 样品采集与处理方法本次研究共计涉及38处调查区域,57个水体,126个样点(图 1)。于2014年1-12月、2021年8月-2022年8月分季节进行水样标本采集和水环境指标测定。样品采集与处理参照《淡水浮游生物研究方法》[39]进行。轮虫定量样品用1 L采水器在水面以下0.5 m处采集水样,后倒入1 L采样瓶中。现场向水样中添加15 mL鲁哥氏液(即水样体积的1.5%)。1 L定量样品带回实验室静置24 h(共48 h),用虹吸法缓慢吸去上清最终定容至50 mL,之后加入4 % 甲醛溶液长期保存。镜检计数时吸取1 mL浓缩液至1 mL的计数框中,轮虫样品在10×10和10×20的放大倍数下进行全片镜检。镜检计数时尽可能鉴定到最小分类单元,轮虫的鉴定参照文献[40-43]。每一瓶定量样品至少3次重复镜检,并换算出浮游动物在1 L水内的丰度。生物量参照《淡水浮游生物研究方法》[39]采用近似几何体积法进行估算。实验室内采用HACH DR/2800型便携式分光光度计测定总氮(TN)、总磷(TP)和化学需氧量(COD)。TN、TP浓度测定参照GB 11894-1989和GB 11893-1989,COD测定采用高锰酸钾氧化法。

|
图 1 调查区域位置及水体分布情况(括号内为该区域调查水体数) Fig.1 Location and distribution of water bodies in the survey area (number of investigated water bodies in parentheses) |
综合营养状态指数(TLI)的计算参照中国环境监测总站设定的《湖泊(水库)富营养化方法分级技术规定》,本研究以COD、TP、TN作为候选指标,具体公式参照文献[44],按TLI的值对水体营养状态进行划分,标准见附表Ⅰ。
1.2.2 QB/T指数、E/O指数、轮虫富营养化等级指数(TSIROT)的计算选用QB/T指数[10]、E/O指数[45-46]、轮虫富营养化等级指数(TSIROT)[9]3个与轮虫相关的生物指数来判断水体营养程度。QB/T指数、E/O指数公式为:
| QB/T= 臂尾轮属轮虫种类数 异尾轮属轮虫种类数 | (1) |
| E/O= 富营养型种种类数 贫营养型种种类数 | (2) |
贫营养型种和富营养型种的判断参照《内陆水域渔业自然资源调查手册》[45]中提供的名录。根据QB/T指数值或E/O指数值对水体营养状态进行划分的标准见附表Ⅱ和附表Ⅲ。
轮虫富营养化等级指数(TSIROT)的计算参照Ejsmont-Karabin[9],Dimictic组、Polymictic组和综合湖泊类型组的公式分别记为TSIROTD、TSIROTP和TSIROTZH,具体公式详见附表Ⅳ。由于晶囊轮属(Asplanchna spp.)的轮虫体积明显比其他轮虫大,对指数的影响权重较大,故在计算中排除[9]。柱足腹尾轮虫(Gastropus stylifer)和较大多肢轮虫(Polyarthra major)在Ejsmont-Karabin[9]的研究中作为贫营养指示种,参与IHT(指示水体富营养化的物种占所有指示种的比例)子公式的计算。虽然在《中国淡水轮虫志》中提到柱足腹尾轮虫与腹足腹尾轮虫(Gastropus hyptopus)的生活习性与分布情况基本一致[41],本研究未发现柱足腹尾轮虫,但是本研究中腹足腹尾轮虫在富营养水体中常被发现。由于依据的鉴定系统不同,在本研究中并未将多肢轮虫细分为较大多肢轮虫,且在Karabin[13, 47]的研究中发现广生多肢轮虫(Polyartbra vulgaris)与水体营养等级之间的关联性较弱;红多肢轮虫(Polyartbra renata)和长肢多肢轮虫(Polyartbra dolichoptera)是富营养湖泊的指示种;较大多肢轮虫是贫营养型湖泊的指示种。本研究认为将按照《中国淡水轮虫志》的系统鉴定出的针簇多肢轮虫(Polyarthra trigla)或者多肢轮虫属都作为贫营养或者富营养的指示种是不合适的。因此在计算时均仅选用TSIROT1~TSIROT5公式进行计算,不将TSIROT6纳入计算,即TSIROT=(TSIROT1+TSIROT2+TSIROT3+TSIROT4+TSIROT5)/5。TSIROT的值与营养状态的对应关系见附表Ⅴ[9]。
1.2.3 α多样性指数使用R(4.2.1)软件“vegan”包中的diversity函数计算Shannon多样性指数和Simpson多样性指数。依据Shannon多样性指数和各点位种类数计算得到Pielou均匀度指数。
1.2.4 K均值聚类与回归分析首先对物种数据进行Bray-Curtis转化,后再对矩阵进行开方使其具有欧式距离属性。使用平均轮廓数法(average silhouette method)确定分组数,后使用stats包中的kmeans函数进行K均值聚类。使用factoextra包中的fviz_cluster()函数对聚类结果进行可视化,同时采用轮廓宽度图来检验分组的效果。
使用局部加权回归(loess)呈现出自变量与响应变量之间大致的回归关系。使用分段回归(piecewise regression)来根据响应变量的状态找到合适的断点位置,从而在不同区间段内更好地构建回归关系,描述自变量与响应变量之间的关系。涉及到的软件包有:segmented、car、stats。
1.2.5 Kendall协调一致性检验(Kendall's W test)由于不同的评价方法在其划分的营养等级描述上存在差异,为了便于横向比较评价结果的差异,综合Ejsmont-Karabin[9]提出的轮虫四分法(附表Ⅲ)和理化TLI划分标准,将营养等级从中营养到重及超富营养排列为4个等级(1~4)。采用Kendall协调一致性检验(Kendall's W test)来衡量不同评价体系下等级变量间的一致性。一般认为在检验显著的前提下,Kendall协调系数越接近1,则评价结果的一致性越强。
1.2.6 NMDS分析使用OECloud工具在https://cloud.oebiotech.com.进行分析和绘图。
1.2.7 云雨图的绘制使用R(4.2.1)软件“tidyverse”“ggplot2”“gghalves”进行相关数据的整理与图形的绘制。
1.2.8 百分比堆积柱状图使用OriginPro 2021和WPS表格进行绘制。
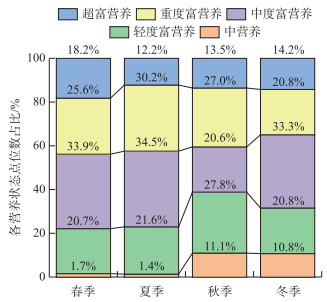
2 结果 2.1 TLI指数评价TLI指数的评价结果(图 2)显示,本研究涉及到的水体在四季均呈中营养到超富营养状态,无贫营养水体。中营养水体在秋季(11.1%)和冬季(10.8%)的占比高于在春季(1.7%)和夏季(1.4%)。轻度富营养水体在春季、夏季和冬季的占比相似,分别为20.7%、21.6%、20.8%,在秋季的占比最高,为27.8%。中度富营养水体在春季、夏季和冬季的占比相似,分别为33.9%、34.5%、33.3%,在秋季的占比最低,为20.6%。重度富营养水体的占比在夏季最高,为30.2%;在春季和秋季占比相似,分别为25.6%和27.0%;在冬季最低,为20.8%。超富营养水体的占比在春季最高,为18.2%;在夏季、秋季、冬季的占比相似,分别为12.2%、13.5%、14.2%。
|
图 2 TLI指数评价水体不同季节各营养状态点位数占比 Fig.2 The proportion of the number of points of each nutrient state in different seasons evaluated by TLI index |
当臂尾轮属或异尾轮属的轮虫在该样点均存在时,则可使用QB/T指数进行评价。在某一季节能使用QB/T指数进行评价的点位越多,则QB/T指数在该季节的适用程度越高。春季121个样点中共有68个点位(占比56.2%)能使用QB/T指数进行评价,贫营养、中营养、富营养水体所占比例分别为11.8%、51.5%、36.8%。这些点位用TLI指数进行评价,评价结果中无贫营养水体,中营养和富营养水体的占比分别为1.5%和98.5%。夏季139个点位中共有103个点位(占比74.1%)能使用QB/T指数进行评价,适用程度最高,贫营养、中营养、富营养水体所占比例分别为16.5%、39.8%、43.7%。这些点位用TLI指数进行评价,评价结果中所有水体均为富营养型。秋季126个点位中共有35个点位(占比27.8%)能使用QB/T指数进行评价,贫营养、中营养、富营养水体所占比例分别为5.7%、42.9%、51.4%。这些点位用TLI指数进行评价,评价结果中所有水体均为富营养型。冬季120个点位中仅有11个点位(占比6.7%)能使用QB/T指数进行评价,适用程度最低,贫营养、中营养、富营养水体所占比例分别为50.0%、37.5%、12.5%。这些点位用TLI指数进行评价,评价结果中无贫营养水体,中营养和富营养水体的占比分别为12.5%和87.5%(表 1、表 2)。
| 表 1 不同季节QB/T指数的适用程度 Tab. 1 Applicability of QB/T index in different seasons |
| 表 2 不同季节QB/T指数与TLI指数评价结果比较 Tab. 2 Comparison of evaluation results between QB/T index and TLI index in different seasons |
春季能用E/O指数进行评价的104个点位中,贫营养、中营养、富营养和超富营养水体所占比例分别为2.9%、46.2%、47.1%和3.8%。对这104个点位用TLI指数进行评价,评价结果中无贫营养水体,中营养、富营养和超富营养水体所占比例依次为1.9%、76.9%和21.2%。春季E/O指数进行评价的结果中,富营养和超富营养水体被低估,中营养水体比例大幅提升。夏季能使用E/O指数进行评价的点位最多,在139个点位中有124个点位(占比为89.2%)适用评价。其中贫营养、中营养、富营养和超富营养水体所占比例分别为0.8%、30.6%、62.9%和5.6%。对这124个点位用TLI指数进行评价,评价结果中无贫营养水体,中营养、富营养和超富营养水体所占比例依次为1.6%、85.5%和12.9%。夏季E/O指数进行评价的结果中,富营养水体被低估,中营养水体的比例大幅度提升。秋季能使用E/O指数进行评价的65个点位中无贫营养水体,中营养、富营养和超富营养水体所占比例分别27.7%、66.2%和6.2%。对这65个点位用TLI指数进行评价,评价结果中无贫营养水体,中营养、富营养和超富营养水体所占比例依次为7.7%、72.3%和20.9%。秋季E/O指数进行评价的结果中,超富营养水体被低估,中营养水体的比例大幅度提升。冬季能使用E/O指数进行评价的点位最少,在120个点位中仅有11个点位能进行评价(占比为9.2%)。其中无贫营养水体,中营养、富营养和超富营养水体所占比例分别为18.2%、27.2%和54.5%。对这11个点位用TLI指数进行评价,评价结果中无贫营养和中营养水体,富营养和超富营养水体所占比例依次为72.7%和27.3%。冬季E/O指数进行评价的结果中,超富营养型水体的比例大幅度下降,中营养和富营养型的比例有所提升(表 3、表 4)。
| 表 3 不同季节E/O指数适用程度 Tab. 3 Applicability of E/O index in different seasons |
| 表 4 不同季节E/O指数与TLI指数评价结果比较 Tab. 4 Comparison of evaluation results between E/O index and TLI index in different seasons |
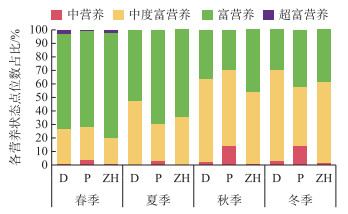
从TSIROT指数评价的结果来看,本次研究所涉及点位的营养状态均是中营养及以上(图 3)。在春季Dimictic组(D)、Polymictic组(P)、综合湖泊类型组(ZH)公式的评价结果均显示富营养状态的点位居多,占比分别为70.67%、70.67%和77.33%;在夏季亦显示富营养状态的点位居多,但占比较春季降低,分别为52.31%、69.23%和64.62%;在秋季则显示中度富营养的点位居多,占比分别为61.54%、56.41%和52.56%;在冬季TSIROTD和TSIROTZH的评价结果均显示中营养的点位居多,占比分别为66.67%、59.65%,TSIROTP的评价结果显示中度富营养和富营养水体的点位较多,分别为43.86%和42.11%。
|
图 3 TSIROT指数评价水体不同季节各营养状态点位数占比 Fig.3 The proportion of the sample points in each nutrient state evaluated by TSIROT index in different seasons |
TSIROT不同公式的评价结果在不同季节均具有显著的一致性(表 5),其中TSIROTD与TSIROTZH组的一致性很强。TSIROTZH与TSIROTP组、TSIROTD与TSIROTP组的一致性较强。从TSIROT各组公式与TLI评价结果的一致性检验结果(表 6)看,TSIROTD和TSIROTZH在夏季和秋季与TLI评价结果的一致性显著。TSIROTP在秋季和冬季与TLI评价结果的一致性显著。
| 表 5 不同季节TSIROT指数三组公式评价结果的一致性检验 Tab. 5 Kendall's W test of the three groups of formula evaluation results of TSIROT index in different seasons |
| 表 6 不同季节TSIROT指数与TLI评价结果的一致性检验 Tab. 6 Kendall's W test between TSIROT index and TLI evaluation results in different seasons |
在同一营养状态水体中,某些点位轮虫密度偏低,群落结构与其余点位差异较大,这可能是由非营养盐因素导致的。故而,先基于Bray-Curtis的K均值聚类,将各季节样点按群落结构的相似性进行划分并分析。结果显示,冬季轮虫的密度与TLI的回归关系不明显。春季、夏季、秋季则在去除群落结构差异较大的点位后,用余下的点位进行后续分析。
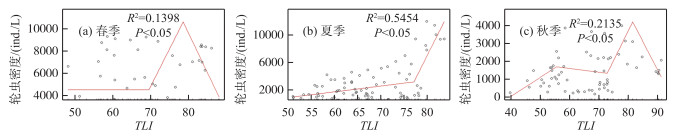
春季轮虫密度与TLI的分段函数断点在69.5和78.5(图 4a)。在第一段TLI≤69.5时,轮虫密度与TLI的回归关系不明显;当69.5 <TLI≤78.5时,轮虫密度随TLI的增加而增加;但当TLI>78.5时,轮虫密度随TLI的增加而降低。夏季轮虫密度与TLI的分段函数断点在77.2(图 4b)。夏季两区间段内轮虫密度与TLI均呈现正相关关系,但是斜率不同。在第二段TLI>77.2时轮虫密度随TLI增加而增加幅度明显大于第一段TLI≤77.2时的增加幅度。秋季轮虫密度与TLI的分段函数3个断点分别为55.7、72.9、81.4(图 4c)。当TLI≤55.7时,轮虫密度随TLI的增加而增加;当55.7 <TLI≤72.9时,轮虫密度随TLI的增加呈现出略微下降的趋势;当72.9 <TLI≤81.4时,轮虫密度随TLI的增加呈现出较第一段增长幅度更大的增长;当TLI>81.4时,轮虫密度呈现出随TLI的增加而降低的趋势。
|
图 4 春季(a)、夏季(b)、秋季(c)轮虫密度与TLI的回归关系 Fig.4 Regression between rotifer density and TLI in spring(a), summer(b) and autumn(c) |
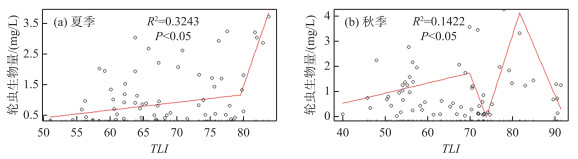
样点按照密度分析中的分组进行分组。轮虫生物量与TLI关系的构建过程与密度的构建过程相同。春季去除生物量大于10 mg/L的点位后,进行平滑回归,发现其与TLI的回归关系仍不太明显。夏季轮虫生物量与TLI的分段函数断点在79.5(图 5a),两区间段内生物量与TLI均呈现正相关关系,但是斜率不同;在第二段TLI>79.5时轮虫生物量随TLI增加而增加的幅度明显大于第一段TLI≤79.5时的增加幅度。秋季轮虫生物量与TLI的分段函数的3个断点分别为69.7、73.7、81.4(图 5b)。当TLI≤69.7时,轮虫生物量随TLI的增加而增加;当69.7 <TLI≤73.7时,轮虫生物量随TLI的增加呈现出明显的下降趋势;当73.7 <TLI≤81.4时,轮虫生物量随TLI的增加辐度大于第一段的增长幅度;当TLI>81.4时,轮虫生物量随TLI的增加而降低。
|
图 5 夏季(a)、秋季(b)轮虫生物量与TLI的回归关系 Fig.5 Regression between rotifer biomass and TLI in summer(a) and autumn(b) |
本研究发现,不同季节轮虫的α多样性指数与TLI的关系不同。在春、秋和冬季TLI=70时, 对于轮虫的α多样性指数来说是一个重要的分界点。在春季TLI处在50~70范围内Shannon指数、Simpson指数、Pielou均匀度指数的均值均呈现随TLI的增加而下降的趋势;当TLI大于70时,以上3个指数的均值均较上一个区间有明显的提升。秋季TLI处在50~70范围内Shannon指数、Simpson指数的均值随TLI的增加有所下降,Pielou均匀度指数的均值却有所上升。当TLI大于70时,以上3个指数的均值均较上一个区间有明显的提升。在冬季,从轻度富营养到超富营养(TLI从50~100)水体中,Shannon指数、Simpson指数的均值均随着TLI的增加而增加,Pielou均匀度指数的均值则呈现出波动变化(表 7)。
| 表 7 不同季节各营养状态轮虫α多样性的平均值与标准差 Tab. 7 Mean values and standard deviations of rotifer α diversity for each trophic state in different seasons |
夏季规律性最强,从轻度富营养到超富营养(TLI从50~100)水体中,Shannon多样性指数、Simpson指数的均值均是随着TLI的增加而增加,Pielou均匀度的均值在不同营养状态的水体中差异不大。即便在规律性最强的夏季,轮虫的α多样性各指数在水体营养状态各阶段(从轻度富营养到超富营养)的数据集中范围相差不大(图 6)。
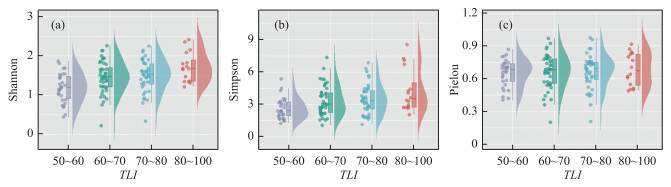
|
图 6 夏季各TLI区间段轮虫α多样性指数与TLI的云雨图 Fig.6 Cloud and rain plots of rotifera α diversity index and TLI in each TLI interval in summer |
从此次研究结果来看,QB/T指数与E/O指数均存在季节的适用性问题。QB/T指数在春、夏季的可实施性较高,在冬季的可实施性最低。在夏季可实施性最强,有74.1%的点位可被评价;但与TLI评价的结果差异较大,出现的贫营养点位(16.5%)在TLI评价结果中均为富营养状态。这可能是由于QB/T指数的构建中将异尾轮属(Trichocerca)的种类都当做贫营养水体的代表,而Bérzinš[48]的研究中发现异尾轮属中的T. cylindrical、T. pusilla、T. capucina、T. porcellus为富营养化水体中出现的种类。所以,仅使用QB/T指数来评价水体营养状态可能会存在较大偏差,因而不适用于上海这样四季分明且水体普遍富营养化地区的水体评价。
E/O指数在春季、夏季、秋季的可实施性较高,但由于贫营养型种和富营养型种的参考名录并不完善或不清楚,导致一些物种不能被明确归类。如上海地区全年在各类水体中均频频出现的多肢轮虫(Polyarthra spp.)在《内陆水域渔业自然资源调查手册》[45]提供的贫营养种和富营养种名录中没有明确的归属。且现阶段E/O指数的评价结果低估了水体的营养状态,一些在理化评价中判断为富营养化的点位在E/O指数评价中为贫营养型(附表Ⅵ)。这可能是被划分到富营养型种的物种较少导致的。
造成以上评价差异的原因可能是这两种方法都依据特定类群的物种是否存在而进行评价。轮虫种群存在明显的季节更替,臂尾轮属和异尾轮属的轮虫在秋冬季节的密度及出现频率较春夏季节明显减少。故而在很多点位仅出现臂尾轮属或异尾轮属轮虫中的一种,或两个属的轮虫均未发现的情况,导致无法进行评价的情况出现。综上所述,QB/T指数与E/O指数进行水体营养状态的评价均存在一定的局限性。
轮虫指数TSIROT综合考虑了指示种和生物量,克服了用单个指标进行评价时的局限性;同时由于两者的融合,减少了单因素评价的误差,相较于QB/T指数和E/O指数具有更强的适用性和准确性。本研究中TSIROT与TLI评价结果的一致性程度较强,但也存在季节适用性的问题,可在上海地区的夏季、秋季使用,不推荐在春季和冬季使用。三组TSIROT公式评价出来的结果有显著的一致性,TSIROTD与TSIROTZH的一致性程度很强,但是与TSIROTP的一致性程度却有所降低。为了提高TSIROT指数的准确性应充分了解被评价湖泊的水文状况,了解被评价水体是否存在热分层现象,从而选择最为合适的公式组。如果水体存在热分层现象,则应该选用TSIROTD或TSIROTZH组公式;如果水体较浅,不存在热分层现象,则应该选用TSIROTP组公式。此外,TSIROT4在没有发现螺形龟甲轮虫的点位应在计算中剔除此项,否则会显著降低TSIROT指数的准确度。
轮虫指数TSIROT在划分营养等级上存在多种标准[9, 25, 49],不利于该方法的推广和标准化使用。其中四分法过于粗略,缺少轻度富营养化的划分;八分法又过于细分,划分出Low meso-eutrophy、High meso-eutrophy和Low eutrophy这样不易界定的等级。此外,目前对TSIROT指数的本土化校准少有提及,大多是直接使用现成的公式进行计算评价。TSIROT指数是基于波兰湖泊群建立的,我国幅员辽阔,具有多种气候类型、水体本底类型多样,轮虫的群落结构特征可能存在区域性差异;且在长三角地区水体营养本底值较高的情况下,生物或许已出现适应性的变化,因此除了统一划分营养等级的标准外,还需要在不同区域重新计算各子公式的变量与TLI之间的回归关系,以提高轮虫指数TSIROT评价的准确性和一致性。
3.2 轮虫的密度和生物量与水体营养状态的关系轮虫密度对水体营养状态的指示效果比轮虫生物量的指示效果要好。夏季轮虫的密度和生物量与TLI的关系最为紧密,随着TLI的升高而升高;其他季节轮虫的密度和生物量与TLI的关系较为复杂,并不呈现单调递增或递减的趋势。Karabin[47]和Ejsmont-Karabin[9]均认为夏季营养盐是影响浮游动物群落稳定性的主要因素,是分析浮游动物群落结构与营养盐关系的最佳季节,本次研究也支持这一观点。夏季水温升高细菌将动植物残体分解为有机碎屑的速度大大加快[50];此外夏季浮游植物种类多、密度高,轮虫的适口食物含量增加[39],从而使得轮虫的种群迅速扩大。这两个过程分别对应了营养盐的释放和利用,使得夏季轮虫的密度与营养盐的释放与吸收关系更为紧密。
轮虫的密度和生物量作为浮游动物生态调查的基本内容,在夏季使用轮虫的密度和生物量来反映水体营养状态变化的指标具有较强的可操作性。由于本次的调查对象中并不包含贫营养型水体,发现的规律在水体从贫营养到富营养状态的变化中是否适用仍有待进一步研究。
3.3 轮虫的α多样性指数与水体营养状态的关系以往使用轮虫的多样性来评价水质,多采用污生生物系统,将水质评价为从清洁到多污型水体[15, 51-54]。污生生物系统评价水质反映的是水体的有机污染情况,水体的营养状况与污生情况有时直接相关,但有时会有差异[10, 55]。从本次研究结果看,仅夏季轮虫的α多样性指数随水体的营养状态的加重有较为明显的规律性变化,但考虑到轮虫的α多样性各指数在水体营养状态各阶段(从轻度富营养到超富营养)的数据集中程度相差不大(图 6),这一方法并不适合用于判断上海城市水体的营养程度。
在本次研究中,在一些富营养化程度高的水体中轮虫的α多样性高于同时期调查的其余区域(附表Ⅶ);一些较为清洁水体中轮虫α多样性反而较低(附表Ⅷ)。这与普遍认为的在一定范围内水体富营养化越严重物种多样性应该越低的认知不符[56-58]。在一些研究中也发现轮虫对营养盐的响应并非总是呈现这样的规律。例如,在翟盼[59]的研究中发现花津湖轮虫的多样性指数与各理化因子之间均没有显著的相关性;在镜湖总磷和磷酸盐浓度与轮虫的物种多样性指数呈极显著的正相关关系;在欧洲的湖泊群中浮游动物的群落结构随着总磷的变化而变化[60],Wen等[61]发现在芜湖市周边的5个湖泊中总氮对轮虫群落的物种多样性的空间变动影响最大。谢萍[62]发现在九莲塘和汀棠湖中轮虫的多样性指数与TN ∶TP(质量比)呈显著的正相关关系,认为在亚热带湖泊中应将TN、TP综合起来考虑对轮虫多样性的时间变化的影响。
此外,我们从Shannon多样性指数公式看,种类数以及各物种的占比均会影响多样性指数的大小。Hurlbert等[63]分析Shannon多样性指数与均匀度指数之间的关系,指出即使分类群数量没有增加,只要均匀度增加了(各物种的相对丰度差异减少),Shannon多样性指数同样也会增加。从此次的研究结果看,这些营养状态较重且Shannon多样性指数较高的点位中Pielou均匀指数也较高(附表Ⅶ)。因此,这些点位有较高的Shannon多样性指数很有可能是由于较高的均匀度导致而非物种种类数的增加导致。随着水体营养状态的加重,适用于富营养环境的轮虫占比逐渐提高,长期在这样的环境压力下,物种组成相似,如果加之景观水体流动性差,容易形成较高的均匀度。
3.4 影响轮虫评价水体营养程度准确性的因素在夏季,生境可能也是影响轮虫指示水体营养程度有效性的一个重要因素。通过调查发现,一些生境类型水体的轮虫群落结构特征与同一时期采集的其他地区的轮虫群落结构显著不同(图 7),基于Bray-Curtis的K均值聚类对其进行分组,并用NMDS分析群落差异。这些样点(图 7中Group3)的轮虫群落结构特征大致可以分为3种情况:密度很高但种类组成单一;种类数有所增加或差异不大但密度较低;种类和密度都很低。这些生境大多有欧菱、浮萍、黑藻、金鱼藻、苦草、满江红、荷花等水生植物(附图Ⅰ),在此类生境中轮虫群落结构在不同的营养状态下差异不大。也有研究者发现了类似的现象,例如Malekzadeh Viayeh[64]研究了伊朗西阿扎拜疆地区22个水体中轮虫与环境的关系,发现轮虫多样性和丰度与水生植被覆盖度呈正相关,且是驱动轮虫群落形成最重要的环境因素之一。Kuczyńska-Kippen[5]研究了波兰地区55个池塘中轮虫与生境的关系,发现虽然水草密闭区域比开阔水域有更高的轮虫多样性,从该研究结果看,睡莲科植物密布的区域轮虫的种类数和密度明显低于开阔水域,沉水植物密布的区域虽然轮虫的种类数较开阔水域多,但是其轮虫密度却比后者低。大型水生植物为轮虫提供了具有异质性的栖息地[65]以及躲避捕食的避难所[66],有利于轮虫形成较高的多样性,但是在其生长的过程中一边吸收着水中的氮磷一边也会向水中释放有机物质,在其死亡后还会形成植物碎屑,这些过程增加了水生生物间营养联系的复杂性[67]。Choi等[68]调查了韩国164个湿地中浮游动物与水体理化指标和大型植物的关系,发现相较于水质参数,大型植物的微生境结构才是影响静水生态系统中浮游动物组合的关键因素。综合来看,水生植物对于轮虫多样性的增加有利,但使得轮虫与水体营养状态之间的联系变得更加复杂,这种复杂的关系有待后续进一步的探究。
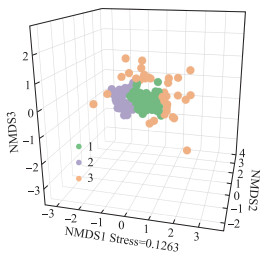
|
图 7 夏季轮虫群落结构NMDS图 Fig.7 NMDS plot of rotifer community structure in summer |
轮虫在淡水生态系统中处于承下启下的位置,其群落特征不仅受到营养盐等理化因子的影响,同时也受到鱼类、大型浮游动物(如枝角类、桡足类)对其捕食或资源竞争形成的下行效应影响[69],以及食物资源可得性、食物资源质量等上行效应的影响[70-71]。考虑到水生生物之间复杂的互作关系,后续可在夏季和秋季使用结构方程模型等方法量化研究生物之间的互作关系对轮虫水质评价结果的影响强度,进一步探讨富营养化梯度下轮虫的响应机制,提升轮虫指示结果的准确性。
本研究发现轮虫的密度、重量生物量与TLI的关系在不同季节存在着不同的响应模式,并非单一的线性关系。考虑到轮虫在指示水体营养状态的复杂性,使用轮虫进行水体营养状态评价时应更为谨慎,仅用轮虫的单一指标进行评价是具有局限性的,应该充分考虑季节和生境对轮虫群落结构的影响,使用复合指标或多参数进行综合评价使结果更为客观准确。
3.5 轮虫对水体营养状态的指示作用对水生态健康评价的意义Gregersen等[72]的研究发现,由于生态系统自身的抵抗力稳定性以及功能冗余性延缓了湖泊营养等级的显著变化,基于理化指标的传统营养等级监测可能并未真正反映出不太剧烈但是却十分重要的生态变化,而基于生物群落结构的指标却能有效对这些重要变化做出积极响应,指示出生态系统对营养状态变化响应的早期信号。故而越来越多的学者开始从单一指标的评价转向对水生态健康的整体评价。目前进行水生态健康评价时,通过将候选参数在受损点和参照点比较,选择出较为适宜的指标进行后续的完整性指数计算或水生态健康指数的计算[73-74]。然而,不同生物类群由于生态习性的不同和对环境变化的耐受程度以及对水体干扰的响应程度不同,不同生物类群对水生态健康评价的结果存在差异[75-76]。因此为了更加客观全面地从不同角度反映出水生态的健康状况,我们有必要补充和完善构建完整性指数或水生态健康指数中的候选指标。水体营养状态是水生态健康的重要内容,本研究证实季节对轮虫指示水体营养状态准确性上存在巨大的影响,进一步说明了在夏季轮虫的密度对水体营养状态有良好的指示效果,TSIROT指数在夏季和秋季指示水体营养状态上具有潜力。因此,一方面在使用生物指标构建或者指示水体生态健康状态时要充分考虑季节的影响,应在不同的季节设置不同的候选参数清单;另一方面在夏季可以将轮虫的密度、本地化校准后的TSIROT指数作为反映水体营养状态或营养状态变化的指标纳入水生态健康评价的计算体系之中,从而有利于水生态健康评价更为准确完善。
4 结论1) 轮虫指数TSIROT和轮虫生物量在指示水体营养状态上有一定的可靠性,但评价效果均受季节影响较大。在上海地区,夏季和秋季TSIROT指数与TLI评价结果有较强的一致性,春季不显著,冬季仅TSIROTP组公式与TLI评价有一致性。轮虫生物量在夏季与TLI的关系最为紧密,随着TLI的升高而升高,且密度对TLI的指示效果比生物量要好,R2分别为0.55、0.32。其余几个季节,轮虫密度和生物量与TLI的关系并不明确。由于QB/T指数、E/O指数自身的局限性以及轮虫的种类组成受温度影响较大,这2种方法在四季分明且水体普遍已经是富营养化的地区不适宜使用。轮虫的α多样性指数(Shannon指数、Simpson指数、Pielou指数)即便是在规律性最强的夏季,其在水体营养状态各阶段(从轻度富营养到超富营养)的数据集中范围相差不大。所以,根据α多样性各指数划定的范围来判断水体营养程度可能不适用于上海地区的城市水体。
2) TSIROT指数三组公式的评价结果有显著的一致性,但是TSIROTP与TSIROTD、TSIROTZH评价的结果一致性程度较弱,故而在使用TSIROT指数前应充分了解被评价湖泊的水文状况,从而提高TSIROT指数的准确性。TSIROT在划分营养等级上存在多种标准,不利于该方法的推广和使用。因此,除了统一划分营养等级的标准外,可以根据国内不同区域的特点重新计算出各子公式的自变量与TLI之间的回归关系以提高TSIROT评价准确性和一致性。
3) 在夏季,生境也是影响轮虫指示水体营养程度有效性的一个重要因素。在考虑水体营养状态对轮虫群落结构的影响时,水生高等植物的数量及种类是一个重要的因素。
5 附录附表Ⅰ~Ⅷ及附图Ⅰ见电子版(DOI: 10.18307/2024.0617)。
| 附表Ⅰ TLI值对应水体营养状态的划分标准 Appendix Ⅰ The classification criteria for TLI values corresponding to the nutrient status of water bodies |
| 附表Ⅱ QB/T指数值对应水体营养状态的划分标准 Appendix Ⅱ The classification criteria for QB/T values corresponding to the nutrient status of water bodies |
| 附表Ⅲ E/O指数值对应水体营养状态的划分标准 Appendix Ⅲ The classification criteria for E/O values corresponding to the nutrient status of water bodies |
| 附表Ⅳ TSIROT各组计算公式 Appendix Ⅳ TSIROTcalculation formula for each group |
| 附表Ⅴ TSIROT指数值对应水体营养状态的划分标准 Appendix Ⅴ Classification criteria for TSIROT values corresponding to the nutritional status of water bodies |
| 附表Ⅵ TLI评价结果与E/O指数评价结果差异较大点位 Appendix Ⅵ Points with large differences between TLI evaluation results and E/O index evaluation results |
| 附表Ⅶ 营养状态较重且α多样性较高的点位情况表 Appendix Ⅶ Situation table of sites with heavier nutritional status and higher α diversity |
| 附表Ⅷ 营养状态较轻且α多样性较低的点位情况 Appendix Ⅷ Sites of light nutritional statuswith low α-diversity |

|
附图Ⅰ 夏季轮虫群落结构与其他点位轮虫群落结构有明显差异的样点生境照片 (a.漕河泾开发区公园,b.辰山植物园,c.大淀湖,d.芳心园1,e.芳心园2,f.古漪园,g.顾村公园,h.汇龙潭,i.泗泾公园,j.杨浦公园) AttachedFig1 Photos of the habitats of sample sites where the rotifer community structure was significantly different from other sites in summer (a. Caohejing Park, b. Chenshan Botanical Garden, c. Dadian Lake, d. Fangxin Garden 1, e. Fangxin Garden 2, f. Guyi Garden, g. Gucun Park, h. Huilongtan Park, i. Sijing Park, j. Yangpu Park) |
致谢: 感谢中国科学院南京地理与湖泊研究所的陈非洲研究员在论文撰写过程中给予的建议和帮助。感谢于潘、沈琴、李博、姜小蝶、王翠香、杨正鑫等在样品采集、数据分析方面的帮助。
| [1] |
王备新. 大型底栖无脊椎动物水质生物评价研究[学位论文]. 南京: 南京农业大学, 2003.
|
| [2] |
吴阿娜. 河流健康状况评价及其在河流管理中的应用[学位论文]. 上海: 华东师范大学, 2005.
|
| [3] |
沈韫芬, 顾曼如, 龚循矩等. 微型生物监测新技术. 北京: 中国建筑工业出版社, 1990.
|
| [4] |
段学花. 河流水沙对底栖动物的生态影响研究[学位论文]. 北京: 清华大学, 2009.
|
| [5] |
Kuczyńska-Kippen N, Basińska AM. Habitat as the most important influencing factor for the rotifer community structure at landscape level. International Review of Hydrobiology, 2014, 99: 58-64. DOI:10.1002/IROH.201301704 |
| [6] |
刘建康. 高级水生生物学. 北京: 科学出版社, 1999.
|
| [7] |
Balkić AG. The importance of environmental differences in the structuring of rotifer functional diversity. Journal of Limnology, 2019, 78(3): 284-295. DOI:10.4081/jlimnol.2019.1903 |
| [8] |
Maemets A. Rotifers as indicators of lake types in Estonia. Hydrobiologia, 1983, 104(1): 357-361. DOI:10.1007/BF00045991 |
| [9] |
Ejsmont-Karabin J. The usefulness of zooplankton as lake ecosystem indicators: Rotifer trophic state index. Polish Journal of Ecology, 2012, 60(2): 339-350. |
| [10] |
Sládeček V. Rotifers as indicators of water quality. Hydrobiologia, 1983, 100(1): 169-201. DOI:10.1007/BF00027429 |
| [11] |
Kolkwitz R, Marsson M. Grundsätze für die biologische beurtheilung des wassers, nach seiner flora und fauna. Druck von L. Schumacher, 1902, 1: 33-72. |
| [12] |
Kolkwitz R, Marsson M. Ökologie der tierischen Saprobien. Beiträge zur Lehre von der biologischen Gewässerbeurteilung. Internationale Revue der Gesamten Hydrobiologie und Hydrographie, 1909, 2(1/2): 126-152. |
| [13] |
Karabin A. Pelagic zooplankton (Rotatoria + Crustacea) variation in the process of lake eutrophication. Ⅱ. Modifying effect of biotic agents. Ekologia Polska, 1985, 4(33): 617-644. |
| [14] |
陈光荣. 广东省城市湖泊浮游动物群落特征及生态效应研究[学位论文]. 广州: 暨南大学, 2007.
|
| [15] |
Wen XL, Xin YL, Zhang L et al. Analysis of community structure of rotifera and ecological assessment of water quality in Lake Jinghu, Wuhu City. Acta Hydrobiologica Sinica, 2006, 30(2): 152-158. [温新利, 席贻龙, 张雷等. 芜湖市镜湖轮虫群落结构分析及水质的生态学评价. 水生生物学报, 2006, 30(2): 152-158.] |
| [16] |
Ju YF, Yu HX, Yu T et al. The zooplankton community structure and water quality of Xiquanyan Reservoir. Acta Ecologica Sinica, 2016, 36(16): 5126-5132. [鞠永富, 于洪贤, 于婷等. 西泉眼水库夏季浮游动物群落结构特征及水质评价. 生态学报, 2016, 36(16): 5126-5132. DOI:10.5846/stxb201501280226] |
| [17] |
Wang S, Chen H, Liu Q et al. Zooplankton community structure and its correlation with water quality in Hancheng Lake. Ecological Science, 2018, 37(2): 114-123. [王松, 陈红, 刘清等. 汉城湖浮游动物群落结构特征及与水质关系. 生态科学, 2018, 37(2): 114-123.] |
| [18] |
Hu J, Zhong JS, Yu WW et al. Features of Metazoan zooplankton and water quality assessment in Yuandang Lake area. Journal of Anhui Agricutre, 2016, 44(16): 51-53. [胡景, 钟俊生, 郁蔚文等. 元荡湖水域后生浮游动物群落特征与水质评价. 安徽农业科学, 2016, 44(16): 51-53. DOI:10.13989/j.cnki.0517-6611.2016.16.017] |
| [19] |
李钥. 贵州红枫水库和百花水库后生浮游动物群落时空变化特征及对水环境的指示作用[学位论文]. 贵阳: 贵州师范大学, 2016.
|
| [20] |
Liu XP, Wang LQ, Zhang N et al. Community structure of metazoan zooplankton and its relationships with environmental factorsin Qingcaosha Reservoir of Shanghai, East China. Chinese Journal of Ecology, 2013, 32(5): 1238-1248. [刘歆璞, 王丽卿, 张宁等. 青草沙水库后生浮游动物群落结构及其与环境因子的关系. 生态学杂志, 2013, 32(5): 1238-1248. DOI:10.13292/j.1000-4890.2013.0230] |
| [21] |
Tang J, Xiang JG, Gu PH et al. Community structure of zooplankton and assessment of water quality in Weishan Lake. Chinese Journal of Fisheries, 2014, 27(2): 32-37. [唐俊, 向建国, 谷庞华等. 微山湖浮游动物群落结构及水质评价. 水产学杂志, 2014, 27(2): 32-37.] |
| [22] |
向劲. 微山湖浮游动物群落时空格局研究[学位论文]. 长沙: 湖南农业大学, 2013.
|
| [23] |
Liang D, Wang Q, Wei N et al. Biological indicators of ecological quality in typical urban river-lake ecosystems: The planktonic rotifer community and its response to environmental factors. Ecological Indicators, 2020, 112: 106127. DOI:10.1016/j.ecolind.2020.106127 |
| [24] |
Liang D, Wei N, Wang Q et al. Influence of hydrological heterogeneity on rotifer community structure in three different water bodies in Shantou Area, Guangdong (China). Zoological Studies, 2019, 58(23): 1-14. DOI:10.6620/ZS.2019.58-23 |
| [25] |
Jurczak T, Wojtal-Frankiewicz A, Frankiewicz P et al. Comprehensive approach to restoring urban recreational reservoirs. Part 2-Use of zooplankton as indicators for the ecological quality assessment. Science of the Total Environment, 2018, 653(25): 1623-1640. DOI:10.1016/j.scitotenv.2018.08.006 |
| [26] |
Gutkowska A, Paturej E, Kowalska E. Rotifer trophic state indices as ecosystem indicators in brackish coastal waters. Oceanologia, 2013, 55(4): 887-899. |
| [27] |
Wang YN, Xu M, Xu JB et al. Zooplankton succession characteristics and water quality evaluation of typical lakes in the hinterland of LixiaRive. Journal of Hohai University: Natural Sciences, 2022, 50(5): 49-57. [王亚宁, 徐明, 许静波等. 里下河腹部地区典型湖泊浮游动物演替特征及水质评价. 河海大学学报: 自然科学版, 2022, 50(5): 49-57. DOI:10.3876/j-issn.1000-1980.2022.05.007] |
| [28] |
张宁. 青草沙水库后生浮游动物群落结构及水质生态学评价[学位论文]. 上海: 上海海洋大学, 2012.
|
| [29] |
黄荣静. 石山口水库浮游生物群落结构及水环境分析[学位论文]. 南京: 南京农业大学, 2013.
|
| [30] |
Tang C, Yi Y, Yang Z et al. Planktonic indicators of trophic states for a shallow lake(Baiyangdian Lake, China). Limnologica, 2019, 78: 125712. DOI:10.1016/j.limno.2019.125712 |
| [31] |
侯磊. 珠江广州河段和磨刀门河口轮虫的群落特征[学位论文]. 广州: 暨南大学, 2011.
|
| [32] |
刘洪健. 莫莫格自然保护区轮虫群落结构分析和水质评价的研究[学位论文]. 长春: 吉林农业大学, 2013.
|
| [33] |
Luo M, Zhao LF, Zheng Y et al. Nutritional status and community structure of rotiferin the riverway of urban landscape. Chinese Journal of Environmental Engineering, 2016, 10(9): 4994-5000. [罗梅, 赵龙飞, 郑月等. 城市景观河道营养状况与轮虫群落结构. 环境工程学报, 2016, 10(9): 4994-5000. DOI:10.12030/j.cjee.201504033] |
| [34] |
徐赛赛. 崇明岛河道后生浮游动物群落结构时空变化及水质评价[学位论文]. 上海: 上海海洋大学, 2023.
|
| [35] |
Chen XY, Liu YZ, Guo XY et al. Nitrogen and phosphorus inputs affectrotifer communities in rivers. Journal of Biosafety, 2020, 29(1): 51-58. [陈星宇, 刘雨泽, 郭逍宇等. 氮磷汇入驱动下的河流轮虫群落演替. 生物安全学报, 2020, 29(1): 51-58. DOI:10.3969/j.issn.2095-1787.2020.01.009] |
| [36] |
Guo LC, Wu SS, Fan X et al. Community structure of metazoan zooplankton and water quality evaluation in different ecological zones of Gaoyou Lake. Journal of Hydroecology, 2019, 40(6): 30-36. [郭刘超, 吴苏舒, 樊旭等. 高邮湖各生态功能区后生浮游动物群落特征及水质评价. 水生态学杂志, 2019, 40(6): 30-36. DOI:10.15928/j.1674-3075.2019.06.005] |
| [37] |
Li L, Liu Y, Yu F et al. Community structure of rotifera and black-odor levelanalysis in Gu River of Guangzhou city. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2020, 59(3): 73-81. [李玲, 刘玉, 于菲等. 广州市谷河轮虫群落结构及水体黑臭水平. 中山大学学报(自然科学版), 2020, 59(3): 73-81.] |
| [38] |
Cheng JJ, Gu Y, Tan L et al. Evaluation of trophic status of Three Gorges Reservoir basedon planktonic rotifer. Environmental Science & Technology, 2021, 44(8): 185-191. [程静静, 谷圆, 谭路等. 基于浮游轮虫三峡水库营养状况评价. 环境科学与技术, 2021, 44(8): 185-191.] |
| [39] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [40] |
罗永婷. 刚果盆地单巢轮虫的研究[学位论文]. 上海: 上海师范大学, 2013.
|
| [41] |
王家楫. 中国淡水轮虫志. 北京: 科学出版社, 1961.
|
| [42] |
金丽文. 上海及周边地区的轮虫研究[学位论文]. 上海: 上海师范大学, 2013.
|
| [43] |
Koste W. Rotatoria. Die Rädertiere Mitteleuropas, Bd. Ⅱ. Berlin: Gebrüder, 1978.
|
| [44] |
Wang MC, Liu XQ, Zhang JH. Evaluate method and classification standard on lake eutrophication. Environmental Monitoring in China, 2002, 18(5): 47-49. [王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47-49. DOI:10.3969/j.issn.1002-6002.2002.05.018] |
| [45] |
张觉民, 何志辉. 内陆水域渔业自然资源调查手册. 北京: 农业出版社, 1991.
|
| [46] |
Hakkari L. Zooplankton species as indicator of environment. Aqua Fenn, 1972, 1: 46-54. |
| [47] |
Karabin A. Pelagic zooplankton(Rotatoria + Crustacea) variation in the process of lake eutrophication. Ⅰ. Structural and quantitative features. Ekologia Polska, 1985, 33(4): 567-616. |
| [48] |
Bērzinš B. Zur Limnologie der Seen Südostlettlands. Schweizerische Zeitschrift für Hydrologie, 1949, 11: 583-607. |
| [49] |
Jolanta EK. An analysis based on rotifer indices of the effects of water and sewage management on water quality in the system of interconnected glacial lakes. Limnological Review, 2013, 13(4): 191-195. DOI:10.2478/limre-2013-0021 |
| [50] |
Lin WL, Liu XZ, Liu JK. The process of detritus formation in four plankters. Acta Hydrobiologica Sinica, 1984, 8(2): 133-140. [林婉莲, 刘鑫洲, 刘建康. 四种浮游生物的碎屑形成过程. 水生生物学报, 1984, 8(2): 133-140.] |
| [51] |
Zhou SC, Huang XF, Tang T et al. Primary studies on plankton rotifers and water quality assessment in xiangxi bay of the Three Gorges Reservoir. Acta Hydrobiologica Sinica, 2006, 30(1): 52-57. [周淑婵, 黄祥飞, 唐涛等. 香溪河库湾轮虫现状及水质评价初探. 水生生物学报, 2006, 30(1): 52-57. DOI:10.3321/j.issn:1000-3207.2006.01.010] |
| [52] |
Lin Q, You WH, Xu FJ et al. Zooplankton community structure and its relationship with environmental factors in Dishui Lake. Acta Ecologica Sinica, 2014, 34(23): 6918-6929. [林青, 由文辉, 徐凤洁等. 滴水湖浮游动物群落结构及其与环境因子的关系. 生态学报, 2014, 34(23): 6918-6929. DOI:10.5846/stxb201303060360] |
| [53] |
欧阳虹. 太阳山湿地水生生态系统健康评价[学位论文]. 银川: 宁夏大学, 2021.
|
| [54] |
陈昕. 连环湖两个水体浮游生物群落结构特征及水生态评价[学位论文]. 上海: 上海海洋大学, 2020.
|
| [55] |
Sládeček V. Relation of saprobic to trophic levels. Internationale Vereinigung für theoretische und angewandte Limnologie: Verhandlungen, 1978, 20(3): 1885-1889. DOI:10.1080/03680770.1977.11896786 |
| [56] |
Xie P, Zhuge Y, Dai M et al. Impacts of eutrophication on biodiversity of plankton community. Acta Hydrobiologica Sinica, 1996, 20: 30-37. |
| [57] |
Li GG, Yu ZM. A study on the diversity of a zooplankton community in Lake Qiandaohu, Zhejiang. Biodiversity Science, 2001, 9(2): 115-121. [李共国, 虞左明. 浙江千岛湖浮游动物群落多样性研究. 生物多样性, 2001, 9(2): 115-121. DOI:10.3321/j.issn:1005-0094.2001.02.004] |
| [58] |
Qian FP, Xi YL, Wen XL et al. Eutrophication impact on community structure and species diversity of rotifers in five lakes of Anhui. Biodiversity Science, 2007, 15(4): 344-355. [钱方平, 席贻龙, 温新利等. 湖泊富营养化对轮虫群落结构及物种多样性的影响. 生物多样性, 2007, 15(4): 344-355. DOI:10.1360/biodiv.060322] |
| [59] |
翟盼. 芜湖市三湖泊轮虫群落的分类群和功能群参数对水体营养水平响应的比较研究[学位论文]. 芜湖: 安徽师范大学, 2016.
|
| [60] |
Jeppesen E, Nõges P, Davidson TA et al. Zooplankton as indicators in lakes: a scientific-based plea for including zooplankton in the ecological quality assessment of lakes according to the European Water Framework Directive(WFD). Hydrobiologia, 2011, 676(1): 279-297. DOI:10.1007/s10750-011-0831-0 |
| [61] |
Wen X, Xi Y, Qian F et al. Comparative analysis of rotifer community structure in five subtropical shallow lakes in East China: role of physical and chemical conditions. Hydrobiologia, 2011, 661(1): 303-316. DOI:10.1007/s10750-010-0539-6 |
| [62] |
Xie P, Xi YL, Wen XL et al. Responses of the spatio-temporal dynamics of rotifer community structure to the concentrations of N and P, and the effect of top-down in two lakes. Acta Ecologica Sinica, 2015, 35(14): 4763-4776. [谢萍, 席贻龙, 温新利等. 两湖泊轮虫群落结构的时空动态对水体氮磷含量及"下行效应"的响应. 生态学报, 2015, 35(14): 4763-4776. DOI:10.5846/stxb201311242802] |
| [63] |
Hurlbert SH. The nonconcept of species diversity: A critique and alternative parameters. Ecology, 1971, 52(4): 577-586. DOI:10.2307/1934145 |
| [64] |
Malekzadeh VR, Špoljar M. Structure of rotifer assemblages in shallow waterbodies of semi-arid northwest Iran differing in salinity and vegetation cover. Hydrobiologia, 2012, 686(1): 73-89. DOI:10.1007/s10750-011-0992-x |
| [65] |
Castro BB, Antunes SC, Pereira R et al. Rotifer community structure in three shallow lakes: seasonal fluctuations and explanatory factors. Hydrobiologia, 2005, 543(1): 221-232. DOI:10.1007/s10750-004-7453-8 |
| [66] |
Cazzanelli M, Warming TP, Christoffersen KS. Emergent and floating-leaved macrophytes as refuge for zooplankton in a eutrophic temperate lake without submerged vegetation. Hydrobiologia, 2008, 605(1): 113-122. DOI:10.1007/s10750-008-9324-1 |
| [67] |
Kurbatova SA, Lapteva NA, Bykova SN et al. Aquatic plants as a factor that changes trophic relations and the structure of zooplankton and microperiphytone communities. Biology Bulletin of the Russian Academy of Sciences, 2019, 46(3): 284-293. DOI:10.1134/S1062359019030051 |
| [68] |
Choi JY, Jeong KS, Kim SK et al. Role of macrophytes as microhabitats for zooplankton community in lentic freshwater ecosystems of South Korea. Ecological Informatics, 2014, 24: 177-185. DOI:10.1016/j.ecoinf.2014.09.002 |
| [69] |
Li Y, Chen F. Are zooplankton useful indicators of water quality in subtropical lakes with high human impacts?. Ecological Indicators, 2020, 113: 106167. DOI:10.1016/j.ecolind.2020.106167 |
| [70] |
Kuczyńska-Kippen N. The species diversity of rotifers(Rotifera) of differentiated macrophyte habitats of Lake Budzynskie. Roczniki Akademii Rolniczejw Poznaniu-CCCLXXⅢ. Bot.-Stec, 2005, 9: 171-176. |
| [71] |
Nandini S, Sarma SSS. Experimental studies on zooplankton-toxic cyanobacteria interactions: A review. Toxics, 2023, 11(2): 176. DOI:10.3390/toxics11020176 |
| [72] |
Gregersen R, Howarth JD, Atalah J et al. Paleo-diatom records reveal ecological change not detected using traditional measures of lake eutrophication. Science of the Total Environment, 2023, 867: 161414. |
| [73] |
白海锋. 渭河流域水生生物群落时空分布特征、驱动机制及水生态系统健康评价[学位论文]. 西安: 西北大学, 2022.
|
| [74] |
水生态健康评价技术指南. 国家标准化管理委员会, 国家市场监督管理总局, 2023.
|
| [75] |
Wu J, Mao R, Li M et al. Assessment of aquatic ecological health based on determination of biological community variability of fish and macroinvertebrates in the Weihe River Basin, China. Journal of Environmental Management, 2020, 267: 110651. DOI:10.1016/j.jenvman.2020.110651 |
| [76] |
Zhao C, Shao N, Yang S et al. Integrated assessment of ecosystem health using multiple indicator species. Ecological Engineering, 2019, 130: 157-168. DOI:10.1016/j.ecoleng.2019.02.016 |
 2024, Vol. 36
2024, Vol. 36 


