(2: 中国科学院大学, 北京 100049)
(3: 南京师范大学地理科学学院, 南京 210023)
(4: 中国科学院抚仙湖高原深水湖泊研究站/抚仙湖高原深水湖泊云南省野外科学观测站, 澄江 652500)
(5: 南方海洋科学与工程广东省实验室, 广州 511548)
(2: University of Chinese Academy of Sciences, Beijing 100049, P.R.China)
(3: School of Geographical Sciences, Nanjing Normal University, Nanjing 210023, P.R.China)
(4: Fuxianhu Research Station for Alpine Deep Lake, Fuxianhu Observation Station of Yunnan Province, Chengjiang 652500, P.R.China)
(5: Southern Marine Sciences and Engineering Guangdong Laboratory(Guangzhou), Guangzhou 511548, P.R.China)
氮素是地球上最基本的元素之一,与人类的生产和生活密切相关[1]。为满足人类经济社会发展的需求,我国活性氮产量从1910年的9.20×106 t增长到2010年的5.60×107 t[2]。人类使用后的氮素残留在地表,随着地表径流和地下水汇入湖泊[3-5]。全球湖泊沉积物中的氮素积累量正以(9.6±1.1)Tg/a的速度增长[6]。而沉积物中过量的氮素受风浪扰动后极易形成内源氮素负荷释放到水柱中,维持藻类生长,造成湖泊富营养化,破坏水生态系统,最终危机人类饮用水安全,这已成为一个全球性的环境问题[7-9]。
沉积物作为湖泊生态系统中氮素的重要源和汇,在微生物的驱动下不同价态和赋存形态的含氮化合物之间相互转化,构成氮循环网络(图 1)[1]。反硝化和厌氧氨氧化过程可在微生物的介导下将溶解态氮转化为气态氮(N2),实现沉积物的氮素脱除,长期以来被认为是湖泊沉积物中主要的脱氮过程[10],直到厌氧铁氨氧化过程(feammox)的发现打破了这一观点[11]。厌氧铁氨氧化过程是近年来新发现的微生物驱动的脱氮过程,在这一过程中,Fe(Ⅲ)作为电子受体,将NH4+氧化生成N2、NO3-和NO2-,根据热力学理论,N2是该过程的主要产物,这预示着厌氧铁氨氧化过程具有潜在的脱氮能力[12]。随着研究的深入,目前已在森林土壤[12]、河口湿地[13]、农田[14]和活性污泥反应器[15]中发现了厌氧铁氨氧化过程,并证实了其重要的脱氮作用。同时,厌氧铁氨氧化过程还会影响N2O的排放,N2O是重要的温室气体,其增温潜势是CO2的300倍[16]。以往的研究表明,在厌氧铁氨氧化过程中并未检测出N2O,这意味着厌氧铁氨氧化过程不产生N2O,或者N2O作为中间产物被消耗[17],因此,厌氧铁氨氧化过程对于缓解温室气体释放和水体富营养化治理具有重要意义。然而,由于厌氧铁氨氧化过程发现较晚,先前湖泊沉积物脱氮过程的研究主要集中在反硝化和厌氧氨氧化过程,鲜有厌氧铁氨氧化过程在湖泊沉积物中的研究报道,致使目前对于湖泊沉积物厌氧铁氨氧化过程的了解有限,湖泊沉积物中反硝化、厌氧氨氧化和厌氧铁氨氧化过程的相对脱氮贡献至今尚不明确。
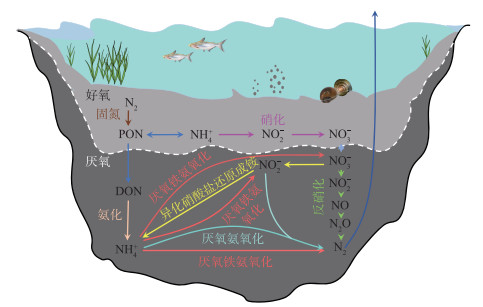
|
图 1 湖泊沉积物中微生物驱动的氮循环过程 Fig.1 Microbial-driven nitrogen cycling processes in lake sediment |
长江中下游地区是我国淡水湖泊最为集中的区域[18],同时,区域内大多数湖泊位于南方富铁红壤覆盖区,铁元素丰富[19]。此外,该区域经济繁荣,工、农业发达,人口密度大,氮污染问题严重[20]。丰富的铁和氮元素为厌氧铁氨氧化过程的发生提供了充分的底物条件。因此,我们推测长江中下游湖泊群可能是厌氧铁氨氧化过程发生的热点地区。基于此,选择长江中下游湖泊群作为研究对象,利用稳定同位素示踪技术揭示湖泊沉积物厌氧铁氨氧化过程的地理分布,定量湖泊沉积物中反硝化、厌氧氨氧化和厌氧铁氨氧化的速率,评估各脱氮过程的贡献,通过16S rRNA基因扩增子分析来解析厌氧铁氨氧化过程的潜在相关微生物。本研究旨在完善对湖泊生态系统氮循环路径的认识,明确湖泊生态系统氮素的转化过程和环境归趋,为湖泊生态系统氮素管理与水体富营养化治理提供重要的理论支撑。
1 材料与方法 1.1 采样点位长江中下游区域是我国水资源最为丰富的地区,湖泊分布密集[21]。该区域属于亚热带季风气候,年平均降水量超过1000 mm,年平均温度在15~20 ℃之间[22]。本研究主要在长江中下游湖泊开展采样工作,湖泊为洪湖、西凉湖、斧头湖、东湖、野猪湖、梁子湖、鄱阳湖、龙感湖、大官湖、黄湖、泊湖、菜子湖、白荡湖、巢湖、固城湖、高邮湖、洪泽湖、玄武湖(图 2)。
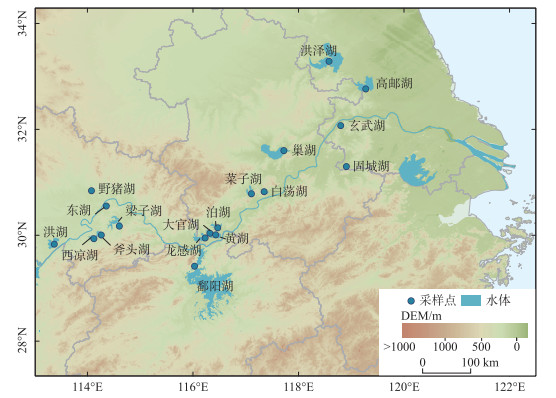
|
图 2 长江中下游湖泊沉积物采样点位分布 Fig.2 Distribution of sampling sites in the middle and lower reaches of the Yangtze River |
分别于2021年12月-2022年1月(冬季)和2022年6-7月(夏季)利用彼得逊采泥器对长江中下游湖泊群表层沉积物进行采集。采集的沉积物样品迅速装入无菌密封袋,并置于保温箱内及时送回实验室。沉积物样品分为两份:第一份置于4 ℃冰箱中保存,用于测定各脱氮过程的速率;第二份置于-20 ℃冰箱,用于分析沉积物理化特性和沉积物中微生物群落结构。
1.3 15N同位素示踪法将新鲜沉积物揉捏均匀与无菌厌氧去离子水(99.999 % 氦气,曝气30 min)按1 ∶7(w/v)的比例混合,制成泥浆,使用磁力搅拌器搅拌均匀,以减少组间误差。将泥浆分装至12 mL的Labco玻璃顶空瓶(Exetainer, Labco, UK),并采用溢流方式封盖确保没有任何顶空[23]。所有的操作均在厌氧工作站中进行(Baker Ruskinn Concept-500,美国)。然后将密封的Labco顶空瓶置于25 ℃、180转/min、黑暗环境下的摇床中预培养48 h,去除沉积物本底的亚硝酸盐、硝酸盐和氧气。预培养结束后进行3组处理:(1)对照组,无菌厌氧去离子水;(2)加入15NH4Cl;(3)加入Na15NO3,其中15NH4Cl或Na15NO3的最终浓度为100 μmol/L 15N。在25 ℃、180转/min的恒温摇床中培养24 h,之后向Labco顶空瓶中加入300 μL饱和ZnCl2溶液,终止瓶中的微生物反应。使用膜接口质谱仪(membrane inlet mass spectrometer, MIMS)直接测定可溶性气体29N2和30N2的组成和含量。通过(2)和(1)中30N2产生量之差计算厌氧铁氨氧化速率;(3)和(1)中30N2产生量计算反硝化速率;(3)和(1)中29N2的产生量计算厌氧氨氧化速率[14]。
1.4 理化性质测定将新鲜沉积物置于105 ℃烘箱干燥至恒重,干燥前后质量差与初始质量的比例即为含水率[24]。新鲜沉积物与超纯水按1 ∶2.5(w/v)的比值混合,使用pH仪测定沉积物pH[25]。沉积物中NH4+、NO3-和NO2-的含量用2 mol/L氯化钾提取后,用紫外分光光度计测定[26]。取0.5 g干泥加入10 mL 3 mol/L的盐酸,震荡离心,去除上清液。加入去离子水清洗多次、离心以去除残留的氯离子,直至沉积物呈中性,再次冻干、研磨后使用元素分析仪(EA3000, EuroVector, 意大利)测定总有机碳(TOC)[27]。Fe(Ⅱ)和Fe(Ⅲ)的含量测定采用Ferrozine显色法[28]。简单来说,将0.05 g的干沉积物加入8 mL的0.5 mol/L盐酸中,在室温下震荡2 h。随后,通过离心获取上清液,用0.45 μm的醋酸纤维滤膜进行过滤,滤液用Ferrozine显色法测定Fe(Ⅱ)含量。同时,将另取一部分滤液加入含有1 % 盐酸羟胺的Ferrozine溶液中,以确定总铁含量,Fe(Ⅲ)含量即为总铁含量减去Fe(Ⅱ)含量。湖水温度利用多参数水质分析仪(YSI 6600,Yellow Springs, 美国)现场测定。
1.5 DNA提取和高通量测序取0.5 g的冻干沉积物,使用Fast DNA© SPIN Kit for Soil(MP Biomedicals,美国)按照试剂盒说明书的指导提取DNA,并利用Nanodrop检测DNA的浓度和纯度。随后,通过PCR扩增细菌16S rRNA基因V4~V5区,采用以下引物对:515F(5'-GTGCCAGCMGCCGCGG-3')和907R(5'-CCGTCAATTCMTTTRAGTTT-3')[29],扩增条件为95 ℃ 2 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共25个循环,最后延伸72 ℃ 5 min。使用Illumina MiSeq平台对DNA文库进行测序(2×250),建库测序工作由上海凌恩生物科技有限公司承担。通过功能组注释与分类系统(functional annotation and profiling of taxa,FAPROTAX)进行微生物功能的生物地球化学过程注释[30]。
1.6 数据分析使用t-test和RDA(redundancy analysis)分析检验冬、夏季沉积物理化性质差异。采用Pearson相关性分析厌氧铁氨氧化、厌氧氨氧化、反硝化速率与环境因子之间的关系。利用基于Bray-Curtis距离的主坐标分析(principal coordinate analysis)来解析冬、夏季湖泊沉积物细菌群落结构的差异,并通过ADONIS检验是否存在显著差异。上述所有分析过程及可视化处理均在R(v.4.2.3)、Origin和Excel 2016中进行。
2 结果 2.1 湖泊理化性质长江中下游湖泊理化性质冬、夏季节差异显著。结果显示(图 3),长江中下游18个湖泊的水温夏季((31.7±1.1)℃)均高于冬季((9.6±2.2)℃)(P < 0.05)。而湖泊沉积物中的pH(冬季为8.0±0.4,夏季为8.3±0.3)、NH4+(冬季为(91.6±46.2) mg/kg,夏季为(162.5±66.7) mg/kg)、NO2-(冬季为(0.17±0.11) mg/kg,夏季为(0.30±0.08) mg/kg)、Fe(Ⅱ)(冬季为(2.7±1.1) mg/kg,夏季为(4.7±1.7) mg/kg)整体呈现夏季要高于冬季的现象(P < 0.05),但个别湖泊存在差异,例如鄱阳湖和泊湖中NH4+含量冬季要高于夏季,大官湖、黄湖、菜子湖、洪泽湖和玄武湖的pH,菜子湖、白荡湖和洪泽湖的NO2-含量,鄱阳湖和高邮湖Fe(Ⅱ)含量冬季均略高于夏季。而DO(冬季为(12.1±1.7) mg/L,夏季为(8.1±1.2) mg/L)和NO3-含量(冬季为(48.3±11.8) mg/kg,夏季为(14.0±6.6) mg/kg)冬季显著高于夏季(P < 0.05)。TOC、TIC、TN和Fe(Ⅲ)的季节差异规律并不显著(P>0.05)。
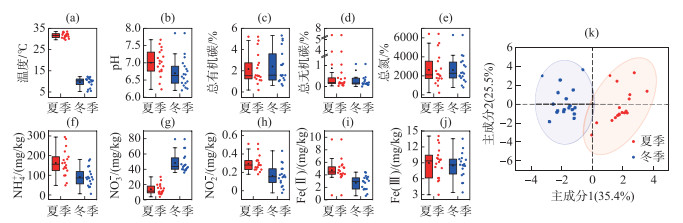
|
图 3 长江中下游各湖泊理化性质(a~j)以及冬季和夏季理化性质变化的主成分分析(k) Fig.3 Physicochemical properties (a-j) and principal component analysis of seasonal variations in the physicochemical properties (k) of lakes in the middle and lower reaches of the Yangtze River |
冬季长江中下游湖泊沉积物平均脱氮速率为(2.45±0.79) mg/(kg ·d),其中玄武湖冬季沉积物的脱氮速率最高,为3.82 mg/(kg ·d)(图 4d)。本研究的湖泊沉积物冬季反硝化平均速率为(2.38±0.80) mg/(kg ·d)(图 4c);厌氧氨氧化平均速率为(0.06±0.04) mg/(kg ·d),洪湖沉积物冬季并未检测出厌氧氨氧化速率(图 4b);厌氧铁氨氧化平均速率为(0.015±0.025) mg/(kg ·d),洪湖和西凉湖沉积物厌氧铁氨氧化速率远高于其他湖泊,速率分别为0.054和0.103 mg/(kg ·d)(图 4a)。本研究的湖泊群夏季沉积物平均脱氮速率为(2.66±1.06) mg/(kg ·d),其中固城湖沉积物夏季脱氮速率最高,为5.61 mg/(kg ·d)(图 4d)。反硝化平均速率为(2.54±1.04) mg/(kg ·d),夏季固城湖沉积物反硝化速率远高于其他湖泊,速率为5.45 mg/(kg ·d)(图 4c);厌氧氨氧化平均速率为(0.12±0.06) mg/(kg ·d),鄱阳湖夏季沉积物并未检测出厌氧氨氧化速率(图 4b);厌氧铁氨氧化平均速率为(0.005±0.005) mg/(kg ·d),野猪湖和龙感湖沉积物未检测出厌氧铁氨氧化速率(图 4a)。厌氧氨氧化过程夏季速率普遍高于冬季(P < 0.05),而反硝化和厌氧铁氨氧化过程冬夏两季速率整体上并未表现出显著差异(P>0.05)。
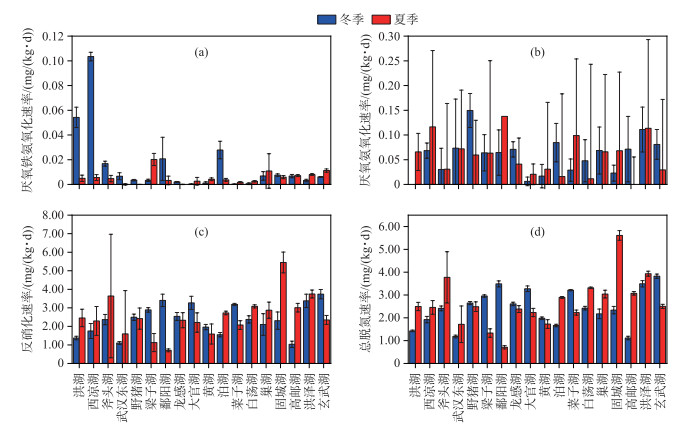
|
图 4 长江中下游湖泊沉积物各脱氮过程速率 Fig.4 Nitrogen removal rates in lake sediments of the middle and lower reaches of the Yangtze River |
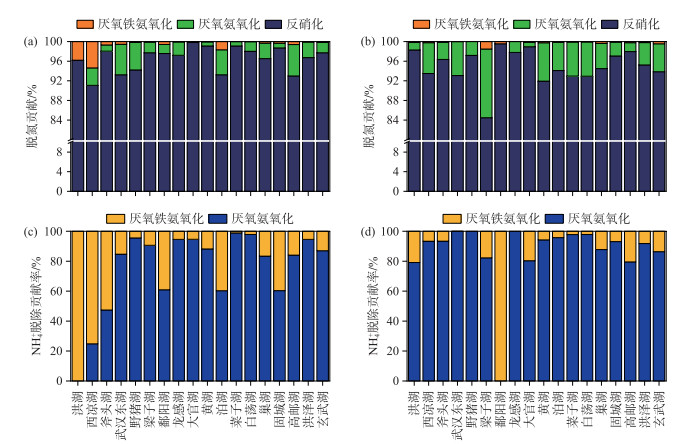
在脱氮贡献方面,冬季反硝化、厌氧氨氧化和厌氧铁氨氧化过程的平均脱氮贡献分别为96.5 % ±2.4 %、2.7 % ±2.0 %、0.8 % ±1.4 % (图 5a)。厌氧铁氨氧化和厌氧氨氧化对NH4+的平均脱除贡献分别为15.5 % ±23.4 %、84.5 % ±23.4 % (图 5c)。夏季反硝化、厌氧氨氧化和厌氧铁氨氧化过程的平均脱氮贡献分别为95.0 % ±3.4 %、4.8 % ±3.2 %、0.2 % ±0.3 % (图 5b)。厌氧铁氨氧化和厌氧氨氧化对NH4+的平均脱除贡献分别为13.4 % ±22.4 %、86.7 % ±22.4 % (图 5d)。反硝化过程在冬季和夏季各个湖泊中的脱氮作用差异较小,在夏季梁子湖中的脱氮贡献明显小于其他湖泊。厌氧氨氧化过程在夏季的脱氮贡献和脱氨贡献均高于冬季(P>0.05),同时在夏季梁子湖中脱氮贡献达到最高,为14.95 %。厌氧铁氨氧化过程在各个湖泊和季节中的脱氮贡献相对有限,而在冬季的洪湖和西凉湖中,厌氧铁氨氧化过程的脱氮贡献(洪湖3.80 %,西凉湖5.38 %)和脱氨贡献(洪湖100 %,西凉湖75.14 %)均远高于其他湖泊。
|
图 5 冬季(a)和夏季(b)厌氧铁氨氧化、厌氧氨氧化和反硝化过程的脱氮贡献率,冬季(c)和夏季(d)厌氧铁氨氧化、厌氧氨氧化过程的NH4+脱除贡献率 Fig.5 Nitrogen removal contributions of feammox, anammox, and denitrification in winter (a) and summer (b), contribution of feammox and anammox to NH4+ removal in winter (c) and summer (d) |
为了研究湖泊沉积物微生物群落,利用Illumina Miseq平台对沉积物进行16S rRNA基因测序。去除短的和低质量序列后,每个沉积物样品得到33731~42095条有效序列。沉积物样品的Simpson指数、Shannon指数和Chao1指数(基于97 % 相似性)见表 1。其中,野猪湖和高邮湖在夏季的Simpson指数略高于冬季,而鄱阳湖和龙感湖在夏季的指数略低于冬季,其他湖泊冬、夏两季Simpson指数差异并不显著。Shannon指数和Chao1指数结果表明,大部分湖泊在冬季和夏季的数值较为接近。然而,鄱阳湖和龙感湖在夏季的Shannon指数显著低于冬季,分别下降了0.73和0.93。Chao1指数也同样显示鄱阳湖和龙感湖在夏季的物种丰富度显著低于冬季。
| 表 1 湖泊沉积物细菌多样性水平 Tab. 1 Diversity of bacteria in lake sediments |
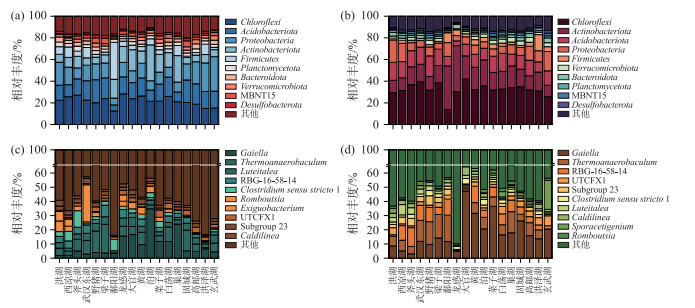
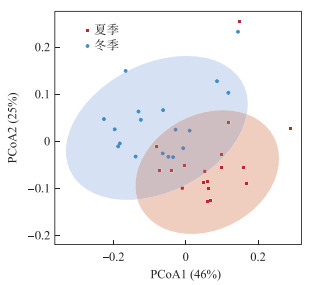
在门分类水平上,长江中下游湖泊冬、夏两季沉积物相对丰度前十的细菌相同,但Chloroflexi(绿弯菌门,冬季21.8 % ±4.2 %,夏季32.4 % ±5.8 %),Actinobacteriota(放线菌门,冬季12.5 % ±7.2 %,夏季19.1 % ±8.6 %),Verrucomicrobiota(疣微菌门,冬季2.8±0.7 %,夏季2.9 % ±1.0 %)相对丰度夏季高于冬季,而Acidobacteriota(酸杆菌门,冬季15.3 % ±4.0 %,夏季13.1 % ±3.4 %),Proteobacteria(变形菌门,冬季14.8 % ±6.3 %,夏季9.7 % ±4.5 %),Firmicutes(厚壁菌门,冬季6.7 % ±7.2 %,夏季4.1 % ±3.1 %),Planctomycetota(浮球菌门,冬季3.1 % ±0.6 %,夏季1.7 % ±0.5 %),Bacteroidota(拟杆菌门,冬季3.1 % ±0.8 %,夏季2.5 % ±0.8 %),MBNT15(冬季2.7 % ±0.4 %,夏季1.7 % ±0.7 %),Desulfobacterota(硫还原菌门,冬季2.0 % ±0.4 %,夏季1.5 % ±0.4 %)的相对丰度则是冬季大于夏季(图 6a, b)。经PCoA分析和ADONIS检验结果表明在门分类水平上,长江中下游湖泊沉积物细菌群落组成具有季节分布特征(图 7,P < 0.05)。
|
图 6 长江中下游湖泊沉积物冬季(a)和夏季(b)门水平相对丰度前十的细菌以及冬季(c)和夏季(d)属水平相对丰度排名前十的细菌 Fig.6 Top 10 bacteria at the phylum level in winter (a) and summer (b), top 10 bacteria at the genus level in winter (c) and summer(d), in lakes of the middle and lower reaches of the Yangtze River |
|
图 7 冬季和夏季微生物群落主坐标分析 Fig.7 PCoA of lake microbial communities in winter and summer |
在属分类水平上,长江中下游湖泊冬季沉积物相对丰度前十的细菌为Gaiella(盖氏菌属,9.3 % ±8.5 %),Thermoanaerobaculum(热厌氧杆菌属,7.2 % ±5.1 %),Luteitalea(4.0 % ±1.6 %),RBG-16-58-14(3.8 % ±1.7 %),Clostridium sensu stricto 1(严格意义上的梭状芽孢杆菌属1,3.3 % ±2.8 %),Romboutsia(2.7 % ±1.9 %),Exiguobacterium(微小杆菌属,2.6 % ±6.1 %),UTCFX1(2.4 % ±1.2 %),Subgroup 23(2.2 % ±0.9 %),Caldilinea(热线菌属,1.9 % ±0.9 %)。夏季沉积物相对丰度前十的细菌为Gaiella(盖氏菌属,17.4 % ±11.4 %),Thermoanaerobaculum(热厌氧杆菌属,8.4 % ±5.4 %),RBG-16-58-14(6.7 % ±3.8 %),UTCFX1(3.0 % ±1.6 %),Subgroup 23(2.8 % ±1.6 %),Clostridium sensu stricto 1(严格意义上的梭状芽孢杆菌属1,2.3 % ±0.9 %),Luteitalea(2.2 % ±1.6 %),Caldilinea(热线菌属,2.2 % ±1.2 %),Sporacetigenium(孢子产酸杆菌属,1.8 % ±4.6 %),Romboutsia(1.7 % ±0.6 %)。在属分类水平上,长江中下游湖泊沉积物的优势微生物存在显著的季节差异(图 6c, d)。
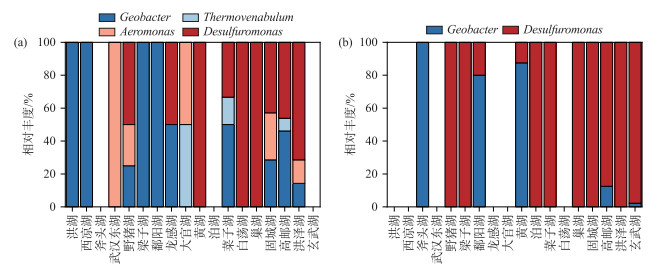
FAPROTAX结果显示,冬季主要的铁还原细菌是Geobacter(地杆菌属)、Thermovenabulum(热静脉菌属)、Aeromonas(气单胞菌属)和Desulfuromonas(脱硫单胞菌属),而夏季主要的铁还原细菌仅有Geobacter和Desulfuromonas(图 8a, b)。
|
图 8 长江中下游湖泊沉积物冬季(a)、夏季(b)主要的铁还原菌 Fig.8 Major iron-reducing bacteria in lakes of the middle and lower reaches of the Yangtze River in winter (a) and summer(b) |
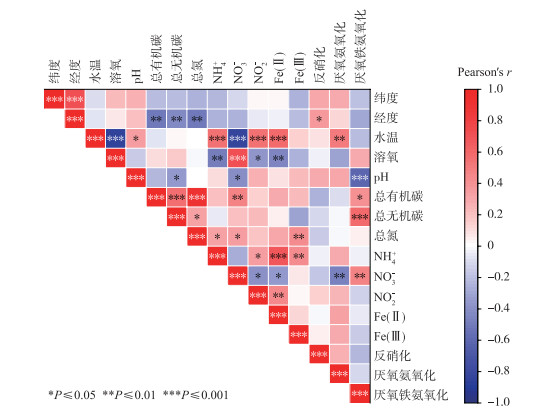
相关性分析结果显示,厌氧铁氨氧化速率与pH呈现负相关,与TIC、TOC、NO3-均呈现正相关(图 9)。长江中下游湖泊沉积物夏季OTU4982(Geothermobacter)、OTU4988(RBG-16-58-14)、OTU 6968(Hypnocyclicus)的相对丰度与厌氧铁氨氧化速率呈现正相关。冬季OTU19(Paenisporosarcina)、OTU659(Romboutsia uncultured bacterium)、OTU1317(Candidatus competibacter)的相对丰度与厌氧铁氨氧化速率呈现正相关(表 2)。
|
图 9 长江中下游湖泊沉积物厌氧铁氨氧化、厌氧氨氧化和反硝化速率与环境因子的Pearson相关性分析 Fig.9 Pearson correlation analysis of feammox, anammox, and denitrification rates with environmental factors in lake sediments of lakes in the middle and lower reaches of the Yangtze River |
| 表 2 厌氧铁氨氧化速率与微生物相对丰度的Pearson相关性分析 Tab. 2 Pearson correlation analysis between feammox rates and microbial relative abundance |
厌氧铁氨氧化过程已在多种生境中被发现,包括森林土壤[12]、农田[14]、河岸带[31]等。然而,对湖泊沉积物中厌氧铁氨氧化过程鲜有研究。本研究利用15N稳定同位素示踪技术对湖泊沉积物中的厌氧铁氨氧化、厌氧氨氧化和反硝化速率进行研究。在进行稳定同位素培养之前,对培养体系进行48 h的黑暗密闭培养,以去除本底的O2、NO2-和NO3-。同时所有实验操作均在厌氧培养箱中进行,确保了实验过程中的厌氧条件,排除硝化过程对本研究的影响。此外,考虑到在自然生境中,通常Fe元素的含量要远高于Mn元素,且在长江中下游湖泊沉积物中具有数量级的差异[32-33]。因此,本研究认为在没有外源Mn元素添加的情况下,锰氨氧化过程对厌氧铁氨氧过程的影响可以忽略。综上所述,本研究中检测到的30N2只能通过厌氧铁氨氧化过程直接生成,或者通过厌氧铁氨氧化过程将15NH4+氧化生成15NO2-和15NO3-,再通过厌氧氨氧化或者反硝化过程生成30N2。所有产生30N2的途径都需要经过厌氧铁氨氧化过程,所以将30N2的产生速率作为厌氧铁氨氧化过程的潜在速率是合理的[12]。在培养体系中检测出30N2的存在也证实了厌氧铁氨氧化过程的发生。本研究中厌氧铁氨氧化速率范围在0~0.10 mg/(kg ·d),该速率与Ding等[31]在太湖区域中的农田、河岸土壤和河流沉积物中报道到的0.02~0.19 mg/(kg ·d)以及Chen等[13]在河口和沿海湿地报道的0.05~0.23 mg/(kg ·d)也相近。
3.1 厌氧铁氨氧化过程的影响因素 3.1.1 pH对厌氧铁氨氧化过程的影响厌氧铁氨氧化过程可能受到多种环境因素的影响。在本研究中,厌氧铁氨氧化的速率与pH呈负相关,这与Yang等[12]的研究结果相符。高pH环境中会降低铁氧化物的活性,从而抑制厌氧铁氨氧化过程。此外,先前的研究表明,酸性条件下,厌氧铁氨氧化过程的功能微生物Acidimicrobiaceae sp. A6菌株表现出更高的活性[34],因此湖泊沉积物中更高的pH可能会抑制厌氧铁氨氧化过程的活性,从而导致厌氧铁氨氧化的速率下降。
3.1.2 碳源对厌氧铁氨氧化过程的影响TOC和TIC均与厌氧铁氨氧化速率呈现正相关,Ding等[31]在河岸带的研究中也观察到高TOC有助于提高厌氧铁氨氧化活性。这可能因为一些有机质可以作为电子穿梭体,促进厌氧铁氨氧化的相关微生物与Fe(Ⅲ)之间的电子传递,从而促进厌氧铁氨氧化过程的发生。此外,较高的TOC还能促进黏土矿物释放Fe(Ⅲ)[35],提高厌氧铁氨氧化过程对Fe(Ⅲ)的利用率。而对于TIC,早在2006年,Sawayama[36]在反应器内发现NaHCO3可以促进厌氧铁氨氧化过程。而后在Acidimicrobiaceae sp. A6菌株的培养实验中也证实了无机碳对Acidimicrobiaceae sp. A6菌株的生长有促进作用[34]。因此,较高的TIC有利于厌氧铁氨氧化过程的发生。
3.1.3 NO3-对厌氧铁氨氧化过程的影响此外,研究还发现NO3-与厌氧铁氨氧化过程呈现正相关,这可能是因为湖泊沉积物中存在硝酸盐依赖亚铁氧化(nitrate-dependent Fe(Ⅱ) oxidation, NDFO)过程。硝酸盐依赖亚铁氧化过程是以Fe(Ⅱ)作为电子供体,将硝酸盐还原的过程[37],在这个过程中会产生厌氧铁氨氧化过程需要的Fe(Ⅲ),从而促进厌氧铁氨氧化过程。Wang等[38]已在湿地、农田和湖泊沉积物中证实了硝酸盐依赖亚铁氧化和厌氧铁氨氧化过程的耦合作用,但目前关于厌氧铁氨氧化和硝酸盐依赖亚铁氧化耦合过程的研究大多聚焦在污水处理系统中[39],自然生境中硝酸盐依赖亚铁氧化和厌氧铁氨氧化耦合作用仍然需要更多深入的研究[40]。
3.2 厌氧铁氨氧化、厌氧氨氧化和反硝化过程的脱氮贡献厌氧铁氨氧化、厌氧氨氧化和反硝化过程能够将NH4+、NO3-和NO2-转化为稳定的N2,实现水生态系统中过量氮素的脱除。从图 4可知,反硝化过程在冬、夏两季对氮脱除的贡献显著,冬季平均脱氮贡献为96.5 % ±2.4 %,夏季平均脱氮贡献为95.0 % ±3.4 %。而在夏季的梁子湖中反硝化脱氮贡献仅为84.5 %,远低于平均值。这可能是由于梁子湖夏季沉积物NO3-含量为18.0 mg/kg,远低于冬季含量(54.9 mg/kg),同时,夏季NH4+含量(249.2 mg/kg)又高于冬季(92.0 mg/kg),梁子湖的NO3-和NH4+含量季节变化显著影响了沉积物反硝化和厌氧氨氧化过程反应底物的浓度,夏季促进了厌氧氨氧化过程活性[41],而抑制了反硝化过程活性[42],造成反硝化过程在梁子湖夏季脱氮贡献最低,厌氧氨氧化过程在梁子湖夏季脱氮贡献最高的结果。
长江中下游湖泊整体脱氮贡献排其次的是厌氧氨氧化过程,其冬、夏两季脱氮贡献分别为2.7 % ±2.0 % 和4.8 % ±3.2 %。但在冬季洪湖和夏季鄱阳湖中并未检测出厌氧氨氧化过程速率。厌氧氨氧化菌是化能自养型,以无机碳作为唯一碳源[10],洪湖沉积物中除了富含TIC外,还具有较高含量的TOC,而当有机碳丰富时,一方面,厌氧氨氧化过程可能会受到有机碳的抑制[43],另一方面,与异养反硝化菌相比,厌氧氨氧化细菌的生长速率非常慢,并且在有机碳丰富时不如反硝化过程具有热力学优势,因此在竞争底物的过程中被逐渐淘汰[44-45]。而在夏季鄱阳湖,沉积物中NH4+(48.8 mg/kg)和NO3-(4.0 mg/kg)含量远低于同时期其他湖泊的平均值(NH4+为162.5 mg/kg,NO3-为14.0 mg/kg)。因此,由于上述原因在冬季洪湖和夏季鄱阳湖中未检测出厌氧氨氧化过程。
相比之下,厌氧铁氨氧化过程的脱氮贡献较为有限,冬季和夏季脱氮贡献分别为0.8 % ±1.4 % 和0.2 % ±0.3 %。但值得注意的是,冬季洪湖和西凉湖的脱氮贡献分别为3.8 % 和5.4 %,远高于平均值。这是由于洪湖和西凉湖沉积物TOC和TIC含量高,为厌氧铁氨氧化过程提供了丰富的碳源和潜在的电子穿梭体,而冬季pH相较于夏季更适宜厌氧铁氨氧化过程,因此厌氧铁氨氧化过程在冬季的洪湖和西凉湖反应异常活跃。与Ding等[23, 46]在水稻田中的报道相比较,本研究中的厌氧氨氧化过程的脱氮贡献相近,反硝化过程的脱氮贡献则要略高于Ding的报道,而厌氧铁氨氧化过程的脱氮贡献明显低于水稻田。在冬夏两季湖泊沉积物中,厌氧铁氨氧化过程对氮的平均脱除贡献均小于1 %。尽管厌氧铁氨氧化过程对于氮素的脱除贡献较为有限,但在NH4+脱除中的贡献中却较为显著,其NH4+脱除贡献冬季为15.5 % ±23.4 %、夏季为13.4 % ±22.4 %。而NH4+是水生生物最容易利用的氮素形式之一[47],也是水质监测的重要指标[48],同时积累在沉积物中的NH4+在浅水湖泊中受风浪扰动后极易形成内源NH4+负荷释放到水柱中,从而维持藻类生长[49]。厌氧铁氨氧化过程在一些湖泊沉积物(冬季:洪湖、西凉湖和斧头湖;夏季:鄱阳湖)中对NH4+的脱除贡献甚至高于厌氧氨氧化,可见厌氧铁氨氧化过程在NH4+脱除中的作用不容忽视。
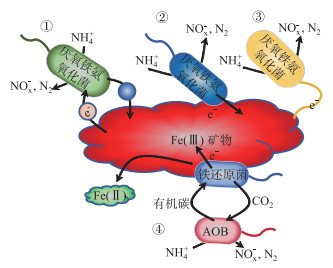
3.3 厌氧铁氨氧化过程潜在的相关微生物FAPROTAX功能预测分析结果显示,冬季主要的铁还原细菌是Geobacter(地杆菌)、Thermovenabulum(热脉杆菌)、Aeromonas(气单胞菌)和Desulfuromonas(硫还原单胞菌),而夏季主要的铁还原细菌仅有Geobacter和Desulfuromonas,2个季节存在明显的差异。造成这一结果的原因可能是在冬季湖泊沉积物pH普遍低于夏季,而异化铁还原菌适宜在较低的pH环境中生长,此外,其他微生物在夏季生命活动可能更为活跃,对铁还原菌的竞争压力较大,而冬季这些竞争微生物活性减缓,给铁还原菌提供了更多生长空间[50],因此在长江中下游湖泊沉积物冬季的异化铁还原菌比夏季更为丰富。其中,Geobacter和Desulfurmonas是长江中下游湖泊沉积物冬、夏季主要的异化铁还原菌。异化铁还原菌能够以胞外的Fe(Ⅲ)作为电子受体,通过胞外呼吸方式完成电子传递[51]。而在先前多项研究中发现Geobacter的丰度与厌氧铁氨氧化速率呈现显著正相关,推测Geobacter可能是厌氧铁氨氧化过程的潜在相关微生物[13, 52-53]。在本研究中虽没有发现其相对丰度与厌氧铁氨氧化速率呈现显著正相关,但仍可能参与或影响着湖泊厌氧铁氨氧化过程(图 10)。
|
图 10 厌氧铁氨氧化过程潜在的反应机制:①通过电子穿梭体;②与Fe(Ⅲ)直接接触;③通过鞭毛传递;④AOB(氨氧化菌)与铁还原菌合作 Fig.10 Potential mechanisms of feammox: ①Through electron shuttles; ②Direct contact with Fe(Ⅲ); ③Via flagella transfer; ④Cooperation between AOB and iron-reducing bacteria |
对沉积物16S rRNA基因测序数据分析的结果显示,冬季OTU19(Paenisporosarcina)、OTU659(Romboutsia_uncultured bacterium)、OTU1317(Candidatus competibacter)的相对丰度与厌氧铁氨氧化速率呈现正相关,夏季OTU4982(Geothermobacter)、OTU4988(RBG-16-58-14)的相对丰度与厌氧铁氨氧化速率呈现正相关。其中Geothermobacter[53]和Paenisporosarcina[54]已被报道具有铁循环相关的功能。Romboutsia[55]被报道能将NH4+氧化生成NO3-,这与厌氧铁氨氧化过程相似。而RBG-16-58-14[56]在河流沉积物中报道与功能基因nxrA和hao呈正相关,这两个基因是NH4+氧化生成NO3-的关键基因,因此RBG-16-58-14可能在NH4+氧化过程起着关键作用。Candidatus competibacter具有脱氮功能[57],同时廖宏燕等[58]在厌氧铁氨氧化反应器中也发现了Candidatus competibacter。所以,OTU19(Paenisporosarcina)、OTU659(Romboutsia_uncultured bacterium)、OTU1317(Candidatus competibacter)、OTU4982(Geothermobacter)和OTU4988(RBG-16-58-14)可能是驱动厌氧铁氨氧化过程的潜在相关微生物。
4 结论长江中下游湖泊沉积物中脱氮贡献呈现厌氧铁氨氧化 < 厌氧氨氧化 < 反硝化的规律。尽管厌氧铁氨氧化过程对于总体氮素脱除的贡献较为有限,但在NH4+脱除中的贡献不可忽视,其NH4+脱除贡献在冬季和夏季分别为15.5 % ±23.4 % 和13.4 % ±22.4 %。pH、NO3-、TOC和TIC可能是厌氧铁氨氧化过程的主要影响因素。OTU19(Paenisporosarcina)、OTU659(Romboutsia_uncultured bacterium)、OTU1317(Candidatus competibacter)、OTU4982(Geothermobacter)、OTU4988(RBG-16-58-14)和Geobacter可能是参与湖泊沉积物厌氧铁氨氧化过程的微生物。
致谢: 感谢笪俊、余春艳和吴琼同学在采样过程中提供的帮助。
| [1] |
Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network. Nature Reviews Microbiology, 2018, 16: 263-276. DOI:10.1038/nrmicro.2018.9 |
| [2] |
Cui SH, Shi YL, Groffman PM et al. Centennial-scale analysis of the creation and fate of reactive nitrogen in China (1910-2010). Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(6): 2052-2057. DOI:10.1073/pnas.1221638110 |
| [3] |
Jiang QH, Jin GQ, Tang HW et al. Ammonium (NH4+) transport processes in the riverbank under varying hydrologic conditions. Science of the Total Environment, 2022, 826: 154097. DOI:10.1016/j.scitotenv.2022.154097 |
| [4] |
Seitzinger S. Nitrogen cycle: Out of reach. Nature, 2008, 452(7184): 162-163. DOI:10.1038/452162a |
| [5] |
Dean WE, Gorham E. Magnitude and significance of carbon burial in lakes, reservoirs, and peatlands. Geology, 1998, 26(6): 535. DOI:10.1130/0091-7613(1998)0260535:masocb>2.3.co;2 |
| [6] |
Wang M, Houlton BZ, Wang ST et al. Human-caused increases in reactive nitrogen burial in sediment of global lakes. Innovation: Cambridge: Mass, 2021, 2(4): 100158. DOI:10.1016/j.xinn.2021.100158 |
| [7] |
Ho JC, Michalak AM, Pahlevan N. Widespread global increase in intense lake phytoplankton blooms since the 1980s. Nature, 2019, 574: 667-670. DOI:10.1038/s41586-019-1648-7 |
| [8] |
Kennedy CD. Nitrogen overload: Environmental degradation, ramifications, and economic costs. Groundwater, 2021, 59(2): 161-162. DOI:10.1111/gwat.13066 |
| [9] |
Huisman J, Codd GA, Paerl HW et al. Cyanobacterial blooms. Nature Reviews Microbiology, 2018, 16: 471-483. DOI:10.1038/s41579-018-0040-1 |
| [10] |
Strous M, Fuerst JA, Kramer EHM et al. Missing lithotroph identified as new planctomycete. Nature, 1999, 400: 446-449. DOI:10.1038/22749 |
| [11] |
Clement J, Shrestha J, Ehrenfeld J et al. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils. Soil Biology and Biochemistry, 2005, 37(12): 2323-2328. DOI:10.1016/j.soilbio.2005.03.027 |
| [12] |
Yang WH, Weber KA, Silver WL. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction. Nature Geoscience, 2012, 5: 538-541. DOI:10.1038/ngeo1530 |
| [13] |
Chen ST, Gao DZ, Li XF et al. Nitrogen loss from anaerobic ammonium oxidation coupled to Iron(Ⅲ) reduction activity across estuarine and coastal wetlands of China: Spatial variations, controlling factors, and environmental implications. CATENA, 2023, 222: 106805. DOI:10.1016/j.catena.2022.106805 |
| [14] |
Ding LJ, An XL, Li S et al. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence. Environmental Science & Technology, 2014, 48(18): 10641-10647. DOI:10.1021/es503113s |
| [15] |
Yao ZB, Wang CH, Song N et al. Oxidation of ammonium in aerobic wastewater by anoxic ferric iron-dependent ammonium oxidation (Feammox) in a biofilm reactor. Desalination and Water Treatment, 2020, 173: 197-206. DOI:10.5004/dwt.2020.24822 |
| [16] |
Guan QS, Cao WZ, Wang M et al. Nitrogen loss through anaerobic ammonium oxidation coupled with iron reduction in a mangrove wetland. European Journal of Soil Science, 2018, 69(4): 732-741. DOI:10.1111/ejss.12552 |
| [17] |
Ivens WP, Tysmans DJ, Kroeze C et al. Modeling global N2O emissions from aquatic systems. Current Opinion in Environmental Sustainability, 2011, 3(5): 350-358. DOI:10.1016/j.cosust.2011.07.007 |
| [18] |
Qin BQ. Approaches to mechanisms and control of eutrophication of shallow lakes in the middle andlower reaches of the Yangze River. J Lake Sci, 2002, 14(3): 193-202. [秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301] |
| [19] |
洪祎君. 中国南方网纹红土的形成机制及网纹成熟度研究[学位论文]. 南昌: 江西师范大学, 2015.
|
| [20] |
Zhu GW, Xu H, Zhu MY et al. Changing characteristics and driving factors of trophic state of lakes in the middle and lower reaches of Yangtze River in the past 30 year. J Lake Sci, 2019, 31(6): 1510-1524. [朱广伟, 许海, 朱梦圆. 三十年来长江中下游湖泊富营养化状况变迁及其影响因素. 湖泊科学, 2019, 31(6): 1510-1524. DOI:10.18307/2019.0622] |
| [21] |
Liu ZM, Zhang YC, Guan BH et al. Spatio-temporal distribution dynamics of different life-form aquatic vegetation in lakes ofthe middle and lower reaches of the Yangtze River, 1986-2020. J Lake Sci, 2023, 35(6): 2022-2036. [刘兆敏, 张玉超, 关保华. 长江中下游湖泊群不同生活型水生植物分布的时空变化(1986-2020年). 湖泊科学, 2023, 35(6): 2022-2036. DOI:10.18307/2023.0631] |
| [22] |
Li J, Wu HW, Zhou YQ et al. Variations of stable oxygen and deuterium isotopes in river and lake waters during flooding season along the middle and lower reaches of the Yangtze River Regions. Environmental Science, 2020, 41(3): 1176-1183. [李静, 吴华武, 周永强. 长江中下游地区丰水期河、湖水氢氧同位素组成特征. 环境科学, 2020, 41(3): 1176-1183. DOI:10.13227/j.hjkx.201908160] |
| [23] |
Ding BJ, Chen ZH, Li ZK et al. Nitrogen loss through anaerobic ammonium oxidation coupled to Iron reduction from ecosystem habitats in the Taihu Estuary region. Science of the Total Environment, 2019, 662: 600-606. DOI:10.1016/j.scitotenv.2019.01.231 |
| [24] |
范成新. 湖泊沉积物调查规范. 北京: 科学出版社, 2018.
|
| [25] |
Li XF, Hou LJ, Liu M et al. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland. Environmental Science & Technology, 2015, 49(19): 11560-11568. DOI:10.1021/acs.est.5b03419 |
| [26] |
Zhu GB, Wang SY, Wang Y et al. Anaerobic ammonia oxidation in a fertilized paddy soil. The ISME Journal, 2011, 5(12): 1905-1912. DOI:10.1038/ismej.2011.63 |
| [27] |
Hou LJ, Liu M, Ou DN et al. Influences of the macrophyte (Scirpus mariqueter) on phosphorous geochemical properties in the intertidal marsh of the Yangtze Estuary. Journal of Geophysical Research: Biogeosciences, 2008, 113(G4). DOI:10.1029/2008JG000780 |
| [28] |
Lovley DR, Phillips EJ. Rapid assay for microbially reducible ferric iron in aquatic sediments. Applied and Environmental Microbiology, 1987, 53(7): 1536-1540. DOI:10.1128/aem.53.7.1536-1540.1987 |
| [29] |
Ren GD, Zhang HY, Lin XG et al. Response of phyllosphere bacterial communities to elevated CO2 during rice growing season. Applied Microbiology and Biotechnology, 2014, 98(22): 9459-9471. DOI:10.1007/s00253-014-5915-0 |
| [30] |
Louca S, Jacques SMS, Pires APF et al. High taxonomic variability despite stable functional structure across microbial communities. Nature Ecology & Evolution, 2016, 1: 15. DOI:10.1038/s41559-016-0015 |
| [31] |
Ding BJ, Qin YB, Luo WQ et al. Spatial and seasonal distributions of Feammox from ecosystem habitats in the Wanshan Region of the Taihu watershed, China. Chemosphere, 2020, 239: 124742. DOI:10.1016/j.chemosphere.2019.124742 |
| [32] |
Bing HJ, Wu YH, Zhang YJ et al. Possible factors controlling the distribution of phosphorus in the sediment of Longgan Lake, middle reach of Yangtze River, China. Environmental Earth Sciences, 2014, 71(10): 4553-4564. DOI:10.1007/s12665-013-2848-3 |
| [33] |
Gong MD, Jin ZF, Wang Y et al. Coupling between iron and phosphorus in sediments of shallow lakes in the middle and lower reaches of Yangtze River using diffusive gradients in thin films (DGT). J Lake Sci, 2017, 29(5): 1103-1111. [龚梦丹, 金增锋, 王燕. 长江中下游典型浅水湖泊沉积物-水界面磷与铁的耦合关系. 湖泊科学, 2017, 29(5): 1103-1111. DOI:10.18307/2017.0508] |
| [34] |
Huang S, Jaffé PR. Isolation and characterization of an ammonium-oxidizing iron reducer: Acidimicrobiaceae sp. A6. PLoS One, 2018, 13(4): e0194007. DOI:10.1371/journal.pone.0194007 |
| [35] |
Jia R, Li LN, Qu D et al. Enhanced iron(Ⅲ) reduction following amendment of paddy soils with biochar and glucose modified biochar. Environmental Science and Pollution Research, 2018, 25(1): 91-103. DOI:10.1007/s11356-016-8081-3 |
| [36] |
Sawayama S. Possibility of anoxic ferric ammonium oxidation. Journal of Bioscience and Bioengineering, 2006, 101(1): 70-72. DOI:10.1263/jbb.101.70 |
| [37] |
Carlson HK, Clark IC, Blazewicz SJ et al. Fe(Ⅱ) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions. Journal of Bacteriology, 2013, 195(14): 3260-3268. DOI:10.1128/JB.00058-13 |
| [38] |
Wang W, Ding BJ, Hu YY et al. Evidence for the occurrence of Feammox coupled with nitrate-dependent Fe(Ⅱ) oxidation in natural enrichment cultures. Chemosphere, 2022, 303(Pt 1): 134903. DOI:10.1016/j.chemosphere.2022.134903 |
| [39] |
Li JM, Zeng W, Liu H et al. Achieving deep autotrophic nitrogen removal in aerated biofilter driven by sponge iron: Performance and mechanism. Environmental Research, 2022, 213: 113653. DOI:10.1016/j.envres.2022.113653 |
| [40] |
Hu KY, Li WX, Wang YN et al. Novel biological nitrogen removal process for the treatment of wastewater with low carbon to nitrogen ratio: A review. Journal of Water Process Engineering, 2023, 53: 103673. DOI:10.1016/j.jwpe.2023.103673 |
| [41] |
Zhang L, Yang JC, Furukawa K. Stable and high-rate nitrogen removal from reject water by partial nitrification and subsequentanammox. Journal of Bioscience and Bioengineering, 2010, 110(4): 441-448. DOI:10.1016/j.jbiosc.2010.05.008 |
| [42] |
Duff JH, Triska FJ. Denitrifïcations in sediments from the hyporheic zone adjacent to a small forested stream. Canadian Journal of Fisheries and Aquatic Sciences, 1990, 47(6): 1140-1147. DOI:10.1139/f90-133 |
| [43] |
Jin RC, Yang GF, Yu JJ et al. The inhibition of the Anammox process: A review. Chemical Engineering Journal, 2012, 197: 67-79. DOI:10.1016/j.cej.2012.05.014 |
| [44] |
Lisa JA, Song B, Tobias CR et al. Genetic and biogeochemical investigation of sedimentary nitrogen cycling communities responding to tidal and seasonal dynamics in Cape Fear River Estuary. Estuarine, Coastal and Shelf Science, 2015, 167: A313-A323. DOI:10.1016/j.ecss.2015.09.008 |
| [45] |
Zhao YG, Huang J, Zhao H et al. Microbial community and N removal of aerobic granular sludge at high COD and N loading rates. Bioresource Technology, 2013, 143: 439-446. DOI:10.1016/j.biortech.2013.06.020 |
| [46] |
丁帮璟. 农田土壤微生物驱动的氮素损失过程及其环境意义[学位论文]. 南京: 南京大学, 2021.
|
| [47] |
Bittsánszky A, Pilinszky K, Gyulai G et al. Overcoming ammonium toxicity. Plant Science: an International Journal of Experimental Plant Biology, 2015, 231: 184-190. DOI:10.1016/j.plantsci.2014.12.005 |
| [48] |
Xu XH, Lian YQ, Li XK et al. Identifying optimal minimum water quality index for weihe river tributaries in Xi'an city. Water Resources and Power, 2023, 41(1): 63-67. [徐新涵, 连炎清, 李晓科. 西安市渭河支流最小水质指数优选. 水电能源科学, 2023, 41(1): 63-67.] |
| [49] |
Liu CY, Yang YT, Zhou JQ et al. Migration and transformation of nitrogen in sediment-water system within storm sewers. Journal of Environmental Management, 2021, 287: 112355. DOI:10.1016/j.jenvman.2021.112355 |
| [50] |
Kappler A, Bryce C, Mansor M et al. An evolving view on biogeochemical cycling of iron. Nature Reviews Microbiology, 2021, 19: 360-374. DOI:10.1038/s41579-020-00502-7 |
| [51] |
Shi L, Dong HL, Reguera G et al. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14: 651-662. DOI:10.1038/nrmicro.2016.93 |
| [52] |
Liu X, Wang F, Jiang HL et al. Anaerobic ammonium oxidation coupled to ferric iron reduction and its contribution to nitrogen loss in the sediment of Meiliang Bay, Lake Taihu. Energy & Environmental Science, 2018, 27(8): 1481-1487. [刘新, 王芳, 江和龙. 太湖梅梁湾沉积物中铁氧化氨作用及其脱氮贡献. 生态环境学报, 2018, 27(8): 1481-1487.] |
| [53] |
Li XM, Ding LJ, Li XM et al. Abundance, diversity, and structure of Geobacteraceae community in paddy soil under long-term fertilization practices. Applied Soil Ecology, 2020, 153: 103577. DOI:10.1016/j.apsoil.2020.103577 |
| [54] |
Jiang YH, Zhang SR, Wei RX et al. Microbial community changes during anaerobic nitrate reduction and Fe(Ⅱ) oxidation of a coastal saline paddy soil under alkaline pH. Journal of Soils and Sediments, 2022, 22(10): 2720-2730. DOI:10.1007/s11368-022-03247-3 |
| [55] |
Yan RX, Wu H, Yang XY et al. Soil decreases N2O emission and increases TN content during combined composting of wheat straw and cow manure by inhibiting denitrification. Chemical Engineering Journal, 2023, 477: 147306. DOI:10.1016/j.cej.2023.147306 |
| [56] |
Zhang L, Li XC, Fang WK et al. Impact of different types of anthropogenic pollution on bacterial community and metabolic genes in urban river sediments. Science of the Total Environment, 2021, 793: 148475. DOI:10.1016/j.scitotenv.2021.148475 |
| [57] |
Su YL, Du R, Wang J et al. Successful start-up of a novel integrated denitrifying phosphorus removal and partial denitrification coupled with anammox process for simultaneous nitrogen and phosphorus removal with fully ordinary suspended sludge. Chemical Engineering Journal, 2023, 477: 147227. DOI:10.1016/j.cej.2023.147227 |
| [58] |
Liao XY, Song C, Wan LY et al. Effect of chelated iron on nitrogen removal efficiency and microbial community structure in the anaerobic ferric ammonium oxidation. Environmental Science, 2021, 42(9): 4366-4373. [廖宏燕, 宋诚, 万柳杨. 螯合铁对厌氧铁氨氧化脱氮效能及微生物群落的影响. 环境科学, 2021, 42(9): 4366-4373. DOI:10.13227/j.hjkx.202012216] |
 2024, Vol. 36
2024, Vol. 36 


