(2: 西藏大学生态环境学院, 青藏高原湿地与流域生态系统实验室, 拉萨 850000)
(3: 西藏大学生态环境学院, 青藏高原生物多样性与生态环境保护教育部重点实验室, 拉萨 850000)
(2: Laboratory of Wetland and Catchment Ecosystem in Tibetan Plateau, School of Ecology and Environment, Tibet University, Lhasa 850000, P. R. China)
(3: Key Laboratory of Biodiversity and Environment on the Qinghai-Tibet Plateau, Ministry of Education, School of Ecology and Environment, Tibet University, Lhasa 850000, P. R. China)
随着全球气候变化和人类活动的加剧,湿地生态系统正面临前所未有的挑战,包括水质恶化、生物多样性丧失和碳排放增加等问题,这些变化对湿地生态系统中的浮游植物群落,特别是优势种结构和功能产生了深远的影响[1-2]。浮游植物作为水环境中的关键生态指示类群和初级生产者,在维持湿地生态系统的健康和稳定中扮演着至关重要的角色[3]。优势种通常指在特定生态系统中,因其丰度高、生物量大或生态功能显著而占据主导地位的物种,它们在研究从个体到生态系统的生态过程中发挥着重要作用,反映了群落在环境中的适应性和竞争力,同时也代表着群落的稳定性[4-5]。浮游植物优势种的时空分布和演替过程直接反映了水环境的变化情况,其丰度、生物量和时间序列的变化往往是湿地水质波动的重要指标之一[6-7]。因此,对浮游植物优势种进行监测和研究,不仅有助于理解水环境的动态变化,还可以深入探讨优势种在湿地生态系统中的生态功能和作用机制。
生态位的研究在理解群落演替、结构功能、种群进化及种间关系等方面发挥着至关重要的作用,它已成为当今生态学研究的重点[8-9]。生态位理论通过计算生态位宽度和重叠值来研究物种在特定环境或不同维度中的竞争和共存关系,从而推测物种的丰富程度和分布状况[10-11]。种间联结指不同物种之间的相互作用和联系,如竞争、共生、捕食和互惠关系等,对于理解种间相互作用、资源空间配置以及物种间相互影响和群落稳定性具有至关重要的意义[12-13]。因此,结合优势种生态位和种间联结性的研究,可以全面了解优势种的相互作用及其对资源环境利用状况,这对于揭示湿地生态系统的稳定性、种间共存关系以及湿地管理与恢复策略具有重要的理论价值和实践意义。目前,结合优势种的生态位和种间联结性的研究主要集中在陆生植物群落[14-15],以及水生态系统中的鱼类[16-17]、虾类[18-19]和原生动物[20]。相对于这些领域,虽然浮游植物优势种的相关研究在近年有所增加[21-24],但在多维度(时间、空间和时空)上的深入研究相对有限。同时,浮游植物群落中的种间关系对于食物链稳定性的确定至关重要[25],因此从多维度深入研究优势种的生态位和种间联结性对全面理解优势种的生态适应性是不可或缺的。
城市湿地在净化城市污染、改善环境以及提供生态服务方面扮演着关键角色[26]。作为城市生态系统的一个重要组成部分,城市湿地能够吸收和分解污染物,有效降低空气和水体的污染物含量,从而提升城市空气质量和水质,显著改善城市生态环境[27-28]。然而,相比其他类型的湿地,城市湿地在生态环境脆弱性方面表现得更为明显,容易受到人类活动、土地开发和污染物排放的影响,导致其生态系统受损和退化[29-30]。拉鲁湿地国家级自然保护区,作为国内面积最大、世界海拔最高的天然城市湿地,主要由高寒湿地生态系统组成,芦苇泥炭沼泽居多,其在调节区域气候、涵养水源、净化水质、维护生物多样性及氧气供应方面发挥着至关重要的生态屏障作用。浮游植物,作为城市湿地生态系统的重要组成部分,以其对环境变化的高灵敏度和广泛分布的特性,能够迅速适应环境变化[31]。因此,研究拉鲁湿地浮游植物优势种的时空生态位及种间关系,对揭示青藏高原城市湿地生态系统的稳定性和生态适应性以及湿地生态系统的管理具有重要意义。至今有关拉鲁湿地相关的生物学和生态学研究文章主要集中在原生动物[32-33]、动物[34]和水生植物[35]等方面,而关于浮游植物的研究相对较少[36-38]。
为深入分析西藏拉鲁湿地浮游植物优势种的时空动态及其生态适应性,于2021年7月、2021年10月和2022年5月在西藏拉鲁湿地国家级自然保护区进行浮游植物定性和定量采集,共采集水样126个,通过综合运用生态位宽度、生态位重叠值、相对资源占有率和生态响应速率等多种生态学方法和指标,并结合总体联结性、χ2检验、联结系数(AC)、共同出现百分率(PC)及点相关系数(φ)等方法计算种间联结性,从时间、空间和时空3个维度对浮游植物优势种的生态位和种间联结性进行综合分析,探究不同维度下优势种的生态适应性、资源空间利用状态以及种间相互关系等信息,以期为进一步研究拉鲁湿地浮游植物群落提供依据。
1 材料与方法 1.1 研究设计本研究采集西藏拉鲁湿地42个具有代表性的样点,包括沼泽湿地12个,湿草甸湿地13个,浅水湿地17个。采样时间分别为2021年7月(丰水期)、2021年10月(枯水期)和2022年5月(平水期)。关于研究区概况、样点设置以及水样采集、处理及鉴定方法等详细信息,已在文献[38]进行详尽的描述,故本文不再赘述。
1.2 数据处理与分析在本研究中,首先计算物种的优势度指数[39-40]和优势种更替率[41-42],选取优势度指数Y>0.02的物种进行深入分析。为了估算优势种的生态位宽度,采用了Colwell等加权修正后的Levins指数[43],生态位重叠值则通过Pianka指数(Oik)进行计算[44]。依据Cody & Martin[45]和May[46]的理论,结合时间和空间指数的乘积来确定时空生态位宽度和重叠值。群落总体联结性通过方差比率(VR)和检验统计量(W)进行评估,种间联结性的分析则结合卡方检验(χ2)、联结系数(AC)、共同出现百分率(PC)和点相关系数(φ)进行[47-50]。优势度、丰度、生态位特征值和种间联结性通过Excel 2019软件计算。应用OriginPro 2022软件对3个维度的生态位宽度进行层次聚类分析,使用欧几里得距离(Euclidean distance)作为距离计算指标。利用Adobe Illustrator 2019软件绘制种间联结性半矩阵图。各计算公式如下:
| Y=fi⋅nin | (1) |
| TR=A+B−2CA+B−C×100% | (2) |
| Bi=1NN∑j=1P2ij | (3) |
| Oik=N∑j=1(Pij⋅Pkj)√N∑j=1P2ij⋅N∑j=1P2kj | (4) |
| ΔOik=∑k=1Oik−∑i=1Oik | (5) |
| R=BiΔOik | (6) |
| 时空生态位宽度值=时间生态位宽度×空间生态位宽度 | (7) |
| 时空生态位重叠值=时间生态位重叠×空间生态位重叠 | (8) |
| σ2T=S∑i=1Pi(1−Pi)2 | (9) |
| S2T=1NN∑j=1(Tj−t)2 | (10) |
| VR=S2Tσ2T | (11) |
| W=N⋅VR | (12) |
| χ2=N[|ad−bc|−N2]2(a+b)(a+c)(b+d)(c+d) | (13) |
| AC=ad−bc(a+b)(b+d)(ad⩾bc) | (14) |
| AC=ad−bc(a+b)(a+c)(ad<bc,d⩾a) | (15) |
| AC=ad−bc(b+d)(d+c)(ad<bc,d<a) | (16) |
| PC=aa+b+c | (17) |
| φ=ad−bc√(a+b)(a+c)(c+d)(b+d) | (18) |
公式(1)~(18)中:fi代表第i种出现的频次,n是某样品中的个体总数,ni是第i种的个体数;优势种更替率(TR)通过计算相邻两季优势种的物种数(A、B)和共同优势种的物种数(C)来确定;物种i生态位宽度为Bi,其空间生态位Pij定义为物种i在j样点的个体数占该样点所有个体数的比例,N为采样点总数; 时间生态位Pij则是物种i在j季节的个体数占该季节所有个体数的比例,N为季节总数。Oik为生态位重叠值,空间生态位Pkj是物种k在j样点的个体数占该样点所有个体数的比例,N为采样点总数; 时间生态位Pkj是物种k在j季节的个体数占该季节所有个体数的比例,N为季节总数; 生态响应速率R是通过求和∑k=1Oik(种群i占据其他种群的总资源量)和∑i=1Oik(种群k被其他的种群占据的总资源量)来计算;σT2表示总研究点方差;ST2代表总种数方差,S表示总优势种数,Tj表示研究点j内出现的优势种种数,t表示研究点中优势种物种数的平均数(t=(T1+T2+…+Tn)/N);如果方差比率VR<1时,表明物种间总体上呈现负关联,如果VR>1时,表明物种间总体上呈现正关联;如果VR=1时,则表明物种间无关联。统计量W为验证VR值偏离1的显著程度,假设物种间总体上无显著关联,则χ0.952(N)<W<χ0.052(N)的概率有90%。种对间的联结性通过计算ad-bc来判断,其中a是组成一个种对的2个物种同时存在的研究点数,b和c是组成一个种对的2个物种中仅出现1个物种的研究点数,d是组成一个种对的2个物种均不出现的研究点数。若ad-bc值为正数,为正联结;反之,则判定为负联结,相等则为无联结。χ2<3.841,表示优势种种对间无显著联结性(P>0.05);3.841≤χ2≤6.635,表示有显著联结性(0.01≤P≤0.05);χ2>6.635, 则表示极显著联结性(P<0.01)。联结系数AC取值范围是[-1, 1],AC=0,表明优势种种对间完全独立;AC值愈趋于1,表明正联结程度愈高;AC值愈趋于-1,则负联结性愈强。PC值在[0, 1]范围内,PC越接近1,表明优势种种对间联结程度越强;PC值为0时,表明种对间无联结性。φ值在[-1, 1]之间,φ值趋近于1时,表示联结性强;φ值趋近于-1时,表示负联结性强。
2 结果与分析 2.1 浮游植物组成及优势种通过对丰水期、枯水期和平水期的定性和定量样本进行综合分析,分别鉴定出浮游植物309、294和284种,其中优势种8种,隶属2门7属(表 1)。3个水情期优势种均以硅藻门为主,各水情期优势种的种类和密度存在差异。3个水情期共有优势种为中型脆杆藻(Fragilaria intermidia),在丰水期和枯水期其优势度最高。部分物种只在某一水情期成为优势种,显示出较强的水情适应性。
| 表 1 拉鲁湿地各浮游植物优势种出现频率(fi)、密度(A, ×105 cells/L)及优势度(Y) Tab. 1 Frequency (fi), density (A, ×105 cells/L) and dominance (Y) of dominant phytoplankton species in Lhalu Wetland |
优势种更替率的计算显示,从丰水期到枯水期的更替率为85.71%,而从枯水期到平水期的更替率为66.67%,表明优势种在不同水情期间的季节性更替非常显著,尤其是从丰水期到枯水期。
2.2 生态位宽度在拉鲁湿地浮游植物群落中,优势种的生态位宽度表现出不同的时空变化(表 2)。在时间维度上,优势种的生态位宽度变化较大,范围为0.343~0.931,均值为0.570,其中中型脆杆藻的生态位宽度最大,其次为链状假鱼腥藻,而最小的生态位宽度为广缘小环藻;在空间维度上,优势种的生态位宽度变化幅度较中等,范围为0.090~0.495,均值为0.255,同样是中型脆杆藻的生态位宽度最大,其次为二头脆杆藻,广缘小环藻的生态位宽度依然是最小;在时空维度上,优势种生态位宽度的变化幅度也属于中等,范围为0.031~0.460,均值为0.162,中型脆杆藻续保持最大生态位宽度,二头脆杆藻紧随其后,广缘小环藻的生态位宽度仍然最小。
| 表 2 拉鲁湿地浮游植物优势种生态位宽度的三维比较 Tab. 2 Three-dimensional comparison of niche breadth of dominant phytoplankton species in Lhalu Wetland |
根据浮游植物优势种在时间、空间、时空维度的生态位宽度的聚类分析(图 1),西藏拉鲁湿地浮游植物优势种可被划分为3大类。第1类仅包括中型脆杆藻,属广生态位种,在时间、空间和时空3个维度的生态位宽度均较高,彰显了其卓越的适应能力。第2类包括二头脆杆藻和肘状针杆藻,属于中生态位种,展现出较高的空间生态位宽度,表明它们能够适应广泛的空间条件。第3类包括披针形曲壳藻、广缘小环藻、普通等片藻、弧形短缝藻、链状假鱼腥藻,属于窄生态位种,在时间和空间生态位上的宽度相对较窄,反映了它们对特定环境条件的高度专一性或依赖性,对环境变化表现出较高的敏感性,仅在特定条件下才能成为优势种。
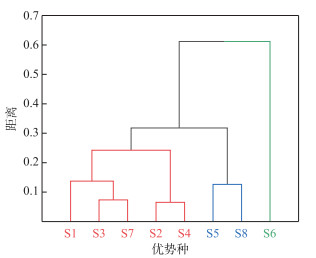
|
图 1 拉鲁湿地浮游植物优势种的生态位宽度聚类分析(物种种类序号同表 2,下同) Fig.1 Cluster analysis of niche breadth of dominant phytoplankton species in Lhalu Wetland (Species numbers are the same as in Tab. 2 and below) |
在时间维度上,优势种生态位重叠值变化范围为0.011~0.997(表 3),其中广缘小环藻和弧形短缝藻的生态位重叠值最高(0.997),披针形曲壳藻和肘状针杆藻的生态位重叠值较高(0.964),而广缘小环藻和链状假鱼腥藻的生态位重叠值最小(0.011)。在28个优势物种对中,有14对的重叠值较高(Oik>0.6),占总对数的50%;4对重叠值中等(0.3<Oik≤0.6),占14.29%;10对重叠值较低(0<Oik≤0.3),占35.71%。结果显示,共有18个种对的Oik>0.3,为有意义的重叠值,占总对数的64.29%,表明在时间维度上浮游植物优势种的生态位重叠值较高,具有明显的时间同步性。
| 表 3 拉鲁湿地浮游植物优势种时间生态位重叠值 Tab. 3 Temporal niche overlap value of dominant phytoplankton species in Lhalu Wetland |
在空间维度上,生态位重叠值变化范围为0.001~0.906(表 4),其中披针形曲壳藻和肘状针杆藻的生态位重叠值最高(0.906),广缘小环藻和弧形短缝藻的生态位重叠值较高(0.882),而广缘小环藻和普通等片藻的生态位重叠值最小(0.001)。28个种对中,有5对的重叠值较高(Oik>0.6),占17.86%;7对重叠值中等(0.3<Oik≤0.6),占25%;16对重叠值较低(0<Oik≤0.3),占57.14%。结果显示,共有12个种对的Oik>0.3,为有意义的重叠值,占总对数的42.86%,表明在空间维度上浮游植物优势种的生态位重叠值较低,具有明显的空间异质性。
| 表 4 拉鲁湿地浮游植物优势种空间生态位重叠值 Tab. 4 Spatial niche overlap value of dominant phytoplankton species in Lhalu Wetland |
在时空维度上,生态位重叠值变化范围为0~0.880(表 5),广缘小环藻和弧形短缝藻的生态位重叠值最高(0.880),披针形曲壳藻和肘状针杆藻的生态位重叠值较高(0.873),而披针形曲壳藻和广缘小环藻、披针形曲壳藻和弧形短缝藻、广缘小环藻和普通等片藻、广缘小环藻和二头脆杆藻、广缘小环藻和链状假鱼腥藻的生态位重叠值最小(0)。28个种对中,有5对的重叠值较高(Oik>0.6),占17.86%;5对重叠值中等(0.3<Oik≤0.6),占17.86%;13对重叠值较低(0<Oik≤0.3),占46.43%;5对无重叠性(Oik=0),占17.86%。结果显示,共有10个种对的Oik>0.3,为有意义的重叠值,占总对数的35.71%,表明在时空维度上浮游植物优势种的生态位重叠值较低,具有明显的时空交互性。
| 表 5 拉鲁湿地浮游植物优势种时空生态位重叠值 Tab. 5 Spatio-temporal niche overlap value of dominant phytoplankton species in Lhalu Wetland |
在西藏拉鲁湿地,浮游植物优势种的相对资源占有量(ΔOik) 和生态响应速率(R)反映了不同维度上的生态动态,如表 6所示。在时间维度上,广缘小环藻ΔOik的波动范围(即绝对值)最大;在空间维度上,中型脆杆藻ΔOik的波动范围(即绝对值)最大;在时空维度上,二头脆杆藻ΔOik的波动范围(即绝对值)最大。在时间维度上,广缘小环藻有最大的负ΔOik,表明在竞争同类资源的过程中处于劣势,相较于其他优势种衰退空间较大,弧形短缝藻、二头脆杆藻同属于衰退型;披针形曲壳藻、普通等片藻、中型脆杆藻、链状假鱼腥藻、肘状针杆藻同处于发展型,其中,中型脆杆藻有最大的正ΔOik,表明中型脆杆藻发展空间最大,与其他的优势种竞争相同资源空间上存在优势,且竞争激烈。在空间维度上,披针形曲壳藻、中型脆杆藻、肘状针杆藻属于发展型,其他优势种属于衰退型;二头脆杆藻的衰退空间最大,链状假鱼腥藻的衰退空间最小。在时空维度上,广缘小环藻、普通等片藻、弧形短缝藻、二头脆杆藻、链状假鱼腥藻属于衰退型,其他优势种属于发展型;中型脆杆藻有最大的发展空间,其次是披针形曲壳藻的发展空间,肘状针杆藻的发展空间最小。
| 表 6 西藏拉鲁湿地浮游植物优势种相对占用资源量(ΔOik)及生态响应速率(R) Tab. 6 Relative occupied resources (ΔOik) and ecological response rate (R) of dominant phytoplankton species in Lhalu wetland, Tibet |
优势种在不同维度上对资源环境条件的生态响应状况可利用生态响应速率(R)来确定。在时间维度上,链状假鱼腥藻的正响应较为强烈(R=0.164),中型脆杆藻的正响应较弱(R=0.083);二头脆杆藻的负响应较为强烈(R=-0.137),广缘小环藻的负响应较弱(R=-0.023)。在空间维度上,肘状针杆藻的正响应较为强烈(R=0.050),披针形曲壳藻的正响应较弱(R=0.029);链状假鱼腥藻的负响应较为强烈(R=-0.094),广缘小环藻的负响应较弱(R=-0.015)。在时空维度上,中型脆杆藻的正响应较为强烈(R=0.060),披针形曲壳藻的正响应较弱(R=0.014);普通等片藻的衰退趋势较为强烈(R=-0.357),广缘小环藻的衰退趋势较弱(R=-0.006)。
从总体上看,西藏拉鲁湿地浮游植物优势种在时间维度上生态响应速率之和为正数(0.383),在空间维度上生态响应速率之和为负数(-0.134),在时空维度上生态响应速率之和为负数(-0.341),表明拉鲁湿地浮游植物群落在时间维度上形成正反馈,在空间维度和时空维度上形成负反馈。
2.5 种间联结性 2.5.1 总体关联性在拉鲁湿地3个水情期42个样点中,χ0.952=101.074,χ0.052=153.198,VR值大于1,统计量W在χ2临界值范围外,表明拉鲁湿地浮游植物优势种间总体上呈显著正关联(表 7)。
| 表 7 拉鲁湿地浮游植物优势种的种间总体关联性 Tab. 7 General interspecific associations of dominant phytoplankton species in Lhalu Wetland |
拉鲁湿地浮游植物群落优势种的χ2检验、联结系数、共同出现百分率和点相关系数结果如图 2所示。χ2检验结果表明,28个种对中,12对联结性不显著χ2<3.841(P>0.05),占总对数的42.86%;3对联结性显著3.841≤χ2≤6.635(0.01≤P≤0.05),占10.71%;13对联结性极显著χ2>6.635(P<0.01),占46.43%;其中正联结性15对,负联结性13对,群落的正负联结比例为1.15,正联结占优势,这与总体联结性呈正联结的结果一致。
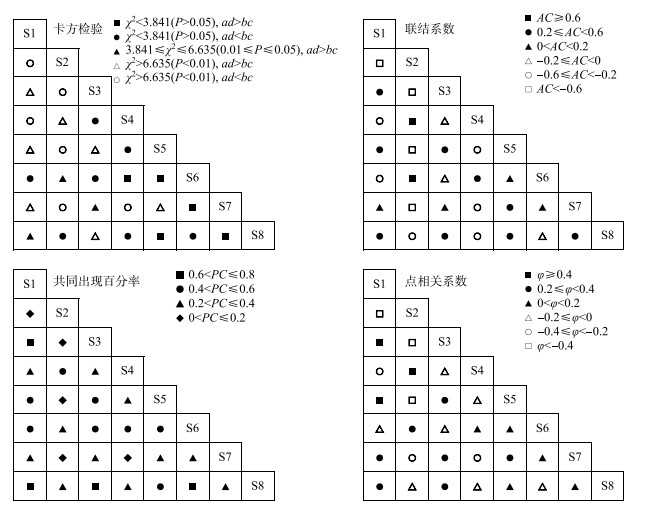
|
图 2 拉鲁湿地浮游植物优势种的种间联结性 Fig.2 Interspecific association of dominant phytoplankton species in Lhalu Wetland |
联结系数AC结果表明,正联结对数为15对,其中有2对正联结系数程度较高(AC≥0.6),占7.14%;9对正联结系数程度一般(0.2≤AC<0.6),占32.14%;4对正联结系数程度趋向独立(0<AC<0.2),占14.29%。负联结对数为13对,其中有4对负联结系数程度较高(AC<-0.6),占14.29%;6对负联结系数程度一般(-0.6≤AC<-0.2),占21.43%;3对负联结系数趋向独立(-0.2≤AC<0),占10.71%。共同出现百分率PC结果表明,4对联结程度较强(0.6<PC≤0.8),8对联结程度一般(0.4<PC≤0.6),11对联结程度较弱(0.2<PC≤0.4),5对联结程度最弱(0<PC≤0.2),分别占总对数的14.29%、28.57%、39.29%、17.86%。点相关系数(φ)结果表明,正联结对数为15对,其中3对正联结系数程度较高(φ≥0.4),占10.71%;7对正联结系数程度一般(0.2≤φ<0.4),占25%;5对正联结系数程度趋向独立(0<φ<0.2),占17.86%;负联结对数为13对,其中有3对负联结系数程度较高(φ<-0.4),占10.71%;3对负联结系数程度一般(-0.4≤φ<-0.2),占10.71%;7对负联结系数程度趋向独立(-0.2≤φ<0),占25%。
3 讨论 3.1 优势种的生态位宽度和生态位重叠值生态位宽度是衡量物种在特定环境中对资源利用广度的指标,涵盖了时间、空间和时空3个维度。较大的生态位宽度通常意味着物种具有较强的适应多变环境的能力,而较小的生态位宽度则可能表明物种适应性和竞争力较弱。在时间维度上,物种的出现跨度与其时间生态位宽度呈正相关,表现为分布的均匀性[51]。如果一个物种在各个季节均匀出现,则表明其具有较大的时间生态位宽度;反之,如果物种出现具有明显的季节性波动,则其时间生态位宽度较小。空间生态位宽度反映了物种在空间分布的范围和均匀程度,而时空二维生态位宽度则综合反映了物种在时间和空间资源利用的程度以及种间竞争关系[52-53]。本研究中,通过不同维度生态位宽度值聚类分析表明,中型脆杆藻为广生态位种,其在各维度上较高的生态位宽度反映了较好的环境适应力和资源利用效率,能够在时间和空间的变化中保持优势地位,显示出对多变环境条件的强大适应性和泛化能力,使其能够在多变的环境条件下保持较高的密度,这可能得益于中型脆杆藻对环境变化的快速响应能力和对不同资源的高效利用,该物种通常以群体形式生活,广泛分布于缓流水体和沼泽中[54],这一生活习性与拉鲁湿地高寒草甸沼泽湿地的特征相契合。二头脆杆藻和肘状针杆藻展现出较高的空间生态位宽度,属于中生态位种,这一类别的物种表现出了一定程度的适应性,能够在多样的空间环境中存活和繁衍,虽然对特定环境条件有一定选择性,但在适宜的生境中能够有效利用资源,占据重要的生态地位。而广缘小环藻作为窄生态位种,仅在特定条件下成为优势种,可能作为环境变化的敏感指标,其存在和优势地位的变化可为监测生态系统健康状态提供重要线索。广缘小环藻能指示特定水域的寡污特征[35]。这一点突显了拉鲁湿地在某些特定条件下水质较为清洁,且该物种对环境的敏感性以及对资源分布的独特需求。拉鲁湿地浮游植物优势种在时间维度上表现出显著的生态位宽度变化(极差,0.588),突显其对季节性环境变化的强大适应能力。这一特征可能与该地区温度、光照和水文条件的季节性波动紧密相关,导致浮游植物在不同季节呈现出不同的种群结构变化。相比之下,空间维度上的生态位宽度变化较小(极差,0.405),表明优势种在湿地不同区域的分布和适应性较为均衡,即使存在一定的环境差异,其对优势种的分布影响相对有限。此外,时空生态位宽度的中等变化幅度(极差,0.429)反映出优势种在时间和空间两个维度上的综合适应性,这种适应性虽不如单一时间维度上那么显著,但仍能够在不同时间段和空间区域保持一定的生态适应性和竞争力。这一结果为研究拉鲁湿地浮游植物群落的稳定性和时空分布格局提供了重要的参考依据。
生态位重叠值衡量的是2个物种在某一维度上生态位重叠的程度,反映了不同的物种对同一资源的竞争程度及利用效率[55-56]。在时间维度上,优势种的生态位重叠值达到有意义的种对比例较高,具有明显的时间同步性,表明浮游植物优势种在不同水情期变化小,这与优势种的时间生态位宽度较大相符,这主要是因为拉鲁湿地浮游植物群落大部分优势种对时间维度资源的利用程度较高,种内和种间都存在强烈的竞争关系,因此呈现出时间生态位重叠较高的现象。在空间维度上,优势种的生态位重叠值达到有意义的种对比例较低,具有明显的空间异质性,表明浮游植物优势种空间生态位分化程度高,这可能是拉鲁湿地内部环境复杂,各个样点水文环境、水质等条件有较大的差异,导致不同区域内浮游植物物种组成和丰度分布存在显著差异,从而呈现出空间异质性。此外,优势种的空间分布呈现出显著的不均匀性,表现为某些物种仅在特定生境中占据优势地位并成功繁衍,而在其他环境条件下则相对较弱,这种现象进一步导致它们的生态位重叠值在不同区域之间的差异。这种分布模式反映了生态位理论的核心观点,即物种分布受其生态位特性、生态和生物性状以及环境因素的共同影响。在时空维度上,优势种的生态位重叠值达到有意义的种对比例较低,具有明显的时空交互性,反映出浮游植物优势种的生态位分化水平较高,种间竞争较弱,优势种之间倾向共存模式,群落结构处于稳定状态。这主要是因为时空生态位重叠值主要受空间维度分布影响,因此呈现出浮游植物优势种的时空生态位重叠较低的现象[57-58]。
3.2 优势种生态响应速率及群落多稳态种群的增长或衰减,作为种间竞争的直接结果,体现了生物与非生物因子之间的复杂和多维的互作关系[59]。在时间、空间和时空维度上,中型脆杆藻均有最大的发展空间,但仅在时空维度上生态响应速率最大,表明中型脆杆藻对环境变化具有较强的敏感性和适应性。在时间维度上,中型脆杆藻具有较快的生长速率和较强的竞争能力,使得它能够快速适应资源的变化,种群数量迅速增加。在空间维度上,中型脆杆藻具有较高的生存适应性,能够适应不同的水体生境,这使得它在不同生境中都有发展的可能性。而在时空维度上,中型脆杆藻能够同时适应时间和空间变化,迅速利用和占领新的资源,从而在相对较短的时间内快速发展。此外,这也表明发展趋势较强的优势种为了获得更多的生态资源可能会通过增大生态位来增强种间竞争力,但是随着种群不断发展,环境承载力和种内竞争不断增强会导致其发展速度放缓[60-61];同样,衰退型种群,如广缘小环藻在时间维度上衰退空间最大,二头脆杆藻在空间和时空维度上衰退空间最大,但2个优势种的衰退生态响应速率相对较小,表明广缘小环藻和二头脆杆藻衰退趋势也会变缓,可能是由于其他物种的竞争压力相对较小,导致它们的生态位范围不会受到过度压缩的影响。此外,可能还存在其他的生态因素,例如生境的物理和化学条件、寄生生物等,也对优势种的生态响应速率产生了影响。在时间维度上,链状假鱼腥藻发展空间较小,但发展响应速率最大;在空间维度上,肘状针杆藻发展空间最小,但发展响应速率最大,这些物种处于发展(衰退)的强盛时期,表明一些生态位宽度较小的藻种为了加强自身的生态适应性会获取更多的资源[62]。反之,在时间维度上,二头脆杆藻衰退空间最小,但衰退响应速率最大。在空间维度上,链状假鱼腥藻衰退空间最小,但衰退速率最大,表明二头脆杆藻和链状假鱼腥藻的生态适应性差,对环境变化的响应敏感。总的来说,生态响应速率和发展(衰退)空间的大小并无明显关联性,不同物种的生态响应速率受多种生态因素的综合影响而不同。
在生态系统的稳定性和演化方向中,生物与环境因素之间的复杂互动和反馈机制起着关键作用[63]。负反馈有助于维持系统的平衡和稳定性,而正反馈可能引发系统的不稳定和演化方向的改变。本研究通过计算拉鲁湿地浮游植物优势种生态响应速率之和,可对群落的反馈机制进行判断,以此来监测群落的稳定状况。拉鲁湿地浮游植物群落优势种生态响应速率在时间维度上形成正反馈,表明群落远离平衡状态或稳态,这可能是由于强烈的种间竞争导致某些物种能快速占据资源,而其他物种则被迫退缩。这种竞争关系在时间维度上不断加剧,导致了优势种的生态响应速率不断增加,从而形成了正反馈。正反馈会加速生态系统的变化和演化,可能导致群落的不稳定性和演化方向的改变。而在空间和时空维度上,群落中的负反馈表明群落达到和保持平衡或稳态,这可能是因为在空间和时空维度上,群落中不同优势种之间的竞争关系较为平衡,没有出现某个种群明显占优的情况,导致整个群落保持相对的平衡状态。综上所述,拉鲁湿地浮游植物群落存在群落多稳态,在空间和时空维度上较时间维度更稳定。
3.3 优势种的种间联结性种间联结性是测量群落结构形成和演化的重要工具,它不仅反映了种间的相互关系,还映射了物种与环境之间的相互作用[64-67]。在生态群落的演替过程中,种间关系往往趋于正关联,这通常指向一个稳定共存的成熟群落[68]。本研究中,拉鲁湿地浮游植物群落优势种总体关联性呈现显著正关联,这表明群落处于较稳定的正向演替阶段,这与张明霞等[69]和李秋华等[70]研究的结果一致。χ2检验结果显示,在28个种对中,正负联结比为1.15,即正联结占优势,表明大多数优势种对生境和资源具有相似的习性,群落结构复杂,趋向稳定,这与总体联结性的结果一致。
在χ2检验的基础上,结合联结系数(AC)、共同出现百分率(PC)和点相关系数(φ)来分析,可以真实反映种间联结的实际情况,还能进一步验证χ2检验中显示为不显著种对,从而得到更精确的结果[20]。根据AC结果所示,虽然多数浮游植物优势种种对间的联结关系不显著,但是有15对优势种种对呈现正联结关系,这与总体关联性和χ2检验结果相一致,说明大多数优势种对生境和资源具有相似的习性,群落结构复杂,群落趋向稳定。PC结果表明4对优势种对联结程度较强(0.6<PC≤0.8)。同时,这4对种对的生态位重叠程度也较高,例如披针形曲壳藻和普通等片藻,这可能是因为虽然它们对生境和资源具有相似的习性,但有互补或互利的资源利用方式,从而表现出非竞争关系[71-72]。φ可以降低PC放大的2个物种均出现时的联结显著程度的影响和AC放大的2个物种均不出现时的联结显著程度的影响[50]。经过φ的测定,如披针形曲壳藻和普通等片藻PC和AC均有降低。所以φ可以校正各项指数的测定结果,使种间联结性研究结果更加精确。同时,φ也说明拉鲁湿地物种间总体趋于正关联,这与χ2检验、AC和PC结论呈现一致性。综合比较以上4种研究方法得出,不同研究方法所得结果有一定差别,但总体上是趋于一致的[73]。例如肘状针杆藻和中型脆杆藻种对,χ2=0.072(ad<bc),即为不显著负联结;AC值为-0.033,即种对间负联结系数程度趋向独立;PC值为0.724,即这2个物种有较大的概率同时出现;φ值为-0.006,即种对间负联结程度趋向独立。总的来说,结合不同的计算指标综合分析可以更科学、更准确地判定种间联结性。
生态位与种间联结性之间存在密切的关系。正联结通常表现为生态位的重叠性和对相似资源的利用,而负联结则反映了种间的排斥性和生态位的分离。在多维度生态位中,种间联结的结果仅可能与“空间分布”生态位结果存在相关性[74]。本研究中,广缘小环藻和弧形短缝藻呈极显著正联结,它们的生态位重叠值也很大,分别为0.882、0.906,这些种对间既存在互利或互补关系,也有相似性。披针形曲壳藻和广缘小环藻呈极显著负联结,它们的生态位重叠值也很小,为0.002,说明这些种对种间竞争激烈,导致生态位分离,降低了生态位重叠。由此可得生态位重叠与浮游植物群落优势种群之间的联结性强弱有比较大的相关关系,即生态位重叠值与种间正联结呈线性正相关,这与李丘霖等[71]和胡成业等[75]的研究结果一致。综上所述,拉鲁湿地浮游植物群落处于比较稳定的正向演替阶段,生态系统的稳定性较强。
| [1] |
Mao DH, Wang ZM, Jia MM et al. Review of global studies on the remote sensing of wetlands from 1975 to 2020. National Remote Sensing Bulletin, 2023, 27(6): 1270-1280. [毛德华, 王宗明, 贾明明等. 全球湿地遥感研究综述: 1975—2020年. 遥感学报, 2023, 27(6): 1270-1280. DOI:10.11834/jrs.20231022] |
| [2] |
Li X, Xia W, Fan YW et al. Dynamic analysis of niche and interspecific association of dominant algae species in Zhalong wetland. Acta Ecologica Sinica, 2023, 43(10): 4098-4108. [李雪, 夏伟, 范亚文等. 扎龙湿地藻类优势种生态位及其种间联结性动态分析. 生态学报, 2023, 43(10): 4098-4108.] |
| [3] |
An RZ, Pan CM, Ta BLZ et al. Vertical distribution characteristics of phytoplankton functional groups and their relationships with environmental factors in Lake Basomtso, Tibet, China. J Lake Sci, 2021, 33(1): 86-101. [安瑞志, 潘成梅, 塔巴拉珍等. 西藏巴松错浮游植物功能群垂直分布特征及其与环境因子的关系. 湖泊科学, 2021, 33(1): 86-101. DOI:10.18307/2021.0114] |
| [4] |
Avolio ML, Forrestel EJ, Chang CC et al. Demystifying dominant species. New Phytologist, 2019, 223(3): 1106-1126. DOI:10.1111/nph.15789 |
| [5] |
Liu Y, An RZ, Wang C et al. Horizontal and vertical distributions of phytoplankton community during the summer season in the Lake Basomtso, Tibet, China. Journal of Hydroecology, 2023, 44(6): 98-106. [刘洋, 安瑞志, 王陈等. 西藏巴松错(湖)夏季浮游植物群落的水平和垂直分布. 水生态学杂志, 2023, 44(6): 98-106. DOI:10.15928/j.1674-3075.202112170415] |
| [6] |
Qian KM, Chen YW, Song XL. Long-term development of phytoplankton dominant species related to eutrophicarion in Lake Taihu. Ecological Science, 2008, 27(2): 65-70. [钱奎梅, 陈宇炜, 宋晓兰. 太湖浮游植物优势种长期演化与富营养化进程的关系. 生态科学, 2008, 27(2): 65-70. DOI:10.3969/j.issn.1008-8873.2008.02.001] |
| [7] |
Pan CM, Liu Y, An RZ et al. Phytoplankton in the Mitika Wetland, Tibet, China: 1. Spatio-temporal niche of dominant species. J Lake Sci, 2021, 33(6): 1805-1819. [潘成梅, 刘洋, 安瑞志等. 西藏麦地卡湿地的浮游植物——1. 优势种的时空生态位. 湖泊科学, 2021, 33(6): 1805-1819. DOI:10.18307/2021.0616] |
| [8] |
Wang ZL, Chen Y, Chen XM et al. Temporal-spatial niches of Chinese White Wax Scale insect(Ericerus pela) and its three dominant Parasitoid wasps. Acta Ecologica Sinica, 2011, 31(4): 914-922. [王自力, 陈勇, 陈晓鸣等. 白蜡虫及其3种优势寄生蜂的时空生态位. 生态学报, 2011, 31(4): 914-922.] |
| [9] |
Xu KD, Lu KE, Lu ZH et al. Ecological niche analysis of dominant shrimp species in the Jiushan Islands Marine Nature Reserve. Biodiversity Science, 2018, 26(6): 601-610. [徐开达, 卢衎尔, 卢占晖等. 韭山列岛自然保护区虾类优势种生态位. 生物多样性, 2018, 26(6): 601-610. DOI:10.17520/biods.2017339] |
| [10] |
Wu CX, Liu F, Kong XB et al. Spatiotemporal niche of competition and coexistence of three Tomicus spp. infesting Pinus yunnanensis during the transferring stage from shoots to trunk. Scientia Silvae Sinicae, 2020, 56(3): 90-99. [武承旭, 刘福, 孔祥波等. 云南松3种切梢小蠹梢转干期竞争共存的时空生态位. 林业科学, 2020, 56(3): 90-99. DOI:10.11707/j.1001-7488.20200310] |
| [11] |
Tan HC, Wang YY, Chen YL et al. Dynamic analysis of niche and interspecific association of dominant phytoplankton species in Xiashan Reservoir. J Lake Sci, 2023, 35(3): 844-853. [谭好臣, 王瑗媛, 陈阳亮等. 多水源水库浮游植物优势种生态位及种间联结性动态分析: 以山东峡山水库为例. 湖泊科学, 2023, 35(3): 844-853. DOI:10.18307/2023.0308] |
| [12] |
Li SF, Liu WD, Su JR et al. Niches and interspecific associations of dominant tree populations at different restoration stages of monsoonal broad-leaved evergreen forest. Chinese Journal of Ecology, 2011, 30(3): 508-515. [李帅锋, 刘万德, 苏建荣等. 季风常绿阔叶林不同恢复阶段乔木优势种群生态位和种间联结. 生态学杂志, 2011, 30(3): 508-515. DOI:10.13292/j.1000-4890.2011.0072] |
| [13] |
Shu Q, Xu RJ, Hu X et al. Niche and interspecific association of the main tree species in Vatica mangachapoi communities in Ganshiling, Hainan Island, China. Chinese Journal of Ecology, 2021, 40(9): 2689-2697. [舒琪, 徐瑞晶, 胡璇等. 海南岛甘什岭青梅群落主要乔木树种生态位与种间联结. 生态学杂志, 2021, 40(9): 2689-2697. DOI:10.13292/j.1000-4890.202109.040] |
| [14] |
Liu Y, Zheng YY, Ao YY. Niche and interspecific association of dominant bryophytes on different substrates. Acta Ecologica Sinica, 2019, 39(1): 286-293. [刘艳, 郑越月, 敖艳艳. 不同生长基质的苔藓植物优势种生态位与种间联结. 生态学报, 2019, 39(1): 286-293. DOI:10.5846/stxb201711162042] |
| [15] |
Liu RH, Chen L, Tu HR et al. Niche and interspecific association of main species in shrub layer of Cyclobalanopsis glauca community in Karst hills of Guilin, southwest China. Acta Ecologica Sinica, 2020, 40(6): 2057-2071. [刘润红, 陈乐, 涂洪润等. 桂林岩溶石山青冈群落灌木层主要物种生态位与种间联结. 生态学报, 2020, 40(6): 2057-2071. DOI:10.5846/stxb201904090689] |
| [16] |
Dong JR, Shui BN, Hu CY et al. Niche and interspecific association of the dominant fish in the south coastal waters of Wenzhou, China. Chinese Journal of Applied Ecology, 2017, 28(5): 1699-1706. [董静瑞, 水柏年, 胡成业等. 温州南部沿岸海域主要鱼类的生态位及种间联结性. 应用生态学报, 2017, 28(5): 1699-1706. DOI:10.13287/j.1001-9332.201705.028] |
| [17] |
Ye S, Yang R, Ding PP et al. Spatio-temporal niches and interspecific association of dominant fish species in the offshore waters of southern Zhejiang. Haiyang Xuebao, 2022, 44(1): 48-62. [叶深, 杨蕊, 丁朋朋等. 浙江南部近海主要鱼类的时空生态位及种间联结性. 海洋学报, 2022, 44(1): 48-62.] |
| [18] |
Ding PP, Gao CX, Peng X et al. Niches and interspecific association of dominant shrimp species in the offshore waters of southern Zhejiang Province, China. Chinese Journal of Applied Ecology, 2019, 30(11): 3942-3950. [丁朋朋, 高春霞, 彭欣. 浙江南部近海主要虾类的时空生态位及种间联结性. 应用生态学报, 2019, 30(11): 3942-3950. DOI:10.13287/j.1001-9332.201911.035] |
| [19] |
Jiang QL, Xu YJ, Zheng J et al. Niches and interspecific association of major shrimp and crab species in Pishan waters of Zhejiang Province, China. Chinese Journal of Applied Ecology, 2021, 32(7): 2604-2614. [蒋巧丽, 许永久, 郑基等. 浙江披山海域主要虾蟹类时空生态位及种间联结性. 应用生态学报, 2021, 32(7): 2604-2614. DOI:10.13287/j.1001-9332.202107.035] |
| [20] |
An RZ, Zhang P, Da Z et al. Niche and interspecific association of dominant protozoan species under different hydrologic periods in the Mitika Wetland of Tibet, China. Scientia Silvae Sinicae, 2020, 57(2): 126-137. [安瑞志, 张鹏, 达珍等. 西藏麦地卡湿地不同水文期原生动物优势种生态位及其种间联结性. 林业科学, 2020, 57(2): 126-137. DOI:10.11707/j.1001-7488.20210213] |
| [21] |
Wu JM, Xu NN, Zhang WJ et al. Seasonal analysis of the niche and interspecific association of dominant species of phytoplankton in the Dinghai Moat, Zhoushan City. J Lake Sci, 2019, 31(2): 429-439. [吴佳梦, 徐娜娜, 张文珺等. 浙江舟山定海护城河浮游植物优势种生态位与种间联结性季节性分析. 湖泊科学, 2019, 31(2): 429-439. DOI:10.18307/2019.0212] |
| [22] |
Yang WH, Shen H, Zhou ML et al. Seasonal variation analysis of the niche and interspecific association with respect to the dominant phytoplankton species in Nanhai Lake. China Environmental Science, 2020, 40(1): 383-391. [杨文焕, 申涵, 周明利等. 包头南海湖浮游植物优势种生态位及种间联结性季节分析. 中国环境科学, 2020, 40(1): 383-391.] |
| [23] |
Tao M, Yue XJ, Yue S et al. Phytoplankton community structure and cyanobacteria bloom risk of reservoirs in hilly regions of Sichuan Province based on dominant species niche and interspecific association. Acta Ecologica Sinica, 2021, 41(23): 9457-9469. [陶敏, 岳兴建, 岳珊等. 四川丘陵区水库浮游植物群落结构与蓝藻水华风险——基于优势种生态位与种间联结研究. 生态学报, 2021, 41(23): 9457-9469. DOI:10.5846/stxb202008182155] |
| [24] |
Tan HC, Wang YY, Chen YL, Liu GX et al. Dynamic analysis of niche and interspecific association of dominant phytoplankton species in Xiashan Reservoir. J Lake Sci, 2023, 35(3): 844-853. DOI: 10.18307/2023.0308. [谭好臣, 王瑗媛, 陈阳亮等. 多水源水库浮游植物优势种生态位及种间联结性动态分析: 以山东峡山水库为例. 湖泊科学, 2023, 35(3): 844-853. ]
|
| [25] |
Zhang NN, Liu YX, Zang SY. Relationships between phytoplankton community in different functional regions and environmental factors in Zhalong Wetland, Heilongjiang Province. J Lake Sci, 2016, 28(3): 554-565. [张囡囡, 刘宜鑫, 臧淑英. 黑龙江扎龙湿地不同功能区浮游植物群落与环境因子的关系. 湖泊科学, 2016, 28(3): 554-565. DOI:10.18307/2016.0311] |
| [26] |
Jia SQ, Jia L, Wang SS et al. Zooplankton functional groups and their response to water physiochemical factors in Jixi Wetland Park in Jinan. Journal of Hydroecology, 2023, 44(6): 113-121. [商书芹, 贾丽, 王帅帅等. 济南济西湿地公园浮游动物功能类群及其对环境因子的响应. 水生态学杂志, 2023, 44(6): 113-121. DOI:10.15928/j.1674-3075.202209270388] |
| [27] |
Liu WH, Wang YM, Fan YF et al. Mercury distribution characteristics and its mass balance in a multifunctional urban wetland. Environmental Science, 2019, 40(5): 2219-2225. [刘伟豪, 王永敏, 樊宇飞等. 多功能型城市人工湿地水体汞分布特征及其量变分析. 环境科学, 2019, 40(5): 2219-2225. DOI:10.13227/j.hjkx.201810150] |
| [28] |
Chen LM, Chen LG, Li TL et al. Comparative analysis of operation schemes for ecological water supply in urban wetland park. Water Resources Protection, 2022, 38(6): 162-167, 174. [陈黎明, 陈炼钢, 李褆来等. 城市湿地公园生态补水调度方案对比分析. 水资源保护, 2022, 38(6): 162-167, 174. DOI:10.3880/j.issn.1004-6933.2022.06.022] |
| [29] |
Li YF, Liu HY, Cai CX et al. The disturbance effect of the surroundings on the water environmental health of urban wetland park: A case study on Xixi Wetland Park, China. Geographical Research, 2015, 34(5): 851-860. [李玉凤, 刘红玉, 蔡春晓等. 城市湿地公园周边干扰对其水环境健康的影响——以西溪国家湿地公园为例. 地理研究, 2015, 34(5): 851-860. DOI:10.11821/dlyj201505005] |
| [30] |
Dai TJ, Wei PL, Pan Y et al. Identification of apparent pollution types and screening of characteristic indexes of landscape water body in Suzhou City. Water Resources Protection, 2021, 37(2): 141-147. [戴天杰, 魏攀龙, 潘杨等. 苏州市景观水体表观污染类型识别及特征指标筛选. 水资源保护, 2021, 37(2): 141-147. DOI:10.3880/j.issn.1004-6933.2021.02.022] |
| [31] |
Fan XC, Dai CF, Lu XX et al. Succession and driving factors of phytoplankton functional groups in Jinhewan urban wetland. Acta Ecologica Sinica, 2018, 38(16): 5726-5738. [范小晨, 代存芳, 陆欣鑫等. 金河湾城市湿地浮游植物功能类群演替及驱动因子. 生态学报, 2018, 38(16): 5726-5738. DOI:10.5846/stxb201710251916] |
| [32] |
Ba S, Huang X, Pu B et al. Community characteristics of ciliates and water environment evaluation in Lhalu wetland during summer and autumn. Chinese Journal of Ecology, 2014, 33(10): 2740-2748. [巴桑, 黄香, 普布等. 拉鲁湿地夏秋季纤毛虫群落特征及其与水环境的关系. 生态学杂志, 2014, 33(10): 2740-2748. DOI:10.13292/j.1000-4890.2014.0239] |
| [33] |
Ba S, Huang X, Pu B et al. Community characteristics of sarcodines and flagellates and water environment evaluation in Lhalu Wetlands. Wetland Science, 2014, 12(2): 182-191. [巴桑, 黄香, 普布等. 拉鲁湿地肉鞭虫群落特征及其水环境评价. 湿地科学, 2014, 12(2): 182-191.] |
| [34] |
Migmar W, Luosang W, Song XZ et al. Study on the body condition and main behavior characteristics of American Bullfrog (Lithobates catesbeianus) in the Lhalu Wetland National Nature Reserve in Tibet. Plateau Science Research, 2021, 5(2): 1-4. [米玛旺堆, 落桑旺秋, 宋璇紫等. 美国牛蛙(Lithobates catesbeianus)在西藏拉鲁湿地中的体质指标及主要行为特征. 高原科学研究, 2021, 5(2): 1-4.] |
| [35] |
Wang JJ, Tian HX, Zhou L et al. Relationship between diversity of aquatic plant communities and water environmental factors in Lhalu Wetland. Environmental Science, 2020, 41(4): 1657-1665. [王佳俊, 田瀚鑫, 周磊等. 拉鲁湿地水生植物群落多样性与水环境因子的关系. 环境科学, 2020, 41(4): 1657-1665. DOI:10.13227/j.hjkx.201910083] |
| [36] |
Ba S, Pu B, Ma ZX et al. Characteristics of planktonic algal community in Lhalu Wetland of Tibet in summer and autumn. Wetland Science, 2012, 10(4): 404-416. [巴桑, 普布, 马正学等. 西藏拉鲁湿地夏季和秋季浮游藻类群落特征. 湿地科学, 2012, 10(4): 404-416.] |
| [37] |
Ma WQ, Chen JL, Zhang YQ et al. Indicator species of phytoplankton pollution and water quality evaluation in Lalu wetland, Tibet. Tibet Science and Technology, 2023, 45(4): 13-22. [马文强, 陈俊霖, 张艳秋等. 西藏拉鲁湿地浮游植物污染指示种及水质评价. 西藏科技, 2023, 45(4): 13-22.] |
| [38] |
Liu Y, An RZ, Yang H et al. Spatial-temporal distribution characteristics and its driving factors of phytoplankton community in Lhalu Wetland, Tibet, China. J Lake Sci, 2024, 36(2): 403-417. [刘洋, 安瑞志, 杨号等. 西藏拉鲁湿地浮游植物群落时空分布特征及其驱动因子. 湖泊科学, 2024, 36(2): 403-417. DOI:10.18307/2024.0216] |
| [39] |
McNaughton SJ. Relationships among functional properties of Californian grassland. Nature, 1967, 216: 168-169. DOI:10.1038/216168b0 |
| [40] |
Habib O, Tippett R, Murphy K. Seasonal changes in phytoplankton community structure in relation to physico-chemical factors in Loch Lomond, Scotland. Hydrobiologia, 1997, 350: 63-79. DOI:10.1023/A:1003037012226 |
| [41] |
Zhang H, Song CM, Yan QL et al. Comparative studies on the spatial niche of zooplankton in the Liaohe Estuary in spring and summer. Marine Environmental Science, 2016, 35(6): 920-925. [张皓, 宋昌民, 闫启仑等. 辽河口春、夏季浮游动物空间生态位的比较. 海洋环境科学, 2016, 35(6): 920-925.] |
| [42] |
Liang M, Jiang Q, Sun LY et al. Spatial niches of dominant macro-zooplankton and meso-zooplankton species in the coastal area of Caofeidian. Ecology and Environmental Sciences, 2018, 27(7): 1241-1250. [梁淼, 姜倩, 孙丽艳等. 曹妃甸近岸海域大、中型浮游动物优势种空间生态位研究. 生态环境学报, 2018, 27(7): 1241-1250.] |
| [43] |
Colwell RK, Futuyma DJ. On the measurement of niche breadth and overlap. Ecology, 1971, 52(4): 567-576. DOI:10.2307/1934144 |
| [44] |
Pianka ER. The structure of lizard communities. Annual Review of Ecology and Systematics, 1973, 4: 53-74. DOI:10.1146/annurev.es.04.110173.000413 |
| [45] |
Co dy, Martin L. Competition and structure of bird communities. London: Macmillan, 1909.
|
| [46] |
May RM. Some notes on estimating the competition matrix, A. Ecology, 1975, 56(3): 737-741. DOI:10.2307/1935511 |
| [47] |
Cheng RM, Wang RL, Liu ZB et al. Interconnection among species of dominant tree populations of Castanopsis community in Three Gorges Reservoir Region. Scientia Silvae Sinicae, 2013, 49(5): 36-42. [程瑞梅, 王瑞丽, 刘泽彬等. 三峡库区栲属群落主要乔木种群的种间联结性. 林业科学, 2013, 49(5): 36-42. DOI:10.11707/j.1001-7488.20130506] |
| [48] |
Dai DX, Yu CG, Liu H et al. Niche and interspecific association of major nekton in the sea area to the east of the Nanji Islands. Chinese Journal of Applied Ecology, 2019, 30(12): 4249-4258. [戴冬旭, 俞存根, 刘惠等. 南麂列岛东侧海域主要游泳动物生态位及种间联结性. 应用生态学报, 2019, 30(12): 4249-4258. DOI:10.13287/j.1001-9332.201912.033] |
| [49] |
张金屯. 数量生态学. 北京: 科学出版社, 2004.
|
| [50] |
Pan Q, Liang J, Ni Y et al. Analysis of inter-specific correlation of Cephalcia kunyushanica and tree layer plant species in natural forests in Kunyushan. Scientia Silvae Sinicae, 2015, 51(10): 85-92. [潘琪, 梁军, 倪杨等. 昆嵛山腮扁叶蜂与乔木层树种的联结性分析. 林业科学, 2015, 51(10): 85-92.] |
| [51] |
Zhou XZ, Li L, Yin ZB et al. Temporal and vertical spatial niche of Erythroneura sudra and its natural enemies. Journal of Anhui Agricultural University, 2003, 30(2): 202-205. [周夏芝, 李磊, 音正兵等. 桃一点叶蝉及其天敌类群时空生态位分析. 安徽农业大学学报, 2003, 30(2): 202-205.] |
| [52] |
Liu K, Yu CG, Xu YJ et al. Spatio-temporal niche of major fish species in Pishan waters off Zhejiang Province, China. Chinese Journal of Applied Ecology, 2021, 32(3): 1069-1079. [刘坤, 俞存根, 许永久等. 浙江披山海域主要鱼类时空生态位. 应用生态学报, 2021, 32(3): 1069-1079. DOI:10.13287/j.1001-9332.202103.033] |
| [53] |
Li XS, Yu ZH, Sun S et al. Ecological niche breadth and niche overlap of dominant species of fish assemblage in Yangtze River Estuary and its adjacent waters. Chinese Journal of Applied Ecology, 2013, 24(8): 2353-2359. [李显森, 于振海, 孙珊等. 长江口及其毗邻海域鱼类群落优势种的生态位宽度与重叠. 应用生态学报, 2013, 24(8): 2353-2359. DOI:10.13287/j.1001-9332.2013.0394] |
| [54] |
胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态. 北京: 科学出版社, 2006.
|
| [55] |
Wang G, Zhao SL, Zhang PY et al. On the definition of niche and the improved formula for measuring niche overlap. Acta Ecologica Sinica, 1984, 4(2): 119-127. [王刚, 赵松岭, 张鹏云等. 关于生态位定义的探讨及生态位重叠计测公式改进的研究. 生态学报, 1984, 4(2): 119-127.] |
| [56] |
Han DY, Xue Y, Ji YP et al. Trophic and spatial niche of five gobiid fishes in Jiaozhou Bay. Journal of Fishery Sciences of China, 2013, 20(1): 148-156. [韩东燕, 薛莹, 纪毓鹏等. 胶州湾5种虾虎鱼类的营养和空间生态位. 中国水产科学, 2013, 20(1): 148-156.] |
| [57] |
Zhang P, Liu Y, An RZ et al. Spatio-temporal niche of dominant Protozoa species in the midstream and downstream of Lhasa River, Tibet, China. Scientia Silvae Sinicae, 2022, 58(1): 78-88. [张鹏, 刘洋, 安瑞志等. 西藏拉萨河中下游原生动物优势种时空生态位. 林业科学, 2022, 58(1): 78-88.] |
| [58] |
Qiu JJ, Wang YX, Li TJ et al. Study on the niche and differentiation of major nekton species in the Zhoushan Changbai sea area. Acta Ecologica Sinica, 2018, 38(18): 6759-6767. [求锦津, 王咏雪, 李铁军等. 舟山长白海域主要游泳动物生态位及其分化研究. 生态学报, 2018, 38(18): 6759-6767. DOI:10.5846/stxb201803300680] |
| [59] |
Pang CH, Fan X, Zhang F et al. The niches of dominant species in different resource dimensions in the lower reaches of Fenhe River, Shanxi Province of China. Chinese Journal of Ecology, 2015, 34(2): 380-386. [庞春花, 范晓, 张峰等. 不同资源维度上汾河流域下游优势种的生态位. 生态学杂志, 2015, 34(2): 380-386. DOI:10.13292/j.1000-4890.2015.0053] |
| [60] |
Feng YM, Chen XL, Qi R et al. Niche characteristics of the primary understory populations of a Picea asperata plantation in the subalpine region of Gansu Province. Pratacultural Science, 2018, 35(4): 807-815. [冯宜明, 陈学龙, 齐瑞等. 甘肃亚高山云杉人工林下植物种群生态位特征. 草业科学, 2018, 35(4): 807-815. DOI:10.11829/j.issn.1001-0629.2017-0236] |
| [61] |
Sun YJ, Chen XX, Fu QF et al. Niche characteristics of dominant species of Cycas fairylakea community in Meilin Reservoir, Shenzhen. Journal of Central South University of Forestry & Technology, 2019, 39(11): 63-70. [孙延军, 陈晓熹, 付奇峰等. 深圳市梅林水库仙湖苏铁群落优势种群生态位研究. 中南林业科技大学学报, 2019, 39(11): 63-70.] |
| [62] |
An RZ, Pan CM, Liu Y et al. Study on the distribution pattern and coexistence mechanism of dominant summering phytoplankton population in the Basomtso. Plateau Science Research, 2020, 4(2): 27-36. [安瑞志, 潘成梅, 刘洋等. 巴松措(湖)夏季浮游植物优势种群分布格局与共存机制研究. 高原科学研究, 2020, 4(2): 27-36.] |
| [63] |
尚玉昌. 普通生态学. 北京: 北京大学出版社, 2010.
|
| [64] |
王伯荪. 植物种群学. 广州: 中山大学出版社, 1989.
|
| [65] |
Ward JS, Parker GR, Ferrandino FJ. Long-term spatial dynamics in an old-growth deciduous forest. Forest Ecology and Management, 1996, 83(3): 189-202. DOI:10.1016/0378-1127(96)03722-x |
| [66] |
Huang XT, Wang SX, Huang BJ et al. Analyses of community stability and inter-specific associations between the rare plant Phyllitis scolopendrium and its associated species. Acta Ecologica Sinica, 2015, 35(1): 80-90. [黄祥童, 王绍先, 黄炳军等. 珍稀植物对开蕨与其伴生物种的联结性及群落稳定性. 生态学报, 2015, 35(1): 80-90. DOI:10.5846/stxb201404280842] |
| [67] |
Ye QP, Zhang WH, Yu SC et al. Interspecific association of the main tree populations of the Quercus acutissima community in the Qiaoshan forest area. Acta Ecologica Sinica, 2018, 38(9): 3165-3174. [叶权平, 张文辉, 于世川等. 桥山林区麻栎群落主要乔木种群的种间联结性. 生态学报, 2018, 38(9): 3165-3174. DOI:10.5846/stxb201706131071] |
| [68] |
Li JF, Pan P, OuYang XZ et al. Interspecific association and species coexistence mechanism of evergreen broad-leaved forest in Lushan Mountain. Chinese Journal of Ecology, 2022, 41(8): 1474-1481. [李坚锋, 潘萍, 欧阳勋志等. 庐山常绿阔叶林种间联结性及物种共存机制. 生态学杂志, 2022, 41(8): 1474-1481. DOI:10.13292/j.1000-4890.202208.016] |
| [69] |
Zhang MX, Wang DX, Kang B et al. Interspecific associations of dominant plant populations in secondary forest of Pinus armandii in Qinling Mountains. Scientia Silvae Sinicae, 2015, 51(1): 12-21. [张明霞, 王得祥, 康冰等. 秦岭华山松天然次生林优势种群的种间联结性. 林业科学, 2015, 51(1): 12-21. DOI:10.11707/j.1001-7488.20150102] |
| [70] |
Li QH, Ma YM. Analysis on niche and interspecific association of dominant species of phytoplankton in Tongzi River. Journal of Guizhou Normal University: Natural Sciences, 2022, 40(2): 11-18. [李秋华, 马一明. 桐梓河浮游植物优势种生态位与种间联结性分析. 贵州师范大学学报: 自然科学版, 2022, 40(2): 11-18. DOI:10.16614/j.gznuj.zrb.2022.02.002] |
| [71] |
Li QL, Zong XH, Deng HP et al. Niche and interspecific association of dominant species in tree layer of Chishui Alsophila spinulosa Community. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(7): 1422-1428. [李丘霖, 宗秀虹, 邓洪平等. 赤水桫椤群落乔木层优势物种生态位与种间联结性研究. 西北植物学报, 2017, 37(7): 1422-1428. DOI:10.7606/j.issn.1000-4025.2017.07.1422] |
| [72] |
Liu Y, An RZ, Wang C et al. Niche and interspecific associations of dominant summer phytoplankton species in basomtso lake, Xizang, China. Journal of Hydroecology, 2024, 45(2): 111-120. [刘洋, 安瑞志, 王陈等. 西藏巴松错夏季浮游植物优势种生态位及其种间联结性. 水生态学杂志, 2024, 45(2): 111-120.] |
| [73] |
申涵. 寒旱区湖泊浮游植物生态位及种间联结特征分析[学位论文]. 包头: 内蒙古科技大学, 2020.
|
| [74] |
Xu MH, Liu M, Zhai DT et al. A review of contents and methods used to analyze various aspects of plant interspecific associations. Acta Ecologica Sinica, 2016, 36(24): 8224-8233. [徐满厚, 刘敏, 翟大彤等. 植物种间联结研究内容与方法评述. 生态学报, 2016, 36(24): 8224-8233. DOI:10.5846/stxb201505311092] |
| [75] |
Hu CY, Shui YY, Du X et al. Niche and interspecific association of nekton in the south coastal waters of Cangnan, ZheJiang, China. Chinese Journal of Applied Ecology, 2015, 26(10): 3195-3201. [胡成业, 水玉跃, 杜肖. 浙江苍南南部沿岸海域主要游泳动物生态位及种间联结性. 应用生态学报, 2015, 26(10): 3195-3201. DOI:10.13287/j.1001-9332.20150921.036] |
 2024, Vol. 36
2024, Vol. 36 


