(2: 上海农林职业技术学院, 上海 201699)
(3: 上海海洋大学, 环境DNA技术与水生态健康评估工程中心, 上海 201306)
(2: Shanghai Vocational College of Agriculture and Forestry, Shanghai 201699, P. R. China)
(3: Center for Environmental DNA Technology and Aquatic Ecological Health Assessment Engineering, Shanghai Ocean University, Shanghai 201306, P. R. China)
纤毛虫等原生动物是水生生态系统重要的参与者,分布广泛且可对环境变化作出迅速反应,在维持生态系统的物种多样性和功能方面至关重要[1]。因原生动物对环境具有高敏感性,可作为优良指示生物用于各类水体的污染监测[2-3]。但相较于其他浮游动物,原生动物微小,鉴定更为困难[4],在国内淡水生态监测和调查中常被忽略,导致相关研究不多,对其群落的了解尚且不足。
崇明岛位于长江入海口,是中国第三大岛,也是全球最大的河口冲积岛之一。三面环江、一面临海的地理特征使其拥有多样的水生生态系统(如江河、湖泊和湿地),形成了复杂的河网水系。鉴于崇明岛独特的地理位置,岛上具有丰富的自然资源和物种多样性。然而,长期的盐水侵蚀、平坦地形和涵闸控制的河道管理导致河道水流速度减慢和营养盐积累,加之近年来生活污水和农业面源污染增加,加重了水质恶化等问题[5-7],亟需对崇明岛水生态环境开展调查。由于海水入侵,盐度常影响水生生物对崇明岛河道营养盐的响应,筛选对盐度不敏感的指示生物尤为重要。为此,本文聚焦整个华东地区研究都较匮乏的原生动物纤毛虫,调查纤毛虫群落结构变化,分析纤毛虫与环境因子的关系,并尝试筛选指示种,以期为长江口地区河道的水生态监测提供基础。
1 材料与方法 1.1 调查站位、样品采集和预处理本研究共在崇明岛设置23个采样点(图 1),并分别于2020年7月、10月以及2021年1月、5月采集样品。采用能够获得更高分类分辨率的定量蛋白银法(quantitative protargol stain method, QPS)进行纤毛虫群落调查。取300 mL表层和底层混合水样,并现场加入15 mL波恩液固定;实验室内,吸取10~30 mL样品,经0.45 μm孔径硝酸纤维素膜过滤收集,然后经琼脂包埋、滤膜固化、清洗漂白、蛋白银染色、显影、氯化金增色、定影、脱水封片等步骤制成永久封片[8],在显微镜(100~1000倍)下鉴定和计数。种类鉴定主要参考文献[9-12],食性划分主要参考Foissner等[13]的方法。
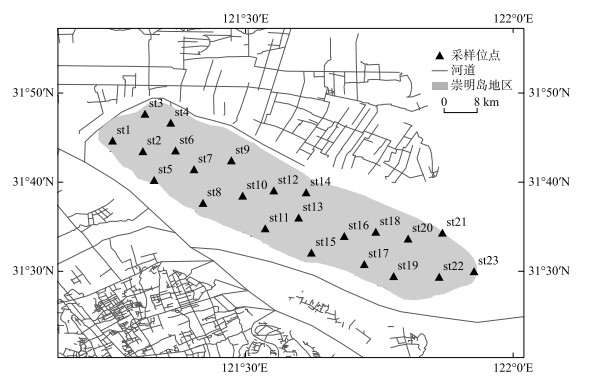
|
图 1 崇明岛各采样点位分布 Fig.1 Distribution of sampling sites in Chongming Island |
水温、盐度(Sal)、溶解氧(DO)、酸碱度(pH)等环境因子监测采用多参数水质测定仪(YSI professional plus)现场测定,叶绿素a(Chl.a)和透明度(SD)分别使用FluoroSenseTM Handheld手持式叶绿素测定仪和萨氏盘现场测定。总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)浓度依照《水和废水监测分析方法》进行测定[14]。降水量在World Weather Online(https://www.worldweatheronline.com/)网站获取。
1.2 数据处理及分析纤毛虫的α多样性指数(包括Margalef指数(d)、Pielou指数(J′)、Shannon-Wiener指数(H′))采用R语言中的vegan包计算。利用Bray-Curtis相异矩阵系数对群落进行β多样性分析,用ANOSIM分析检验不同季节的群落结构差异。采用基于距离的冗余模型(distance-based redundancy analysis, dbRDA)寻找影响浮游纤毛虫群落结构的主要环境因子,同时通过冗余分析解析环境因子对不同季节纤毛虫群落结构的影响[15]。选取总氮、总磷和氨氮作为营养盐环境因子,根据《地表水环境质量标准》(GB 3838—2002)对崇明岛水质指标进行营养等级划分,利用R语言中的labdsv包对各物种的指示值(indicator value index, IndVal)进行计算,选择P<0.05的物种作为指示种[16]。IndVal的计算公式如下:
| IndValij=Aij×Bij | (1) |
式中,Aij表示物种i在j类水质样点的平均丰度占该物种在所有样点总丰度的比例,Bij表示物种i的j类水质样点数占所有j类水质样点数的比例[17]。
通过SIMPER(similarity percentages)分析计算每个物种对整体群落相似性贡献的百分数并按递减的顺序排列,挑选出累计贡献度达到90%的物种作为优势种。利用Spearman秩相关性分析计算其与盐度及营养盐之间的相关性,综合选出适合崇明岛区域的指示种。
2 结果 2.1 崇明岛河道理化因子崇明岛河道表层水温在5.3~26.8 ℃之间波动,年平均温度为17.8 ℃;水体盐度为0.12‰~3.28‰,年平均盐度为0.39‰,其中5月st13和st23盐度最高,分别为3.28‰和2.03‰,可能受到海水入侵;5月叶绿素a平均浓度最高,为34.37 μg/L,而10月最低,仅为6.59 μg/L;2020年7月、10月以及2021年1月、5月氨氮平均浓度分别为2.86、0.25、0.07、0.12 mg/L,年平均浓度为0.86 mg/L,整体属于Ⅲ类水(表 1)。而7月营养盐浓度较高,溶解氧和透明度较低,可能是该月降雨多致使底泥搅起造成。
| 表 1 崇明岛河道水环境参数 Tab. 1 Environmental parameters of rivers in Chongming Island |
本次调查共发现纤毛虫131种,隶属于3纲11目,并在目级别下比较不同月份纤毛虫的α多样性指数(图 2)。寡毛目为优势类群,占物种总丰度的61.2%。不同月份纤毛虫丰度具有明显变化,1月>5月>7月>10月。
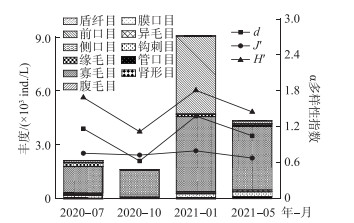
|
图 2 不同月份纤毛虫物种组成以及α多样性指数 Fig.2 Species composition of ciliates and the alpha diversity indexes in different months |
除Pielou指数外,α多样性指数均呈现1月>7月>5月>10月的趋势。Spearman相关性分析(表 2)显示,Margalef指数与NO3--N浓度呈显著正相关(P<0.05),与叶绿素a浓度呈极显著正相关(P<0.01)。Pielou指数与盐度和叶绿素a浓度均呈极显著负相关(P<0.01)。Shannon-Wiener指数与NO2--N浓度呈显著正相关(P<0.05),与NO3--N浓度呈极显著正相关(P<0.01)。
| 表 2 多样性指数与环境因子之间的相关性分析 Tab. 2 Correlation analysis between diversity index and environmental factors |
对4个月份的浮游纤毛虫群落结构差异性进行ANOSIM检验,结果表明4个月份的纤毛虫群落结构差异极显著(P<0.01)。为了探寻驱动崇明岛河道纤毛虫群落变化的环境因子,采用基于距离的冗余模型dbRDA对DistlLM结果进行可视化(图 3),发现叶绿素a、降水量、溶解氧、水温以及营养盐(NH3-N、NO2--N、TP、TN)是影响崇明岛河道浮游纤毛虫群落结构的重要因子(P<0.05)。RDA结果表明,7月纤毛虫群落结构受营养盐影响较大,第一轴和第二轴分别与溶解氧、总氮、总磷和氨氮的相关性较高,并且前两轴共解释了48.41%。10月的环境因子中,叶绿素a、氨氮、亚硝态氮、pH和盐度显著影响浮游纤毛虫群落组成,且前两轴的解释率达65.44%。1月第一轴主要与氨氮、总氮和硝态氮的相关性较高,第二轴主要与溶解氧和总磷相关,前两轴解释了45.23%。5月的样本则分布较为分散,第一轴主要与溶解氧和叶绿素a呈显著相关,第二轴与总磷呈显著相关,前两轴共解释52.05%。
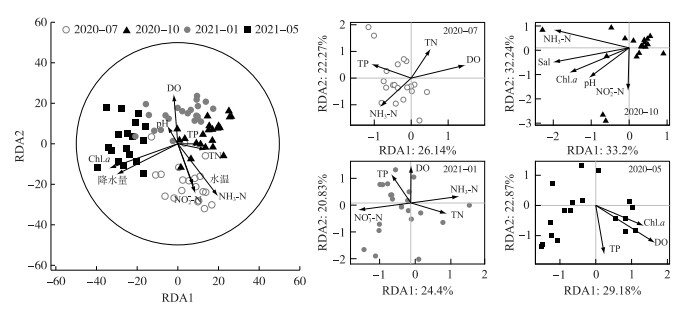
|
图 3 崇明岛不同月份纤毛虫群落结构和环境因子的冗余分析 Fig.3 Redundancy analysis between ciliate community structure and environmental factors in different months of Chongming Island |
崇明岛河道浮游纤毛虫群落累计贡献率达90%以上的种类共12个(表 3),高贡献率物种主要为藻食性类群,其中藻食性物种透明裂隙虫(Rimostrombidium hyalinum)丰度与总氮、总磷呈显著负相关关系(P<0.01),在1月和10月多个点位维持较高丰度,尤其是10月份的st13样点;主要以藻类和细菌为食的浮游藤壶虫(Balanion planctonicum)在1月种群大暴发,而在7月的平均丰度仅为3.03 ind./L,其与总氮和总磷均呈显著正相关关系;而混合营养型的奇异海游虫(Pelagostrombidium mirabile)在各季节分布均匀,为1、7和10月的优势种,且其丰度与总磷呈极显著负相关关系(P<0.01);杂食性物种象鼻拟长颈虫(Paradileptus elephantinus) 在7月和10月分布均匀,但在1月和5月未检出,其丰度与氨氮和盐度存在极显著负相关关系(P<0.01)。
| 表 3 累积贡献率达90%以上的物种丰度与环境因子的相关性分析 Tab. 3 Correlation between abundance of species contributing to 90% of cumulative abundance and environmental factors |
此外,IndVal指数显示(表 4),优势种中象鼻拟长颈虫、奇异海游虫分别可指示总磷达Ⅰ类水标准的水体和总氮达Ⅱ类水标准的水体;而透明裂隙虫则能指示氨氮达Ⅲ类水标准的水体,它的大量出现可能预示着水质存在污染风险。
| 表 4 崇明岛与营养盐有关的原生动物指示种 Tab. 4 Indicator species of ciliates related to nutrients in Chongming Island |
本次调查在崇明岛河道共发现了131种纤毛虫,隶属于11目3纲,多膜纲和动基片纲的数量占主导地位,而寡膜纲的种类相对较少。优势类群主要为寡毛目和前口目,且以藻食性和杂食性物种为主。崇明岛河道纤毛虫物种数量高于中国上海市城区河道(44种)[18]、秦皇岛的洋河(46种)[19],也高于西班牙河流(67种)[20]、巴西河道(84种)[21]以及多瑙河匈牙利段水域(83种)[22],与中国拉萨河中下游(136种)[23]、南美洲热带城市河流(143种)[24]相似,这说明崇明岛具有丰富的纤毛虫原生动物资源。陈立婧等[25]用传统沉降计数法对崇明岛明珠湖原生动物的调查发现,纤毛虫为60种,远低于本次对崇明河道的调查结果。而李静等[26]同样用定量蛋白银法对太湖的调查结果(117种)也略低于本次调查结果。流速与浮游生物的多样性通常呈反比[27],故水库或者湖泊等较为稳定的水体内纤毛虫种类数量常比流动型水体更多,但此次崇明岛河道调查的纤毛虫物种数反而高于崇明岛明珠湖和太湖,与明珠湖调查结果的差异很可能是研究方法造成的,而与太湖的差异则进一步表明崇明岛纤毛虫原生动物种类丰富。
奇异海游虫、透明裂隙虫、恩茨筒壳虫、浮游藤壶虫等12个种对纤毛虫群落具有显著贡献,是优势种,其中恩茨筒壳虫同样是崇明岛明珠湖的优势种[25]。这些优势类群与李静等[26]在太湖调查到的类群类似,主要是寡毛目和前口目;奥地利中/寡营养的皮伯格湖的调查也有类似的结果[28]。奇异海游虫、透明裂隙虫等在不同水域中均表现出优势地位,它们可能对于维持水生态平衡具有重要作用。
纤毛图式是纤毛虫鉴定的重要形态特征,传统的沉降计数法因缺失该信息,降低了物种鉴定的分辨率,常导致鉴定困难,物种丰富度低估。而定量蛋白银法可弥补该问题,实现精准分类鉴定,在国外调查中广泛使用[29-32],改进后已作为国家标准用于海洋底栖微型生物调查[33]。本研究进一步验证了定量蛋白银法在纤毛虫等原生动物生态学研究中的重要价值,建议在国内淡水浮游原生动物调查和监测时优先选用。但定量蛋白银法的操作较为繁琐,从过滤包埋到制片耗时较久(2 h左右),一些关键步骤(如样品包埋、漂白、染色及显影等)均需一定经验,因此限制了该方法的推广。同时,相较海洋原生动物,国内淡水原生动物鉴定资料稀缺,仅有资料中大量种类缺少纤毛图式等重要鉴定信息,也是定量蛋白银法用于国内淡水原生动物研究远少于海洋研究的另一重要原因。因此该方法的推广,一方面需要对相关实验人员开展培训;另一方面急需原生动物分类学家对国内原生动物开展形态分类学研究,形成一套涵盖全面鉴定特征的图解鉴定资料。
3.2 原生动物群落结构与环境因子的关系根据dbRDA排序结果显示,驱动崇明岛原生动物群落结构形成的环境因子为叶绿素a、溶解氧、氨氮等,这可能与该区域优势浮游纤毛虫主要为藻食性和杂食性有关。国内外其他对淡水河流、湖泊的研究也有类似的发现[34-39]。在环境因子中,叶绿素a浓度对浮游原生动物群落结构影响尤为显著,其具有明显春季高峰、夏季降低的季节性变化[40]。藻类等浮游植物在春季大量繁殖,而夏季采样期间高降水量影响了藻类生长,藻类的变化进而影响藻食性和杂食性纤毛虫的丰度。
不同季节中营养盐均为纤毛虫群落空间异质性的主要影响因素,这表明纤毛虫在不同季节均对水体富营养水平有指示作用。崇明岛在7月出现季节性强降雨,这不仅搅动底泥释放营养盐,还将周边农田和居民区的营养盐冲刷入水体[41],导致水体营养盐水平显著升高,进而影响浮游纤毛虫群落。1月通常桡足类等更高营养级的浮游动物较少[42],降雨稀少,适宜的营养盐和叶绿素a浓度、较低的捕食压力以及稳定的水动力条件为该时期浮游纤毛虫提供了适宜环境,促使物种多样性升高,优势种透明裂隙虫和浮游藤壶虫暴发式增长。在河口区,盐度常干扰水生生物对其他环境因子的响应。但在崇明岛河道,盐度对大部分季节的纤毛虫群落并无显著影响(图 3),显示出纤毛虫在该生境不易受盐度干扰,其群落变化能更直接地反映富营养水平。
3.3 优势种对崇明岛河道水环境的指示IndVal指数显示象鼻拟长颈虫和奇异海游虫优势种可指示寡营养水体(Ⅰ类和Ⅱ类水),它们在空间上分布较为均匀,在营养盐较低的样点有着较高的丰度。与盐度的相关性分析中,奇异海游虫丰度与盐度没有显著相关性,但象鼻拟长颈虫丰度与盐度呈显著负相关关系,表明前者不易受盐度干扰,能更直接指示寡营养水体。本研究还发现透明裂隙虫丰度与盐度无显著相关性,对中度营养状态(Ⅲ类水)水体有指示意义,这与Pfister等[43]对欧洲中富营养水体的研究相一致。此外,经典耐污种前口目的浮游藤壶虫丰度分别与总氮、总磷呈极显著、显著正相关关系(表 3),其在1月的st13丰度最高,但在其他样点罕见,表明该物种对富营养化程度较高水体具有较好的指示作用。国内外对湖泊和河流的调查常发现寡毛目在寡营养水体中占绝对优势,而前口目的一些种类在富营养化水体中会变为优势类群[19, 44-45],这些均与本研究结果相互印证。李静等[26]虽然发现前口目纤毛虫在太湖高营养水平的水域数量降低,但也可能是生物间的相互作用造成的。
4 结论本研究首次采用定量蛋白银法对崇明岛河道四季浮游纤毛虫进行调查,共发现纤毛虫131种。叶绿素a、水温、溶解氧及营养盐是驱动浮游纤毛虫群落结构变化的主要环境因子,盐度对其影响不显著,因此浮游纤毛虫能更直接反映河道水质状况。奇异海游虫、透明裂隙虫可作为崇明岛水质状况的潜在指示物种。
致谢: 感谢上海海洋大学韩琨、何佳莲、张子慧、尹思成、雷琦、陈琦等同学在采样过程给予的帮助,感谢唐进同学在QPS实验上的协助。
| [1] |
Esteban GF, Fenchel TM. Ecology of Protozoa: The biology of free-living phagotrophic prtists. Berlin: Springer, 2020.
|
| [2] |
沈韫芬, 顾曼如, 龚循矩. 微型生物监测新技术. 北京: 中国建筑工业出版社, 1990: 152-159.
|
| [3] |
Stoeck T, Kochems R, Forster D et al. Metabarcoding of benthic ciliate communities shows high potential for environmental monitoring in salmon aquaculture. Ecological Indicators, 2018, 85: 153-164. DOI:10.1016/j.ecolind.2017.10.041 |
| [4] |
Weisse T, Montagnes DJS. Ecology of planktonic ciliates in a changing world: Concepts, methods, and challenges. Journal of Eukaryotic Microbiology, 2022, 69(5): e12879. DOI:10.1111/jeu.12879 |
| [5] |
Jiang DG, Li JH, Xu JY et al. Three-dimensional fluorescence spectra of dissolved organic matter in a eutrophic river on Chongming Island. Journal of Hydroecology, 2019, 40(3): 33-40. [姜德刚, 李建华, 徐金燕等. 崇明岛富营养化河道溶解有机质的三维荧光光谱特征. 水生态学杂志, 2019, 40(3): 33-40. DOI:10.15928/j.1674-3075.2019.03.005] |
| [6] |
Ma BB, He YY, Dai ZJ. Study on the influence of intensive human activities on the variation process of tidal flat resources in Chongming Island. Journal of Natural Resources, 2022, 37(4): 1025-1035. [马彬彬, 何钰滢, 戴志军. 流域和河口高强度人类活动对崇明岛滩涂资源变化过程的影响. 自然资源学报, 2022, 37(4): 1025-1035. DOI:10.31497/zrzyxb.20220413] |
| [7] |
Wang HZ, Liu XQ, Wang HJ. The Yangtze River-Floodplain ecosystem: Multiple threats and holistic conservation. Acta Hydrobiologica Sinica, 2019, 43(S1): 157-182. [王洪铸, 刘学勤, 王海军. 长江河流-泛滥平原生态系统面临的威胁与整体保护对策. 水生生物学报, 2019, 43(S1): 157-182. DOI:10.7541/2019.178] |
| [8] |
Skibbe O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für Hydrobiologie, 1994, 130(3): 339-347. DOI:10.1127/archiv-hydrobiol/130/1994/339 |
| [9] |
Jiang XZ. Notes on the freshwater tintinnoinea from Jiangsu and Anhui Provinces. Acta Hydrobiologica Sinica, 1956(1): 61-87. [蒋燮治. 江苏安徽淡水沙壳纤毛虫的调查报告. 水生生物学报, 1956(1): 61-87.] |
| [10] |
张武昌, 丰美萍, 于莹等. 砂壳纤毛虫图谱. 北京: 科学出版社, 2012: 75-489.
|
| [11] |
Corliss JO. The ciliated protozoa: characterization, classification, and guide to the literature. 2nd ed. London: Pergamon Press, 1979: 1-455.
|
| [12] |
Lynn DH. The ciliated protozoa: characterization, classification, and guide to the literature. 3rd ed. Dordrecht: Springer, 2008: 1-605.
|
| [13] |
Foissner W, Berger H. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayerischen Landesamtes für Wasserwirtschaft, 1999, 99(3): 1-793. |
| [14] |
国家环境保护总局. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 2002: 200-284.
|
| [15] |
Borcard D. Numerical ecology with R. New York: Springer, 2011: 156-197.
|
| [16] |
DeCáceres M, Legendre P. Associations between species and groups of sites: Indices and statistical inference. Ecology, 2009, 90(12): 3566-3574. DOI:10.1890/08-1823.1 |
| [17] |
Dufrene M, Legendre P. Species assemblages and indicator species: The need for a flexible asymmetrical approach. Ecological Monographs, 1997, 67(3): 345. DOI:10.2307/2963459 |
| [18] |
Mao KY, Yu N, Jiang XQ et al. The characteristics of protozoan community structure in the urban rivers of Shanghai in winter. Sichuan Journal of Zoology, 2009, 28(4): 537-541. [毛开云, 禹娜, 姜雪芹等. 冬季上海市城区河道中原生动物群落的结构特征. 四川动物, 2009, 28(4): 537-541.] |
| [19] |
Feng JS. Ciliates in Yanghe River and relation with water quality pollution. Environmental Science & Technology, 2005, 28(4): 56-57, 118. [冯建社. 洋河的纤毛虫调查与水质污染的关系. 环境科学与技术, 2005, 28(4): 56-57, 118.] |
| [20] |
Sola A, Serrano S, Guinea A. Influence of environmental characteristics on the distribution of ciliates in the River Henares (Central Spain). Hydrobiologia, 1996, 324(3): 237-252. DOI:10.1007/BF00016396 |
| [21] |
Debastiani C, Meira BR, Lansac-Tôha FM et al. Protozoa ciliates community structure in urban streams and their environmental use as indicators. Brazilian Journal of Biology, 2016, 76(4): 1043-1053. DOI:10.1590/1519-6984.08615 |
| [22] |
Kiss AK, Acs E, Kiss KT et al. Structure and seasonal dynamics of the protozoan community (heterotrophic flagellates, ciliates, amoeboid protozoa) in the plankton of a large river (River Danube, Hungary). European Journal of Protistology, 2009, 45(2): 121-138. DOI:10.1016/j.ejop.2008.08.002 |
| [23] |
Yang Q, Zhang P, An RZ et al. Spatial and temporal distribution patterns and driving mechanisms of ciliate communities in the midstream and downstream reaches of the Lhasa River. Biodiversity Science, 2022, 30(6): 136-150. [杨清, 张鹏, 安瑞志等. 拉萨河中下游纤毛虫群落时空分布模式及其驱动机制. 生物多样性, 2022, 30(6): 136-150. DOI:10.17520/biods.2022012] |
| [24] |
Velho LFM, de Fátima Rodrigues de Castro S, Lansac-Tôha FM et al. Spatial and temporal variation in species composition of ciliates communities (Alveolata, Ciliophora) from tropical urban and rural streams. Annales de Limnologie-International Journal of Limnology, 2021, 57: 24. DOI:10.1051/limn/2021022 |
| [25] |
Chen LJ, Gu J, Hu ZJ et al. The research of protozoa community structure in Mingzhu Lake of Chongming Island, Shanghai. Journal of Fisheries of China, 2010, 34(9): 1404-1413. [陈立婧, 顾静, 胡忠军等. 上海崇明明珠湖原生动物的群落结构. 水产学报, 2010, 34(9): 1404-1413. DOI:10.3724/SP.J.1231.2010.06933] |
| [26] |
Li J, Dai X, Sun Y et al. Community structure of planktonic ciliates and its relationship to environmental variables in Lake Taihu. Acta Ecologica Sinica, 2014, 34(16): 4672-4681. [李静, 戴曦, 孙颖等. 太湖浮游纤毛虫群落结构及其与环境因子的关系. 生态学报, 2014, 34(16): 4672-4681. DOI:10.5846/stxb201212241852] |
| [27] |
Zheng JX, Hu JX, Zhou LF et al. Ecological research of protozoan community in upper reaches of the Yangtze River. Biodiversity Science, 2009, 2(2): 88-92. [郑金秀, 胡菊香, 周连凤等. 长江上游原生动物的群落生态学研究. 水生态学杂志, 2009, 2(2): 88-92.] |
| [28] |
Stoeck T, Breiner HW, Filker S et al. A morphogenetic survey on ciliate plankton from a mountain lake pinpoints the necessity of lineage-specific barcode markers in microbial ecology. Environmental Microbiology, 2014, 16(2): 430-444. DOI:10.1111/1462-2920.12194 |
| [29] |
Montagnes DJS, Lynn DH. A quantitative protargol stain (QPS) for ciliates: Method description and test of its quantitative nature. Marine Microbial Food Webs, 1987, 2(2): 83-93. |
| [30] |
Safi LS, Fontoura NF, Severo HJ et al. Temporal structure of the peritrich ciliate assemblage in a large Neotropical Lake. Zoological Studies, 2014, 53(1): 17. DOI:10.1186/s40555-014-0017-3 |
| [31] |
Suzuki T, Ota T. Planktonic ciliates below sea ice in Franklin Bay, Canada. Plankton and Benthos Research, 2011, 6(3): 141-157. DOI:10.3800/pbr.6.141 |
| [32] |
Vrba J, Bojková J, Chvojka P et al. Constraints on the biological recovery of the Bohemian Forest lakes from acid stress. Freshwater Biology, 2016, 61(4): 376-395. DOI:10.1111/fwb.12714 |
| [33] |
国家海洋局. 海洋微型底栖生物调查规范. 北京: 中国标准出版社, 2011: 1-22.
|
| [34] |
Beaver JR, Crisman TL. The role of ciliated protozoa in pelagic freshwater ecosystems. Microbial Ecology, 1989, 17(2): 111-136. DOI:10.1007/BF02011847 |
| [35] |
Xu RL, Zheng YL. Seasonal changes of planktonic Ciliate communities in Yuexiu Lake, an urban lake of Guangzhou city. J Lake Sci, 2000, 12(2): 124-131. [徐润林, 郑永利. 广州市区越秀湖浮游纤毛虫群落的季节变化. 湖泊科学, 2000, 12(2): 124-131. DOI:10.18307/2000.0205] |
| [36] |
Wiackowski K, Ventelä AM, Moilanen M et al. What factors control planktonic ciliates during summer in a highly eutrophic lake?. Hydrobiologia, 2001, 443(1): 43-57. DOI:10.1023/A:1017592019513 |
| [37] |
Conty A, Bécares E. Unimodal patterns of microbial communities with eutrophication in Mediterranean shallow lakes. Hydrobiologia, 2013, 700(1): 257-265. DOI:10.1007/s10750-012-1235-5 |
| [38] |
Ning YZ, Yan ZJ, Sun J et al. Ciliate community characteristics and bioassessment of water quality in the Heihe River Basin. Chinese Journal of Ecology, 2017, 36(5): 1350-1356. [宁应之, 烟郑杰, 孙静等. 黑河干流纤毛虫群落组成及其对水质的响应. 生态学杂志, 2017, 36(5): 1350-1356. DOI:10.13292/j.1000-4890.201705.007] |
| [39] |
Da Z, Zhang P, An RZ et al. Species distribution and factors driving the protozoan community in the middle and lower Lhasa River. Journal of Hydroecology, 2023, 44(4): 10-17. [达珍, 张鹏, 安瑞志等. 拉萨河中下游原生动物群落物种分布格局及其驱动因素. 水生态学杂志, 2023, 44(4): 10-17. DOI:10.15928/j.1674-3075.202109230333] |
| [40] |
Huang HQ, Hou JJ, Weng C et al. Dynamics of chlorophyll a and its potential relationship with environmental factors in typical river of Chongming Island. Ecology and Environmental Sciences, 2016, 25(8): 1369-1375. [黄慧琴, 侯进菊, 翁辰等. 崇明岛典型河道水体中叶绿素a动态特征及其与环境因子的相关分析. 生态环境学报, 2016, 25(8): 1369-1375.] |
| [41] |
Liu HK, Zhao GR, Teng F. Research on river network water pollution characteristics and prevention of Chongming Island. Water Power, 2023, 49(10): 17-21, 50. [刘宏宽, 赵庚润, 滕飞. 崇明岛河网水污染特征及防治研究. 水力发电, 2023, 49(10): 17-21, 50. DOI:10.3969/j.issn.0559-9342.2023.10.004] |
| [42] |
Smetacek V. The annual cycle of protozooplankton in the Kiel Bight. Marine Biology, 1981, 63(1): 1-11. DOI:10.1007/BF00394657 |
| [43] |
Pfister G, Sonntag B, Posch T. Comparison of a direct live count and an improved quantitative protargol stain (QPS) in determining abundance and cell volumes of pelagic freshwater protozoa. Aquatic Microbial Ecology, 1999, 18(1): 95-103. DOI:10.3354/ame018095 |
| [44] |
Sonntag B, Posch T, Klammer S et al. Phagotrophic ciliates and flagellates in an oligotrophic, deep, alpine lake: Contrasting variability with seasons and depths. Aquatic Microbial Ecology, 2006, 43: 193-207. DOI:10.3354/ame043193 |
| [45] |
Zhang XK, Liu K, Wan A et al. Community structure of zooplankton and its relationship with survivability of the Yangtze finless porpoise in Xijiang oxbow, Anqing City. Acta Hydrobiologica Sinica, 2018, 42(2): 392-399. [张晓可, 刘凯, 万安等. 安庆西江浮游动物群落结构及江豚生存状况评估. 水生生物学报, 2018, 42(2): 392-399. DOI:10.7541/2018.050] |
 2024, Vol. 36
2024, Vol. 36 


