摘要
解磷菌(phosphate-solubilizing microorganisms,PSM)在沉积物磷释放过程中发挥着重要的作用,但在湖泛发生过程中,沉积物中PSM对磷释放的影响以及PSM对湖泛的适应机制尚不清楚。本研究以太湖为研究对象,分别在湖泛期和非湖泛期采集了上覆水和沉积物样品,并测定样品中主要理化因子。通过基于16S rRNA基因的Illumina高通量测序研究沉积物中微生物群落结构特征,比较湖泛期与非湖泛期沉积物中PSM种群结构的差异,并利用微生物网络共现图揭示了PSM与其他微生物之间的相互关系。研究结果表明,相较于非湖泛期,湖泛期上覆水中总磷和磷酸盐浓度提高了10倍以上。湖泛期沉积物中PSM的相对丰度约是非湖泛期的7倍。在湖泛期,沉积物中的PSM以不动杆菌属(Acinetobacter)、鞘氨醇杆菌属(Novosphingobium)和黄杆菌属(Flavobacterium)为主,非湖泛期沉积物中PSM分布较少,主要为鞘氨醇杆菌属、黄杆菌属和固氮杆菌属(Azotobacter)。相关性分析结果表明,不同的PSM对各种形态磷的释放影响存在差异,PSM与有机磷(Org-P)、铁结合态磷(BD-P)和钙结合态磷(Ca-P)的相关性系数均小于-0.627,且主要磷释放对象为Ca-P和Org-P。微生物网络分析表明湖泛期PSM的正相关邻节点主要为反硝化细菌和发酵菌,负相关邻节点主要是铁还原菌和硫酸盐还原菌,这说明PSM在磷释放过程中与反硝化细菌及参与有机质代谢的发酵细菌进行协作,而与铁还原菌和硫还原菌存在一定的竞争关系,在湖泛环境下PSM与多种微生物共同作用促进了沉积物内源磷的释放。综上所述,PSM能够调整群落结构及其相关细菌的相互作用来应对湖泛的发生。本研究结果有助于进一步认识PSM对沉积物磷释放及对湖泊环境变化的适应过程。
Abstract
Phosphate-solubilizing microorganisms (PSM) play an important role in the process of sediment phosphorus release. However, the effect of PSM on phosphorus release in sediments and the adaptation mechanism of PSM to black bloom are still unclear. This study collected surface water and sediment samples from Lake Taihu during black and non-black bloom periods, and determined the major physicochemical factors in the samples. The characteristics of microbial community structure in sediments were studied by 16S rRNA and Illumina high-throughput sequencing, and the differences of PSM species structure between black bloom and non-black bloom sediments were analyzed. In addition, the relationship between PSM and other microorganisms were also studied via microbial co-occurrence networks. The results indicated that concentrations of TP and PO3-4-P in the surface water during the black bloom period were more than 10 times higher than those during the non-black bloom period. The relative abundance of PSM in the sediments during the black bloom period was approximately 7 times higher than that during the non-black bloom period. During the black bloom period, PSM in sediments was dominated by Acinetobacter, Novosphingobium and Flavobacterium, and PSM was less distributed in non-black bloom sediments. Correlation analysis showed that different PSM had different effects on the release of various phosphorus fractions. The correlation coefficients between the main PSM and organic phosphorus (Org-P), iron-bound phosphorus (BD-P) and calcium-bound phosphorus (Ca-P) were less than -0.627, and the main phosphorus release fractions were Ca-P and Org-P. The microbial network analysis showed that the positive correlation nodes of PSM in the black bloom period were mainly denitrifying bacteria and fermenting bacteria, and the negative correlation nodes were mainly iron-reducing bacteria and sulfate-reducing bacteria. This indicated that PSM tended to collaborate with denitrifying bacteria and fermenting bacteria involved in organic matter metabolism during phosphorus release, while competing with iron reducing bacteria and sulfur reducing bacteria to a certain extent. In a lake environment, PSM worked together with multiple microorganisms to promote the release of endogenous phosphorus in sediments. In summary, PSM could adjust the community structure and its interaction with related bacteria to cope with the occurrence of black bloom. These results extend our knowledge on the importance of PSM during black blooms and the adaptation of PSM to environmental changes in freshwater lakes.
随着社会经济发展,过量的磷(P)元素排入淡水水体后导致藻类过度生长和水体富营养化,甚至引发蓝藻水华等严重的水环境问题[1]。在蓝藻水华发生过程中,蓝藻死亡分解后在微生物作用下生成的硫化物会与底泥中的部分重金属反应而形成致黑物质,视觉表现为黑色,称为“黑水团”,也称做藻源性湖泛[2-3]。湖泛将导致水体中溶解氧(DO)浓度接近0,并向水体中释放微囊藻毒素、硫化物、甲烷和嗅味物质等有害物质,对湖泊生态系统稳定造成严重影响[2,4-5]。比如,2007年在太湖南泉水源地发生的藻源性湖泛导致无锡发生了供水危机[2]。此外,湖泛发生过程中还伴随着沉积物中磷的释放与迁移转化[6-7]。有研究表明,蓝藻厌氧分解引起的藻源性湖泛会改变水体和沉积物的理化性质,直接或间接地加剧了沉积物中还原性磷的溶解,导致沉积物中磷释放[8-9],如在蓝藻厌氧分解过程中,水体中的DO和沉积物氧化还原电位(ORP)下降,促进了沉积物中有机磷(Org-P)矿化,并导致铁结合态磷(BD-P)的还原性溶解,使得沉积物中的磷被释放到水体中[10-11]。
沉积物中的磷释放过程受到温度、pH、扰动、微生物代谢等多种因素的影响[12]。解磷菌(phosphate-solubilizing microorganisms,PSM)是沉积物微生物群落中的重要类群之一,在磷释放过程中发挥着重要作用[13]。PSM能够将不溶性磷酸盐溶解为游离正磷酸盐[14],为藻类生长提供重要的磷元素来源[15]。PSM广泛分布于河流、湿地、湖泊沉积物以及土壤等多种环境中[14,16-18],主要由细菌、少部分古菌和真菌组成。从属种上看,PSM主要包括芽孢杆菌属、假单胞菌属、不动杆菌属等[14]。从解磷机理角度,解磷菌可分为有机解磷菌(OPB)和无机解磷菌(IPB)。IPB能够产生酸性物质将沉积物中不溶性无机磷溶解为水溶性无机磷酸盐[13,16];OPB产生的磷酸水解酶能够将有机磷矿化为溶解态磷酸盐[19]。当前关于PSM相关特征基因的研究主要集中在IPB产酸和OPB分泌酶的相关基因,但由于解磷菌在解磷过程中分泌的酸和酶种类较多,编码基因也具有多样性,因此当前对解磷菌特征功能基因的认识还非常有限[20]。当蓝藻水华暴发时,沉积物中PSM相对丰度会明显增高,这些PSM将不溶性磷转化为可溶性磷,导致沉积物中内源磷向上覆水中大量释放,进一步加剧了藻类的生长繁殖[21]。此外,在蓝藻厌氧分解过程中,蓝藻附生的PSM通过自身的生长与代谢促进了沉积物-水界面处磷的释放与迁移转化[11,22]。因此,PSM对沉积物中内源磷的迁移、转化过程有重要的影响[23]。在富营养化湖泊中,以往的研究主要关注PSM群落结构及其对磷循环的影响[11,13,21],而当湖泛发生时,沉积物中PSM的群落结构特征以及与其他微生物相互作用尚不清楚。
本研究以太湖沉积物为研究对象,分别在湖泛期和非湖泛期于同一位点采集了上覆水和沉积物样品,监测了湖泛期和非湖泛期上覆水与沉积物中理化指标含量(浓度)变化,比较了沉积物中不同磷形态含量的差异,通过16S rRNA基因扩增子测序,研究了湖泛期与非湖泛期沉积物中微生物的群落结构。本研究分析了湖泛期间PSM相对丰度与沉积物中各种磷形态变化的相关性,比较了湖泛期与非湖泛期沉积物中PSM与其他微生物之间的相互作用。本研究有助于进一步阐明PSM在富营养化湖泊中磷循环中的重要作用,以期从功能微生物角度为突发性湖泛防治提供科学依据。
1 材料与方法
1.1 样品采集与保存
太湖为我国第三大淡水湖泊(30°55′40″~31°32′58″N,119°52′32″~120°36′10″E),水域面积2338 km2,平均水深1.9 m[24]。2019年6月11日,竺山湾附近的采样点(31°24′45″N,120°01′45″E)发生了湖泛(附图Ⅰ)。用取水器采集表层上覆水样品(水面下2 m处),将上覆水装入500 mL聚乙烯样品瓶中。使用柱状采样器采集底层上覆水和柱状沉积物样品。每根柱状沉积物代表一个平行样品,共三组平行。在4~6 h内将上覆水和沉积物样品运回实验室,立即测定上覆水中氨氮(NH3-N)、磷酸盐(PO3-4-P)、可溶性硫化物(∑H2S)、总氮(TN)和总磷(TP)浓度。以1 cm为一层将不同深度沉积物样品分别装入聚乙烯封口袋中。取部分新鲜沉积物样品于15 mL离心管中,10000 r/min离心0.5 min后取上清液,过0.45 μm滤膜,测定间隙水中NH3-N、PO3-4-P、∑H2S和硫酸根离子(SO2-4)浓度。此外,将部分沉积物自然风干后研磨,测定TN、TP、总有机碳(TOC)含量。剩余沉积物样品于-20℃保存,备用。湖泛发生1个月后(2019年7月15日),在同一采样点再次采集上覆水和沉积物样品,按照上述步骤处理样品。
1.2 上覆水与沉积物理化指标测定
现场使用多参数测量仪(YSI ProDss,USA)测定了采样点位上覆水中溶解氧(DO)浓度、pH、电导率和叶绿素a(Chl.a)浓度。上覆水及沉积物间隙水NH3-N浓度采用纳氏试剂分光光度法测定,PO3-4-P浓度采用钼酸铵比色法测定。在水样中分别加入碱性过硫酸钾,121℃消解30 min,再分别通过紫外分光光度法和钼酸铵比色法测定TN、TP浓度。∑H2S浓度采用亚甲基蓝比色法测定[25],SO2-4浓度通过离子色谱仪进行测定,TOC含量采用重铬酸钾-油浴法测定[25]。沉积物中各种磷形态通过多步连续提取法测定,分别用1 mol/L NH4Cl、0.11 mol/L Na2S2O4/NaHCO3、0.1 mol/L NaOH、0.5 mol/L HCl提取沉积物中可交换态磷(Ex-P)、铁结合态磷(BD-P)、铝结合态磷(Al-P)、钙结合态磷(Ca-P)、有机磷(Org-P),再用分光光度法测定各形态磷含量,最后用TP减去以上各步所提取的磷形态得到残渣磷含量(Res-P)[26]。
1.3 沉积物微生物群落结构分析
用来表征解磷菌的功能基因种类较多,使用某一种或几种引物无法全面识别沉积物中PSM类群[14,20]。本研究基于通用引物扩增来获得微生物群落组成,并结合已有研究中典型PSM的物种分类信息[14,20,27-29],以确定沉积物中主要PSM种属类群。具体操作如下:用试剂盒(PowerSoil@DNA,MOBIO)分别提取湖泛期与非湖泛期表层1~5 cm沉积物样品中的总DNA,使用纯化试剂盒(Sangon Biotech,China)进行纯化,并使用引物Eub341F和Univ907R进行16S rRNA基因片段的PCR扩增[30],然后使用NanoDrop 2000/2000c UV_Vis分光光度计(Thermo Scientific,Wilmington,DE,USA)测定提取的DNA浓度和纯度。DNA样品送测序公司进行Illumnina高通量测序。将序列相似度大于97%的归属为操作分类单元(OTUs),基于NT_v20200604、Silva138/18s和PR2_v4.5数据库进行比对,得到每个OTU所对应的物种分类信息,将已识别的菌种与前人研究结果进行比对,筛选出沉积物中主要的PSM类群。同时,将测定的微生物数据使用R.3.4.3中的Vegan包进行数据预处理、α多样性和相对丰度的计算,并在门和属水平上选择OTU数量排名前20的微生物进行β多样性分析;通过主成分分析(PCoA)研究不同样品中微生物群落的差异性,利用微生物网络共现图揭示PSM与其他微生物之间的相互关系。
1.4 统计分析
使用SPSS 20通过方差分析(ANOVA)确定统计显著差异。P<0.05认为相关性显著,使用Duncan法进行事后检验。
2 结果与讨论
2.1 上覆水与沉积物中理化因子变化情况
湖泛导致上覆水中∑H2S、NH3-N、TN、TP和PO3-4-P浓度明显升高(图1)。在非湖泛期,上覆水中未检出∑H2S,而当湖泛期,上覆水中∑H2S浓度达到1.28 mg/L(图1)。与非湖泛期相比,NH3-N浓度升高了约11倍;TP和PO3-4-P浓度分别从非湖泛期的0.12、0.08 mg/L升高到湖泛期的1.28和0.8 mg/L(图1)。参照中国国家环境监测中心的营养水平指数,湖泛期的水质指标均明显超过生态标准[31],对太湖的水生态系统构成了严重威胁。
湖泛期,沉积物中TP含量随深度(1~5 cm)增加而升高,而间隙水中PO3-4-P浓度随深度(1~3 cm)增加而降低(附表Ⅰ),这表明沉积物中的TP转化为PO3-4-P向上覆水中释放。在非湖泛期,沉积物中TP、PO3-4-P分布特征与湖泛期相反(附表Ⅰ)。以上结果表明,在湖泛期间沉积物成为水体中的磷 “源”,磷从沉积物向上覆水中释放[9],而非湖泛期沉积物是水体中的磷 “汇”,磷从上覆水向沉积物中汇集。此外,湖泛期1~5 cm沉积物间隙水中∑H2S和NH3-N平均浓度分别是非湖泛期的1.4倍和47.5倍。
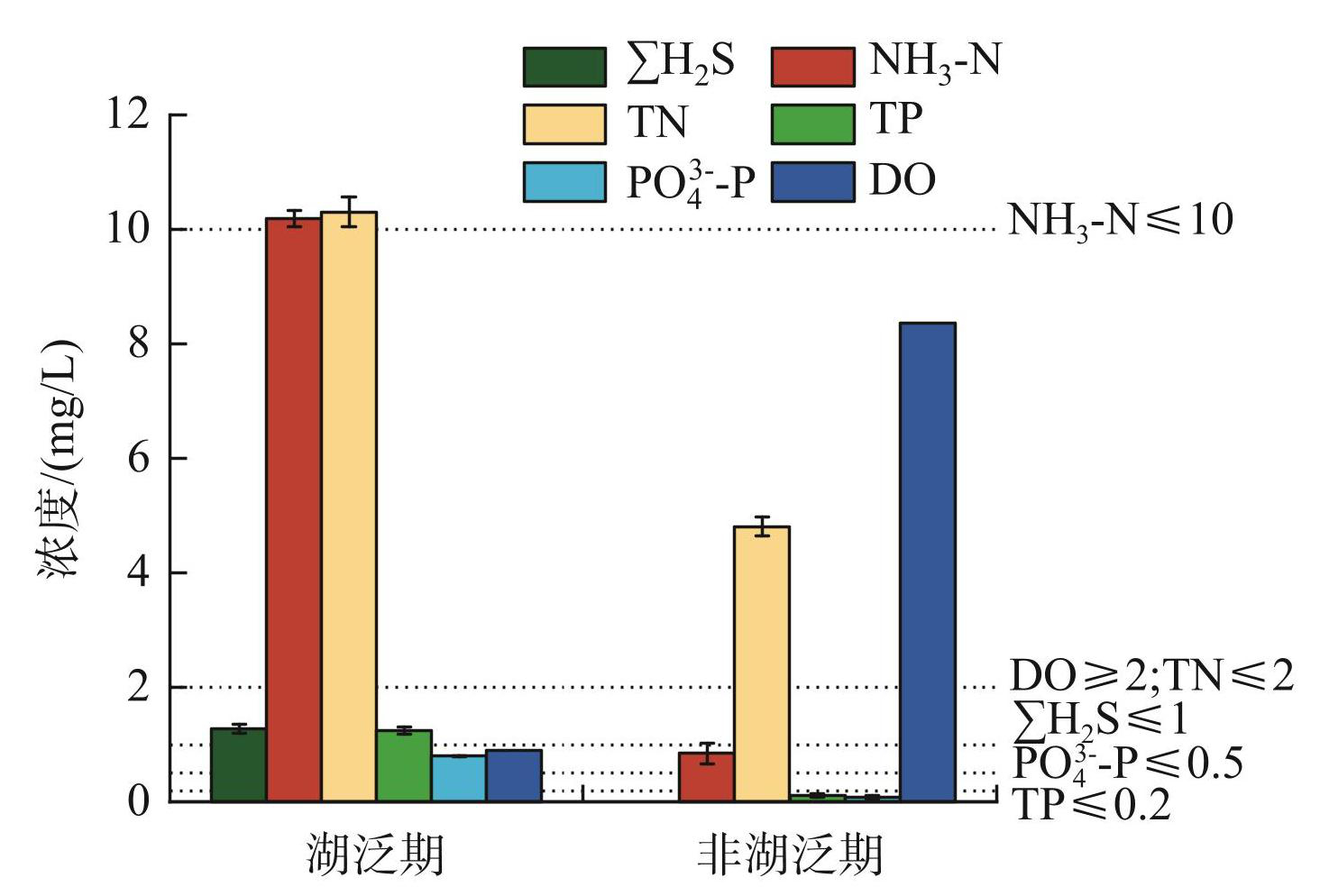
图1湖泛期与非湖泛期上覆水中主要环境因子变化 (虚线表示湖泊富营养化评价指标,每个样品设置3个平行)
Fig.1Main physicochemical parameters in the surface water during black bloom and the non-black bloom periods (Dotted lines indicated lake eutrophication evaluation index, and experiments were performed in triplicate)
2.2 湖泛期与非湖泛期沉积物磷形态的变化
湖泛期沉积物的BD-P、Ca-P在磷释放过程中发挥了重要作用(图2)。湖泛期1~5 cm沉积物中,BD-P平均含量相较于非湖泛期下降了约55.36%。蓝藻厌氧分解为铁还原细菌提供了充足的有机底物,促进沉积物中Fe(Ⅲ)还原为Fe(Ⅱ),导致部分BD-P溶解并释放到水体中[32-34]。相较于湖泛期,非湖泛期沉积物中Al-P含量均值更高(图2)。无论湖泛期还是非湖泛期,Al-P在不同深度沉积物中含量明显变化(图2)。此外,非湖泛期沉积物中Ca-P的平均含量(242.3 μg/g)也明显高于湖泛期(约122.4 μg/g)。从空间分布来看,湖泛期Ca-P更多地分布于深层沉积物中,而非湖泛期沉积物中Ca-P含量总体上随着深度增加而逐渐降低。虽然Ca-P被认为是沉积物中相对稳定的磷形态[13],但是本研究结果表明Ca-P也是湖泛期沉积物中被释放的主要磷形态之一。此外,湖泛期间藻类沉降和死亡导致沉积物中有机物含量增多,促进了表层沉积物中Org-P的累积[35]。如图2所示,湖泛期1~5 cm沉积物中,Org-P平均含量比非湖泛期高出约39.0%。
2.3 微生物群落多样性变化
基于通用引物扩增来获得微生物群落组成,然后结合已有研究中典型PSM的物种分类信息,最终确定沉积物中几种典型的丰度较高的PSM种属类群(附图Ⅱ,图3)。水华的生消影响着PSM的群落结构,在太湖水华期间优势PSM属为不动杆菌属(Acinetobacter)和假单细胞菌属(Pseudomonas),并伴随着水华的消亡其丰度也随着下降[20]。本研究中,湖泛期主要PSM菌属为不动杆菌属、鞘氨醇杆菌属(Novosphingobium)和黄杆菌属(Flavobacterium)。蓝藻降解促进了沉积物中解磷细菌的生长繁殖[20],导致湖泛期沉积物中PSM相对丰度明显高于非湖泛期。比如,湖泛期不动杆菌属在1~5 cm沉积物中的平均相对丰度达到了0.92%(图3a),远高于非湖泛期(图3b)。同时,PSM主要分布在表层1~2 cm沉积物中(图3)。湖泛期沉积物中PSM的相对丰度从1 cm处的3.30%±0.05%下降到5 cm处的1.74%±0.01%(图3a),而非湖泛期不同深度沉积物中PSM的相对丰度均未超过0.8%(图3b)。
有研究表明,不动杆菌属细菌是典型的OPB[36],能够在厌氧环境中持续分解体内的聚磷酸盐产生ATP,并将该过程所产生的PO3-4释放出来[37-38],湖泛的发生使得水环境处于厌氧状态(图1),为不动杆菌属提供了适宜的生存环境。黄杆菌属是一类IPB,能够以有机磷底物作为碳源和磷源,并在利用有机磷底物过程中释放PO3-4 [39]。湖泛期,沉积物中大量的Org-P为黄杆菌属的生长繁殖提供了充足的底物(图2),促进其生长繁殖。当湖泛消亡后,沉积物中有机磷减少,黄杆菌属的相对丰度也随之减少(图3b)。鞘氨醇杆菌属细菌是一种典型的OPB,能够通过降解微囊藻毒素获得营养底物[40],湖泛期间大量的微囊藻为鞘氨醇杆菌属提供了充足的营养底物,这可能是导致其在湖泛期相对丰度高的原因之一。在本研究中湖泛的发生导致水质和微生物生存环境发生了剧烈变化,持续的厌氧环境和充足的含磷有机底物,为不动杆菌属、鞘氨醇杆菌属及黄杆菌属的微生物提供了适宜的生存条件,使之成为了湖泛期沉积物中主要的PSM类群。除了介导磷释放以外,部分PSM类群(如不动杆菌属、假单胞菌属等)还具有异养硝化及好氧反硝化等功能[36],湖泛期水体中充足的碳、氮源也可能是促进PSM生长繁殖的重要原因之一。
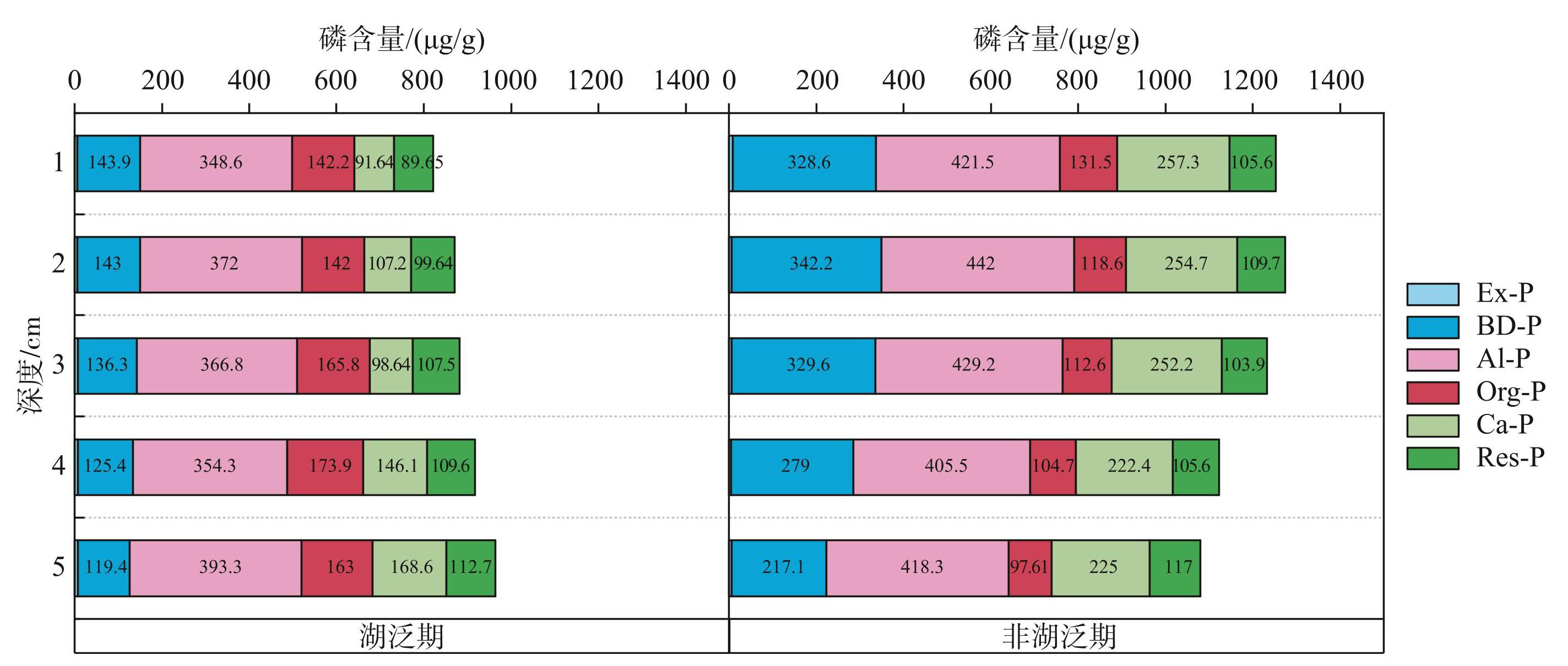
图2湖泛期与非湖泛期沉积物中不同形态磷含量
Fig.2Content of different fractions of phosphorus in sediments during black bloom and non-black bloom periods
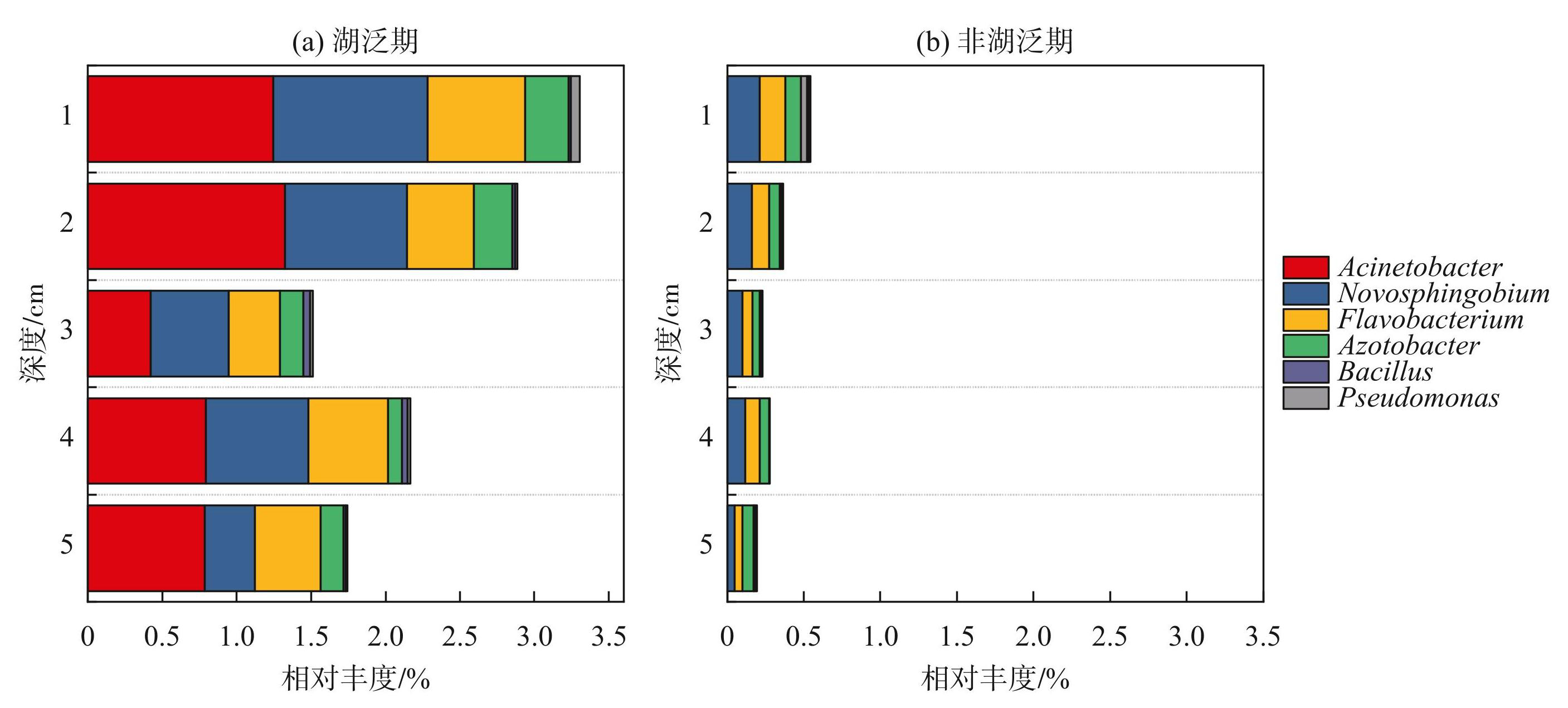
图3湖泛期(a)与非湖泛期(b)主要PSM属在不同深度沉积物中的相对丰度分布 (平均相对丰度大于0.05%)
Fig.3The relative abundance distribution of the main PSM genera under different depths of sediment during black bloom (a) and non-black bloom (b) periods (Average relative abundance >0.05%)
2.4 PSM对沉积物中不同磷形态的影响
线性回归分析表明,湖泛期沉积物中PSM相对丰度与沉积物中PO3-4-P浓度呈正相关,与TP呈负相关(附表Ⅱ),这说明在湖泛过程中,PSM的代谢促进了沉积物中内源磷向上覆水的释放。不同PSM对磷形态的释放具有选择性,磷释放潜能也存在差异,且受到外界环境的影响[13]。湖泛期,虽然固氮杆菌属的相对丰度在PSM种群中是最低(图3a),但与Ca-P含量的相关性最强(-0.843);而相对丰度第三的黄杆菌属与Ca-P含量的相关性却最低(-0.698)(图4)。同样地,相对丰度最低的芽孢杆菌(Bacillus)与Org-P含量的相关性却不是最低(图4)。因此,在湖泛过程中,不同属的PSM对各形态磷含量的影响程度与PSM本身的相对丰度没有必然联系。
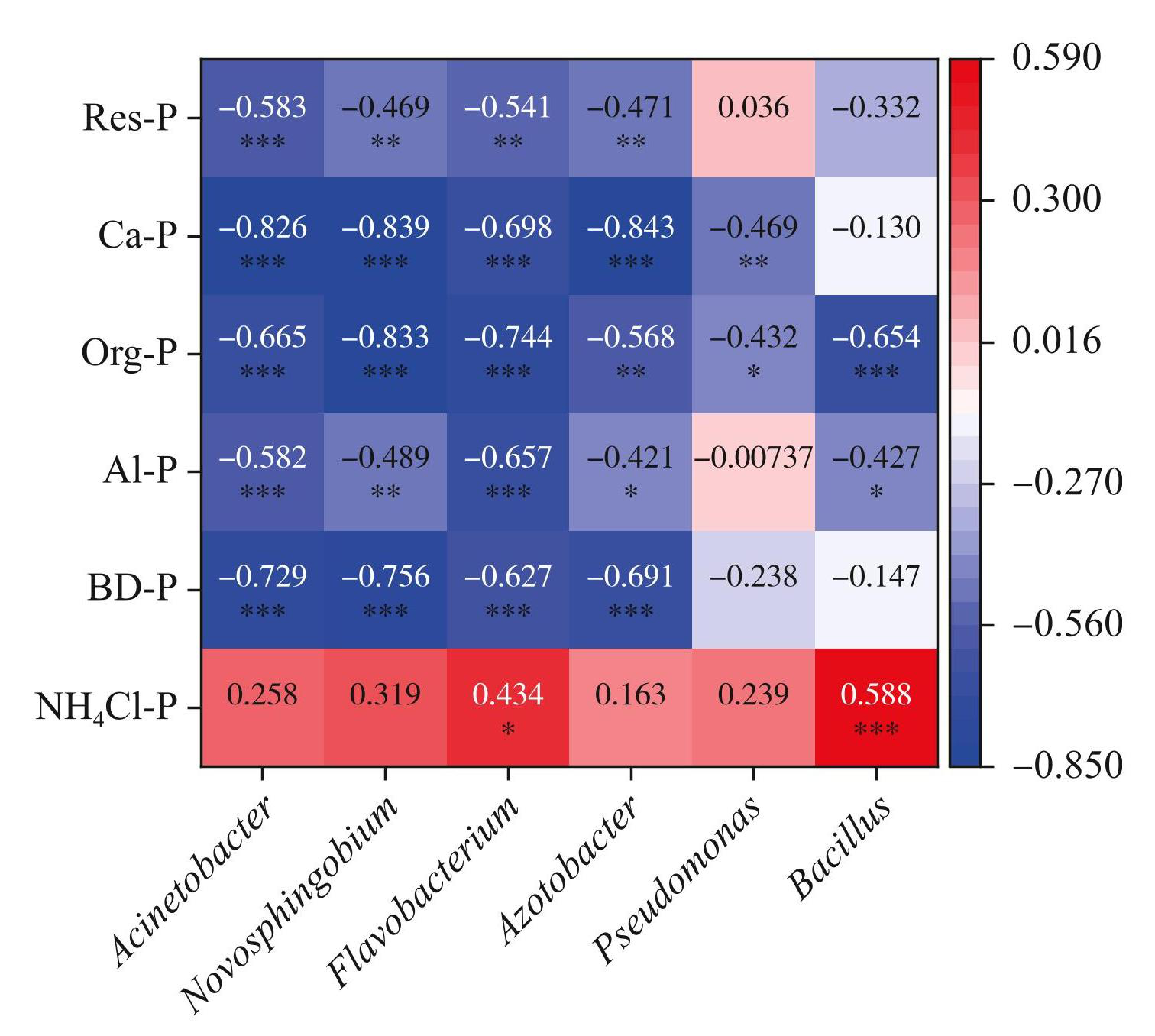
图4湖泛期PSM与各种磷形态含量的相关性热图 (*表示P<0.05,**表示P<0.01,***表示P<0.001,未标注表示P>0.05)
Fig.4Heatmap of correlation between PSM and content of various phosphorus fractions based on correlation analysis during black bloom period(* indicated P<0.05, ** indicated P<0.01, *** indicated P<0.001, and unmarked indicated P>0.05)
湖泛期与非湖泛期沉积物中主要PSM菌属的相对丰度与沉积物间隙水中PO3-4浓度的变化趋势一致(附表I),这表明在蓝藻水华厌氧分解过程中,PSM在沉积物的磷释放中发挥了重要作用。具体来看,湖泛期时PSM主要影响了Ca-P与Org-P的释放,而对NH4Cl-P、Res-P等其他磷的释放并无显著影响。如图5所示,主要的PSM属与Ca-P、BD-P和Org-P呈现显著负相关,如湖泛期丰度最高的不动杆菌属与Ca-P、BD-P和Org-P的相关性系数分别为-0.826、-0.729和-0.665。一般认为Ca-P是沉积物中较稳定的磷形态,但是本研究表明Ca-P是湖泛期释放的主要磷形态之一(图4)。有研究表明,PSM对Ca-P的释放与较低的pH有关[41-42]。此外,部分PSM产生的有机酸还能通过螯合作用溶解Ca-P从而释放[13,43]。湖泛期沉积物中的Org-P含量更高的原因可能是PSM释放了部分有机磷,但是蓝藻水华的厌氧分解会产生更多的Org-P,最终导致了Org-P的累积(图2)。因此相较于非湖泛期Org-P与PSM变化趋势一致,但在湖泛期通过分析不同种类PSM与不同形态磷之间的相关性可以发现,PSM与Org-P含量呈现显著负相关(图4),此前的研究也发现部分IPB会利用有机磷作为营养底物代谢以释放部分Org-P[39]。研究发现PSM在湖泛期对于沉积物中BD-P的释放会有一定的影响[44-46],虽然本研究中BD-P含量与大部分PSM均呈现负相关(图4),但目前PSM对于BD-P的释磷机理及影响因素尚不清楚,值得后续进一步研究[20]。
2.5 湖泛期与非湖泛期PSM与其他功能微生物的相互作用
湖泛期沉积物中微生物群落网络的图密度、边数和平均聚类系数、正相关连接率均低于非湖泛期,但是模块化指数和网络直径大于非湖泛期(附表Ⅱ),这表明湖泛的发生降低了沉积物中微生物群落网络的复杂性。湖泛期,PSM是沉积物微生物共存网络图中的重要特征节点之一,且不同属PSM相互连的邻居节点数量和种类明显不同(图5a)。比如,湖泛期相对丰度第二的鞘氨醇杆菌属的正相关节点数为6个,而相对丰度最低的固氮杆菌有18个正相关节点(图5a)。如图6所示,固氮杆菌属是湖泛期与不动杆菌属联系最紧密的菌属,但与鞘氨醇杆菌属和黄杆菌属没有明显相关性。除具备解磷功能之外,不动杆菌属还被认为具有异养硝化能力[36,47],推测在湖泛过程中固氮杆菌通过生物固氮为不动杆菌属提供了NH+4,促使两者之间作用紧密。然而,鞘氨醇杆菌属、黄杆菌属等PSM不具备利用NH+4的异养硝化能力[36,47],导致这些PSM类群与固氮杆菌属相互作用不显著(P>0.05)(图6)。此外,脱硫杆菌属(Desulfatiglans)是湖泛期固氮杆菌属、不动杆菌属的主要负相关节点,但与鞘氨醇杆菌属和黄杆菌属也没有明显相关性(图7)。以上结果表明,不同属的PSM在微生物群落中的生态作用存在差异,PSM与多种微生物共同参与了湖泛期沉积物中内源磷的释放过程。
图5湖泛期(a)与非湖泛期(b)的微生物网络共现图(节点的颜色代表微生物所属的门,每个节点的大小与相对丰度呈正比。红色和绿色线分别表示正、负相关连接,箭头标注为PSM)
Fig.5The co-occurrence network diagrams of microbial communities during black bloom period (a) and non-black bloom period (b) (Each node's color represents the phylum it belongs to. The size of each node is proportional to the relative abundance. Red and green lines indicate positive and negative connections, respectively. The arrows represent the PSM genera in the network)
一方面,湖泛期沉积物中PSM的主要正相关节点为反硝化细菌与发酵细菌。比如,在不动杆菌属和鞘氨醇杆菌属的主要正相关节点中,热单细胞菌属(Thermomonas)和土生单胞菌属(Thermomonas)为典型的反硝化细菌[48],产糖发酵菌属(Saccharofermentans)和脱氯单胞菌属(Dechloromonas)是典型的发酵细菌(图6)[49-53]。有研究表明,反硝化细菌等异养微生物在代谢分解有机物的过程中会导致环境维持厌氧状态,促进PSM的厌氧释磷过程[54];同时PSM释放的PO3-4为反硝化细菌的生长代谢提供了额外的磷源,进而增强了微生物反硝化的过程[54]。此外,发酵细菌对有机物的分解导致水体pH降低,也促进了OPB对不溶性无机磷的溶解[55]。因此,在湖泛期,发酵细菌、反硝化细菌与PSM的协同作用促进了沉积物中内源磷释放[56]。另一方面,PSM的主要负相关节点包括铁还原细菌(iron-reducing bacteria,IRB)与硫还原细菌(sulfate-reducing bacteria,SRB)。比如,厌氧粘细菌属(Anaeromyxobacter)、地温杆菌属(Geothermobacter)、脱硫杆菌属(Desulfobacca)、脱硫酸盐菌属(Desulfatiglans)是不动杆菌属等主要PSM的负相关节点(图6)[57-61]。尽管IRB和SRB的代谢导致沉积物中磷的释放[32],但湖泛期沉积物中主要的PSM与这些细菌呈负相关(图6),这表明PSM与IRB、SRB在沉积物内源磷释放过程中存在一定的竞争关系。当重度水华发生时,IRB与SRB介导的PO3-4解吸是沉积物中磷释放的主要原因之一,而在中度或者轻度水华条件下PSM的增溶作用是磷释放的主要途径[46]。因此,在富营养化湖泊中,当发生不同程度的湖泛时,PSM、IRB和SRB之间在沉积物中释放内源磷的竞争关系可能存在差异。
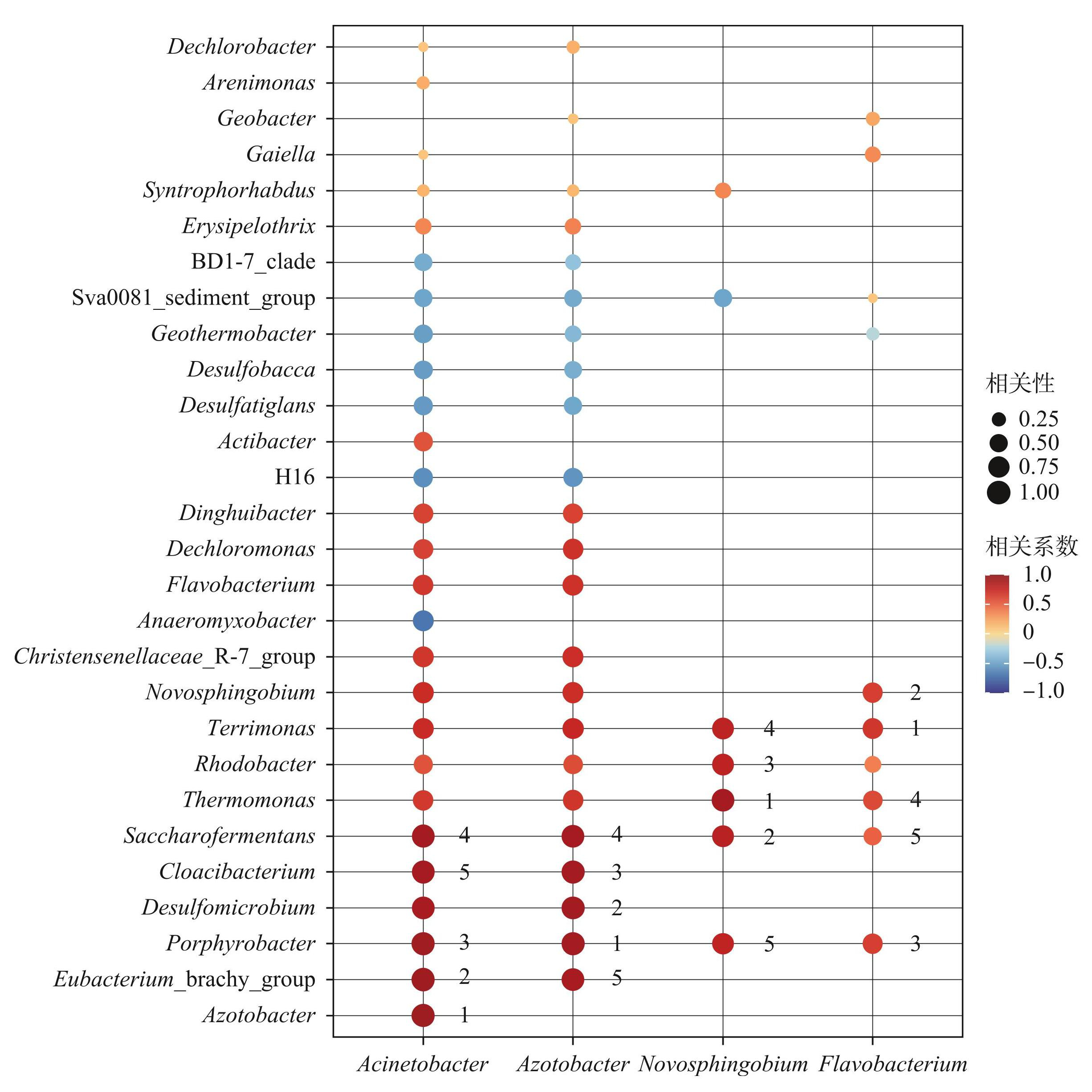
图6湖泛期微生物网络共现图中与PSM属关联最紧密的前5个相邻节点 (圆的大小与相邻节点的相对丰度呈正比,数字表示相邻节点与PSM之间相关系数的权重)
Fig.6The top 5 tightest neighbor nodes connected with PSM genera in the networks during the black bloom period (The size of the circle is proportional to the relative abundance of adjacent nodes, and the number represents the weight of the correlation between adjacent nodes and PSM)
在外源磷输入得到控制的情况下,沉积物中内源磷的释放成为湖泊中磷的重要来源。本研究结果表明,湖泛期,PSM是沉积物中内源磷释放的重要参与者。近年来,关于湖泛对淡水生态系统影响的研究主要依托室内模拟实验[9,16]。尽管室内模拟实验具有可重复及变量可控等优点,有助于明确不同变量之间的变化及关系,但无法完全重现自然水体中湖泛过程及其影响。本研究基于对原位湖泛样品的检测和分析,能够较为真实地反映PSM群落对突发性湖泛的响应特征及其对沉积物磷释放的影响。在富营养化湖泊中,湖泛能够持续数小时至数天不等,整个湖泛生消过程对PSM的影响仍需进一步研究。
3 结论
在富营养化湖泊中,湖泛的发生促进了表层沉积物中PSM的生长繁殖,主要的PSM包括不动杆菌属、鞘氨醇杆菌属和黄杆菌属。PSM释放的内源磷主要来自沉积物中的Org-P和Ca-P。不同PSM对各种磷形态的释放差异与细菌本身的相对丰度无直接联系。湖泛期PSM与发酵细菌和反硝化细菌协同作用促进了磷的释放,尤其是PSM与反硝化细菌的协同作用间接增强了PSM释放磷的能力。研究表明,PSM能够调整自身群落结构,并改变与其他细菌的相互作用来响应湖泛的发生。本研究有助于进一步理解湖泊沉积物内源磷释放的机理,揭示PSM对水环境剧烈变化的响应机制。
4 附录
附表Ⅰ~Ⅲ和附图Ⅰ~Ⅱ见电子版(DOI: 10.18307/2025.0221)。

