摘要
长江禁渔后,鄱阳湖凶猛性鱼类资源恢复明显,探究其在自然环境中的食物组成对预测鄱阳湖鱼类资源发展趋势具有重要意义。本研究于2022年8—11月期间,在鄱阳湖5个采样点(都昌、南矶山、鄱阳、余干和进贤)使用三层流刺网共采集了240尾鲇、乌鳢、鳜、翘嘴鲌样品,并分别使用胃含物分析法和eDNA宏条形码技术对上述4种凶猛性鱼类的食物组成进行分析。胃含物分析结果表明,4种鄱阳湖凶猛性鱼类鲇、乌鳢、鳜和翘嘴鲌的摄食率较高,空胃率低。鱼类在4种凶猛性鱼类的食物组成中占比较高,其次为虾类。鲇、乌鳢、鳜和翘嘴鲌的食物分别由5类10种、4类15种、3类11种和5类12种饵料生物组成,其中相对重要性指数百分比最高的饵料生物分别为鲫、鲫、 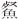 和鲤;鲫、鲤、泥鳅和日本沼虾均在4种凶猛性鱼类的肠道内容物中出现。基于eDNA宏条形码技术的饵料生物种类组成与胃含物分析结果相似,分别在鲇、乌鳢、鳜和翘嘴鲌的肠道内容物中发现了7、5、6和6种饵料生物,其中相对丰度最高的饵料生物分别为鲤、鲤、鲤和鲢。此外,本研究发现新的饵料生物存在,即团头鲂、似鳊、贝氏
和鲤;鲫、鲤、泥鳅和日本沼虾均在4种凶猛性鱼类的肠道内容物中出现。基于eDNA宏条形码技术的饵料生物种类组成与胃含物分析结果相似,分别在鲇、乌鳢、鳜和翘嘴鲌的肠道内容物中发现了7、5、6和6种饵料生物,其中相对丰度最高的饵料生物分别为鲤、鲤、鲤和鲢。此外,本研究发现新的饵料生物存在,即团头鲂、似鳊、贝氏 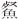 和黑尾近红鲌,这4种鱼并未在胃含物分析结果中检出。综上,长江禁渔后鄱阳湖的凶猛性鱼类的食物来源充足,食性范围广泛,其中鱼类是其主要的食物来源,其次为虾类。同时,胃含物分析法与eDNA宏条形码技术的结合能够更好地探究鱼类的食物组成,是综合分析鱼类食性的有效途径。
和黑尾近红鲌,这4种鱼并未在胃含物分析结果中检出。综上,长江禁渔后鄱阳湖的凶猛性鱼类的食物来源充足,食性范围广泛,其中鱼类是其主要的食物来源,其次为虾类。同时,胃含物分析法与eDNA宏条形码技术的结合能够更好地探究鱼类的食物组成,是综合分析鱼类食性的有效途径。
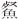 和鲤;鲫、鲤、泥鳅和日本沼虾均在4种凶猛性鱼类的肠道内容物中出现。基于eDNA宏条形码技术的饵料生物种类组成与胃含物分析结果相似,分别在鲇、乌鳢、鳜和翘嘴鲌的肠道内容物中发现了7、5、6和6种饵料生物,其中相对丰度最高的饵料生物分别为鲤、鲤、鲤和鲢。此外,本研究发现新的饵料生物存在,即团头鲂、似鳊、贝氏
和鲤;鲫、鲤、泥鳅和日本沼虾均在4种凶猛性鱼类的肠道内容物中出现。基于eDNA宏条形码技术的饵料生物种类组成与胃含物分析结果相似,分别在鲇、乌鳢、鳜和翘嘴鲌的肠道内容物中发现了7、5、6和6种饵料生物,其中相对丰度最高的饵料生物分别为鲤、鲤、鲤和鲢。此外,本研究发现新的饵料生物存在,即团头鲂、似鳊、贝氏 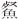 和黑尾近红鲌,这4种鱼并未在胃含物分析结果中检出。综上,长江禁渔后鄱阳湖的凶猛性鱼类的食物来源充足,食性范围广泛,其中鱼类是其主要的食物来源,其次为虾类。同时,胃含物分析法与eDNA宏条形码技术的结合能够更好地探究鱼类的食物组成,是综合分析鱼类食性的有效途径。
和黑尾近红鲌,这4种鱼并未在胃含物分析结果中检出。综上,长江禁渔后鄱阳湖的凶猛性鱼类的食物来源充足,食性范围广泛,其中鱼类是其主要的食物来源,其次为虾类。同时,胃含物分析法与eDNA宏条形码技术的结合能够更好地探究鱼类的食物组成,是综合分析鱼类食性的有效途径。Abstract
After the closure of fishing in the Yangtze River, the recovery of carnivorous fish resources in Lake Poyang has been significant, and exploring their dietary composition in the natural environment is crucial for predicting the development tendency of fish resources in Lake Poyang. This study collected 240 specimens of Silurus asotus, Channa argus, Siniperca chuatsi, and Culter alburnus with three-layer drift gillnet at five sampling sites (Duchang, Nanjishan, Poyang, Yugan and Jinxian) in Lake Poyang from August to November 2022. The dietary composition of four fierce fish species mentioned above was analyzed using stomach content analysis and eDNA Metabarcoding technology. The results of Stomach content showed that these fish species had a high feeding rate and a low empty stomach rate. Fish constituted a significant part of their diet, followed by shrimp. The diets of S. asotus, C. argus, S. chuatsi, and C. alburnus consisted of prey from 5 categories and 10 species, 4 categories and 15 species, 3 categories and 11 species, and 5 categories and 12 species, respectively, with the highest IRI% prey being Carassius auratus, C. auratus, Hemiculter leucisculus, and Cyprinus carpio, respectively. C. auratus, C. carpio, Misgurnus anguillicaudatus, and Macrobrachium nipponense were found in the intestinal contents of all four fierce fish species. The species composition of prey organisms based on eDNA Metabarcoding technology is similar to the results of stomach contents analysis, identifying 7, 5, 6, and 6 prey species in the gut contents of S. asotus, C. argus, S. chuatsi, and C. alburnus, respectively, with C. carpio, C. carpio, C. carpio, and Hypophthalmichthys molitrix having the highest relative abundance. Additionally, eDNA Metabarcoding technology revealed new prey species not detected in stomach content analysis, including Megalobrama amblycephala, Pseudobrama simoni, Hemiculter bleekeri, and Ancherythroculter nigrocauda. In summary, after the fishing ban in the Yangtze River, the predatory fish in Lake Poyang have an abundant food supply and a wide diet range, with fish being their primary food source, followed by shrimp. And the combination of stomach content analysis and eDNA Metabarcoding technology allows for a more comprehensive investigation of fish diets, making it an effective approach for analyzing fish feeding habits.
鄱阳湖是我国最大的淡水湖,位于长江中下游,是一个典型的江、河、湖泊复合生态系统[1]。受赣江、抚河、信江、饶河、修水“五河”等长江主要支流的影响,鄱阳湖水域面积在丰水期和枯水期表现出显著的季节性变化[2],即冬季枯水期水位低似“河”,夏季丰水期水位高为“湖”,这种变化极大地影响了湿地植被的分布和多样性,进而影响水生动物的生存及习性[3]。鄱阳湖复杂的生境孕育了丰富的水生生物资源并使其成为众多淡水肉食性鱼类的理想栖息地[4]。如鄱阳湖南矶山保护区有着丰富的鲇(Silurus asotus)、乌鳢(Channa argus)资源,在鄱阳湖湖区及“五河”入湖口均有捕获[5];鳜(Siniperca chuatsi)和翘嘴鲌(Culter alburnus)等凶猛性鱼类在鄱阳湖中广泛分布,是鄱阳湖中典型的凶猛肉食性鱼类[6]。然而由于滥捕、干旱和环境污染等因素的影响,鄱阳湖凶猛性鱼类资源曾一度萎缩明显,调查显示,鄱阳湖肉食性鱼类种类数量从1980年的55种减少至2020年的44种[7],其中南方大口鲇(Silurus meridionalis Chen)等凶猛性鱼类资源量显著减少。但自长江十年禁渔以来,鄱阳湖凶猛性鱼类资源呈现出持续上升的趋势。2021年调查结果显示,禁捕初期,鄱阳湖凶猛性鱼类的平均体长、体重均有不同程度地增加,其中鳜的增长率突出,凶猛性鱼类低龄化问题减轻,高龄鱼类数量明显增加[8]。
摄食是鱼类从外界获取能量的主要方式,是维持自身生长、发育和繁殖等生命活动的基础[9]。鱼类作为水生生态系统的主要组成成分,其食性是决定食物链上下游生物资源发展的关键性因素[10],同时,因摄食而形成的种内及种间的捕食、竞争等关系是决定鱼类群落演替的主要内部因素[11]。因此,鱼类食性研究对预测水生生物资源发展趋势及保护具有重要意义。
目前,研究鱼类食性的方法主要包括胃含物分析法[12]、稳定同位素分析法和eDNA宏条形码技术[13]等。胃含物分析法是利用解剖镜对捕食者尚未消化的胃含物进行鉴定分析,该方法仅能对较大或完整的食物碎片进行鉴定,对消化完全或呈液态的食物几乎无法鉴别[14]。而eDNA宏条形码技术则通过对生物体胃肠道内具有分类学信息的基因进行扩增,并使用基因测序仪得到大量物种的DNA信息,并与数据库进行比对,得到样品中存在的多个物种鉴定数据[15]。eDNA宏条形码技术可对形态学方法中无法鉴定的物种提供数据补充,两者相结合可显著提高样本利用率并增加胃含物中饵料生物的信息量[16]。
现阶段,关于鄱阳湖中凶猛性鱼类的食性研究较少,食性调查多集中于刀鲚(Coilia nasus)[17]、长江江豚(Neophocaena asiaeorientalis)[18]等资源量锐减甚至濒危的动物。同时,当前国内外食性分析研究对象大多针对单一物种,对具有相似习性的物种群体研究较少。并且,在凶猛性鱼类资源量持续增加的背景下,作为食物链顶端捕食者,凶猛性鱼类捕食活动是否会影响下游猎物的资源发展及鄱阳湖生态系统的平衡仍是未知。
为探究禁渔后鄱阳湖凶猛性鱼类的食物组成,本研究以鲇、乌鳢、鳜、翘嘴鲌为对象,分别使用胃含物分析法和eDNA宏条形码技术对鄱阳湖5个采样点采集的上述鱼类的肠道内容物进行定性和定量分析,探究其食物组成与摄食强度,揭示鄱阳湖凶猛性鱼类的食性和生态关系,以期为鄱阳湖渔业资源可持续发展提供理论依据。
1 材料与方法
1.1 样品采集
2022年8—11月,分别在鄱阳湖水域的5个采样点(图1),即都昌(29°26′N,116°07′E)、南矶山(28°55′N,116°29′E)、鄱阳(29°05′N,116°42′E)、余干(28°50′N,116°38′E)和进贤(28°51′N,116°13′E)采样点使用三层流刺网(网长100 m、网高2 m、网目7 cm)对鄱阳湖凶猛性鱼类进行随机采集,各采样点设置3个采样断面,各断面间隔1 km,采样时在各断面设置上述规格的网具,采样周期均控制在7 d左右,每日17:00放网,次日5:00收网。本研究共采集到鲇(Silurus asotus)、乌鳢(Channa argus)、鳜(Siniperca chuatsi)、翘嘴鲌(Culter alburnus)4种凶猛性鱼类,共240尾。
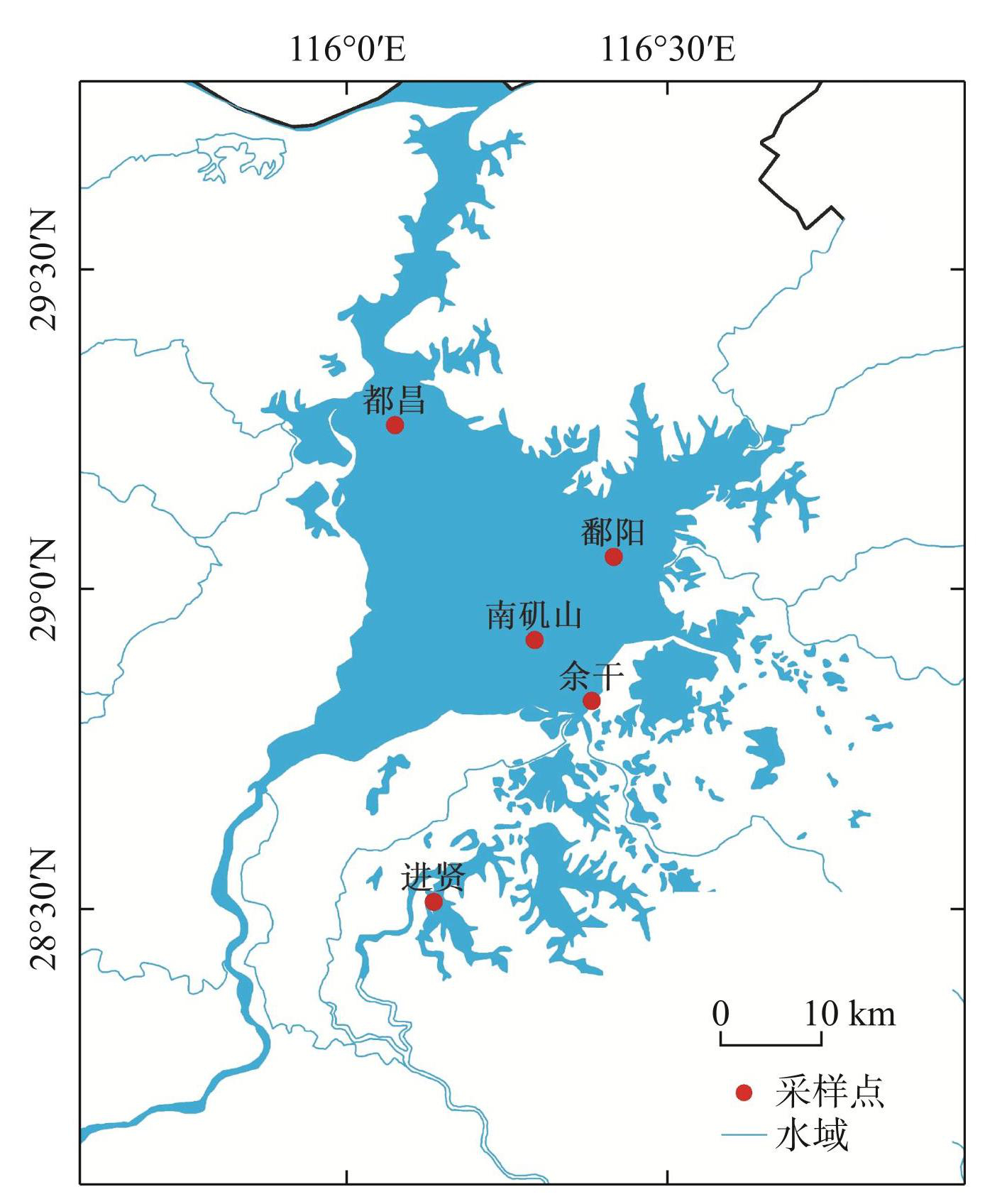
图1鄱阳湖凶猛性鱼类采样点位分布
Fig.1Distribution of sampling sites of ferocious fish in Lake Poyang
1.2 样品处理
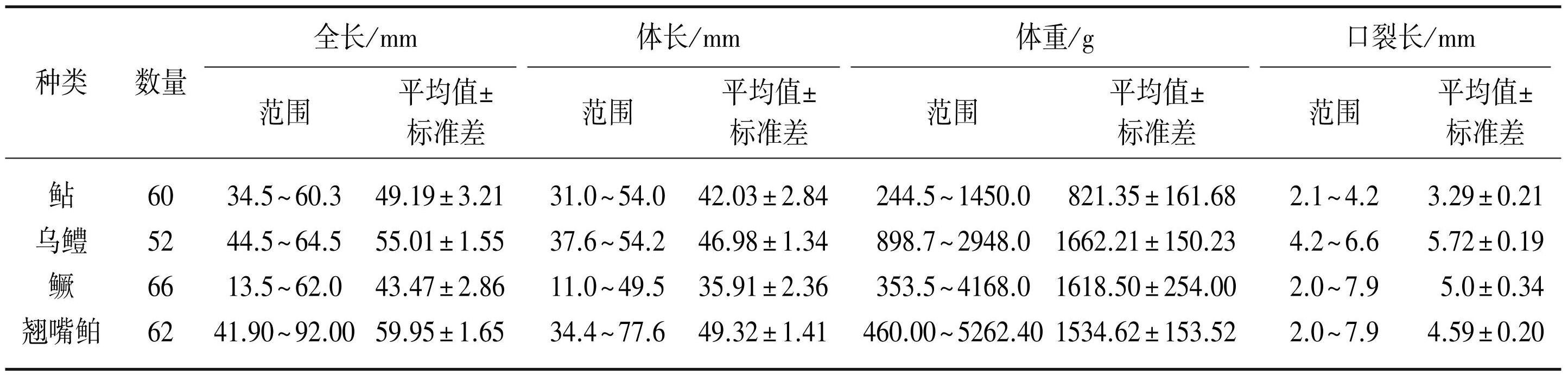
样品采集后放入低温保存箱内并立刻带回实验室,对鱼类进行常规形态学测量,包括全长、体长、体重、口裂长(表1)。迅速解剖并摘取鱼类胃肠道,测其胃肠道重量和摄食强度,摄食强度通过胃肠道的食物充塞度及饱满指数反映,评价标准根据胃肠道内食物所占体积大小分别将食物充塞度定义为1~5级。使用无菌解剖刀从胃肠道中提取内容物,并根据两种食性分析方法要求分别使用10%的福尔马林溶液及95%的乙醇溶液进行固定保存。
表1鄱阳湖凶猛性鱼类的全长、体长、体重、口裂长
Tab.1 Total length, body length, body weight and oral fissure length of fierce fishes in Lake Poyang
1.3 胃含物分析法
1.4 eDNA宏条形码技术
在无菌状态下取出整个肠道,并使用吸水纸擦干胃肠道表面水分,用无菌解剖刀解剖胃肠道并提取内容物于无菌离心管中,使用DNA快速提取试剂盒(FastDNA® Spin Kit for Soil,MP Biomedicals,America)并按照说明书进行肠道内容物总DNA的提取,DNA的质量与浓度使用分光光度法测定。检验合格后,使用扩增片段长度为180 bp的鱼类通用引物MiFish-U-F(序列:GTCGGTAAAACTCGTGCCAGC)和MiFish-U-R(序列:CATAGTGGGGTATCTAATCCCAGTTTG)对18S rDNA V4区域进行扩增,扩增总体系为20 μL:5×FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L的正、反向引物各0.8 μL,FastPfu聚合酶0.4 μL,BSA 0.2 μL,DNA模板10 ng,补ddH2O至20 μL。PCR扩增程序为95℃预变性3 min;95℃变性30 s,65℃退火30 s,72℃延伸45 s,进行30个循环;最后72℃稳定延伸10 min。
使用2%琼脂糖凝胶电泳、AxyPrep DNA Gel Extraction Kit和 QuantusTM Fluorometer对PCR产物进行检测、纯化和定量后,在Illumina测序平台进行测序,并将得到的下机数据通过原始筛选并除去嵌合体后得到有效序列。使用Uparse软件[21-22](http://drive5.com/uparse/,version 7.1),按照97%相似性对非重复序列(不含单序列)进行OTU聚类,并在聚类过程中去除嵌合体,得到OTU代表序列。后使用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析以得出饵料生物种类及其相对丰度。
1.5 数据处理与分析
胃含物分析法中评价饵料重要性的指标包括重量百分比(W%)、数量百分比(N%)、出现率(F%)、饱满指数(C%)、摄食率(S%),评价方法如下:
(1)
(2)
(3)
(4)
(5)
式中,Wi为某种饵料生物的实际重量,∑Wi为所有饵料生物总实际重量,Ni为某种饵料生物的数量,∑Ni为所有饵料生物总数量,Fi为包含某种饵料成分的肠道数,Ei为有食物的消化道数,Gi为内容物团的实际重量,W0为鱼体净体重,Si为有食物的消化道数,H0为所检视的总消化道数。
根据相对重要性指数(IRI)和相对重要性指数百分比(IRI%)来评估饵料生物的重要性,计算方法如下:
(6)
(7)
式中,∑IRI为所有食物的相对重要性指数之和。利用SPSS 27.0软件对结果进行方差分析,若P<0.05,认为存在显著性差异。
2 结果
2.1 4种凶猛性鱼类的摄食强度
4种凶猛性鱼类均有摄食,其中鲇和乌鳢的摄食率较高,分别为90.00%和92.31%;鳜和翘嘴鲌的摄食率较低,分别为66.67%和67.74%(表2)。鲇、乌鳢的肠道充塞度最高为4级,占比分别为10.00%和7.69%;鳜和翘嘴鲌的肠道充塞度最高为5级,占比分别为19.05%和3.23%。除鳜和乌鳢的饱满指数显著大于翘嘴鲌外(P<0.05),其余各凶猛性鱼类的饱满指数间无显著性差异(P>0.05)。
表24种凶猛性鱼类的肠道充塞度、捕食率和饱满指数*
Tab.2 Intestinal fullness grade, feeding rate and saturation index of four ferocious fishes
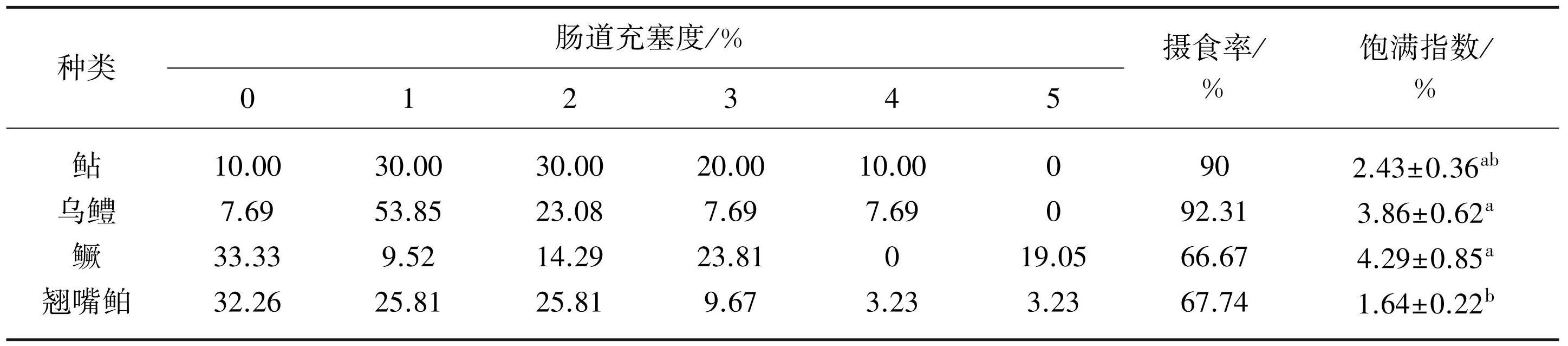
*上标不同小写字母表示组间存在显著性差异(P<0.05)。
2.2 基于胃含物分析法的4种凶猛性鱼类的食物组成
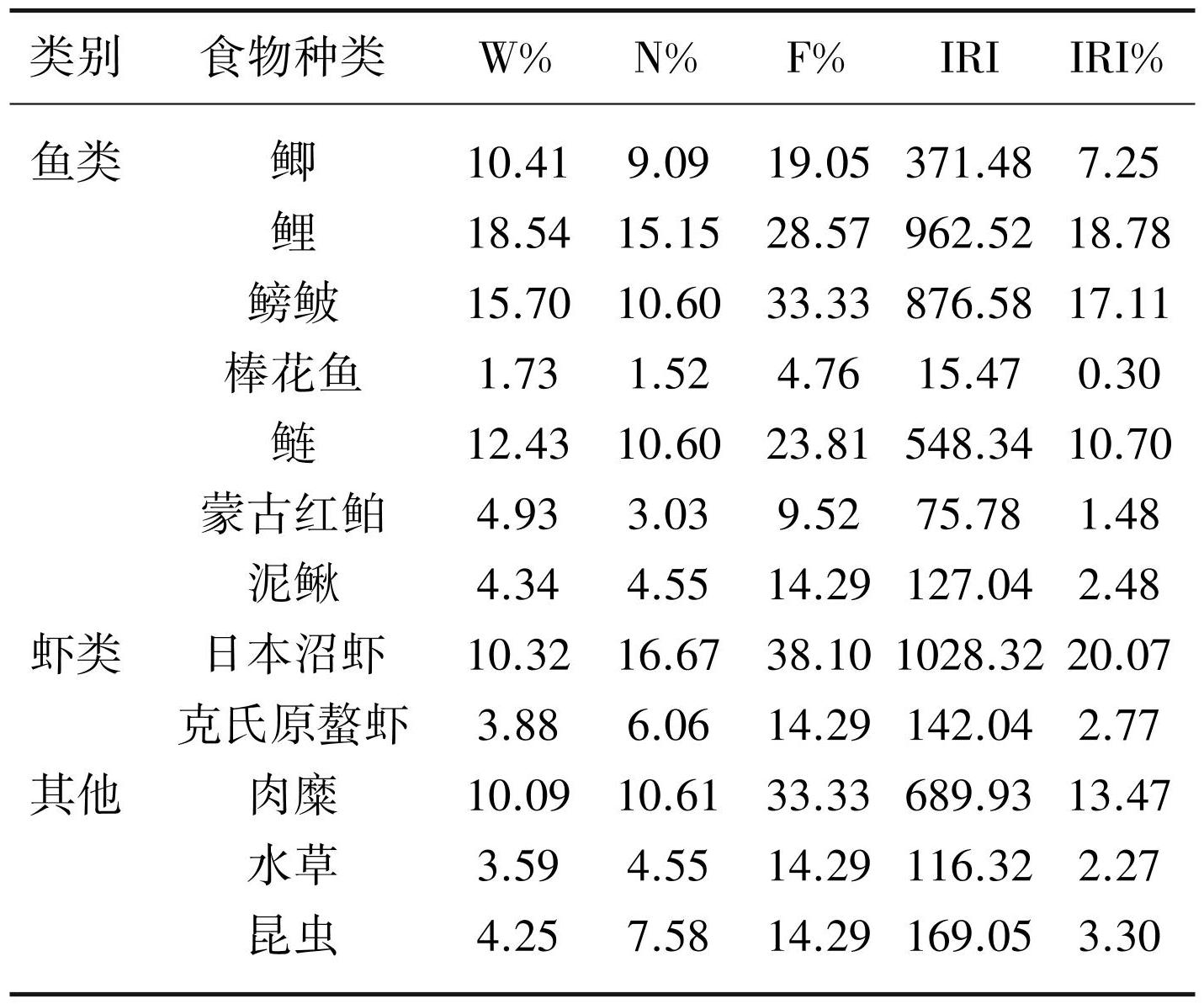
胃含物分析法结果显示,鲇的食物由鱼类、虾类、肉糜、水草和昆虫5类共10种饵料生物组成(表3)。W%、N%、F%和IRI% 4个指标均显示鱼类是鲇最主要的饵料生物类群,其中鲫(Carassius auratus)的W%、N%和IRI%最高,泥鳅(Misgurnus anguillicaudatus)次之;F%最高的鱼类为鲫和泥鳅,其次是麦穗鱼(Pseudorasbora parva)。W%、N%、F%和IRI%最低的鱼类为鲢(Hypophthalmichthys molitrix)。虾类在鲇食物组成占比中仅低于鱼类,其中日本沼虾(Macrobrachium nipponense)的W%、N%、F%和IRI%均大于克氏原螯虾(Procambarus clarkii)。其他3种类型的食物中,肉糜的食物占比最高;水草的食物占比最小。
乌鳢的食物由4类共15种饵料生物组成,包括鱼类、虾类、肉糜和昆虫,其中乌鳢、刺鳅(Mastacembelus aculeatus)、沙塘鳢(Odontobutis obscurus)和红鳍原鲌(Cultrichthys erythropterus)并未在其他3种凶猛性鱼类的肠道内容物中出现。W%、N%、F%和IRI%4个指标均表明鱼类是乌鳢最主要的食物来源,其中4个指标最高的鱼类为鲫;W%最小的鱼类为沙塘鳢,乌鳢的N%、IRI%最小,F%最小的鱼类为乌鳢和沙塘鳢(表4)。虾类是乌鳢食物占比中仅次于鱼类的生物类群,4个指标均表明日本沼虾在虾类食物中占据绝对优势。其他2种类型的食物中,肉糜的食物占比最高;昆虫的相对重要性差异较小。
表3鲇的食物组成
Tab.3 Food composition of S. asotus
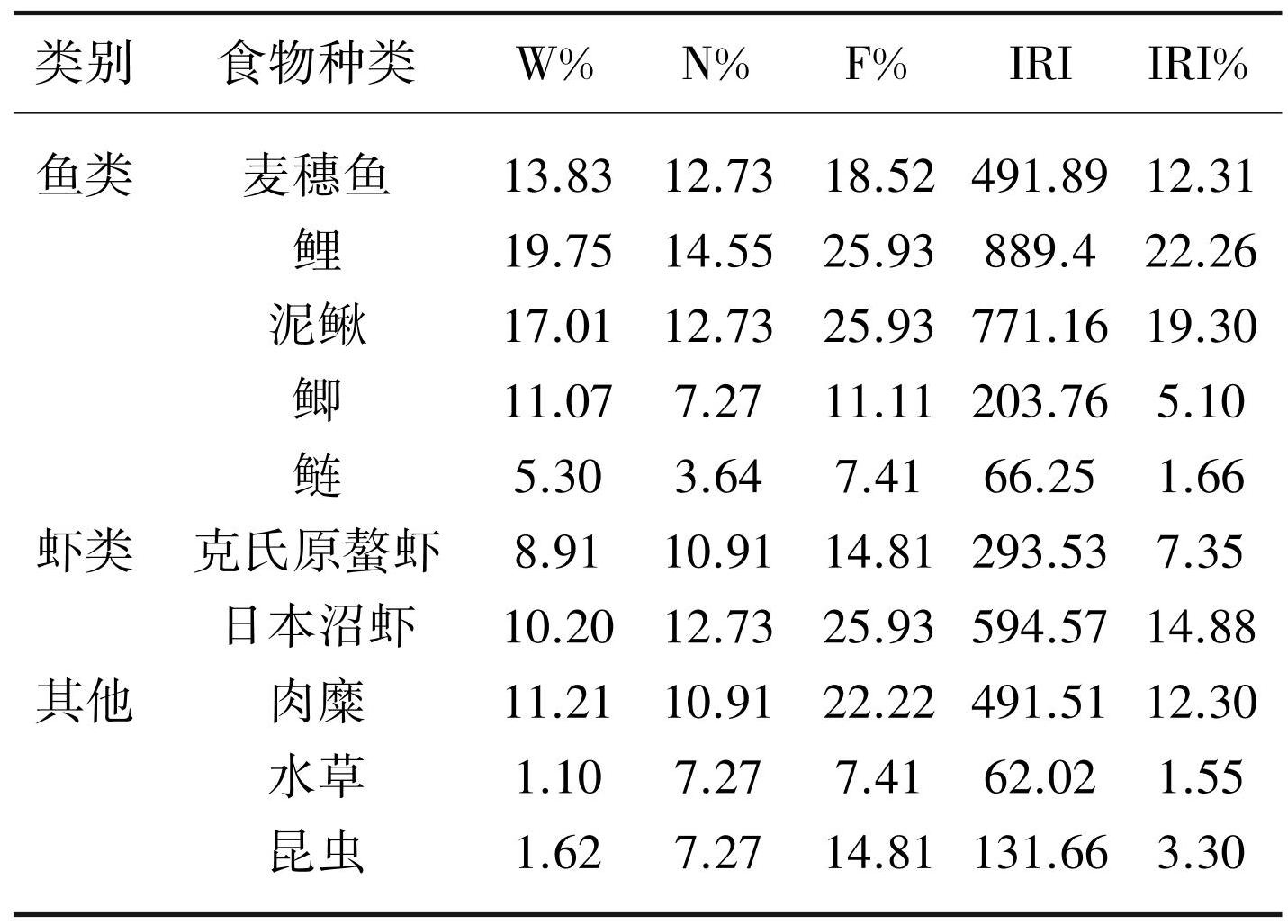
表4乌鳢的食物组成
Tab.4 Food composition of C. argus
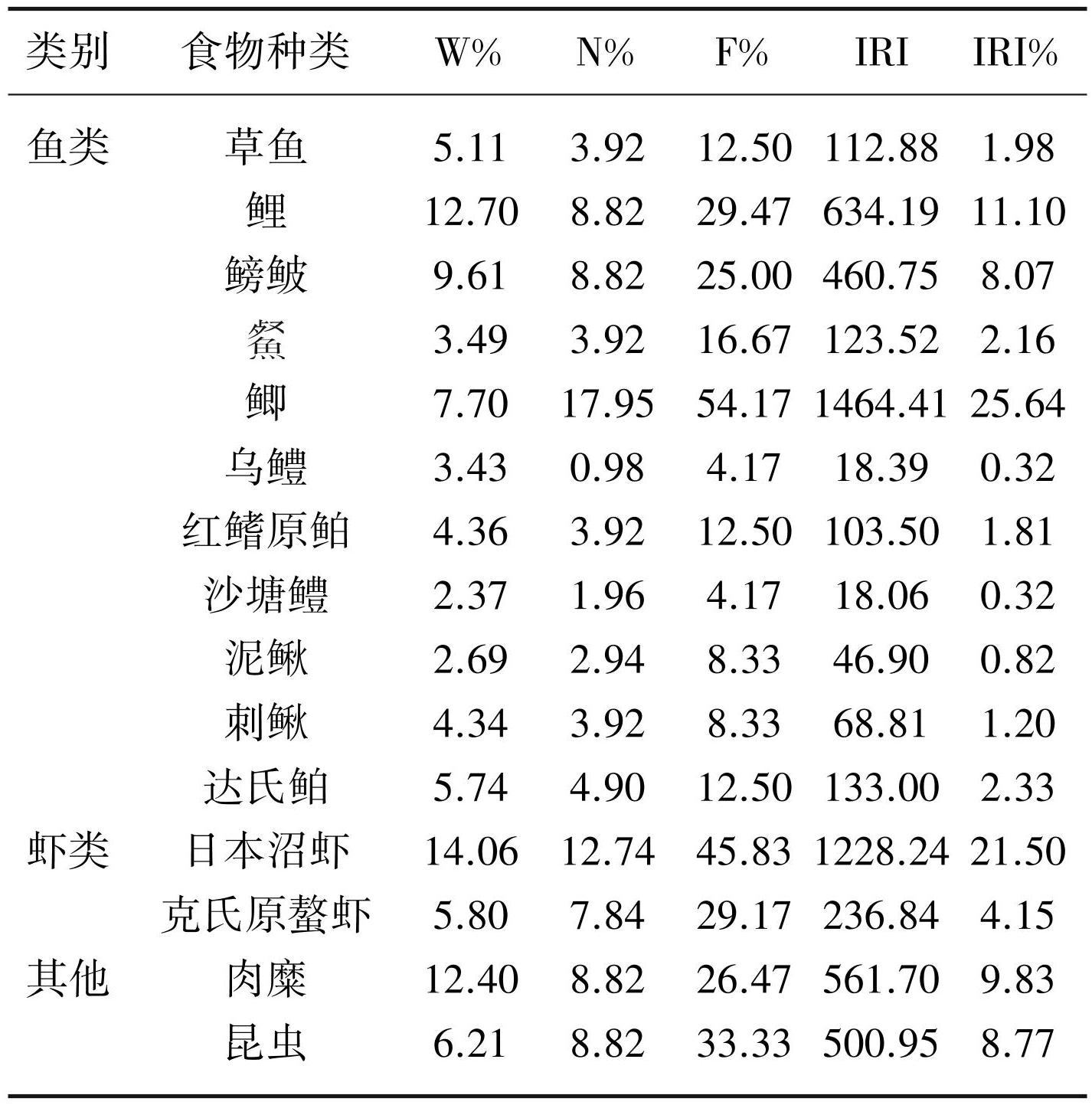
鳜的食物由3类共11种食物组成,包括鱼类、虾类和肉糜,其中鳙(Aristichys nobilis)、三角鲂(Megalobrama terminalis)仅在鳜的肠道内容物中发现(表5)。4个指标,即W%、N%、F%和IRI%均显示鱼类在鳜的食物组成中占优势,其中鲤(Cyprinus carpio)的W%最高,泥鳅的N%最高,F%和IRI%最高的鱼类为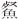 (Hemiculter leucisculus)。肉糜的食物占比次之,日本沼虾作为唯一种虾类饵料生物,其相对重要性与肉糜差异较小。
(Hemiculter leucisculus)。肉糜的食物占比次之,日本沼虾作为唯一种虾类饵料生物,其相对重要性与肉糜差异较小。
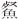 (Hemiculter leucisculus)。肉糜的食物占比次之,日本沼虾作为唯一种虾类饵料生物,其相对重要性与肉糜差异较小。
(Hemiculter leucisculus)。肉糜的食物占比次之,日本沼虾作为唯一种虾类饵料生物,其相对重要性与肉糜差异较小。
翘嘴鲌的食物组成结构与鲇相似,即共检出5类12种饵料生物,且仅在翘嘴鲌的肠道内容物中鉴定到蒙古红鲌(Culter mongolicus)和棒花鱼(Abbottina rivularis)(表6)。在鱼类饵料生物中,W%、N%和IRI%最高的鱼类为鲤;鳑鲏(Rhodeinae)的F%最高。虾类饵料生物中,日本沼虾的相对重要性(IRI%=20.07)均高于其他物种,而克氏原螯虾的相对重要性较低。其他3种类型的食物中,肉糜的食物占比最高;水草的食物占比最小,其相对重要性与昆虫差异较小。
2.3 基于eDNA宏条形码技术的肠道内容物
4种鄱阳湖凶猛性鱼类肠道内容物的测序结果表明,除去其自身序列后,共获得平均长度为176 bp共48964条有效序列。根据97%相似性聚类后共鉴定到1门1纲1目2科13属共15种饵料生物。
如图2a所示,共在鲇肠道内容物中鉴定到7种饵料生物,即鲤、麦穗鱼、似鳊(Pseudobrama simoni)、鲢、鳑鲏、团头鲂(Megalobrama amblycephala)和蒙古红鲌,其中鲤的相对丰度最高,为51.69%;麦穗鱼、似鳊和鲢之间的相对丰度差异较小,蒙古红鲌最低,为2.56%(表7)。在乌鳢的肠道内容物中共鉴定到5种饵料生物(图2b),包括鲤、达氏鲌(Chanodichthys dabryi)、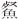 、泥鳅和鲢,其中鲤的相对丰度最高,为70.26%,达氏鲌和之间的相对丰度差异较小,鲢最低,为2.92%(表7)。鳜的肠道内容物中共鉴定到鲫、
、泥鳅和鲢,其中鲤的相对丰度最高,为70.26%,达氏鲌和之间的相对丰度差异较小,鲢最低,为2.92%(表7)。鳜的肠道内容物中共鉴定到鲫、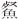 、鲢、鲤、三角鲂、达氏鲌6种饵料生物(图2c),其中鲢的相对丰度最高,为48.52%;其次为
、鲢、鲤、三角鲂、达氏鲌6种饵料生物(图2c),其中鲢的相对丰度最高,为48.52%;其次为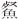 ;达氏鲌最低,为4.58%;翘嘴鲌的胃肠道内容物中共鉴定到鲤、泥鳅、
;达氏鲌最低,为4.58%;翘嘴鲌的胃肠道内容物中共鉴定到鲤、泥鳅、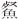 、贝氏
、贝氏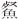 (Hemiculter bleekeri)、蒙古鲌、鳑鲏和黑尾近红鲌(Ancherythroculter nigrocauda)7种饵料生物(图2d),其中鲤的相对丰度最高,为43.64%;泥鳅次之;黑尾近红鲌最低,为2.52%(表7)。
(Hemiculter bleekeri)、蒙古鲌、鳑鲏和黑尾近红鲌(Ancherythroculter nigrocauda)7种饵料生物(图2d),其中鲤的相对丰度最高,为43.64%;泥鳅次之;黑尾近红鲌最低,为2.52%(表7)。
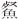 、泥鳅和鲢,其中鲤的相对丰度最高,为70.26%,达氏鲌和之间的相对丰度差异较小,鲢最低,为2.92%(表7)。鳜的肠道内容物中共鉴定到鲫、
、泥鳅和鲢,其中鲤的相对丰度最高,为70.26%,达氏鲌和之间的相对丰度差异较小,鲢最低,为2.92%(表7)。鳜的肠道内容物中共鉴定到鲫、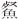 、鲢、鲤、三角鲂、达氏鲌6种饵料生物(图2c),其中鲢的相对丰度最高,为48.52%;其次为
、鲢、鲤、三角鲂、达氏鲌6种饵料生物(图2c),其中鲢的相对丰度最高,为48.52%;其次为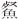 ;达氏鲌最低,为4.58%;翘嘴鲌的胃肠道内容物中共鉴定到鲤、泥鳅、
;达氏鲌最低,为4.58%;翘嘴鲌的胃肠道内容物中共鉴定到鲤、泥鳅、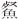 、贝氏
、贝氏 (Hemiculter bleekeri)、蒙古鲌、鳑鲏和黑尾近红鲌(Ancherythroculter nigrocauda)7种饵料生物(图2d),其中鲤的相对丰度最高,为43.64%;泥鳅次之;黑尾近红鲌最低,为2.52%(表7)。
(Hemiculter bleekeri)、蒙古鲌、鳑鲏和黑尾近红鲌(Ancherythroculter nigrocauda)7种饵料生物(图2d),其中鲤的相对丰度最高,为43.64%;泥鳅次之;黑尾近红鲌最低,为2.52%(表7)。
表5鳜的食物组成
Tab.5 Food composition of S. chuatsi

表6翘嘴鲌的食物组成
Tab.6 Food composition of C. alburnus
3 讨论
3.1 鄱阳湖4种凶猛性鱼类的摄食强度
个体发育程度、捕食能力和方式以及环境中饵料生物结构是影响鱼类摄食强度的重要因素,同时摄食强度的高低是鱼类对环境适应能力强弱的体现[23]。本研究中,采集自鄱阳湖湖区5个采样点的鲇、乌鳢、鳜和翘嘴鲌摄食率较高,空胃率较低。结合样本采集时间分析,8—11月鄱阳湖的水温较高[24],对鱼类而言,在适温范围内水温的升高会提升个体的代谢强度,增强鱼类的捕食欲望,从而导致鱼类的摄食率升高[25-26]。同时冬季饵料生物种类及数量会大幅减少,鱼类必须在此阶段进行捕食活动以应对即将到来的冬季,做好越冬准备[27]。4种鄱阳湖凶猛性鱼类中,鲇、乌鳢和翘嘴鲌的肠道充塞度较低,而鳜较高,并且鳜和乌鳢的饱满指数显著大于翘嘴鲌,该结果可能与鱼类的个体发育程度和捕食能力有关。随着鱼体生长,鱼类的食物多样性逐渐增加,摄食范围更广,食量更大。并且口裂大小也是限制鱼类捕食能力强弱的关键因素[28],本研究中鲇和翘嘴鲌体重、口裂均小于鳜和乌鳢,较小的口裂与体重会降低捕食者对猎物的捕食成功率,缩小捕食者的食物范围,并直接影响捕食者对猎物的捕食活动[29]。同时鲇、乌鳢和翘嘴鲌的交配及产卵时间均集中在4—9月[30],该阶段鱼类因交配和繁殖行为而导致捕食欲望受到抑制,进而影响摄食强度[31]。
3.2 基于胃含物分析法的4种鄱阳湖凶猛性鱼类的食性分析
鱼类的食物选择受自身需求、捕食能力和策略、环境条件差异以及饵料资源状况等因素影响,导致不同种类的鱼类食性间存在差异[32]。本研究中,4种鄱阳湖凶猛性鱼类的食性均呈现出以鱼类为主、虾类为辅、昆虫等其他生物为补充的组成模式,其中鲇、乌鳢、鳜和翘嘴鲌分别捕食了11、15、11和12种饵料生物,这与中国花鲈(Lateolabrax japonicus)[33]、达氏鲌[34]等凶猛性鱼类的食物组成相似,该结果可能与鱼类自身的摄食习性和捕食能力有关。在鲇和乌鳢的食物组成中,IRI%最高的鲫更受鲇和乌鳢的喜好;在鳜的食物组成中, 的IRI%最高;翘嘴鲌最喜好的饵料生物为鲤,这与谭北平[35]、杨代勤等[36]对太湖中乌鳢和鳜的食性研究结果保持一致。并且4种凶猛性鱼类的饵料生物较为集中,鲫、鲤、泥鳅、日本沼虾均在4种凶猛性鱼类的肠道内容物中出现,该结果与梁子湖中鲇、鳜等6种凶猛性鱼类的饵料相似性研究结果相吻合[37]。鄱阳湖鱼类资源组成结构是影响凶猛性鱼类食性的根本原因,有研究表明,鄱阳湖中鲤科鱼类占比最高,鲫、鲤、鳑鲏等鱼类也大量存在于鄱阳湖中[38]。同时长江禁渔后鄱阳湖流域持续的草鱼、鲫、鲤等鱼类的增殖放流使得鄱阳湖中对应的鱼类资源量迅速增加[39],未受过捕食威胁的放流鱼类的反捕食能力较弱,被凶猛性鱼类捕食的几率更大。在鲇、乌鳢和翘嘴鲌的胃含物中均发现有昆虫存在,这是因为鱼类的食性会随个体生长发生变化,个体较小的凶猛性鱼类多以昆虫、虾类为食[40]。而水草的出现则可能是凶猛性鱼类在进行捕食活动时连同周围的植物一同摄入所导致。鳜未捕食克氏原螯虾的原因可能与鳜的捕食方式和克氏原螯虾自身的反捕食能力效应有关,当克氏原螯虾感受到捕食者存在时会保持静止并利用环境遮蔽物躲避捕食者的攻击,降低了被鳜发现的几率[41]。
的IRI%最高;翘嘴鲌最喜好的饵料生物为鲤,这与谭北平[35]、杨代勤等[36]对太湖中乌鳢和鳜的食性研究结果保持一致。并且4种凶猛性鱼类的饵料生物较为集中,鲫、鲤、泥鳅、日本沼虾均在4种凶猛性鱼类的肠道内容物中出现,该结果与梁子湖中鲇、鳜等6种凶猛性鱼类的饵料相似性研究结果相吻合[37]。鄱阳湖鱼类资源组成结构是影响凶猛性鱼类食性的根本原因,有研究表明,鄱阳湖中鲤科鱼类占比最高,鲫、鲤、鳑鲏等鱼类也大量存在于鄱阳湖中[38]。同时长江禁渔后鄱阳湖流域持续的草鱼、鲫、鲤等鱼类的增殖放流使得鄱阳湖中对应的鱼类资源量迅速增加[39],未受过捕食威胁的放流鱼类的反捕食能力较弱,被凶猛性鱼类捕食的几率更大。在鲇、乌鳢和翘嘴鲌的胃含物中均发现有昆虫存在,这是因为鱼类的食性会随个体生长发生变化,个体较小的凶猛性鱼类多以昆虫、虾类为食[40]。而水草的出现则可能是凶猛性鱼类在进行捕食活动时连同周围的植物一同摄入所导致。鳜未捕食克氏原螯虾的原因可能与鳜的捕食方式和克氏原螯虾自身的反捕食能力效应有关,当克氏原螯虾感受到捕食者存在时会保持静止并利用环境遮蔽物躲避捕食者的攻击,降低了被鳜发现的几率[41]。
 的IRI%最高;翘嘴鲌最喜好的饵料生物为鲤,这与谭北平[35]、杨代勤等[36]对太湖中乌鳢和鳜的食性研究结果保持一致。并且4种凶猛性鱼类的饵料生物较为集中,鲫、鲤、泥鳅、日本沼虾均在4种凶猛性鱼类的肠道内容物中出现,该结果与梁子湖中鲇、鳜等6种凶猛性鱼类的饵料相似性研究结果相吻合[37]。鄱阳湖鱼类资源组成结构是影响凶猛性鱼类食性的根本原因,有研究表明,鄱阳湖中鲤科鱼类占比最高,鲫、鲤、鳑鲏等鱼类也大量存在于鄱阳湖中[38]。同时长江禁渔后鄱阳湖流域持续的草鱼、鲫、鲤等鱼类的增殖放流使得鄱阳湖中对应的鱼类资源量迅速增加[39],未受过捕食威胁的放流鱼类的反捕食能力较弱,被凶猛性鱼类捕食的几率更大。在鲇、乌鳢和翘嘴鲌的胃含物中均发现有昆虫存在,这是因为鱼类的食性会随个体生长发生变化,个体较小的凶猛性鱼类多以昆虫、虾类为食[40]。而水草的出现则可能是凶猛性鱼类在进行捕食活动时连同周围的植物一同摄入所导致。鳜未捕食克氏原螯虾的原因可能与鳜的捕食方式和克氏原螯虾自身的反捕食能力效应有关,当克氏原螯虾感受到捕食者存在时会保持静止并利用环境遮蔽物躲避捕食者的攻击,降低了被鳜发现的几率[41]。
的IRI%最高;翘嘴鲌最喜好的饵料生物为鲤,这与谭北平[35]、杨代勤等[36]对太湖中乌鳢和鳜的食性研究结果保持一致。并且4种凶猛性鱼类的饵料生物较为集中,鲫、鲤、泥鳅、日本沼虾均在4种凶猛性鱼类的肠道内容物中出现,该结果与梁子湖中鲇、鳜等6种凶猛性鱼类的饵料相似性研究结果相吻合[37]。鄱阳湖鱼类资源组成结构是影响凶猛性鱼类食性的根本原因,有研究表明,鄱阳湖中鲤科鱼类占比最高,鲫、鲤、鳑鲏等鱼类也大量存在于鄱阳湖中[38]。同时长江禁渔后鄱阳湖流域持续的草鱼、鲫、鲤等鱼类的增殖放流使得鄱阳湖中对应的鱼类资源量迅速增加[39],未受过捕食威胁的放流鱼类的反捕食能力较弱,被凶猛性鱼类捕食的几率更大。在鲇、乌鳢和翘嘴鲌的胃含物中均发现有昆虫存在,这是因为鱼类的食性会随个体生长发生变化,个体较小的凶猛性鱼类多以昆虫、虾类为食[40]。而水草的出现则可能是凶猛性鱼类在进行捕食活动时连同周围的植物一同摄入所导致。鳜未捕食克氏原螯虾的原因可能与鳜的捕食方式和克氏原螯虾自身的反捕食能力效应有关,当克氏原螯虾感受到捕食者存在时会保持静止并利用环境遮蔽物躲避捕食者的攻击,降低了被鳜发现的几率[41]。

图2鲇(a)、乌鳢(b)、鳜(c)、翘嘴鲌(d)的食物组成及相对丰度(种水平)
Fig.2Food composition and relative abundance of S. asotus (a), C. argus (b), S. chuatsi (c), and C. alburnus (d) (species level)
表74种凶猛性鱼类肠道内含物相对丰度
Tab.7 Relative abundance of stomach contents for four species of ferocious fishes

3.3 基于eDNA宏条形码技术的4种鄱阳湖凶猛性鱼类的食性分析
营养供应是影响鱼类生长发育的关键因素,也是影响环境渔业资源可持续发展的重要因子[42]。本研究中,基于eDNA宏条形码技术乌鳢、鳜和翘嘴鲌的鱼类种类组成与胃含物分析法相似,基于两种方法的共同饵料生物在eDNA结果中的占比分别为80.00%、83.33%和57.15%,而鲇仅为42.85%。在鲇、乌鳢、鳜和翘嘴鲌的肠道内容物中分别发现了7、5、6和6种饵料生物。其中,鲤在4种鄱阳湖凶猛性鱼类的肠道内容物中均有发现,并且鲇、乌鳢和翘嘴鲌对其摄食喜好度较高;鲢在鳜肠道内容物中的相对丰度最高,为48.52%,该结果与胃含物分析结果差异明显。鲤作为长江流域重要的经济型鱼类,喜好栖息于底层,从栖息环境及习性等方面比较,鲤被上述4种凶猛性鱼类大量捕食的可能性较低,本研究结果中鲤大量出现的原因可能与测序过程中鲤科鱼类序列相似度较高而导致的误判[43]及测序样本数量有限相关。测序结果中,团头鲂、似鳊、贝氏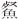 和黑尾近红鲌4种饵料生物并未在胃含物分析法中发现,这可能是由于部分肠道内容物以肉糜状态存在,难以使用胃含物分析法进行定性和定量分析[13]。黑尾近红鲌作为一种广泛分布于长江中上游地区的鱼类[44],近年来在江西省九江、赣州市等均有引进并进行人工繁育养殖[45],黑尾近红鲌越塘并流入鄱阳湖可能是本研究中翘嘴鲌胃含物发现其存在的原因之一。
和黑尾近红鲌4种饵料生物并未在胃含物分析法中发现,这可能是由于部分肠道内容物以肉糜状态存在,难以使用胃含物分析法进行定性和定量分析[13]。黑尾近红鲌作为一种广泛分布于长江中上游地区的鱼类[44],近年来在江西省九江、赣州市等均有引进并进行人工繁育养殖[45],黑尾近红鲌越塘并流入鄱阳湖可能是本研究中翘嘴鲌胃含物发现其存在的原因之一。
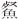 和黑尾近红鲌4种饵料生物并未在胃含物分析法中发现,这可能是由于部分肠道内容物以肉糜状态存在,难以使用胃含物分析法进行定性和定量分析[13]。黑尾近红鲌作为一种广泛分布于长江中上游地区的鱼类[44],近年来在江西省九江、赣州市等均有引进并进行人工繁育养殖[45],黑尾近红鲌越塘并流入鄱阳湖可能是本研究中翘嘴鲌胃含物发现其存在的原因之一。
和黑尾近红鲌4种饵料生物并未在胃含物分析法中发现,这可能是由于部分肠道内容物以肉糜状态存在,难以使用胃含物分析法进行定性和定量分析[13]。黑尾近红鲌作为一种广泛分布于长江中上游地区的鱼类[44],近年来在江西省九江、赣州市等均有引进并进行人工繁育养殖[45],黑尾近红鲌越塘并流入鄱阳湖可能是本研究中翘嘴鲌胃含物发现其存在的原因之一。
3.4 胃含物分析法和eDNA宏条形码技术在食性分析中的优劣比较
胃含物分析法[46]和eDNA宏条形码技术[14]是目前食性分析中应用最广泛的2种方法。胃含物分析法是通过对捕食者胃肠道中未消化完全的食物残渣进行定性和定量分析从而得到捕食者的食物组成[47],该方法能较为直观地了解捕食者的食物组成,鉴定偏差较小[48]。但对消化程度较高或呈液态的食物几乎无法分辨,进而影响食性分析结果,增加实验结果的偶然性。如本研究中4种凶猛性鱼类的肠道内容物中均出现了无法分辨的肉糜。并且胃含物种类鉴定耗费时间长,测定的单一指标对某种食物生态重要性的评价能力有限,且对操作人员的物种分类和鉴定能力要求较高[49]。而eDNA宏条形码技术可对胃含物分析法中无法鉴定的物种信息进行补充和校正[50],eDNA宏条形码技术的精准度高、鉴定范围广,可以准确地反映食物信息[51]。但对于不同类型的饵料生物需针对性地设计不同的特异性引物,并且使用不同的特异性引物进行测序会导致试验方法的复杂性和标准化难度增加,产生具有不同偏差的数据集,使得数据整合和分析复杂化[52]。在本研究中虾蟹类的特异性引物因其片段长度(710 bp)较长而无法应用于eDNA宏条形码技术中,这也是导致本研究中eDNA宏条形码技术的结果仅有鱼类饵料生物的具体原因。特异性引物的偏好性较强,即不同物种的特异性引物在PCR扩增过程中的扩增效率可能存在差异[53],并且不同物种的特异性引物可能出现交叉反应,导致非目标物种的DNA片段被扩增,影响测序结果的代表性和准确性,进而影响物种多样性的真实反应[54]。同时为排除鱼类自身DNA的干扰,在序列处理时会将捕食者自身的序列进行筛除,导致无法判断捕食者是否存在同类自食行为[52]。因此,在鱼类食性分析中,先利用胃含物分析法对饵料生物种类进行初步的定性分析,后利用eDNA宏条形码技术对内容物进行系统详尽的DNA分析,以获取全面的食物种类信息。两种方法的结合运用可提高食性分析结果的准确性和全面性,深入了解并剖析鱼类的食物网结构和生态关系,为鱼类食性研究提供更加丰富的数据支持。即胃含物分析法与eDNA宏条形码技术的结合运用是综合分析鱼类食物组成的有效途径,值得在后续研究中进一步探索。
4 结论
4种鄱阳湖凶猛性鱼类鲇、乌鳢、鳜、翘嘴鲌的摄食率较高,空位率较低;摄食食物包括鱼类、虾类、昆虫等,食物组成结构较为类似。其中鱼类在4种凶猛性鱼类的食物组成中占比最大,4种鄱阳湖凶猛性鱼类对鲫、鲤、鲢等鲤科鱼类和日本沼虾的摄食偏好性较高。这可能与禁渔后鄱阳湖生态环境改善,鱼类资源得到恢复有关,但仍需进一步研究证实。同时胃含物分析法和eDNA宏条形码技术在食性分析中的优势互补,两者结合运用能显著提升鱼类食物组成的分析效率。
致谢:感谢江西省水产科学研究所资源调查室在鱼类鉴别及调查提供的技术支持。
