摘要
河流具有独特且复杂的树枝状等级性网络拓扑结构,使得河流连通性和生境异质性在不同河网位置上存在明显差异。长期以来,河流生态系统通常被视为局部或线性结构进行研究,忽略了河网位置对群落构建等生态过程的影响。本研究以具有复杂网络结构和自然流态的赤水河为研究区域,探索了河流网络位置对底栖动物α、β多样性和群落构建过程的影响。其中,α多样性使用物种数、Shannon-Wiener多样性、Simpson多样性和Pielou均匀度指数来度量;β多样性使用Sørensen相异性指数(βsør)和Bray-Curtis相异性指数(dBC)来表征,并将其分割为置换和嵌套两种组分;群落构建过程采用冗余分析和变差分解来实现。结果显示:1) 赤水河全流域底栖动物群落主要受环境过滤驱动;2) 河流网络位置塑造着赤水河底栖动物的多样性格局和群落构建过程。河网中心的干流底栖动物群落主要受环境过滤的影响,而河网边缘的支流底栖动物群落则受到空间限制和环境过滤的共同作用,该发现质疑了河流网络位置假说(network position hypothesis, NPH)在赤水河流域的适用性;支流的α多样性明显高于干流,而干流的β多样性则显著高于支流;β多样性主要由置换组分构成,这表明尽可能多地保护不同位点和生境是维持底栖动物物种多样性的重要举措。本研究有助于深入理解复杂河网影响下底栖动物的物种共存和维持机制,为提出适用于我国亚热带季风区河网的新假说提供视角,为长江上游水生生物保护区选址和设计提供参考和依据。
Abstract
Rivers possess unique and complex branching hierarchical network topology, which leads to noticeable differences in connectivity and habitat heterogeneity across different sections of the river network. Historically, river ecosystems have been studied as local or linear structures, overlooking the influence of river network positions on ecological phenomena, such as community assembly. We focused on the Chishui River, which has a complex network structure and natural flow regime, to explore the effects of river network positions on species diversity (α and β diversity) and community assembly of macroinvertebrates. α diversity was measured using species richness, Shannon-Wiener diversity index, Simpson diversity index, and Pielou evenness index. β diversity was characterized using the Sørensen dissimilarity index (βsør) and Bray-Curtis dissimilarity index (dBC), which were further partitioned into turnover and nestedness components, respectively. Community assembly was assessed using Redundancy analysis (RDA) and associated variation partitioning. We found that: 1) Macroinvertebrate communities in the entire river basin are primarily regulated by environmental filtering. 2) River network positions affected the diversity patterns and community assembly processes in the Chishui River. Mainstream communities were primarily influenced by environmental filtering, while tributary communities were structured by both spatial constraints and environmental filtering. These findings challenge the applicability of the Network Position Hypothesis (NPH) in the Chishui River Basin. Additionally, α diversity was significantly higher in tributaries compared to the mainstream, whereas β diversity was significantly higher in the mainstream. β diversity of macroinvertebrate communities was mainly composed of turnover, suggesting that protecting different sites and habitats is crucial for maintaining regional species diversity. This study provides insights into the mechanisms of species coexistence and maintenance in benthic communities under the influence of complex river networks and contributes to the development of new hypotheses applicable to river networks in subtropical monsoon regions in China. It also provides reference and basis for site selection and design of biological protection zones in the upper reaches of the Yangtze River.
Keywords
群落构建机制是生态学中的核心问题之一,对理解生物群落的形成和丧失、生物多样性的保护和维持至关重要[1]。经典的生态位理论认为,环境过滤和生物间相互作用等确定性过程导致的共存物种间的生态位分化在群落构建中占主导地位[2];而Hubbell[3]提出的中性理论则认为生物个体的扩散和生态漂变等随机性过程是群落构建的决定因子。这两种理论既相互对立又互为补充,在过去二十多年间成为生态学领域的焦点[4-5]。如今,人们已认识到将两种理论进行整合可以更好地解释物种共存[6]。在这些理论的指导下,国内外学者积极投身到群落构建的探索中,开启了群落生态学研究的新时代[7]。然而,相比于陆生动植物,人们对河流生物群落构建的认识依然不足[8-10]。
河流具有独特和复杂的树枝状等级性网络拓扑结构,不同的河网位置有着迥异的水文连通度、隔离度和生境异质性,这些属性深刻影响着河流生物多样性格局与群落构建过程[11-13]。因此,处于不同河流网络位置(如干流和支流)上的群落,其组装机制可能存在差异。鉴于此,Brown等[14]对不同河网位置上的群落构建过程进行了预测;Schmera等[15]进一步对这一预测进行总结凝练,并命名为网络位置假说(network position hypothesis,NPH)。NPH假说认为:1)处于河流网络边缘、相对隔离且环境异质性高的源头/支流(低级别河流)群落,其构建过程主要受环境过滤主导;2)对于河流网络中心、连通度高的干流(高级别河流),由于物种在位点间频繁扩散和交流,环境过滤和群体效应共同作用于群落构建。尽管NPH进行了开创性的预测,并受到了许多生态学研究者的关注,但迄今仅有少数研究对该假说进行了验证,所得结论也因生物类群和研究区域的不同而有所差异[15-18]。因此,亟需开展相关研究对该假说在河流中的适用性进行验证。
赤水河被誉为生态河、美景河、美酒河、英雄河,是长江上游干流唯一未修建水坝的大型一级支流,也是长江上游珍稀特有鱼类国家级自然保护区的重要组成部分,在水生生物多样性保护方面发挥着不可替代的作用[19-20]。赤水河流域河网发达,支流众多,河流呈典型网状发散,保持着较为完好的生态环境和河流连续体,为验证NPH等生态学假说提供了理想的研究场所[21-22]。
大型底栖无脊椎动物(简称底栖动物)是河流生态系统中的重要类群,在能量流动和物质循环中起着承上启下的作用[23-24]。该类群种类繁多,对环境变化具有高度敏感性和可预测性等优点,是评估河流生态系统健康状况的关键类群[25-26],亦是探索河流群落构建机制的模式生物[27-28]。目前对底栖动物群落构建的研究主要聚焦于比较生态位和中性过程在不同时空尺度上的相对贡献,较少关注河网位置在群落构建中的作用[14-16]。
本研究以赤水河为研究区域,以底栖动物为研究对象,探索河流网络位置对底栖动物多样性(α和β)和群落构建(环境过滤vs.空间过程)的影响,同时对NPH假说在我国亚热带河流的适用性进行验证。研究提出了3个先验假设: 1)基于NPH假说,赤水河支流的底栖动物群落主要受环境过滤驱动,而干流的群落则受到环境过滤和空间过程的共同作用[14];2)由于过度扩散(群体效应)通常会导致群落的均质化,干流群落的β多样性可能低于支流群落[17];3)考虑到赤水河较大的流域范围和较高的环境异质性,物种替换可能是β多样性的主要组成部分[22]。本研究的开展有助于提高人们对亚热带复杂河网影响下底栖动物群落构建的认识水平,丰富和完善底栖动物多样性维持的理论体系,为长江上游生态环境和生物多样性保护提供科学依据。
1 材料与方法
1.1 研究区域
赤水河(27°20′~28°50′N,104°45′~106°51′E)发源于云南省镇雄县,流经云南、贵州、四川3个省份,最后在四川省合江县汇入长江。河流干流全长437 km,流域面积 21010 km2。赤水河属于亚热带大陆性季风气候,温暖湿润,无霜期长,雨量充沛,夏季湿热而冬季干旱[29]。此外,赤水河还是长江上游实施全面禁渔的首条试点河流,在长江上游水生生物保护等方面发挥着极其重要的作用[30-31]。本研究选取赤水河干流及其重要支流(铜车河、倒流河、二道河、古蔺河、桐梓河和习水河等)进行调查。
1.2 样品采集和处理
在赤水河流域共布设位点109个(图1),包括干流54个和支流55个,于2023年4月开展底栖动物的野外调查。在各位点所在的100 m河段内,选取底质、水深和流速等均有代表性的生境(如深潭、激流、有机质或沉水植物等)进行样本采集。每个位点均采集2~3个定量样品和1个定性样品。基于河道内的生境状况,在以石块底质为主、可涉水的河段,使用索伯网(孔径为420 μm,面积为0.09 m2)进行定量采集;在以淤泥或细沙为主、不可涉水的河段则使用彼得逊采泥器(1/16 m2)进行定量采集。使用手抄网对各位点底栖动物进行定性采集,从而对定量样品进行补充和完善。所采样品经450 μm孔径的铜筛筛洗干净后,分别置入白瓷盘中,并进行初步分拣和保存。使用75%的酒精对标本进行固定,存放于50 mL标本瓶中。于解剖镜和显微镜下将底栖动物鉴定至最低的分类阶元(一般为种或属),并记录各物种的数量及湿重。底栖动物的形态鉴定参考相关文献[32-36]。

图1赤水河流域底栖动物调查样点分布
Fig.1Distribution of sampling sites for benthic macroinvertebrates in the Chishui River Basin
1.3 环境及空间因子
在采集底栖动物的同时,对每个位点的环境指标进行测定。海拔和经纬度坐标用麦哲伦GPS(探险家210型)测定,河宽用测距仪测定。于河流横断面上等距离测定水深,并用 LJD-10 流速仪于0.6倍水深处测定流速。水温、溶解氧、电导率、pH 使用美国YSI公司水质多参数分析仪(YSI6600)测定。依照 Barbour[37]的标准,将底质分为巨石、卵石、砾石和泥沙,并估算每一类型的百分比。在每个样点水下30 cm采集1 L水样于聚乙烯瓶中,低温保存并在24 h内带回实验室内测定水化指标,依据《水和废水监测分析方法》(第四版)测定高锰酸盐指数、总氮、氨氮、总磷4项指标[38]。
基于特征函数的分析方法可以有效地模拟多空间尺度上的生态格局与过程,因此被普遍应用于描述扩散等随机性过程[39]。在本研究中,我们选用邻体矩阵主坐标分析(principal coordinates of neighbour matrices,PCNM)来定量刻画各样点间的空间构型[40]。该分析的优点是能够同时考虑多个尺度的空间结构,从而更全面地理解样本之间的空间关系,同时还可以帮助识别在不同空间尺度下存在的空间模式和空间分布的变化,为研究人员提供了一种强大的工具来理解和解释复杂的空间数据[39-40]。PCNM是Moran特征向量图分析(Moran's Eigenvector Map)的一种,是基于位点之间地理等距离的一种空间分析模型,可对任何种类的空间构型进行建模[41]。一个位点的空间因子可由多个空间参数来衡量,每个空间参数可以表征空间过程的一个方面。空间变量是具有正特征根的向量,可用作多元回归或排序分析的解释变量。由于底栖动物的生长、繁殖和扩散等重要生命活动多集中于河道内部,因此,我们采用位点间的水系距离矩阵计算多维空间向量。PCNM分析使用R语言vegan 包的pcnm函数完成[42]。
1.4 数据分析
1.4.1 环境和群落的空间格局
首先,使用置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)来比较环境特征和群落结构在干、支流间是否存在差异。PERMANOVA是一种非参数方法,通过对数据进行重排,对组间的差异进行检验,因此不需要假定数据符合特定的分布。PERMANOVA利用欧式距离和Bray-Curtis距离分别对环境和群落的总方差进行分解,分析不同分组因素(本文中为河网位置)对样本差异的解释度,并使用置换检验对各个变量解释的统计学意义进行显著性分析。之后,分别采用主成分分析(principal components analysis,PCA)和主坐标分析(principal co-ordinates analysis,PCoA)对干支流间环境和群落的差异进行可视化。PERMANOVA分析使用R语言vegan软件包的adonis函数运行;PCA和PCoA分别使用FactoMineR[43]和stats包[44]运行。
1.4.2 生物多样性指数
使用物种数、Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数来表征群落的α多样性。使用Sørensen相异性指数(βsør)和Bray-Curtis相异性指数(dBC)来度量群落的β多样性。许多学者认为,β多样性可分为物种置换部分和嵌套部分[45]。置换部分反映了由环境筛选、地理隔离或历史隔离形成的群落间的物种替换过程,而嵌套部分指两个群落间物种丰富度的差别,反映了导致物种损失的非随机过程[46]。因此,将β多样性划分为置换和嵌套对理解多样性格局有着重要意义[9,47]。本研究亦将Sørensen和Bray-Curtis指数分别分解为置换(βsim和dBC-bal)和嵌套(βnes和dBC-gra)部分。α多样性和β多样性的计算分别在R语言的vegan和betapart软件包中实现[45]。
使用秩和检验(rank sum test)比较干支流间α多样性(物种丰富度、Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数)、密度和生物量的差异。秩和检验是一种非参数统计方法,适用于非正态分布或方差不齐的数据,用于比较两组独立样本的中位数是否存在差异[48]。之后,采用置换多元离散度分析(permutation multivariate dispersion,PERMDISP)比较干流和支流β多样性的差异[49]。秩和检验和PERMDISP分别使用R语言的wilcox.test及betadisper函数运行。
1.4.3 群落变化的解释
采用冗余分析(redundancy analysis,RDA)分别解析全流域、干流、支流底栖动物群落结构与环境因子和空间因子的关系[50]。数据分析前,对不满足正态分布的环境因子进行正态性转化。其中,对百分比数据(如底质组成)进行开平方根转化,对其他环境因子(除pH外)进行lg(x+1)转化。此外,考虑到环境因子间的相关性,需计算两两因子间的相关性,并剔除强相关的因子(|R|>0.75)。运行RDA,首先需对模型进行总体检验,如果总体模型显著,则使用前选方法筛选能够解释响应变量的最优因子组合。
采用变差分解(variation partitioning)分析环境因子和空间因子在解释生物群落变异中的相对作用[51]。变差分解可将群落变异分解为4个部分:(1)仅被环境因子解释的部分[E];(2)仅被空间因子解释的部分[S];(3)被环境因子和空间因子共同解释的部分[E∩S];(4)未被解释的部分 [Residuals],并用置换检验来分析其显著性。最后,根据各部分对应的校正R2值和P值,来确定影响生物参数的主要因素(即空间因子和环境因子哪个才是驱动参数变化的主要因素)。冗余分析和变差分解分别采用 R 软件vegan 包的rda和varpart 函数进行计算[42]。
2 结果与分析
2.1 环境和群落结构
本次调查在赤水河流域共采集到底栖动物231种,隶属于5门10纲23目86科191属(附表Ⅰ)。其中,扁形动物门1种,线形动物门2种,环节动物门15种,软体动物门13种,节肢动物门202种。PCA和PERMANOVA分析(F=61.877,P=0.001)表明,支流和干流的环境条件存在显著差异(图2a,附表Ⅱ)。同样,PCoA和PERMANOVA(F=10.786,P=0.001)分析显示,支流和干流底栖动物的群落结构亦存在明显差异(图2b)。
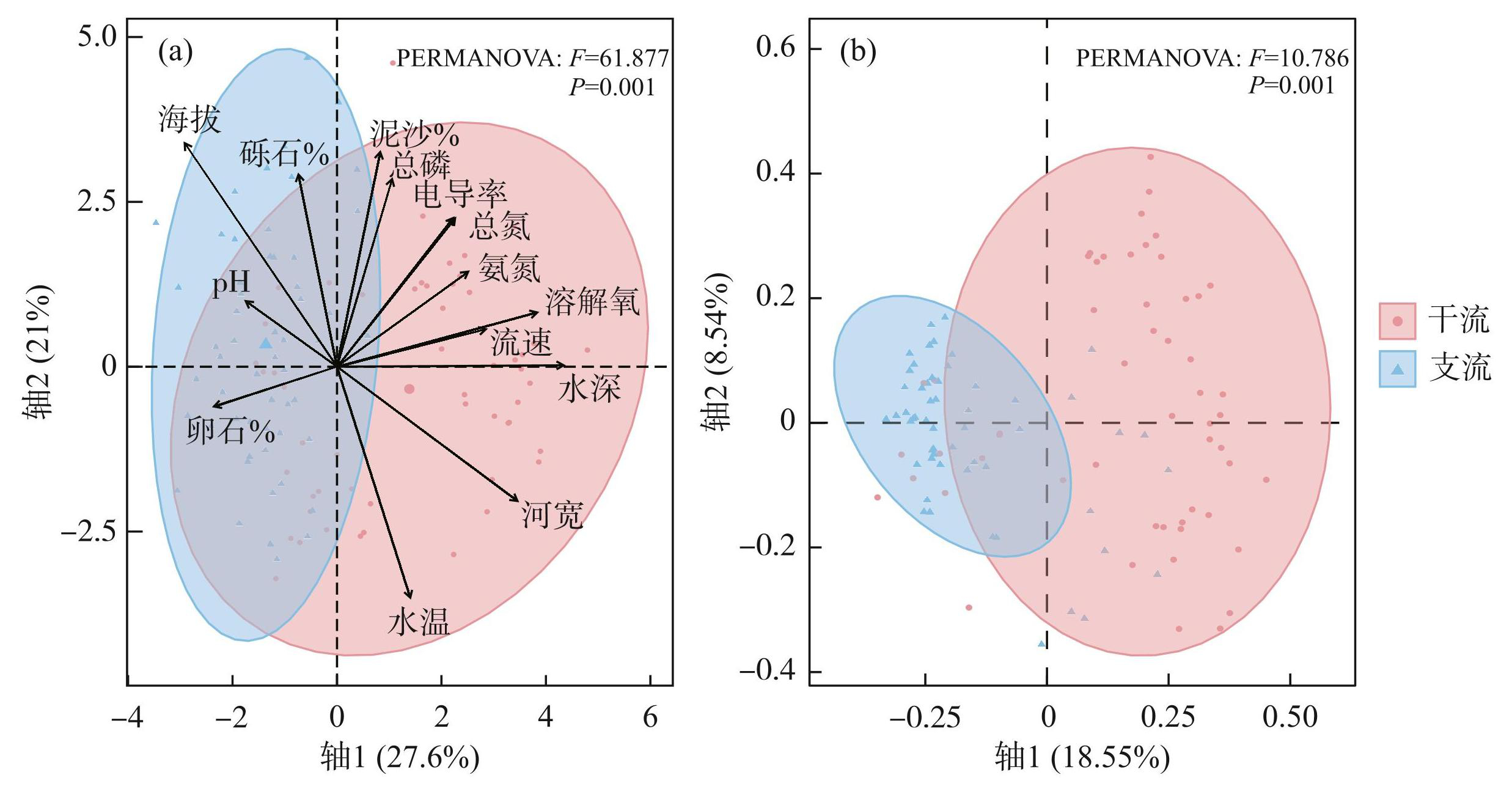
图2赤水河干流和支流环境条件和群落结构的PCA(a)和PCoA(b)排序图
Fig.2PCA (a) and PCoA (b) ordination plots for environmental conditions and community structure in the mainstem and tributaries of Chishui River
2.2 多样性的空间格局
非参数检验结果显示,赤水河支流底栖动物的物种丰富度(图3a)、密度(图3b)和Shannon-Wiener多样性指数(图3d)均显著高于干流,但干流的生物量(图3c)极显著高于支流(P<0.001)。Simpson多样性指数(图3e)和均匀度指数(图3f)在干、支流间没有显著差异。
全流域底栖动物群落的总β多样性均值为0.745(Bray-Curtis指数)和0.726(Sørensen指数);置换组分是构成β多样性的主要部分,占β多样性的87%;嵌套组分仅占13%。干、支流群落的β多样性亦主要由置换组分构成(表1)。此外,PERMDISP分析显示,干流底栖动物群落的β多样性显著高于支流(Bray-Curtis:F=33.551,P<0.001;Sørensen:F=31.205,P<0.001)。
2.3 群落构建
冗余分析结果显示,影响赤水河全流域底栖动物群落结构的关键环境因子包括海拔、水深、流速、卵石%、总氮、溶解氧、pH和总磷,空间因子包括PCNM1、2、3、7、8、9、33和59(图4a)。驱动赤水河干流底栖动物群落结构变化的关键环境因子包括水深、河宽和水温,空间因子包括PCNM2和PCNM23(图4c);对支流底栖动物群落结构有显著作用的环境因子为海拔、水深、流速和电导率,空间因子为PCNM1、3、5、7、8、24(图4e)。
变差分解分析显示,在赤水河全流域,就单独贡献([E]和[S])而言,环境因子(10%)对群落变异的解释度高于空间因子(4%)(图4b),表明环境过滤是驱动流域内底栖动物群落构建的主导因素;在赤水河干流,亦表现为环境因子(10%)的解释度高于空间因子(4%)(图4d);相反,对于赤水河支流的底栖动物,空间作用(8%)对其群落结构的影响高于环境因子(6%)(图4f)。
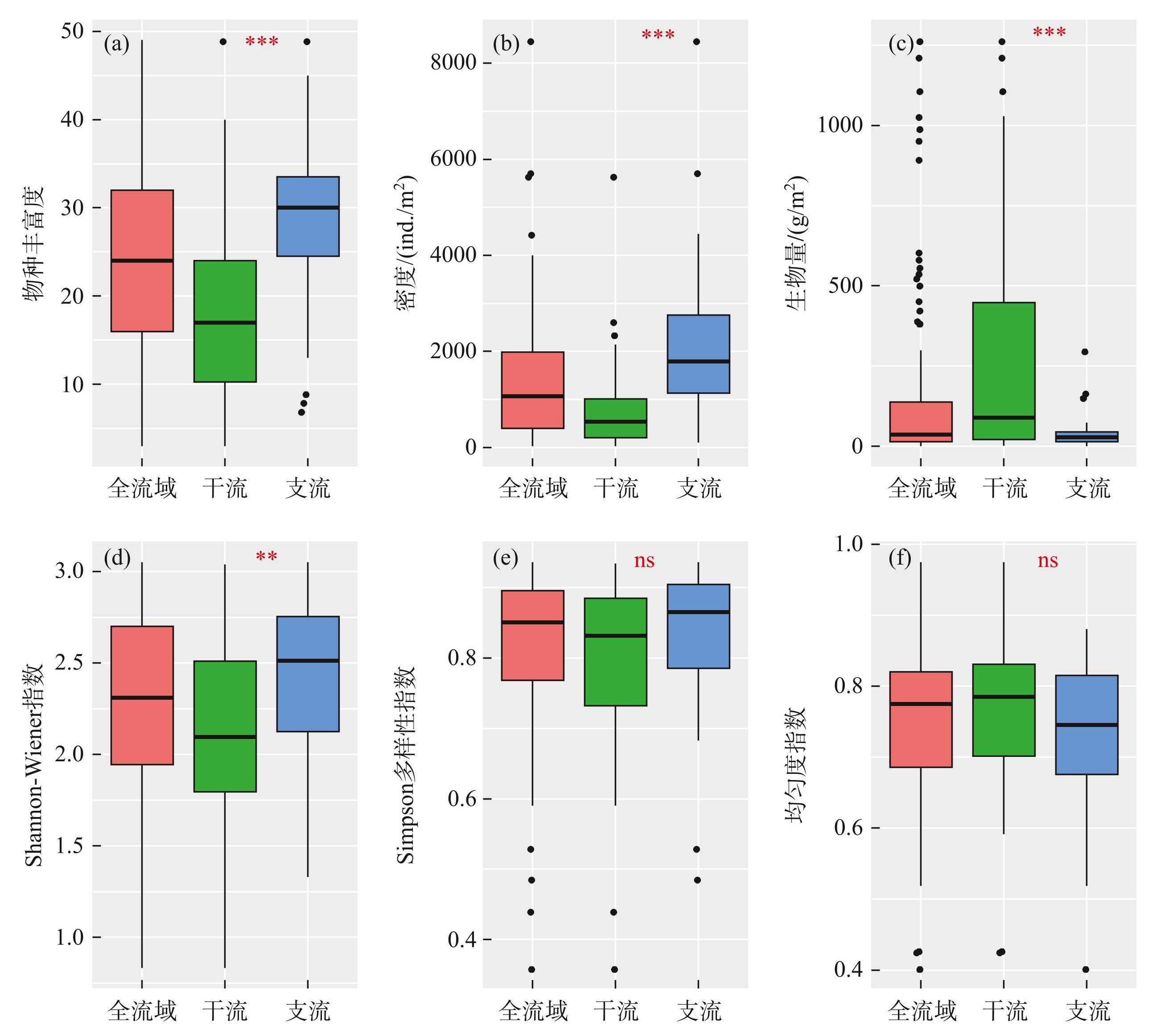
图3赤水河干流和支流底栖动物α多样性(物种丰富度、Shannon-Wiener多样性指数、 Simpson多样性指数和均匀度指数)、密度和生物量的差异 (*P<0.05,**P<0.01,***P<0.001,ns为不显著)
Fig.3Differences in macroinvertebrate α diversity (species richness, Shannon-Wiener diversity, Simpson diversity, and evenness index) , density, and biomass between the mainstem and tributaries of Chishui River(Statistical significance was indicated by *P<0.05, **P<0.01, ***P<0.001, while ns denoted non-significance)
表1基于Bray-Curtis指数和Sørensen指数的β多样性分解结果
Tab.1 Results of β diversity partitioning based on Bray-Curtis and Sørensen indices
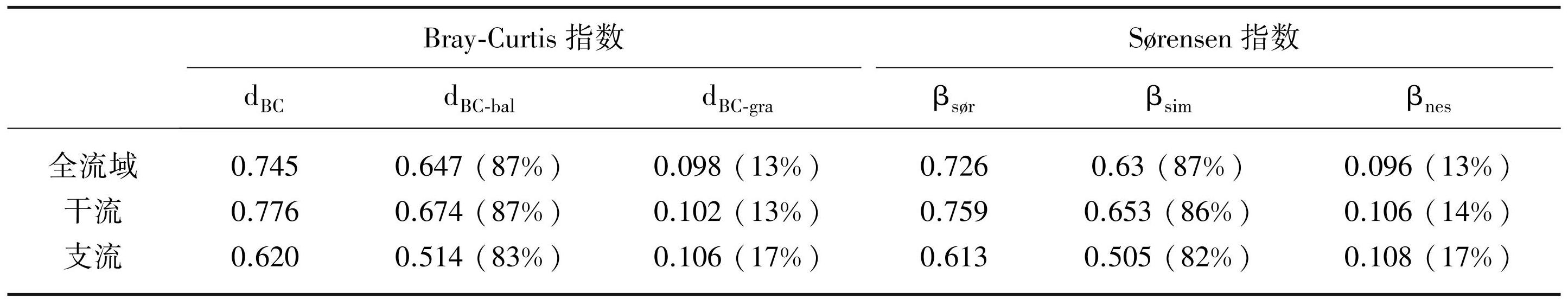

图4全流域(a、b)、干流(c、d)和支流(e、f)底栖动物群落的冗余分析和变差分解结果
Fig.4Results of RDA and variation partitioning analyses for macroinvertebrate communities in the whole river basin (a, b) , mainstem (c, d) and tributaries (e, f)
3 讨论
本文以具有复杂网络结构和自然流态的赤水河为研究区域,探索河流网络位置对底栖动物多样性格局和群落构建过程的影响。以此为基础,探讨NPH假说的适用性,并就该理论未来的发展与完善提出新的见解和建议。研究发现赤水河底栖动物群落结构受到环境因子和空间因子的共同驱动,表明环境过滤和扩散过程均是影响群落构建的重要因素[52-56]。此外,环境过滤在整个流域的重要性明显高于扩散过程。这主要是因为:1)赤水河流域具有较高的环境异质性[19,22]。在自然条件(如海拔、底质类型和营养盐浓度)和人类活动(如城镇、农业和工业)的共同作用下,各位点间存在巨大的环境梯度,形成强大的“过滤器”,使环境过滤在底栖动物群落构建中占主导作用[8,57-59]。2)赤水河底栖动物的优势类群为水生昆虫[60],这些生物具有较强的迁移能力(尤其是羽化后的成虫),能够有效地寻找适宜其生存和繁衍的环境条件[55,61]。此外,水生昆虫中的EPT类群(蜉蝣目、襀翅目和毛翅目)在物种组成中占据较高比例(约30%)。这类生物对环境变化非常敏感(通常被用作清洁水体指示生物),因而受到环境过滤的强烈作用[62]。此外,空间过程亦解释了部分群落变异。然而,值得注意的是,基于图论的网络空间模型既可以表征扩散限制也可以表征群体效应,相对贡献难以通过变差分解来区分[63-64]。考虑到赤水河较大的流域面积和复杂的地貌特征,我们推测在全流域尺度上的空间作用主要为扩散限制而非群体效应[65]。
干流和支流底栖动物的群落构建过程存在一定差异,表明河流网络位置对底栖动物的群落构建产生了影响[17]。然而,本研究发现干流群落主要受环境过滤驱动,而支流群落则受扩散限制和环境过滤的共同作用。上述结果与NPH的预测恰好相反(拒绝假设1),表明该假说在解释赤水河底栖动物群落构建时存在局限性。事实上,自NPH提出以来,已陆续有学者对其进行验证,但仅有部分研究结果支持该假说的预测。例如,Jamoneau等[54]比较了上、中、下游硅藻的群落构建机制,发现环境过滤是各河段硅藻群落构建的主要驱动因素,而空间过程(群体效应)仅在中、下游的作用更为明显(部分验证了NPH)。Li[55]分析了干、支流底栖动物群落构建过程的差异,发现支流群落受到环境和空间过程的共同驱动,而干流群落则主要受环境过滤影响(与NPH完全相反)。Henriques-Silva 等[16]基于28个流域的鱼类数据对NPH进行验证,发现仅有10个流域完全支持NPH,而其余18个流域并不支持或不完全支持。Schmera 等[15]使用硅藻、大型植物、底栖动物和鱼类数据分别验证NPH,发现仅有底栖动物群落完全符合NPH的预测。这些看似矛盾甚至相悖的结果表明,河流网络位置对群落构建过程的影响具有明显的场景依赖性[6,56]。考虑到不同研究区域的独特性(如环境异质性、景观连通度和生物地理历史)和生物类群的特殊性(如生活史、迁移能力和环境耐受力),基于野外观测难以得出较为普适性的规律[18]。因此,未来需要进一步研究,并提出适用于我国河流网络的新假说。
本研究未支持NPH的原因主要归因于以下两点:首先,支流通常处于河流网络结构的边缘,彼此之间相互阻隔,缺乏直接的水文连通,是河流景观中隔离程度最高的区域,故而生物在支流之间的迁移极为受限[18]。扩散限制通常在隔离度高、连通性低的系统中发挥关键作用[55-56]。相比之下,干流通常位于河流网络的中心位置,水网结构简单、连通度高且水流量大,生物在干流更易随水流扩散从而到达适宜的生境[54]。因此,环境过滤对干流底栖动物群落的影响更显著[17]。另外,支流比干流拥有更多的稀有种。相关研究表明,稀有种由于种群规模较小,更容易受到生态漂变和扩散限制等随机过程的影响[66];而常见种占据生物群落的核心生态位,通常更易受环境过滤的调控[67]。
本研究发现支流的α多样性显著高于干流,这可能是因为支流主要是高山激流生境,底质组成以卵石等大粒径石块为主。底质的颗粒大小、稳定程度、表面构造和营养成分等都对底栖动物群落组成和分布有着重要影响[68]。研究表明,底质组成的异质性和稳定性越高,底栖动物的物种多样性就越丰富[21]。较大粒径的底质可为底栖动物提供更多的生存空间、食物来源和产卵场所,还可作为底栖动物的避难所,以抵御外界环境的干扰(如洪水和鱼类捕食等)[60]。相比之下,以泥沙底质为主的干流河段(主要指中下游)更易遭受水流冲刷,使得微生境稳定性较差,底栖动物难以定居和生存,导致α多样性处于较低水平[69]。此外,激流通常携带着丰富的溶解氧,适宜于喜流水、富氧型底栖动物(尤其是EPT昆虫)的生存[70]。因此,溪流生境通常比大河干流维系着更高的底栖动物α多样性,这一发现也与前人的研究结果相一致[68,71-73]。
与假设2不一致的是,我们发现干流的β多样性显著高于支流,这与先前相关研究的结果恰好相反[17,54,74]。这主要是由于赤水河作为一条接近自然状态的大型河流,保持了生态环境和生物群落较为原始的状况[31]。赤水河干流的环境特征从上游(河宽仅有数米的可涉水小型溪流)到中下游(河宽达数百米的大型深水型河流)发生了一系列剧烈的变化,形成了高度的环境异质性[19]。相应地,从上游至河口,生物群落的组成上亦存在明显的纵向格局,从而维持着干流河段较高的β多样性。相反,本次调查的支流多为溪流生境,各位点间环境状况(如卵石底质、浅水、激流)较为接近,故而其物种组成上(相较干流)更加相似,β多样性也相对较低。
与假设3的预测相一致,基于有无和丰度数据的β多样性均主要由置换组分构成,表明群落间的物种替代是引起群落变化的主要原因[45]。在保护生物学领域,对β多样性置换和嵌套组分的研究,可用于指导保护措施的制定,从而更有效地选择保护区域。通常,如果某地区具有较高的嵌套成分,则应优先保护物种丰富度高的位点[22]。该方案只需较少数量或面积的保护区便能够尽可能多地保护物种[9,46]。相反,如果某区域具有较高的置换成分,则意味着需要保护多个位点。因为这些位点在物种组成上具有明显的差异,需要增加保护区的面积或者数量以囊括物种变化梯度[45,75]。在本研究中,置换组分是流域内底栖动物β多样性的主要成分,这说明尽可能多的保护不同位点/生境/河段/亚流域成为维护赤水河底栖动物多样性和特有性的重要举措,必要时可将整个赤水河流域(干流及其支流)纳入保护区进行保护。另一方面,由于局域环境是造成底栖动物群落结构变化的主导因素,因此保护和修复河流环境(尤其是物理栖境)、维持较高的生境异质性,亦是保护赤水河底栖动物多样性的可行之策[55]。
现代河流生态学研究的中心和重心主要在西方发达国家,所提出的理论和假说、技术和方法也主要是基于这些国家的河流系统[52-53]。这些理论和假说是否适合于研究较为欠缺的河流(主要是发展中国家和欠发达地区)仍未可知[17,19]。因此,应在世界上不同河流开展广泛的调查研究,从而对这些理论和假说进行验证、修订和完善,使之能成为一般性的科学规律和知识,从而服务于人类社会。本研究探讨了河网位置在底栖动物群落构建中的作用,初步揭示了空间格局和潜在过程,但仍存在以下不足。首先,研究仅简单将位点划分为干、支流,而未对各位点所处的网络位置和连通度进行更为精细的统计和度量;其次,由于相关数据缺乏,本研究仅关注河网对底栖动物群落的影响,未纳入多生物类群响应机制的比较;另外,河流生态系统的水文情势具有较强的时间动态,其生物群落也表现出显著的时间变异,但目前关于NPH在时间维度上适用性的实证研究还相对缺乏;最后,本研究未考虑生态漂变和物种间相互作用等生态过程在群落构建中的贡献,导致模型解释率偏低。鉴于此,后续研究可从以下几个方面入手:(1)精确度量河网位置和水系结构;(2)综合比较多生物类群的响应模式;(3)基于不同水文时期进行验证;(4)整合多种生态过程与机制等,从而深化NPH内涵,拓展其应用。此外,未来还应在更多流域开展定量评估,将人类活动对水系连通性的影响纳入NPH框架,使之服务于河流生态系统管理和保护实践。这些研究的开展不仅有助于加深对河网生物多样性维持机制的理解,也为流域尺度河网优化和保护提供新思路和依据。后续研究可围绕这些思路,提出更具体的科学问题和技术路线,以丰富NPH的研究内容和方法体系。
4 附录
附表Ⅰ和附表Ⅱ见电子版(DOI: 10.18307/2025.0235)。
