(2: 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
(2: State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
湖泊水体富营养化已经日益成为一个普遍且频发的环境问题[1],其产生的蓝藻水华灾害给人类饮用水安全及生态系统的健康带来威胁[2-3],去除蓝藻水华特别是微囊藻水华及其代谢产物微囊藻毒素是当今蓝藻水华灾害防控中的研究热点.
目前报道较多的藻华控制技术主要有硫酸铜控藻法、机械打捞法和改性黏土法等.硫酸铜杀藻技术较为简易,但因其自身的毒性使得其应用局限性也较大;机械打捞法应用最为普遍,近些年在传统机械打捞基础上又发展如重力感应筛选法等,该类方法在节能和成本控制上尚需进行较大改进;壳聚糖改性黏土法因为取材便利、方法简便成为近期控藻方面的研究热点[4-6], 在毒素去除方面也已有很多的报道,比如活性炭不仅能对常规的水污染(如重金属和溴酸盐)有良好的吸附去除效率[7-9],对蓝藻毒素去除也有着广泛的报道[10-13]; 在氧化法毒素去除技术中,光降解氧化作用研究的较多,最典型的有二氧化钛光催化降解、Fenton氧化降解等[14-15],此外氧化还原法如Cl2、O3、KMnO4等氧化降解微囊藻毒素也有很多报道[16-18].尽管有上述多种方法和技术,目前能够同时用于藻细胞及其产生的藻毒素去除的方法报道仍较欠缺,发展和探讨能够同时去除蓝藻和蓝藻毒素的技术显得十分必要.
一般水华微囊藻细胞表面都含有多糖,野外的微囊藻还有胶壳,这些结构中都存在羧基和羰基等官能团,因此微囊藻细胞具有吸附重金属离子的能力,在某些情况下可以用来去除水体中浓度过高的重金属离子[19-21].由于微囊藻细胞表面存在上述官能团结构,一些带阳离子或带正电的物质可以用来聚沉或者絮凝微囊藻细胞[22-23].在我们前期的研究成果中,铁离子改性材料可以快速高效地去除微囊藻毒素,同时由于藻细胞表面的官能团结构,Fe(Ⅲ)也能和铝离子一样对藻细胞产生聚沉絮凝反应[24].因此,利用廉价取材便利的天然土壤通过对其进行Fe(Ⅲ)固定改性及自身内含金属活性激活,就可能得到一种可以同时对藻细胞和藻毒素去除起作用的天然材料[25].本研究的目的在于筛选土壤去除蓝藻细胞和毒素的关键理化因子,并对其进行离子化人工改造,以增强其去除蓝藻细胞和蓝藻毒素的性能.
1 材料与方法 1.1 土壤样品及主要试剂毒素MC-LR标准品购自依普锐斯科技(北京),实验用纯MC-LR是从实验室培养的微囊藻FACHB-905中用改进的Ramanan法提取纯化得到,其纯度在高效液相色谱上检测达到95 %以上[26].实验用的4种天然土壤样品(编号Ⅰ、Ⅱ、Ⅲ和Ⅳ)的采集地点分别为江西抚州、湖北咸宁、江西抚州和湖北武汉. Fe(NO3)3·9H2O、KH2PO4、HNO3、HF和HClO4等试剂来自上海国药试剂有限公司,色谱纯甲醇来自Fisher公司(英国拉尔夫保),其它所用试剂均为分析纯.实验用铜绿微囊藻(Microcystis aeruginosa)FACHB-905来自中国科学院水生生物研究所淡水藻种库,用于培养藻细胞的培养基为BG-11,具体培养藻的方法和过程参考文献[4].
1.2 土壤主要金属含量的测定及土壤性质表征根据已有的研究结果,特意选取3种可能影响毒素吸附的金属(铁、铜、镁), 对其在土壤中的含量进行测定[24, 27].土壤金属含量测定基本步骤为:先烘干土壤,称取定量的土壤样品加入聚四氟乙烯坩锅中,加热,用HNO3/HF/HClO4法消解飞硅,消解液用容量瓶定容后在GBC AVANTA-M原子吸收光谱仪(GBC科学仪器公司, 澳大利亚)上测定,具体操作按照GB/T 15337-2008原子吸收光谱分析法通则进行.土壤在1 :5水溶液稀释后用PHS-3C型酸度计(雷磁仪器,上海)测定pH值,土壤阳离子交换量测定采用乙酸铵法(具体参考国家地质标准FHZDZTR 0029-土壤阳离子交换量的测定),其机械组成测定参考土壤检测农业行业/国家标准(NY/T 1121.3-2006).
1.3 土壤的预处理与离子改性土壤从各个地方采集后,先放入烘箱中100℃烘干,研磨,然后过80目(170 μm)的滤筛.在进行离子改性前,先配好Fe(NO3)3·9H2O溶液,然后将研磨过滤筛后的均质土壤颗粒物缓慢加入溶液中,Fe(NO3)3 ·9H2O终浓度为0.02 g/ml, 土壤颗粒物浓度为0.16 g/ml, 混合悬浊液在磁力搅拌器慢速搅拌下混合反应24 h后,根据需要用的土壤量取出一定体积的悬浊液,6000转/min离心5 min(或者用0.45 μm滤膜过滤),用纯净水洗改性的土壤2次以去除多余残留的Fe(Ⅲ).
1.4 土壤改性前后对毒素的去除在土壤毒素去除实验中,毒素初始浓度为100 μg/L(pH值7.8), 土壤Ⅰ、Ⅱ、Ⅲ使用量均为3.750 g/L, 土壤Ⅳ为1.875 g/L,反应体系体积为20 ml.两者混合后在摇床上混合反应30 min,反应完毕后体系在8000转/min离心速度下离心分离,上清液毒素经过C18小柱浓缩富集后用HPLC法检测,使用仪器为岛津LC-10A (岛津,日本)(带光电二极管列阵检测器,分离色谱柱为岛津shim-pack (CLO-ODS 6.0×150),流动相为60 %色谱纯甲醇混合40 % KH2PO4溶液(0.05 mol/L,pH=3), 流动相速度为1 ml/min,柱温箱温度恒定在40℃,液相进样体积为10 μl.当毒素浓度较低时,毒素样品在稀释适当倍率后通过ELISA方法检测,ELISA方法检测步骤具体参照文献[28].
1.5 改性土壤用于去除微囊藻及野外蓝藻水华控制实验所用铜绿微囊藻FACHB 905, 在向藻细胞液中加入定量离子改性土壤后,在设定的时间点从液柱中部取适量体积的藻液,在血球计数板上用显微镜计数.野外蓝藻水华控制试验于中国科学院水生生物研究所官桥野外实验基地进行,投加改性土壤剂量为40 mg/L,水样与藻类样品分别从实验池4个角落及中心点等体积采取后混匀带回实验室于2 h内测定.
2 结果与分析 2.1 改性前后土壤对毒素去除能力的变化土壤Fe(Ⅲ)改性前后对微囊藻毒素的吸附能力如图 1所示.在未进行Fe(Ⅲ)改性之前的原土壤样品中,毒素去除能力最高的是土壤样品Ⅳ,毒素吸附能力为337.0 ng/g, 其次是Ⅲ(147.4 ng/g)、Ⅱ(56.8 ng/g)和Ⅰ(45.8 ng/g).经过Fe(Ⅲ)改性后,所有的土壤样品对微囊藻毒素的吸附能力都有显著提高,其中改性后去除毒素能力最高的是土壤Ⅳ,其毒素去除能力高达50116.5 ng/g, 与未进行Fe(Ⅲ)改性土壤前的土壤相比,其对毒素的吸附去除能力整整提高了约148倍;同时, 改性后的土壤Ⅳ毒素去除能力也在4种改性土壤中占有绝对优势地位,其去除能力是排名第2的土壤Ⅰ(2539.2 ng/g)的近20倍.目前已有的研究表明,土壤机械组对其吸附毒素能力有较大的影响,一般土壤中的黏土含量越高,土壤吸附毒素能力就越强[29].土壤基本理化参数表明, 在4种土壤中,土壤Ⅳ的黏土含量最高,因此土壤Ⅳ自身对蓝藻毒素的吸附能力较好;同时由于微囊藻毒素分子本身属于有机分子,具有一定的疏水性,因此极性弱的介质比较容易吸附微囊藻毒素[30].在土壤有机质含量方面,土壤Ⅳ在4种土壤中具有绝对优势,其有机质含量最高,因此土壤Ⅳ的疏水性也会相应增强,毒素吸附能力也越高(表 1).
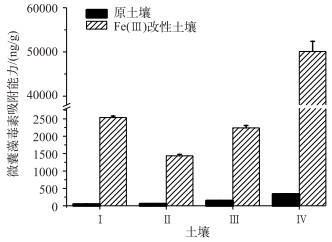
|
图 1 4种不同土壤Fe(Ⅲ)改性前、后去除微囊藻毒素的能力 Fig.1 Removal ability of Microcystis microcystin by four types of soil before and after Fe(Ⅲ) modification |
| 表 1 4种不同土壤的基本理化参数 Tab.1 Basic physical and chemical properties of four types of soil |
经过Fe(Ⅲ)改性后,4种土壤中土壤Ⅳ的毒素吸附能力远远超过其他土壤.之前的研究显示,材料固定吸附的Fe(Ⅲ)增多,其吸附毒素的能力也会提高[24].土壤吸附阳离子(比如铁离子)的能力与土壤的阳离子交换量大小直接相关,主要受土壤中一些有机质分子含量的影响,比如腐植酸、单宁酸等带有羰基和羧基的有机质,这些有机质的官能团能够大量络合吸附Fe(Ⅲ),由于Fe(Ⅲ)与微囊藻毒素发生金属络合反应而吸附微囊藻毒素. 4种土壤中,土壤Ⅳ的阳离子交换值最高(32.18 c mol/kg),其交换吸附Fe(Ⅲ)能力因此也最强,改性后对毒素吸附的潜力也最高.
土壤交换吸附Fe(Ⅲ)的量决定改性土壤的毒素吸附能力,而土壤本身的金属含量与毒素吸附量间的潜在关系尚不清楚.如表 1所示,在几种比较关键的金属含量中,特别是比较高的铁含量中,土壤Ⅱ本身优势都比较明显,但该土壤不管改性前还是改性后毒素吸附能力并没有表现出明显优势,原因可能在于土壤中自身的金属可能以比较复杂的氧化物等形式存在,活性络合位点已经被土壤中的其他元素和化合物占满,没有富余的毒素络合吸附位点.对于上述观点,本文也通过另一个实验进行验证,如图 2所示,在不同pH值环境下改性土壤Ⅳ的毒素去除效率实验中发现,pH值越高去除效率越差,原因可能在于在高pH值条件下,土壤吸附的金属以更复杂的羟基水合络合物存在,其和毒素的吸附位点也受到一定程度的限制.此外, 高pH值会增强毒素的亲水性,也不利于土壤对毒素的吸附.
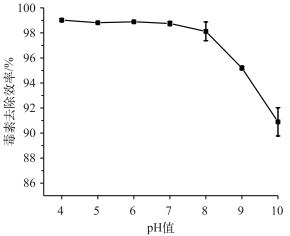
|
图 2 不同pH值条件下改性土壤Ⅳ的微囊藻毒素去除效率 Fig.2 The Microcystis microcystin uptake by Fe(Ⅲ) modified soil under different pH conditions |
为了安全地将微囊藻毒素浓度控制在世界卫生组织推荐的安全标准以下,在使用改性土壤Ⅳ常规剂量1.875 g/L的条件下,研究毒素初始浓度与去除后最终的浓度,结果如图 3所示.在毒素浓度小于60 μg/L时,最终经过Fe(Ⅲ)改性土壤去除的毒素最终平衡浓度都控制在毒素安全标准以下,当毒素浓度超过这个界线时,毒素最终平衡浓度呈现出线性增长的趋势,因此推荐毒素浓度较高情况下对毒素进行二次吸附的深度处理,可以将毒素浓度完全控制在安全水平.
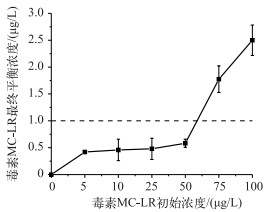
|
图 3 不同毒素初始浓度条件下,经过Fe(Ⅲ)改性土壤去除后毒素的最终平衡浓度 Fig.3 The final MC-LR concentration after function by Fe(Ⅲ) modified soil Ⅳ varied as the initial MC-LR concentration (虚线代表世界卫生组织推荐的饮用水中MC-LR的安全线,实验中使用的改性土壤Ⅳ的剂量为1.875 g/L) (The dotted line represented the WHO guideline value for MC-LR, The dose of Fe(Ⅲ) modified soil Ⅳ was 1.875 g/L) |
4种改性土壤对微囊藻细胞的去除效率的基本趋势与其在微囊藻毒素的去除效率中的趋势相近(图 4)改性土壤Ⅳ仍是4种土壤中去除微囊藻细胞效率最高的,其次是改性土壤Ⅰ.从土壤的基本性质可以看出,土壤Ⅳ的阳离子交换值最大,其次是土壤Ⅰ.根据Fourest and Roux的广义酸碱理论,Fe(Ⅲ)对于藻细胞表面的羟基、羰基和羧基等官能团是一种软性的酸,具有天然的亲和吸附能力,同时Fe(Ⅲ)也能使藻细胞发生聚沉反应,从而去除微囊藻细胞[21, 31].因此,改性土壤能固定越多的Fe(Ⅲ),那么其聚沉吸附微囊藻的能力也就越强,应用于藻细胞去除的潜力就越大.从的土壤理化参数可以看出,土壤Ⅳ的阳离子交换值最大,其次是土壤Ⅰ(表 1),因此土壤Ⅳ能够固定最多的Fe(Ⅲ),其次是土壤Ⅰ.在筛选铁离子改性土壤时,应该尽量选那些阳离子交换量比较大的土壤进行离子改性;在初步外观选择过程中,应选那些表观上比较肥沃的土壤,因为肥沃的土壤中含有的有机酸比如单宁酸、腐植酸等含量会更高,能够络合吸附的铁离子也会更多.
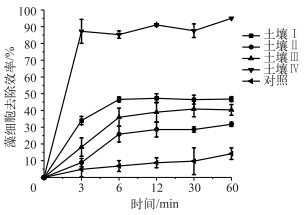
|
图 4 4种不同改性土壤去除微囊藻细胞的动力学曲线 Fig.4 Removal efficiency of Microcystis aeruginosa cells (6.33×109 cells/L) by four different soils (The soil dose used was 16 mg/L) (土壤使用剂量为16 mg/L,微囊藻细胞的浓度为6.33×109 cells/L) |
从不同改性土壤使用剂量情况下的去除效率动力学曲线(图 5)可以看出,在较低的使用剂量下(如13 mg/L),改性土壤去除微囊藻的时间比较长,但随着时间的推移其沉降藻细胞进程仍在一直进行,没有明显的平衡稳定期出现.改性土壤浓度比较低时,单位水体中Fe(Ⅲ)较少,聚集的微囊藻数量少且聚集的类似群体的尺寸比较小,这些小尺寸的被聚集的微囊藻群粒由于尺寸并不大,在重力作用下并不容易立刻沉降下来.当提高改性土壤用量时,可观察到有非常明显的平衡稳定期开始出现;使用的改性土壤剂量毒素在40 mg/L以上时,平衡时间由5 h不断向更短的时间迁移,原因就在于当Fe(Ⅲ)改性土壤浓度增加时,被聚集成团的微囊藻会更多,这些小团之间又容易被铁离子改性土壤桥接在一起形成更大尺度的大群簇微囊藻聚集体,尺寸越大,越容易下沉被去除.在实际应用中,应根据藻类的密度和需要的时间来决定土壤的使用剂量,从而达到在限时限量条件下完成对微囊藻的控制.去除Fe(Ⅲ)改性土壤的剂量仍不能过高,因Fe(Ⅲ)改性土壤并非完全稳定,这些Fe(Ⅲ)容易在某些条件下(如水体酸化)与水体发生交换反应,部分Fe(Ⅲ)释放扩散到水体中,容易造成二次污染.

|
图 5 5种不同剂量浓度的Fe(Ⅲ)改性土壤Ⅳ去除微囊藻的动力学曲线 Fig.5 Kinetics of Microcystis aeruginosa cells (3.7×1010 cells/L) removal by Fe(Ⅲ) modified soil Ⅳ at five different doses (微囊藻细胞的初始浓度为3.7×1010 cells/L) |
从天然原位去除实验中藻密度和毒素变化情况(表 2)可以看出,经过加入铁离子改性土壤6 h后,微囊藻水华藻细胞密度也得到较好的控制,微囊藻细胞密度从之前的1.25×109 cells/L下降到1.6×108 cells/L, 藻细胞的去除效率达到87.2 %,实验池中的透明度得到显著改善,从之前约22 cm上升到46 cm,相比于空白对照组有较好的改善(相关照片见图 6).实验池中的微囊藻毒素从1.4 μg/L下降到0.6 μg/L,去除效率达到57 %,相比之前室内条件下的效果,毒素去除效率有所下降,而对照组在实验前后藻类和毒素浓度均没有明显变化.离子改性方法去除蓝藻毒素与蓝藻细胞有着共同的机理机制,即金属离子可以与藻毒素发生络合吸附反应生成毒素-金属配位体,同时藻类细胞表面的胶质和多糖等含有氧磷等成分,也易与金属离子发生络合配位反应[32-33].当二者同时遇到金属离子时, 由于藻细胞数量较多且单个细胞上含有的官能团数量占优势,因此二者竞争反应结果为藻细胞占据优势.与室内除藻效果比, 野外蓝藻去除依然可以获得较高的去除效率,但毒素去除效果会因水体其它物质竞争反应, 如蓝藻和水体有机物等而有一定的下降. Fe(Ⅲ)改性土壤在藻类与毒素同时控制中显示出一定的潜力,需要后续工作进一步研究与完善.同时在实际的野外应用中,Fe(Ⅲ)改性土壤依然需要根据藻细胞密度(图 5剂量效应)合理控制投加剂量,不能过量添加.因为已有的研究表明,水体中铁的富集将对微囊藻的生长具有一定的促进作用[34].此外,Fe(Ⅲ)改性土壤的添加将使水体铁离子产生较强的水解反应,从而使自然水体pH值下降(如本研究中自然水体pH值从7.3下降到6.9),而铁离子自身的氧化能力在酸性环境下会得到进一步增强,上述综合效应将在一定程度上对水体中其它水生生物生存安全造成威胁.如何增强该材料的稳定性,尽量减少其对环境的负面影响,将是本研究后续工作的一个重点.离子改性土壤法与其它改性黏土法一样,在野外应用中沉降的蓝藻依然存在局部再悬浮的风险,但这种风险可以通过投加土壤覆盖层来减缓,Pan等[35]的研究成果表明,投加沙粒或者改性黏土作为沉降蓝藻的上覆遮盖层后,水质与蓝藻向上扩散的风险可以得到较好的改善.
| 表 2 实验池中微囊藻和毒素在加入Fe(Ⅲ)改性土壤前、后的浓度变化情况 Tab.2 The variation of Microcystis density and MCs concentration in Guanqiao experimental ponds before and after adding Fe(Ⅲ) modified soil(40 mg/L) (改性土壤剂量40 mg/L) |

|
图 6 Fe(Ⅲ)改性土壤加入实验池前(A)和加入实验池后(B)表面微囊藻水华变化 Fig.6 Photographs showing the surface conditions of experimental pond in Guanqiao before(A) and after(B) the field treatment experiment with Fe(Ⅲ) modified soil(40 mg/L) |
土壤中黏土的含量是影响其对毒素吸附的重要因子,经过Fe(Ⅲ)改性后,土壤阳离子交换能力大小直接决定了改性土壤对毒素的吸附能力.土壤阳离子交换量随土壤中有机质含量的增高而增加. Fe(Ⅲ)改性土壤吸附毒素的能力与其自身金属含量的高低关系并不明显,其对毒素的吸附随pH值升高而下降. Fe(Ⅲ)改性土壤具有沉降除藻功能,其去除蓝藻细胞的能力也直接取决于土壤阳离子交换量大小. Fe(Ⅲ)改性土壤可在野外发生水华水体中同时应用于微囊藻的控制及微囊藻毒素去除,但使用前应根据剂量效应结果选择合适的使用剂量.
| [1] |
张艳艳. 试论太湖富营养化的发展、现状及治理. 环境科学与管理, 2009, 34(5): 126-129. |
| [2] |
Gan NQ, Sun XY, Song LR et al. Activation of nrf2 by microcystin-LR provides advantages for liver cancer cell growth. Chemical Research in Toxicology, 2010, 23(9): 1477-1484. DOI:10.1021/tx1001628 |
| [3] |
Song LR, ChenW, Peng L et al. Distribution and bioaccumulation of microcystins in water columns:a systematic investigation into the environmental fate and the risks associated with microcystins in meiliang bay, lake taihu. Water Research, 2007, 41: 2853-2864. DOI:10.1016/j.watres.2007.02.013 |
| [4] |
Wu ZX, Gan NQ, Huang Q et al. Response of Microcystis to copper stress-do phenotypes of Microcystis make a difference in stress tolerance. Environmental Pollution, 2007, 147(2): 324-330. DOI:10.1016/j.envpol.2006.05.022 |
| [5] |
Van HE, Deluchat V, Chazal PM et al. Environmental impact of two successive chemical treatments in a small shallow eutrophied lake:part Ⅱ.Case of copper sulfate. Environmental Pollution, 2002, 120(3): 627-634. DOI:10.1016/S0269-7491(02)00191-4 |
| [6] |
Pan G, Zhang MM, Chen H et al. Removal of cyanobacterial blooms in taihu lake using local soils.Ⅰ.Equilibrium and kinetic screening on the flocculation of Microcystis aeruginosa using commercially available clays and minerals. Environmental Pollution, 2006, 141(2): 195-200. DOI:10.1016/j.envpol.2005.08.041 |
| [7] |
Shirakashi T, Tanaka K, Tamura T et al. Adsorption of Hgbrn complexes on activated carbon. Nippon Kagaku Kaishi, 1999, 2: 137-143. |
| [8] |
Selomulya C, Meeyoo V, Amal R. Mechanisms of Cr(Ⅵ) removal from water by various types of activated carbons. Journal of Chemical Technology and Biotechnology, 1999, 74(2): 111-122. DOI:10.1002/(ISSN)1097-4660 |
| [9] |
Alomair MA, Elsharkawy EA. Removal of heavy metals via adsorption on activated carbon synthesized from solid wastes. Environmental Technology, 2007, 28(4): 443-451. DOI:10.1080/09593332808618808 |
| [10] |
Cook D, Newcombe G, Iwaprogramme C. 3rd world water congress:drinking water treatment. London:IWA Publishing, 2002, 201-207. |
| [11] |
Campinas M, Rosa MJ. The ionic strength effect on microcystin and natural organic matter surrogate adsorption onto PAC. Journal of Colloid and Interface Science, 2006, 299(2): 520-529. DOI:10.1016/j.jcis.2006.02.042 |
| [12] |
Campinas M, Rosa MJ. Removal of microcystins by PAC/UF. Separation and Purification Technology, 2010, 71(1): 114-120. DOI:10.1016/j.seppur.2009.11.010 |
| [13] |
Donati C, Drikas M, Hayes R et al. Microcystin-LR adsorption by powdered activated carbon. Water Research, 1994, 28(8): 1735-1742. DOI:10.1016/0043-1354(94)90245-3 |
| [14] |
Lawton LA, Robertson P, Cornish B et al. Detoxification of microcystins (cyanobacterial hepatotoxins) using TiO2 photocatalytic oxidation. Environmental Science & Technology, 1999, 33(5): 771-775. |
| [15] |
Choi H, Antoniou MG, Pelaez M et al. Mesoporous nitrogen-doped TiO2 for the photocatalytic destruction of the cyanobacterial toxin microcystin-LR under visible light irradiation. Environmental Science & Technology, 2007, 41(21): 7530-7535. |
| [16] |
Rositano J, Newcombe G, Nicholson B et al. Ozonation of NOM and algal toxins in four treated waters. Water Research, 2001, 35(1): 23-32. DOI:10.1016/S0043-1354(00)00252-9 |
| [17] |
Acero JL, Rodriguez E, Meriluoto J. Kinetics of reactions between chlorine and the cyanobacterial toxins microcystins. Water Research, 2005, 39(8): 1628-1638. DOI:10.1016/j.watres.2005.01.022 |
| [18] |
Rodriguez E, Majado ME, Meriluoto J et al. Oxidation of microcystins by permanganate:reaction kinetics and implications for water treatment. Water Research, 2007, 41(1): 102-110. DOI:10.1016/j.watres.2006.10.004 |
| [19] |
Singh S, Pradhan S, Rai LC. Comparative assessment of Fe3+ and Cu2+ biosorption by field and laboratory-grown Microcystis. Process Biochemistry, 1988, 33(5): 495-504. |
| [20] |
Singh S, Rai BN, Rai LC. Ni (Ⅱ) and Cr (Ⅵ) sorption kinetics by Microcystis in single and multimetallic system. Process Biochemistry, 2001, 36(12): 1205-1213. DOI:10.1016/S0032-9592(01)00160-1 |
| [21] |
Pradhan S, Singh S, Rai LC. Characterization of various functional groups present in the capsule of Microcystis and study of their role in biosorption of Fe, Ni and Cr. Bioresource Technology, 2007, 98(3): 595-601. DOI:10.1016/j.biortech.2006.02.041 |
| [22] |
Hadjoudja S, Deluchat V, Baudu M. Cell surface characterisation of Microcystis aeruginosa and Chlorella vulgaris. Journal of Colloid and Interface Science, 2011, 342(2): 293-299. |
| [23] |
Greger M, Johansson M. Aggregation effects due to aluminum adsorption to cell walls of the unicellular green alga Scenedesmus obtusiusculus. Phycological Research, 2004, 52(1): 53-58. DOI:10.1111/pre.2004.52.issue-1 |
| [24] |
Dai GF, Quan CY, Zhang XZ et al. Fast removal of cyanobacterial toxin microcystin-LR by a low-cytotoxic microgel-Fe(Ⅲ) complex. Water Research, 2012, 46(5): 1482-1489. DOI:10.1016/j.watres.2011.11.010 |
| [25] |
聂祥平. 聚合氯化铝铁和粘土应急去除蓝藻的室外模拟研究. 环境科学与技术, 2012, 35(3): 98-103. |
| [26] |
Ramanan S, Tang J, Velayudhan A. Isolation and preparative purification of microcystin variants. Journal of Chromatography A, 2000, 883(12): 103-112. |
| [27] |
Humble AV, Gadd GM, Coddg A. Binding of copper and zinc to three cyanobacterial microcystins quantified by differential pulse polarography. Water Research, 1997, 31(7): 1679-1686. DOI:10.1016/S0043-1354(97)00033-X |
| [28] |
Lei LM, Wu YS, Gan NQ et al. An Elisa-like time-resolved fluorescence immunoassay for microcystin detection. Clinica Chimica Acta, 2004, 348(12): 177-180. |
| [29] |
Mohamed ZA, El-sharouny HM, Ali WS. Microcystin concentrations in the nile river sediments and removal of microcystin-LR by sediments during batch experiments. Archives of Environmental Contamination and Toxicology, 2007, 52(4): 489-495. DOI:10.1007/s00244-006-0140-1 |
| [30] |
Liu GL, Qian Y, Dai SG et al. Adsorption of microcystin-LR and LW on suspended particulate matter (SPM) at different pH. Water Air and Soil Pollution, 2008, 192(1-4): 67-76. DOI:10.1007/s11270-008-9635-x |
| [31] |
Fourest E, Roux JC. Heavy-metal biosorption by fungal mycelial by-products-mechanisms and influence of pH. Applied Microbiology and Biotechnology, 1992, 37(3): 399-403. DOI:10.1007/BF00211001 |
| [32] |
Pivokonsky M, Safarikova J, Bubakova P et al. Coagulation of peptides and proteins produced by Microcystis aeruginosa:interaction mechanisms and the effect of Fe-peptide/protein complexes formation. Water Research, 2012, 46(17): 5583-5590. DOI:10.1016/j.watres.2012.07.040 |
| [33] |
Ma M, Liu R, Liu H et al. Mn(Ⅶ)-Fe(Ⅱ) pre-treatment for Microcystis aeruginosa removal by al coagulation:simultaneous enhanced cyanobacterium removal and residual coagulant control. Water Research, 2014, 65: 73-84. DOI:10.1016/j.watres.2014.07.011 |
| [34] |
Xu H, Zhu G, Qin B et al. Growth response of Microcystis spp.To iron enrichment in different regions of lake Taihu. China.Hydrobiologia, 2013, 700(1): 187-202. DOI:10.1007/s10750-012-1229-3 |
| [35] |
Pan G, Dai L, Li L et al. Reducing the recruitment of sedimented algae and nutrient release into the overlying water using modified soil/sand flocculation-capping in eutrophic lakes. Environmental Science & Technology, 2012, 46(9): 5077-5084. |
 2016, Vol. 28
2016, Vol. 28 
