(2: 西藏大学理学院, 拉萨 850000)
(2: School of Science, Tibet University, Lhasa 850000, P. R. China)
酵母菌是自然界的一大微生物类群,广泛分布于食品、花卉、水果、树木、土壤、发酵物、海洋及淡水等环境中,而湖泊是酵母菌重要栖息生境之一.近年来,国内外学者逐步开展不同类型湖泊酵母菌多样性及其活性研究.Brandão等[1]对阿根廷Nahuel Huapi湖酵母菌多样性进行研究,共获得14属32种的酵母菌; Medeiros等[2]对巴西4个湖泊的酵母菌进行分离与鉴定,并分析环境理化因子与酵母菌多样性的相关性; Silva-Bedoya等[3]从哥伦比亚中心湖和主体湖分离到138株酵母菌,并结合MSP-PCR和26S rDNA D1/D2序列分析研究且比较这2个湖泊酵母菌多样性.我国学者也开展湖泊中活性酵母菌资源的开发,如黄继国等[4]对长春南湖水耐冷酵母菌进行筛选并研究其产酶特性.相对低海拔湖泊而言,高海拔湖泊环境具有低温、辐射强等特点,对其酵母菌多样性及功能特性研究具有重要意义.Libkind等[5-7]对阿根廷高海拔湖水(1370~1700 m)中的酵母多样性以及光保护化合物(类胡萝卜素和类菌胞素)产生能力进行研究,并分离到一些能够产生类菌胞素且抗紫外线的酵母.Russo等[8-9]研究阿根廷巴塔哥尼亚西北部高海拔(1606~1891 m)Rio Agrio and Lake Caviahue (RAC)系统中酵母菌多样性,并获得一些耐酸酵母菌菌株.国内学者近年来也开始逐步开展高原湖泊酵母菌多样性及活性的研究.如周新丽等[10]对云南高原湖泊程海湖湖水酵母菌进行分离、鉴定以及胞外酶活性测定; 严亚萍等[11]研究云南阳宗海酵母菌种群结构,分析环境因子对酵母菌种群分布的影响,并初步测定供试酵母菌产胞外酶活性.
云南抚仙湖位于云南省玉溪市境内,是典型的高原湖泊,同时也是我国第二大深水湖泊[12],湖面海拔1722.5 m,湖泊面积212 km2,平均水深95.2 m,湖心最深处为158.9 m[13].抚仙湖属珠江流域南盘江水系,是珠江源头的第一大湖,湖泊面积和蓄水量分别居全国第8位和第3位,占云南省九大高原湖泊总蓄水量的66.6%[14].抚仙湖流域水资源丰富,既是滇中地区社会经济可持续发展的重要资源保障,又是泛珠三角区域发展的战略水资源,也是珠江流域、西南地区重大战略意义的饮用水源[15].
多年来,学者对云南抚仙湖浮游植物[16-17]、沉水植物[18-19]、浮游动物[20]、大型底栖动物[21]等水生生物多样性进行系统研究,近年来,也有关于抚仙湖沉水植物真菌多样性研究[22]的零星报道,然而尚未见涉及其酵母菌多样性的研究报道.开展抚仙湖酵母菌多样性及其与理化因子相关性研究能够为高原湖泊酵母菌群落特性研究提供理论依据,并为酵母菌资源的保护、开发及利用奠定基础.
1 研究方法 1.1 样点设置云南抚仙湖的湖水采样设置11个点(FW1~FW11)(图 1),采样范围为24°23′~24°38′N,102°50′~102°57′E,各样点详细地理位置见表 1.为更深入了解抚仙湖酵母菌多样性,并系统分析酵母菌多样性与理化因子的相关性等,将抚仙湖11个采样点按照地理位置划分为4个区域,分别为湖心区(FW2、FW3、FW7、FW8)、沿岸区(FW1、FW4、FW5、FW6、FW9、FW10、FW11)、北沿岸区(FW1、FW4、FW5、FW6)以及南沿岸区(FW9、FW10、FW11),其中岸距<1000 m的样点归为沿岸区,岸距≥1000 m的样点归为湖心区.采样时间为2013年12月12日.
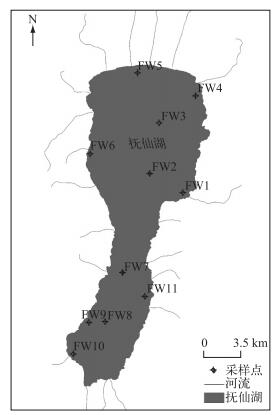
|
图 1 云南抚仙湖采集样点分布 Fig.1 Distribution of sampling sites in Lake Fuxian, Yunnan Province |
| 表 1 云南抚仙湖采样点概况 Tab.1 General situation of sampling sites in Lake Fuxian, Yunnan Province |
为探析酵母菌多样性与湖水理化因子之间的关系,测定抚仙湖表层水7项理化指标,包括酸碱度(pH)、电导率、浊度、总磷(TP)、总氮(TN)、总有机碳(TOC)以及总硬度.
水样的pH值和电导率均采用Orion 5 star (Thermo Scientific)进行测定;浊度采用TN100浊度仪(Eutech Instruments PteLtd.)进行测定.TP、TN、TOC浓度以及总硬度委托昆明绿岛环境科技有限公司检测,分别参照GB 11893-1989(钼酸铵分光光度法)、HJ 636-2012(碱性过硫酸钾消解紫外分光光度法)、GB/T 13193-1991(非分散红外吸收法)以及GB 7477-1987(EDTA滴定法)进行测定.
1.3 酵母菌的分离与保藏采用原位培养法进行酵母菌的分离.培养基及分离方法等参照文献[11]进行,每个水样过滤体积为2400 ml.纯化菌株真空冷冻干燥和甘油管保藏.
1.4 酵母菌的分类鉴定采用经典分类法[23]对获得的菌株进行形态及生理生化特征分析,并结合26S rDNA D1/D2区域序列分析进行分类鉴定.
1.4.1 DNA提取及扩增DNA提取参照文献[24]进行.26S rDNA D1/D2区域序列的PCR扩增和测序参照文献[25]进行.引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′),NL4 (5′-GGTCCGTGTTTCAAGACGG-3′).PCR扩增程序:94℃ 5 min;94℃ 1 min,56℃ 1 min,72℃ 1.5 min,35个循环;72℃ 10 min.1%琼脂糖凝胶电泳检测扩增目标产物后送上海生工生物有限公司测序.
1.4.2 序列分析供试菌株26S rDNA D1/D2测序结果采用DNAStar软件进行图谱分析,对序列进行人工校对后在GenBank核酸序列数据库中进行同源性搜索(BLAST search).然后选取与供试菌株关系较近的模式菌株的26S rDNA D1/D2区域序列比较其相似程度.应用Clustal X进行序列比对,用MEGA 4.0软件的邻接法(Neighbor-Joining)进行分子系统学分析[26].供试菌株的序列已上传至NBCI的GenBank核酸序列数据库,登录号为:KT427537~KT427631.
1.5 数据分析及处理采用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)、Simpson多样性指数(D)、出现频率以及相对丰度等对酵母菌多样性进行分析[21].
采用Excel、SPSS和CANOCO等软件进行数据分析与处理.其中多样性指数计算采用Excel软件,物种多样性与环境因子相关性分析使用SPSS软件中的Pearson分析法,用CANOCO软件进行酵母菌-环境双轴排序.
2 结果与分析 2.1 抚仙湖湖水中酵母菌多样性分析 2.1.1 抚仙湖湖水中酵母菌种类通过原位培养法,从抚仙湖湖水中共获得酵母菌553株(表 2).结合经典分类法及26S rDNA D1/D2区域序列分析法将其中的551株归为22属52种和1个潜在的新分类单元,2株未鉴定.结果显示,73株属于子囊菌酵母(9属12种),占分离菌株数的13.20%;405株为担子菌酵母(12属38种和1个潜在的新分类单元),占73.24%;类酵母73株,仅1属2种(13.20%).
| 表 2 云南抚仙湖11个样点酵母菌种群分布 Tab.2 Distribution of yeast community in Lake Fuxian, Yunnan Province |
抚仙湖湖水中分离获得的隐球酵母属种类最多,为15种,其次分别为红酵母属(6种)、红冬孢酵母属(5种)、假丝酵母属(4种)和线黑粉酵母属(3种).掷孢酵母属、丝孢酵母属、出芽短梗霉属均分离到2种,其他14属都仅为1种.其中FW9样点分离到的酵母菌种数最多,达22种,其次为FW6样点(20种),FW1、FW5以及FW11样点种类最少,均为11种.
酵母菌属水平数据显示,红酵母属相对丰度最高,为38.33%,其次为隐球酵母属(21.68%)和出芽短梗霉属(13.20%).可以看出,红酵母属、隐球酵母属和出芽短梗霉属是抚仙湖湖水中酵母菌的优势属.此外,假丝酵母属、线黑粉酵母属和丝孢酵母属的相对丰度也较高,分别为8.68%、5.78%和4.52%.
分析酵母菌种水平相对丰度,胶红酵母相对丰度最高,为33.27%,其次为出芽短梗霉(12.12%)、浅白隐球酵母(6.69%)、酱油假丝酵母(5.97%)、乳酪隐球酵母(4.88%)、斋藤隐球酵母(4.52%),其余19个种酵母菌各仅分离到1株,相对丰度仅为0.18%.胶红酵母和出芽短梗霉出现频率都为100%,另外,浅白隐球酵母、乳酪隐球酵母和斋藤隐球酵母相对丰度均超过90%.出现频率和相对丰度数据表明,这5个种酵母菌为抚仙湖酵母菌的优势种.
为进一步探讨抚仙湖酵母菌多样性,对湖水中红色酵母菌(红酵母属、红冬孢酵母属、浸麻孢囊线黑粉酵母、浅红掷孢酵母以及瑞纳锁掷孢酵母)丰度及比例进行比较.结果显示,红色酵母菌共242株(43.76%),其中红酵母属211株,占红色酵母菌的87.19%;胶红酵母丰度最高,共计184株,在红酵母属和红色酵母菌中的比例分别为87.20%、76.03%.
2.1.2 抚仙湖不同样点酵母菌多样性指数分析为更合理地探讨云南抚仙湖湖水中酵母菌多样性,对各样点酵母菌Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)和Simpson多样性指数(D)、物种丰富度和总丰度进行分析,结果如表 3所示.
| 表 3 云南抚仙湖湖水不同样点酵母菌多样性指数* Tab.3 Diversity indexes of yeasts in different sites from Lake Fuxian, Yunnan Province |
酵母菌总丰度显示,FW6样点酵母菌丰度明显高于其他样点,为1057 cfu/L,其次为FW4、FW5及FW8样点,总丰度均超过250 cfu/L,其他样点总丰度则较低;红色酵母菌丰度表明,FW6样点总丰度仍为最高,达到885 cfu/L,其次为FW4和FW8,其他样点较低.Duncan检验结果显示,不同样点之间酵母菌以及红色酵母菌丰度分布存在显著性差异(P<0.05).
FW9样点物种丰富度、H′、J′和D均最高,多样性最丰富;其次为FW2样点,H′和D值分别2.28和0.87;FW9样点J′最高,其次是FW11、FW2、FW3和FW7;FW6样点H′、J′和D值最低,分别仅为0.81、0.12和0.31.
2.1.3 抚仙湖不同区域酵母菌多样性指数分析抚仙湖北沿岸区红色酵母菌以及酵母菌总丰度最高,而南沿岸区则最低;H′、J′以及D值比较表明,南沿岸区高于北沿岸区,湖心区高于沿岸区(图 2).然而,Duncan检验结果显示,除J′存在显著性差异外,抚仙湖4个区域其他多样性指数均不存在显著性差异(P>0.05).南沿岸区湖水中酵母菌J′明显高于北沿岸区(P<0.05),说明南沿岸区酵母菌分布明显比北沿岸区均匀.
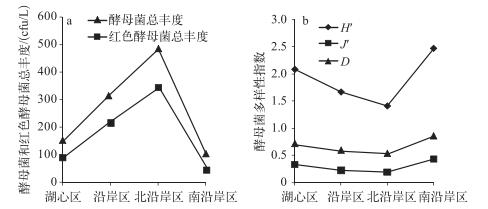
|
图 2 云南抚仙湖各区域酵母菌和红色酵母菌总丰度(a)及酵母菌多样性指数(b)差异性比较 Fig.2 Comparison of yeast and red yeast abundance(a), yeast diversity indexes(b) in different regions of Lake Fuxian, Yunnna Province |
抚仙湖11个样点湖水7项理化因子数据如表 4所示.通过Duncan检验法分析各区域湖水理化因子差异性(表 5)可以看出,各区域电导率、浊度、TP、TN以及总硬度不存在显著性差异(P>0.05),湖心区与其他几个区域相比,pH值存在显著差异(P<0.05),北沿岸区TOC浓度显著高于南沿岸区(P<0.05).
| 表 4 云南抚仙湖不同样点湖水理化因子 Tab.4 Aquatic environmental factors of different sites in Lake Fuxian, Yunnan Province |
| 表 5 云南抚仙湖不同区域湖水理化因子* Tab.5 Aquatic environmental factors of different regions in Lake Fuxian, Yunnan Province |
Pearson相关性分析结果显示(表 6),抚仙湖湖水中酵母菌物种丰富度与7项理化因子之间均不存在显著相关性(P>0.05),相比而言,物种丰富度与TN浓度的相关性系数较高,为0.489.TOC浓度与酵母菌总丰度和红色酵母菌总丰度均存在明显的相关性(P<0.05),相关性系数分别为0.725、0.720,TP浓度与酵母菌总丰度以及红色酵母菌总丰度之间的相关性系数也相对较高,分别为0.391、0.419,但不存在显著性差异.相关性分析结果表明,TOC浓度是影响抚仙湖酵母菌及红色酵母菌总丰度的主要理化因子.
| 表 6 云南抚仙湖湖水酵母菌物种丰富度、总丰度与理化因子相关性 Tab.6 Correlations between species richness, total abundance of yeast and aquatic environmental factors of Lake Fuxian, Yunnan Province |
Pearson相关性分析尽管能够显示理化因子与物种之间的相关性,然而若要直观地反映生物群落随环境条件的变化趋势等,还需要借助多元统计的方法将生物群落进行排序,本文采用CANOCO进行抚仙湖酵母菌与环境相关性分析.首先,利用CANOCO进行去趋势对应分析(DCA),所得结果中第1排序轴的梯度长度值为1.918,根据Ter-Braak等[27]的理论,当该值介于1.5~3.0时,选择线性模型做冗余分析(RDA)或者选择单峰模型做典型对应分析(CCA)均合适,进一步分析,认为选择RDA更合适.
冗余分析排序图可以将样点、物种以及环境因子反映在同一个图上,从而能够直观地反映生物群落组成与环境变量之间的关系.先通过自动预选环境变量的方法选出有显著解释性的环境变量[28],蒙特卡罗置换检验结果显示TOC为显著性解释变量(P<0.05).然后将其他6项环境因子分别作为独立变量进行分析,即将单独解释能力最强的环境变量(TOC)标记为协变量,再将其他的候选变量一一作为唯一的主变量引入分析,结果表明,这6项因子都能够拒绝零假设,即皆能解释响应变量,因此将6项环境因子均选入模型进行偏蒙特卡罗置换检验.检验结果表明这6项理化因子解释量不存在显著性差异,所以最终确定仅进行显著性解释变量TOC与酵母菌群落组成的冗余分析(表 7).
| 表 7 云南抚仙湖湖水酵母菌-TOC浓度冗余分析组成 Tab.7 RDA of yeast community associated with TOC in Lake Fuxian, Yunnan Province |
第1排序轴和第2排序轴对响应变量即物种数据的解释比例共达99%,其中第1排序轴对响应变量的解释比例为47.7%.TOC浓度与第1排序轴相关系数为0.696(P<0.05).尽管第2排序轴的解释量大于第1轴,但蒙特卡罗检验结果显示,不影响第一轴解释量的显著性.
图 3为抚仙湖酵母菌群落组成与TOC浓度冗余分析双轴排序图, 显示沿着第1排序轴正方向,TOC浓度逐渐增加,不同样点TOC浓度高低状况与表 4结果一致.可以看出,通过设定物种适合度排除与排序图的解释参考价值不高的种群后,12个种群的酵母菌在排序图中被展示出来(图 3),胶红酵母等7种酵母菌之间存在较强的正相关性,粘红酵母等4种酵母菌之间也存在较强的正相关性;环境变量与物种之间的相关性在图中通过表示两者射线间的夹角大小得以体现,夹角越小,表示相关性越大,可以看出,TOC浓度与胶红酵母等11种酵母之间存在正相关性,而与沼泽生红冬孢酵母之间则存在负相关性.Pearson相关性分析结果显示,TOC浓度与胶红酵母、汉逊德巴利酵母、库德毕赤酵母、威氏隐球酵母、斯鲁菲亚红酵母存在明显的相关性(P<0.05),相关系数分别为0.694、0.961、0.634、0.634、0.634,与沼泽生红冬孢酵母相关系数为-0.696(P<0.05).由此可知,冗余分析排序图与Pearson相关性分析相一致,说明第1排序轴能够显著预测抚仙湖湖水中酵母菌的种群变化规律.
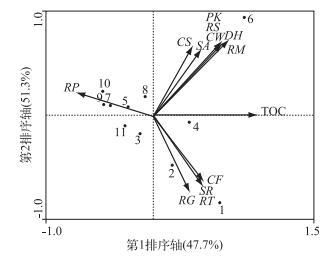
|
图 3 云南抚仙湖湖水酵母菌-TOC浓度冗余分析双序图 Fig.3 RDA ordination diagram of yeast community associated with TOC variable in Lake Fuxian, Yunnan Province (RM:胶红酵母; DH:汉逊德巴利酵母; PK:库德毕赤酵母; RS:斯鲁菲亚红酵母; CW:威氏隐球酵母; SA:浅红掷孢酵母; CS:酱油假丝酵母; RP:沼泽生红冬孢酵母; RG:粘红酵母; RT:台湾红酵母; SR:瑞纳锁掷孢酵母; CF:浅黄隐球酵母; 数字1~11分别表示FW1~FW11采样点) |
从云南抚仙湖共获得553株酵母菌,将其中的551株鉴定为22属52种和1个潜在的新分类单元,表明抚仙湖拥有丰富的酵母菌资源.多样性指数分析结果表明,FW6样点多样性指数最低,而FW9样点酵母菌种类丰富且分布均匀.分析抚仙湖采样点地理位置可以看出,FW6样点位于禄充渔村旁,距离岸边最近,此处人为活动频繁,因而容易导致水体中有机物浓度增加,从而使其中酵母菌群落组成与其他样点存在差异,而FW9样点位于南部湖心偏东岸区域,此区域大都为陡峭的岩石湖岸, 居民区少,旅游污染程度也比较小,此处透明度也明显高于其他区域[29],而透明度与湖泊中TOC浓度等具有密切关系.抚仙湖酵母菌多样性指数差异分析显示,北沿岸区物种丰富度较低,但酵母菌总丰度却高于其他3个区域,另外,南区酵母菌Pielou均匀度指数显著高于北区,究其原因,北区由于滨临澄江坝区,城镇生活污水和农业源污染比较集中,而且东北部大范围的磷矿开采、西北部严重的水土流失等,都加剧了北部湖区的水质污染[29],从而导致北沿岸区某些酵母菌种群丰度增加而影响了此区域酵母菌物种丰富度和均匀度.
云南抚仙湖与云南高原湖泊阳宗海[11]、以及阿根廷高山湖泊[6]酵母菌种群比较结果表明,抚仙湖湖水中分离到的种群最多,其次为阳宗海的13属40种,阿根廷5个高山湖泊仅分离到12属20种.阿根廷5个高山湖泊海拔(1400~1750 m)尽管与抚仙湖差异不大,分离方法也均采用原位培养法,但是2个湖泊仅有5个共有种,包括出芽短梗霉、双倒卵形红冬孢酵母、胶红酵母、斋藤隐球酵母和浅白隐球酵母,显示两者之间酵母菌群落组成存在较大差异.究其原因,除地理位置及其他环境因子不同外,抚仙湖水体透明度范围为0.5~6.2 m[29],而Patagonian高山湖泊中3个湖泊水体透明度最低限为10 m[6],2个湖泊酵母菌种群差异与水体透明度之间可能存在一定关联.
抚仙湖与阳宗海[11]酵母菌分布16个共有种,胶红酵母和出芽短梗霉为共有优势种.分布于2个湖泊的酵母菌还包括红酵母2个种(禾本红酵母和粘红酵母)、隐球酵母7个种(威氏隐球酵母、乌兹别克斯坦隐球酵母、淡黄隐球酵母、乳酪隐球酵母、浅黄隐球酵母、卡恩斯隐球酵母和浅白隐球酵母),另外,异常威克汉姆酵母、库德毕赤酵母、热带假丝酵母、双倒卵形红冬孢酵母以及玉米汉纳酵母5个种也均存在于2个湖泊中.然而,德巴利酵母、半乳糖霉、地霉、类德酵母、拟威尔酵母属、孢囊线黑粉酵母、线黑粉酵母、白冬孢酵母、锁掷酵母、掷孢酵母、丝孢酵母、阿顿尼奥酵母等12种(属)酵母菌却仅在抚仙湖中分离到, 说明云南抚仙湖和阳宗海酵母菌种群组成存在较大差异.
进一步分析发现,阳宗海[11]中分布毕赤酵母5种共29株,其中库德毕赤酵母有17株,相对丰度超过16%,就抚仙湖而言,却仅从TOC浓度最高的FW6湖水样点中分离到1株库德毕赤酵母,相对丰度仅为0.18%.红冬孢酵母分布情况则显示,阳宗海仅分离到2株双倒卵形红冬孢酵母,而抚仙湖湖水中分离到的红冬孢酵母有5种25株,相对丰度达4.52%.这2个种群酵母菌截然不同的分布情况是否受到湖泊中某些理化因子的影响?它们的种群数量差异是否能够反映所处环境的污染程度?结合抚仙湖酵母菌-TOC冗余分析结果(库德毕赤酵母丰度与TOC浓度呈显著正相关;沼泽生红冬孢酵母丰度与TOC浓度呈显著负相关),可以推测抚仙湖水质明显好于阳宗海,而2个湖泊的水质状况也明确证实了上述推测.云南省第三大湖泊阳宗海虽然地理位置和海拔与抚仙湖差异不大,且同属于珠江流域南盘江水系[30],但是由于流域人口的增加和工农业的发展,阳宗海湖体水质恶化呈现富营养化[31],而抚仙湖为贫营养型湖泊,是我国为数不多的保持Ⅰ类水质的大型湖泊[15].
为更深入探讨酵母菌种群分布对环境状况的预测功能以及理化因子对酵母菌群落组成的影响,本文比较了毕赤酵母和红冬孢酵母的分布环境.文献显示,红冬孢酵母主要分布于受人为干扰较小的海洋环境、土壤及植物表面[23],在冰川[32]、热带太平洋[33]等也有少量分布,而毕赤酵母则主要存在于有机碳等营养物质含量丰富的果实[23]、酿酒物(大曲、酒醅、酒渣)[34]、原料乳和发酵乳制品[35]中,另外,污泥、土壤及污水样品[36]中也有分布,进一步证实抚仙湖的水质明显优于阳宗海.综上所述,云南抚仙湖湖水中酵母菌分布与TOC浓度密切相关;酵母菌群落组成尤其某些对环境因子敏感种类(如毕赤酵母、红冬孢酵母等)的生长繁殖受理化因子水平的制约且能够在一定程度上反映湖泊受污染程度;尽管抚仙湖相对其他高原湖泊而言,水质较好,但近年集中在北区东岸(FW6样点所在的区域)的磷矿开发产业对抚仙湖生态系统和流域环境构成威胁[37].
与其他湖泊[1-11, 38-42]酵母菌群落组成比较结果表明,云南抚仙湖含特有酵母菌18种,包括线黑粉酵母(虫生线黑粉酵母、指甲线黑粉酵母、花状线黑粉酵母)、红冬孢酵母(河流红冬孢酵母、沼泽生红冬孢酵母)、隐球酵母(樱桃色隐球酵母、长莓隐球酵母)、红酵母(牧草红酵母、台湾红酵母)、掷孢酵母(浅红掷孢酵母、法夫掷孢酵母)、丝孢酵母(细长丝孢酵母、串珠丝孢酵母)、木糖假丝酵母、长孢类德酵母、梭形假溢酵母、瑞纳锁掷孢酵母以及产酶短梗霉,其中子囊菌酵母1种,担子菌酵母16种(占分离担子菌酵母41%),类酵母1种.18种酵母菌中,其中5种(樱桃色隐球酵母、花状线黑粉酵母、指甲线黑粉酵母、沼泽生红冬孢酵母以及产酶短梗霉)出现频率均超过30%,6种(木糖假丝酵母、虫生线黑粉酵母、花状线黑粉酵母、指甲线黑粉酵母、沼泽生红冬孢酵母和产酶短梗霉)相对丰度均超过1%,另外,线黑粉酵母、掷孢酵母、丝孢酵母、假溢酵母以及类德酵母特有种数占抚仙湖分离种数的比例均为100%.目前文献[23]报道的线黑粉酵母和红冬孢酵母分别为5种和9种,而从抚仙湖就分别分离得到3种和5种,比例均超过50%.研究表明,红冬孢酵母具有产油脂[43]、番茄红素[44]、γ-氨基丁酸[45]以及类胡萝卜素[46]等活性,除此以外还能够降解废水[47]、油烟污染物[48]等,沼泽生红冬孢酵母的生防效果[49-50]则备受关注.可见,云南抚仙湖富含特殊且极具应用潜力的酵母菌资源.
高原湖泊具有特殊的地理位置和环境特征,蕴含丰富且独特的微生物资源,然而其脆弱的生态系统极易受到人为及环境因素的破坏,从而导致其中微生物群落不可逆且快速的演替.尽快系统开展高原湖泊微生物多样性研究,分离并筛选具有特殊应用价值的生物资源,一方面能够为湖泊生态系统的保护提供理论依据,另一方面对于开发、保护及利用微生物资源意义显著.近年来,随着人们对湖泊健康的重视,建立了多种生物指标评价体系,主要生物指标有附着藻类指数、底栖动物多样性指数、鱼类完整性指数等[51].笔者认为深入开展环境因子与酵母菌种群结构相关性研究,从而筛选出对理化因素变化敏感的酵母菌做为环境污染指示菌,具有一定的研究和应用前景.
4 结论云南抚仙湖酵母菌具有丰富的多样性,共分布有22属52种和1个潜在新分类单元的酵母菌;酵母菌-环境冗余分析显示,云南抚仙湖湖酵母菌群落组成的空间分布与TOC浓度密切相关.
致谢: 感谢抚仙湖湖泊管委会和吴程同学在工作上的大力支持.| [1] |
Brandão LR, Libkind D, Vaz Aline BM et al. Yeasts from an oligotrophic lake in Patagonia (Argentina):diversity, distribution and synthesis of photoprotective compounds and extracellular enzymes. FEMS Microbiology Ecology, 2011, 76: 1-13. DOI:10.1111/fem.2011.76.issue-1 |
| [2] |
Medeiros AO, Missagia BS, Brandão LR et al. Water quality and diversity of yeasts from tropical lakes and rivers from the Rio Doce basin in southeastern Brazil. Brazilian Journal of Microbiology, 2012, 43(4): 1582-1594. DOI:10.1590/S1517-83822012000400043 |
| [3] |
Silva-Bedoya LM, Ramírez-Castrilló NM, Osorio-Cadavid E. Yeast diversity associated to sediments and water from two Colombian artificial lakes. Brazilian Journal of Microbiology, 2014, 45: 135-142. DOI:10.1590/S1517-83822014005000035 |
| [4] |
黄继国, 杨柳, 王玉等. 长春南湖水耐冷菌的筛选及其产酶特性. 吉林大学学报:理学版, 2011, 49(1): 153-157. |
| [5] |
Libkind D, Dieguez MC, Moliné M et al. UV Effects on aquatic and coastal ecosystems occurrence of photoprotective compounds in yeasts from freshwater ecosystems of northwestern Patagonia (Argentina). Photochemistry and Photobiology, 2006, 82: 972-980. DOI:10.1562/2005-09-09-RA-679 |
| [6] |
Libkind D, Moliné M, Sampaio JP et al. Yeasts from high-altitude lakes:influence of UV radiation. FEMS Microbiology Ecology, 2009, 69: 353-362. DOI:10.1111/fem.2009.69.issue-3 |
| [7] |
Libkind D, Moliné M, van Broock MR. Production of the UVB-absorbing compound mycosporine-glutamino-glucoside by Xanthophyllomyces dendrorhous(Phaffia rhodozyma). FEMS Yeast Research, 2011, 11(1): 52-59. DOI:10.1111/fyr.2011.11.issue-1 |
| [8] |
Russo G, Libkind D, Sampaio JP et al. Yeast diversity in the acidic RioAgrio Lake Caviahue volcanic environment (Patagonia, Argentina). FEMS Microbiology Ecology, 2008, 65: 415-424. DOI:10.1111/fem.2008.65.issue-3 |
| [9] |
Russo G, Libkind D, Ulloa RJ et al. Crptococcus agionensis sp. nov., a basidiomycetous yeast fo the acidic rock drainage ecoclade isolated from an acidic aquatic environment of volcanic origin. International Journal of Systematic and Evolutionary Microbiology, 2010, 60: 996-1000. DOI:10.1099/ijs.0.012534-0 |
| [10] |
周新丽, 李治滢, 杨丽源等. 云南程海湖酵母菌多样性及应用. 微生物学报, 2011, 51(4): 547-553. |
| [11] |
严亚萍, 李治滢, 董明华等. 云南阳宗海酵母菌种群结构及产胞外酶测试. 微生物学报, 2013, 53(11): 1205-1212. |
| [12] |
Liu W, Wu JL, Zeng HA et al. Geochemical evidence of human impacts on deep Lake Fuxian, southwest China. Limnologica, 2014, 45: 1-6. DOI:10.1016/j.limno.2013.09.003 |
| [13] |
宋媛媛, 冯慕华, 苏争光等. 抚仙湖不同来源沉积物磷形态垂向分布特征. 环境科学学报, 2013, 33(9): 2579-2589. |
| [14] |
李艳萍. 气象因子对抚仙湖水量的影响. 水电能源科学, 2012, 30(12): 34-36. |
| [15] |
高伟, 陈岩, 徐敏等. 抚仙湖水质变化(1980-2011年)趋势与驱动力分析. 湖泊科学, 2013, 25(5): 635-642. DOI:10.18307/2013.0503 |
| [16] |
此里能布, 毛建忠, 赵华刚等. 2011年抚仙湖浮游植物群落结构研究. 环境科学导刊, 2013, 32(3): 26-30. |
| [17] |
潘继征, 熊飞, 李文朝等. 抚仙湖浮游植物群落结构、分布及其影响因子. 生态学报, 2009, 29(10): 5376-5385. DOI:10.3321/j.issn:1000-0933.2009.10.024 |
| [18] |
夏天翔, 李文朝, 熊飞. 抚仙湖不同类型岸带沉水植物分布及水体氮磷特征. 生态学杂志, 2007, 26(6): 846-852. |
| [19] |
熊飞, 李文朝, 潘继征. 云南抚仙湖沉水植物分布及群落结构特征. 云南植物研究, 2006, 28(3): 277-282. |
| [20] |
潘继征, 熊飞, 李文朝等. 抚仙湖浮游甲壳动物群落结构与空间分布. 湖泊科学, 2009, 21(3): 408-414. DOI:10.18307/2009.0315 |
| [21] |
熊飞, 李文朝, 潘继征. 高原深水湖泊抚仙湖大型底栖动物群落结构及多样性. 生物多样性, 2008, 16(3): 288-297. |
| [22] |
Cai L, Tsui CKM, Zhang KQ et al. Aquatic fungi from Lake Fuxian, Yunnan, China. Fungal Diversity, 2002, 9: 57-70. |
| [23] |
Kurtzman CP, Fell JW, Boekhout T. The yeast:A taxonomic study(5th eds). Amsterdam: Elsevier Science Publishers, 2011.
|
| [24] |
Nisiotou AA, Spiropoulos AE, Nychas GJE. Yeast community structures and dynamics in healthy and Botrytis-affected grape must fermentations. Applied and Environmental Microbiology, 2007, 73(21): 6705-6713. DOI:10.1128/AEM.01279-07 |
| [25] |
Kurtzman CP, Robnett CJ. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) ribosomal DNA partial sequences. Antonie van Leeuwenhoek, 1998, 73: 331-371. DOI:10.1023/A:1001761008817 |
| [26] |
白逢彦, 王辰. 海南热带雨林腐木上酵母菌物种多样性研究. 菌物学报, 2009, 28(3): 354-362. |
| [27] |
张杰, 余潮, 王自海等. 不同植被群落表层土壤中细菌群落多样性. 环境科学研究, 2013, 26(8): 866-872. |
| [28] |
Leps J, Šmilauer P. Multivariate analysis of ecological data using CANOCO. Cambridge: Cambridge University Press, 2003, 43-75.
|
| [29] |
潘继征, 熊飞, 李文朝等. 云南抚仙湖透明度的时空变化及影响因子分析. 湖泊科学, 2008, 20(5): 681-686. DOI:10.18307/2008.0519 |
| [30] |
毕建培, 刘晨, 黎绍佐. 阳宗海砷污染水质变化过程分析. 水资源保护, 2014, 30(1): 84-88. |
| [31] |
袁琳娜, 杨常亮, 李晓铭等. 高原深水湖泊水温日成层对溶解氧、酸碱度、总磷浓度和藻类密度的影响:以云南阳宗海为例. 湖泊科学, 2014, 26(1): 161-168. DOI:10.18307/2014.0120 |
| [32] |
Turk M, Plemenitaš A, Gunde-Cimerman N. Extremophilic yeasts:plasma-membrane fluidity as determinant of stress tolerance. Fungal Biology, 2011, 115: 950-958. DOI:10.1016/j.funbio.2011.04.006 |
| [33] |
王祥敏, 李明, 骆祝华等. 热带太平洋活性微生物菌株的筛选和鉴定. 台湾海峡, 2006, 25(4): 465-472. |
| [34] |
王薇, 吴群, 徐岩. 清香型白酒固态酿造过程中酵母种群结构和多样性分析. 微生物学通报, 2012, 39(9): 1272-1279. |
| [35] |
卿蔓君, 白梅, 张勇等. 西藏曲拉和云南乳饼中酵母菌的鉴定及其生物多样性. 微生物学报, 2010, 50(9): 1141-1146. |
| [36] |
覃香香, 周玉恒, 蔡爱华等. 甘蔗糖蜜总糖中提高蔗糖纯度的菌株分离鉴定及生物纯化性能. 广西科学, 2013, 20(1): 40-43. |
| [37] |
冯慕华, 潘继征, 柯凡等. 云南抚仙湖流域废弃磷矿区水污染现状. 湖泊科学, 2008, 20(6): 766-772. DOI:10.18307/2008.0615 |
| [38] |
Libkind D, Brizzio S, Ruffini A et al. Molecular characterization of carotenogenic yeasts from aquatic environments in Patagonia, Argentina. Antonie van Leeuwenhoek, 2003, 84: 313-322. DOI:10.1023/A:1026058116545 |
| [39] |
Medeirosa AO, Kohlera LM, Hamdana JS et al. Diversity and antifungal susceptibility of yeasts from tropical freshwater environments in Southeastern Brazil. Water Research, 2008, 42: 3921-3929. DOI:10.1016/j.watres.2008.05.026 |
| [40] |
de Garcia V, Libkind D, Moliné M et al. Cold-adapted yeasts in patagonian habitats. Springer Berlin Heidelberg, 2014, 123-146. |
| [41] |
Shivaji S, Bhadra B, Rao RS et al. Rhodotorula himalayensis sp. nov., a novel psychrophilic yeast isolated from Roopkund Lake of the Himalayan mountain ranges, India. Extremophiles, 2008, 12: 375-381. DOI:10.1007/s00792-008-0144-z |
| [42] |
Pietryczuk A, Cudowski A, Hauschild T. Effect of trophic status in lakes on fungal species diversity and abundance. Ecotoxicology and Environmental Safety, 2014, 109: 32-37. DOI:10.1016/j.ecoenv.2014.07.032 |
| [43] |
Munch G, Sestric R, Sparling R et al. Lipid production in the under-characterized oleaginous yeasts, Rhodosporidium babjevae and Rhodosporidium diobovatum, from biodiesel-derived waste glycerol. Bioresource Technology, 2015, 185: 49-55. DOI:10.1016/j.biortech.2015.02.051 |
| [44] |
赵山山, 石楠, 张利平. 红酵母系统发育及番茄红素的测定. 安徽农业科学, 2008, 36(12): 4955-4957. DOI:10.3969/j.issn.0517-6611.2008.12.018 |
| [45] |
徐晓波, 蒋冬花, 李杰. 5株生物合成GABA酵母菌株的分离、筛选和鉴定. 微生物学杂志, 2009, 29(1): 55-59. |
| [46] |
杨世平, 吴灶和, 简纪常. 沼泽生红冬孢酵母生长及产类胡萝卜素培养条件的研究. 微生物学杂志, 2011, 31(3): 61-66. |
| [47] |
Zhou WW, Wang WR, Li YH. Lipid production by Rhodosporidium toruloides Y2 in bioethanol wastewater and evaluation of biomass energetic yield. Bioresource Technology, 2013, 127: 435-440. DOI:10.1016/j.biortech.2012.09.067 |
| [48] |
廖雷, 钱公望. 油烟污染物降解优势菌的驯化培育及其性能. 中国环境科学, 2006, 26(6): 727-731. |
| [49] |
Lu LF, Ye CZ, Guo SH et al. Preharvest application of antagonistic yeast Rhodosporidium paludigenum induced resistance against postharvest diseases in mandarin orange. Biological Control, 2013, 67: 130-136. DOI:10.1016/j.biocontrol.2013.07.016 |
| [50] |
Lu LF, Lu HP, Wu CQ et al. Rhodosporidium paludigenum induces resistance and defense-related responses against Penicillium digitatum in citrus fruit. Postharvest Biology and Technology, 2013, 85: 196-202. DOI:10.1016/j.postharvbio.2013.06.014 |
| [51] |
杜程鹏, 李艳华, 赵萍萍等. 抚仙湖后生浮游动物种类组成及水质评价. 环境科学导刊, 2013, 32(4): 46-50. |
 2016, Vol. 28
2016, Vol. 28 

