(2: 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072)
(3: 中国科学院大学, 北京 100049)
(4: 锡林浩特市第六中学, 锡林浩特 026000)
(5: 福建省水产技术推广总站, 福州 350003)
(2: State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(4: NO. 6 Middle School Xilinhot, Xilinhot 026000, P. R. China)
(5: Fujian Marine Products Technical Promotion Station, Fuzhou 350003, P. R. China)
浮游动物是一个生态学范畴的概念,是依据其生活方式而划分的一类生物类群,包括原生动物、轮虫、枝角类和桡足类[1].因其独特的生活方式,在水域生态系统中发挥着重要的作用.一方面浮游动物以食物链为纽带,发挥着上行效应和下行效应,如以浮游植物为食的浮游动物可降低浮游植物的生物量[2],通过原生动物的捕食作用调节水细菌的数量,推动水生态系统的物质循环[3],因此将原生动物称为水中“清道夫”也在情理之中,同时水体中滤食杂食性鱼类能够显著影响浮游动物群落结构,导致浮游动物群落的小型化[4],多元营养捕食和被捕食模型(multi-nutrient predator-prey model)指出,有害蓝藻水华会以牺牲藻类物种丰富度为代价来获取自身的生长,以对抗浮游动物的捕食作用,这一点也需引起注意[5].另一方面由于原生动物在不同的污染带指示种有所不同,因此在水质监测中扮演着重要的角色[6].同时在全球变暖背景下,温带海域北黄海浮游动物暖水种种类增加、分布北移,暖温种丰度升高,与之不同的是,亚热带海域东海浮游动物暖水种丰度增加、暖温种丰度降低,这种差异反映了不同生态类群浮游动物对气候变化的响应不同,从而不同温度区系浮游动物对气候变化的响应也不同[7];由于气候的变暖,Aleknagik湖的Daphnia和Bosmina这2种浮游动物的生产力和丰度显著提高[8],气候变暖也会缩小浮游植物和食藻性浮游动物生物量高峰之间的时间间隔[9].在全球气候变暖和人类活动对自然影响的框架之下,高原水域生态安全屏障愈发突出,通过有效监测浮游动物群落,积极推动高原水域生态系统的健康发展则显得尤为重要.
1 实验设计和数据处理关于研究区域概况、采站设置、采样时间、环境因子的采集和分析、数据统计和分析等内容参考同系列文章[10-12].
用25#浮游生物网过滤200 L水样,加入鲁哥氏剂,带回实验室,静置48 h后浓缩.原生动物计数时,将浓缩样充分摇匀后吸取0.1 ml置于计数框内,在10×20倍显微镜下全片观察,每个样品计数2次.2次计数结果与其平均数之差小于10%的结果有效,否则需计数第3片.轮虫类、枝角类、桡足类需对采集样品瓶全瓶观察并计数,根据相关参考文献,将浮游动物鉴定到种或属[6, 13-14].
对原生动物进行定量分析,公式为:
| $ 原生动物 = 2片计数框某种原生动物的个数 \times \frac{{浓缩样品体积}}{{分析样品体积 \times 取样样品体积}} $ | (1) |
使用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)、物种丰富度(SR)、总丰度(TA)和浮游动物生物量来判别尼洋河浮游动物的多样性.H′和J′计算公式分别为[15]:
| $ H' =-\sum\limits_{i = 1}^S {{p_i}} \cdot \ln {p_i} $ | (2) |
| $ J' = H'/H{'_{\max }} = H'/\ln S $ | (3) |
式中,S为浮游动物种类数,pi为浮游动物i占所有浮游动物的比例(%).H′max为理论上最大多样性指数.
物种丰富度:指某一采样点或者季节出现的物种个数.
总丰度:指某一采样点或者季节单位体积出现的浮游动物个体数量,单位为ind./L.
浮游动物生物量:指某一区域浮游动物的重量,单位为mg/L.
出现频率:指某一浮游动物出现的次数占所有调查样点数的百分比.
相对丰度:指某一浮游动物个体数占所有物种个体数的百分比.
2 结果分析 2.1 尼洋河浮游动物种类以及优势种尼洋河原生动物9目13科14属,轮虫1目7科17属,枝角类仅1目1科1属,桡足类2目2科2属.原生动物以砂壳虫和瞬目虫为主,出现频率分别为43.75%和43.75%,相对丰度分别为21.70%和23.80%,合计超过了45%;轮虫则以橘轮虫和单趾轮虫为主,出现频率分别为37.50%和25.00%,但相对丰度均未超过1%(表 1).
| 表 1 尼洋河浮游动物种类出现频率和相对丰度 Tab.1 Occurrence frequency and relative abundance of zooplankton species in Niyang River |
尼洋河浮游动物以原生动物和轮虫为主(表 1),尼洋河原生动物与轮虫总丰度在季节方面存在相似的演替规律(图 1),即出现2次高峰和2次低谷,2次高峰分别出现在春、秋季,2次低谷分别出现在夏季和冬季,尼洋河原生动物与轮虫生物量在季节方面演替则有所不同,原生动物生物量只有1个低谷,出现在夏季,而轮虫生物量则有2个低谷,分别出现在夏季和冬季.在尼洋河沿程方面,随着海拔的升高,原生动物总丰度和生物量基本呈现下降趋势,轮虫的总丰度和生物量均在秋季出现高峰.

|
图 1 尼洋河原生动物、轮虫丰度和生物量的时空演替特征 Fig.1 Spatio-temporal succession characteristics of abundance and biomass for protozoa and rotifera in Niyang River |
用PCA方法探究尼洋河浮游动物时空特征(图 2),结果表明,尼洋河下游较其它河段浮游动物丰富,夏、秋季与冬、春季浮游动物有较大的不同,底质为砂石的河段浮游动物较底质为粘土的河段丰富,可见底质为砂石的河道对浮游动物群落结构有着很重要的影响.
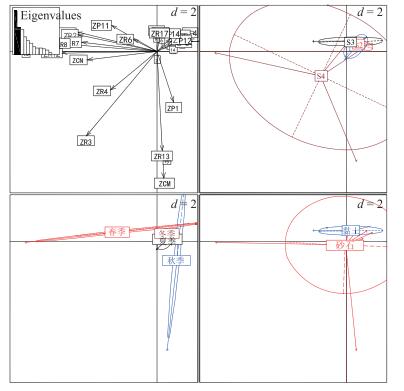
|
图 2 基于PCA分析尼洋河浮游动物时空特征 Fig.2 Spatio-temporal character for zooplankton in Niyang River based on PCA (图中数字为样点标记,其中1、2、3、4分别为采样点Ⅰ的春、夏、秋、冬季;5、6、7、8分别为采样点Ⅱ的春、夏、秋、冬季;9、10、11、12分别为采样点Ⅲ的春、夏、秋、冬;13、14、15、16分别为采样点Ⅳ的春、夏、秋、冬季. S1~S4分别指采样点Ⅰ~Ⅳ; 浮游动物编号同表 1.第1主成分解释率为25.4%(图中左上图第1条黑色柱所示),第2主成分解释率为15.8%(图中左上图第2条黑色柱所示),前两个主成分解释率和达41.2%) |
为了更进一步反映尼洋河浮游动物群落的时空特征,本文选择物种丰富度、总丰度、Shannon-Wiener多样性指数、均匀度指数以及生物量,分析以上5个指标在尼洋河沿程及季节浮游动物群落变化情况,结果如图 3所示.
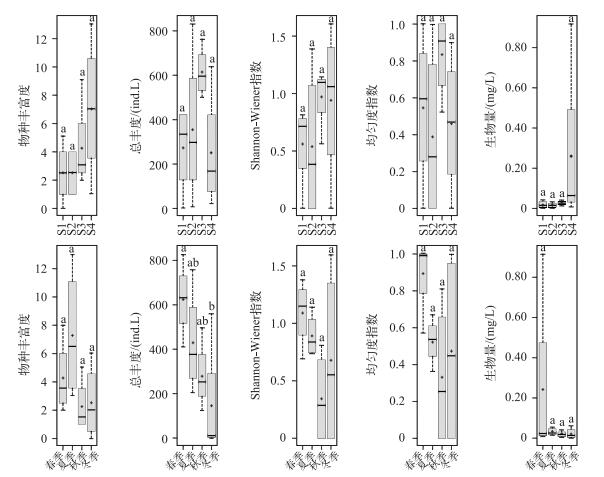
|
图 3 尼洋河浮游动物时空变化特征 Fig.3 Spatio-temporal dynamic character for zooplankton in Niyang River (“·”表示尼洋河浮游动物评价参数的平均值,用Duncan法检验各采样点以及季节之间浮游动物参数差异性,不同字母表示处理间差异达显著水平(P < 0.05)) |
尼洋河浮游动物沿程变化方面,浮游动物群落5个指标不存在显著差异(P>0.05).随着海拔的升高,尼洋河浮游动物丰富度和生物量呈现减小的趋势,丰富度最大值为7,最小值也超过了2,生物量最大值超过了0.20 mg/L, 最小值则维持在0.02 mg/L左右.Shannon-Wiener多样性指数和均匀度指数呈现相似的变化规律,即:均出现2个波峰和2个低谷,2个波峰分别出现在尼洋河中上游和中下游,2个低谷则分别出现在尼洋河中游和下游;Shannon-Wiener多样性指数介于0.5~1.0之间,均匀度指数则介于0.4~0.9之间.尼洋河浮游动物总丰度波峰出现在尼洋河中下游,高于600 ind./L,最小值则出现在尼洋河下游,在200 ind./L以上.
尼洋河浮游动物季节变化方面,仅总丰度秋季和冬季之间存在显著差异(P < 0.05),其他4个指标在各个季节之间均不存在显著差异(P>0.05).浮游动物总丰度和生物量变化趋势相似,均表现为秋季>春季>夏季>冬季,总丰度最大值超过600 ind./L,最小值则低于200 ind./L,生物量最大值超过0.20 mg/L, 最小值则低于0.02 mg/L.浮游动物Shannon-Wiener多样性指数和均匀度指数表现为相似的变化趋势,即:均在夏季出现1个低谷,最大值出现在秋季; Shannon-Wiener多样性指数介于0.4~1.2之间,均匀度指数介于0.3~0.9之间.浮游动物物种丰富度最大值出现在春季,在7左右,最小值出现在夏季,在2左右.
2.3 尼洋河浮游动物与环境因子关系及关键预测因子为了更加清晰地阐释尼洋河浮游动物与环境因子之间的关系,我们将浮游动物主要的2个类群(原生动物和轮虫)与9项环境指标进行CCA分析,9项环境指标包括表层水温、表层pH值、硬度、矿化度、表层溶解氧、总氮、氨氮、总磷、总碱度,详见图 4.结果显示,原生动物类群里,砂壳虫属丰度受水体溶解氧浓度的影响较大,前管虫、袋座虫、肾形虫、瞬目虫和斜口虫属丰度受水体矿化度的影响较大,鳞壳虫属丰度则主要与水体中氨氮浓度关联较大.轮虫类群里,单趾轮虫、无柄轮虫、枝胃轮虫、囊足轮虫丰度与水体矿化度关联较大,龟甲轮虫丰度则与总磷浓度有着较大的关联.
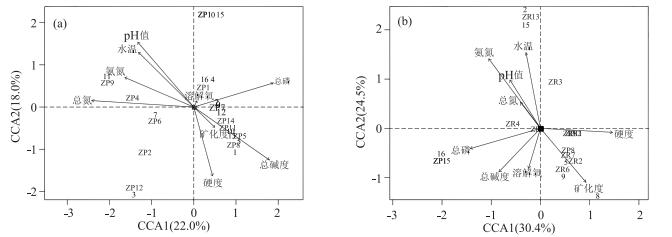
|
图 4 基于CCA方法分析尼洋河原生动物(a)以及轮虫(b)与环境因子、采样点的关系 Fig.4 Relationships among protozoa (a) or rotifera (b), environment factors and sampling sites in Niyang River based on CCA |
选择浮游动物总丰度、Shannon-Wiener多样性指数、均匀度指数3项指标,采用CART模型预测浮游动物群落与环境因子的相互作用关系(图 5),结果显示,尼洋河浮游动物总丰度受到硬度、季节、海拔以及河道底质等因素的影响.具体来讲,在春、冬季,在硬度≥2.305°DH的水体中,浮游动物总丰度为1.67 ind./L;在夏、秋季,在硬度≥ 2.305°DH的水体中,浮游动物总丰度为256 ind./L;在海拔高于3086 m的水域里,当硬度 < 2.305°DH时,浮游动物总丰度为0 ind./L;冬季,在海拔低于3086 m的水域中,当硬度 < 2.305°DH时,浮游动物总丰度为16.68 ind./L;在春、夏和秋季,在海拔低于3086 m的水域中,当硬度 < 2.305°DH,同时底质为砂石时,浮游动物总丰度为125 ind./L;在春、夏和秋季,在海拔低于3086 m的水域中,当硬度 < 2.305°DH,同时底质为黏土时,浮游动物总丰度为500 ind./L.综上所述,CART模型显示,冬季浮游动物总丰度较低,高海拔时,浮游动物总丰度也比较低.
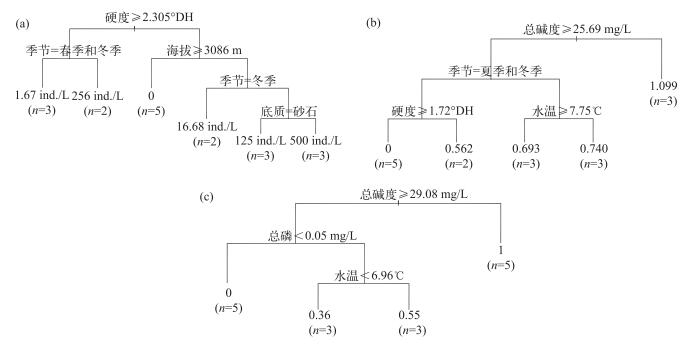
|
图 5 基于分类回归树分析尼洋河浮游动物总丰度(a)、Shannon-Wiener多样性指数(b)、均匀度指数(c)与环境因子之间的关系 Fig.5 Relationships between total abundance(a), Shannon-Wiener diversity index(b), Pielou evenness index(c) of zooplankton and environment factors in Niyang River based on CART |
尼洋河浮游动物Shannon-Wiener多样性指数受到总碱度、季节、硬度和水温的影响较大.具体来讲,当总碱度 < 25.69 mg/L时,浮游动物Shannon-Wiener多样性指数为1.099;在冬、夏季,在总碱度≥ 25.69 mg/L的水体中,同时硬度≥1.72°DH时,浮游动物Shannon-Wiener多样性指数为0;在冬、夏季,当总碱度≥ 25.69 mg/L的水体中,同时硬度 < 1.72°DH时,浮游动物Shannon-Wiener多样性指数为0.562;在春、秋季,水温≥7.75℃的水体中,当总碱度≥25.69 mg/L时,浮游动物Shannon-Wiener多样性指数为0.693;在春、季,水温 < 7.75℃的水体中,当总碱度≥25.69 mg/L时,浮游动物Shannon-Wiener多样性指数为0.740.综上所述,CART模型显示,低总碱度、低硬度的水体,浮游动物Shannon-Wiener多样性指数较高,春、秋季的浮游动物Shannon-Wiener多样性指数也较高.
尼洋河浮游动物均匀度指数受总碱度、总磷浓度和水温的影响较大.具体来讲,当总碱度 < 29.08 mg/L时,浮游动物均匀度指数为1;当总碱度≥29.08 mg/L且总磷浓度 < 0.05 mg/L时,浮游动物均匀度指数为0;在水温 < 6.96℃的水体中,同时总碱度≥29.08 mg/L和总磷浓度 < 0.05 mg/L时,浮游动物均匀度指数为0.36;在水温≥6.96℃的水体中,同时总碱度≥29.08 mg/L和总磷浓度 < 0.05 mg/L时,浮游动物均匀度指数为0.55.综上所述,CART模型显示,低碱度的水体浮游动物均匀度指数较高,高总碱度、低总磷浓度的水体浮游动物均匀度指数较低,水温较高的水体浮游动物均匀度指数也较高.
3 讨论海拔决定一个地区的温度和光照等环境因素的变化,属于宏观尺度的环境因子,通常情况下,由于海拔的升高,水域温度降低,冰冻期延长[18-19],物种的丰富度也随之降低[20].由此可见,海拔通过对水温的直接影响,从而间接影响水生生物的群落结构.研究表明随着温度的升高,枝角类较桡足类更易适应温度的变化,意味着气候变暖将改变浮游动物群落结构[21],水温对浮游动物群落结构的影响不容忽视.小江回水区浮游动物群落现存量与水温呈显著正相关[22]; 上海崇明明珠湖原生动物密度和生物量均与水温呈正相关[23]; 温瑞塘河的水温是影响浮游动物密度变化最主要的因素[24]; 乐清湾海域浮游动物物种数与水温呈极显著正相关,丰度与水温呈极显著正相关,生物量与水温呈极显著正相关[25].这些资料一致显示,水温与浮游动物密度和生物量存在正相关.回顾本实验结果,随着尼洋河海拔高度不断提升(自采样点Ⅳ到采样点Ⅰ),浮游动物的物种丰富度和生物量呈现递减的趋势,关于浮游动物总丰度,以尼洋河下游(采样点Ⅲ)为转折点,这个河段以上,总丰度与海拔呈负相关,尼洋河与雅鲁藏布江交汇处浮游动物总丰度回落幅度较大,原因有待进一步探讨.
另外,浮游动物群落结构对营养盐的响应也值得关注,营养盐(C)来源有:流域内岩石风化产物(Cw)、人为因素贡献(Canth)、大气降水(Cdry)、大气干沉降(Cwet)、生物圈贡献(Cbio)和物质再循环过程中的净迁移量(Cexch)[26],可表示为:
| $ C = {C_{\rm{w}}} + {C_{{\rm{anth}}}} + {C_{{\rm{dry}}}} + {C_{{\rm{wet}}}} + {C_{{\rm{exch}}}} $ | (4) |
研究表明,由于营养盐的输入,丰水季的原生动物多样性指数与种类数大于枯水季[27],同时,营养盐能够积极推动浮游动物群落结构组成和演变.如:上海崇明明珠湖浮游动物的密度和生物量与总氮、总磷、叶绿素a浓度呈正相关[23].温瑞塘河的高锰酸盐指数、总氮和氨氮浓度对浮游动物的密度分布也有重要影响,但总氮浓度的变化趋势由氨氮浓度大小决定[24].乐清湾海域浮游动物物种数与盐度、叶绿素a浓度、浮游植物细胞密度均呈极显著正相关;丰度与叶绿素a浓度、浮游植物细胞密度呈极显著正相关;生物量与叶绿素a浓度呈极显著正相关[25].需要强调的是,不同的季节,浮游动物群落结构的相关环境因子有可能发生变化,如:崇明东滩潮沟盐度是影响冬、春季涨潮时浮游动物总丰度分布的主要因子,水温则是影响夏、秋季涨潮时总丰度分布的主要因子[28].回顾我们的实验结果,尼洋河是以融水为主的河流[10],融水量的多少直接影响到营养盐大小,从而对浮游生物群落结构产生影响.在夏季,尼洋河开始有大量的雪融水和天然降水源源不断输入,虽然有营养盐的补给,但是此时水流较急,不适宜大量浮游动物生长和繁殖,导致尼洋河夏季浮游动物生物量、物种丰富度、总丰度较低,其中夏季浮游动物物种丰富度最低,而浮游动物生物量和总丰度则仅高于冬季(归咎于低温).
由于浮游动物是一类完全没有游泳能力,或者游泳能力微弱,不足以抵抗水体流动的生物群体[1],水流对浮游动物群落结构的作用不容忽视.尼洋河浮游动物Shannon-Wiener多样性指数和均匀度指数更多地受到水体稳定性的影响,这种稳定性是营养盐的输入、水流流速大小以及水温的综合反映.回顾我们的实验结果,沿程方面,采样点Ⅱ为巴河和尼洋河的交汇处,采样点Ⅳ为尼洋河与雅鲁藏布江的交汇处[10],河水的交汇导致水体不稳定,尼洋河浮游动物Shannon-Wiener多样性指数和均匀度指数在这2个河段处于低谷位置.季节方面,由于夏季水流较急,水体不稳定,尼洋河浮游动物Shannon-Wiener多样性指数和均匀度指数最低,另外,受到低温的影响,尼洋河冬季的浮游动物Shannon-Wiener多样性指数和均匀度指数则处于次之的位置.
但是随着人为干扰因素的不断加大,如水库、水坝、水电站的建设,特别强调的是,水电站的建设改变了自然河流的水文节律,导致河流的流量特征发生改变,引起河流中各类物种发生演替[29],成为影响河流流量的三大原因之一[30],同时还会减少淡水生态系统服务和产品价值[31],改变天然水体的水流和水质理化状况,导致浮游动物群落结构也随之改变,如:长江上游随着水库水文情势的变化,原生动物种类组成也由以有壳肉足虫为主的河流型逐渐转变为以纤毛虫占优势的静水型种类[32],加强对尼洋河浮游动物连续性动态监测则显得尤为重要,从而为尼洋河水域生态可持续发展提供依据.
| [1] |
刘建康. 高级水生生物学. 北京: 科学出版社, 1999, 199-223.
|
| [2] |
Pogozhev PI, Gerasimova TN. The role of zooplankton in the regulation of phytoplankton biomass growth and water transparency in water bodies polluted by nutrients. Water Resourse, 2011, 38(3): 400-408. DOI:10.1134/S009780781101009X |
| [3] |
周可新, 许木启, 曹宏. 原生动物的捕食作用对水细菌的影响. 水生生物学报, 2003, 27(2): 191-195. |
| [4] |
陈炳辉, 刘正文. 滤食杂食性鱼类放养对浮游动物群落结构的影响. 生态科学, 2012, 31(2): 161-166. |
| [5] |
Mitra A, Flynn KJ. Promotion of harmful algal blooms by zooplankton predatory activity. Biology Letters, 2006, 2(2): 194-197. DOI:10.1098/rsbl.2006.0447 |
| [6] |
沈韫芬, 章宗涉, 龚循矩等. 微型生物监测新技术. 北京: 中国建筑工业出版社, 1990.
|
| [7] |
杨青, 王真良, 樊景凤等. 北黄海秋、冬季浮游动物多样性及年间变化. 生态学报, 2012, 32(21): 6747-6754. |
| [8] |
Carter JL, Schindler DE. Responses of zooplankton populations to four decades of climate warming in lakes of southwestern Alaska. Ecosystems, 2012, 15(6): 1010-1026. DOI:10.1007/s10021-012-9560-0 |
| [9] |
Aberle N, Bauer B, Lewandowska A et al. Warming induces shifts in microzooplankton phenology and reduces time-lags between phytoplankton and protozoan production. Marine Biology, 2012, 159(11): 2441-2453. DOI:10.1007/s00227-012-1947-0 |
| [10] |
刘海平, 叶少文, 杨学峰等. 西藏尼洋河水生生物群落时空动态及与环境因子的关系:1.浮游植物. 湖泊科学, 2013, 25(5): 695-706. DOI:10.18307/2013.0511 |
| [11] |
刘海平, 叶少文, 杨学峰等. 西藏尼洋河水生生物群落时空动态及与环境因子关系:2.着生藻类. 湖泊科学, 2013, 25(6): 907-915. DOI:10.18307/2013.0615 |
| [12] |
刘海平, 叶少文, 杨学峰等. 西藏尼洋河水生生物群落时空动态及与环境因子关系:3.大型底栖动物. 湖泊科学, 2014, 26(1): 154-160. DOI:10.18307/2014.0119 |
| [13] |
王家楫. 中国淡水轮虫志. 北京: 科学出版社, 1961.
|
| [14] |
中国科学院动物研究所甲壳动物研究组. 中国动物志. 北京: 科学出版社, 1979.
|
| [15] |
Shannon EE, Weaver W. The mathematical theory of communication. London: University Illinois Press, 1949, 125.
|
| [16] |
Pielou EC. Ecological diversity. New York: John Wiley, 1975, 165.
|
| [17] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002, 45-46, 109, 121-124.
|
| [18] |
Rundle SD, Jenkins A, Ormerod SJ. Macroinvertebrate communities in streams in Himalaya, Nepal. Freshwater Biology, 1993, 30(1): 169-180. DOI:10.1111/fwb.1993.30.issue-1 |
| [19] |
Ao M, Alfred JRB, Gupta A. Studies on some lotic systems in the north-eastern hill regions of India. Limnologica, 1984, 15(1): 135-141. |
| [20] |
Suren AM. Macroinvertebrate communities of streams in western Nepal:effects of altitude and land use. Freshwater Biology, 1994, 32(2): 323-336. DOI:10.1111/fwb.1994.32.issue-2 |
| [21] |
Ekvall MK, Hansson LA. Differences in recruitment and life-history strategy alter zooplankton spring dynamics under climate-change conditions. PloS ONE, 2012, 7(9): e44614. DOI:10.1371/journal.pone.0044614 |
| [22] |
陈小娟, 潘晓洁, 冯坤等. 小江回水区原生动物和轮虫群落结构特征研究. 水生态学杂志, 2012, 33(5): 31-35. |
| [23] |
陈立婧, 顾静, 胡忠军等. 上海崇明明珠湖原生动物的群落结构. 水产学报, 2010, 34(9): 1404-1413. |
| [24] |
肖佰财, 孙陆宇, 冯德祥等. 温瑞塘河后生浮游动物群落结构及其与环境因子的关系. 水生态学杂志, 2012, 33(4): 14-20. |
| [25] |
徐晓群, 曾江宁, 陈全震等. 乐清湾海域浮游动物群落分布的季节变化特征及其环境影响因子. 海洋学研究, 2012, 30(1): 34-40. |
| [26] |
何敏. 小流域风化剥蚀作用及碳侵蚀通量的初步研究[学位论文]. 昆明: 昆明理工大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10674-1011056619.htm
|
| [27] |
吴生桂, 简东, 曾强等. 东江水库对耒水中下游原生动物的影响. 长江流域资源与环境, 2000, 9(1): 125-129. |
| [28] |
李强, 安传光, 徐霖林等. 崇明东滩潮沟浮游动物数量分布与变动. 海洋与湖沼, 2010, 41(2): 214-222. DOI:10.11693/hyhz201002009009 |
| [29] |
IUCN-International Union for the conservation of Nature.Vision for water and nature:a world strategy for conservation and sustainable management of water resources in the 21st century.Gland (Switzerland) and Cambridge (UK):IUCN, 2000. http://www.cabdirect.org/abstracts/20001913417.html
|
| [30] |
Brian DR, Ruth M, David LH et al. Ecologically sustainable water management:managing river flows for ecological integrity. Ecological Applications, 2003, 13(1): 206-224. DOI:10.1890/1051-0761(2003)013[0206:ESWMMR]2.0.CO;2 |
| [31] |
Collier M, Webb R, Schmidt J.Dams and rivers:primer on the downstream effects of dams.US Geological Survey Circular 1126.US Geological Survey, Tucson, Arizona, 1997. http://www.researchgate.net/publication/245831214_Dams_and_rivers_a_primer_on_the_downstream_effects_of_dams
|
| [32] |
郑金秀, 胡菊香, 周连凤等. 长江上游原生动物的群落生态学研究. 水生态学杂志, 2009, 2(2): 88-93. |
 2016, Vol. 28
2016, Vol. 28 

