(2: 南京林业大学南方现代林业协同创新中心, 南京 210037)
(2: Co-innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, P. R. China)
三峡大坝的修建使库区形成了落差近30 m、面积达300 km2的消落带, 随着库区秋冬季的蓄水及水位的频繁波动, 生长在消落带不同海拔高程及沿岸的植物将遭受不同强度的水淹, 面对如此复杂多变的水淹环境, 一些适应性差的植物逐渐死亡, 从而加剧消落带生境的破碎及植被的退化, 对库区生物多样性、生态系统结构与功能产生严重的影响[1].如何恢复和重建消落带植被, 保证其生态功能的良好运行, 是当今亟待解决的重要科学问题[2].有研究表明, 乡土树种在维持库区生态环境, 确保库岸生态系统功能的正常发挥中起到重要的作用, 因此, 筛选乡土树种进行消落带的生态恢复将成为一种快速而行之有效的方式[3-4].
中华蚊母树(Distylium chinense(Franch.) Diels)是三峡库区具有代表性的乡土树种, 具有耐淹性强、根系发达、生长快、适应性强的特点, 主要分布在长江及其支流两岸海拔150 m以下陡峭山坡上和石壁中, 成株高度为0.8~1.2 m.但由于三峡库区的修建, 其原有栖息地被淹没, 天然资源濒临灭绝.近几年来, 有学者逐渐尝试通过人工种植中华蚊母树的方式来重建库区消落带植被, 并取得良好的效果, 如冯义龙等[5]通过示范区种植发现, 中华蚊母树可以在消落带海拔163 m以上存活生长.
植株是否耐淹主要是由其生理特性所决定, 一些植物可以通过形成不定根、特化皮孔以及通气组织来适应淹水环境[6]; 一些植物能够调节体内各种保护酶的活性、渗透调节物质的含量来增加对水淹的抵御能力[7]; 还有一些植物可以保持低的碳水化合物代谢或根部形成更多的碳水化合物(尤其是淀粉)作为储备物质来适应淹水胁迫等[8]; 有关中华蚊母树耐淹机制的研究也开展了大量的工作, 涉及生长[9-10]、光合[10-11]、质膜透性[12]以及非结构碳水化合物[13]等方面, 为保证航运安全, 中华蚊母树在消落带进行恢复时应在消落带的高海拔区域(165~175 m)种植, 而消落带高海拔区域在秋、冬季节(每年10月至次年3月)最长可遭受近5个月的水淹, 而目前针对于中华蚊母树在库区消落带的这种恢复特点以及受水淹情况开展的研究还比较少, 一些学者已经开始尝试研究中华蚊母树生长(基径、株高和叶片增加量)和光合特性对秋、冬季节短期淹水的响应[10-11], 但仍缺乏中华蚊母树对更长时间水淹的响应机制的研究, 同时, 除植物光合在植物抵抗水淹胁迫中起关键作用外, 内部的生理代谢(如渗透调节物质、抗氧化酶等)也发挥了重要作用.水淹对植物的胁迫作用最主要的是缺氧, 在缺氧植物细胞中, 其氧化胁迫反应与分子氧还原生成有毒的自由基, 而植物内部生理代谢的调节作用可以抵抗活性氧分子的毒害.因此, 本研究模拟消落带秋、冬季节高海拔区域淹水环境, 选取2年生中华蚊母树为研究对象, 从生物量和生理生化特性2个方面, 对其耐淹机理进行研究, 旨在揭示中华蚊母树幼苗生长及生理生化特性对秋、冬季长期淹水的响应, 从而为三峡库区消落带耐淹植物的筛选以及植被的恢复与重建提供理论基础.
1 材料与方法 1.1 材料与地点2012年8月将2年生中华蚊母树幼苗移栽至花盆中, 每盆1株.盆高17 cm, 盆口直径22 cm.供试土壤为当地砂壤土, 每盆土重3.5 kg.将所有实验植株置于湖北秭归三峡库区森林生态系统国家定位观测研究站(30°53′N, 110°54′E; 海拔高度296 m)进行相同光照和水分条件的管理.于2012年10月1日选取204棵长势基本一致的中华蚊母树(平均株高为24.5 cm, 平均基径为6.5 mm)开展实验.
1.2 实验设计本实验模拟三峡库区秋、冬季(10-3月份)水位动态变化节律(水位数据来自于中国长江三峡集团公司)(图 1), 将实验用苗随机分成3组, 分别为对照组(CK)、部分水淹组(PF)以及全淹组(CF), 每组68盆.其中CK组进行常规水分管理; PF组水面在土壤上方12 cm左右; CF组水面没过植株20 cm左右. PF组在长、宽、高分别为4 m×4 m×0.45 m的水池中进行, CF组在长、宽、高为4 m×4 m×0.75 m的水池中进行, 由于模拟用水相对清澈, 为充分模拟全淹植物在消落带水体中受到的低光强环境, 本研究在CF组水池上方布设一层遮阴网, 使得到达水下植物的光照强度小于10 μmol/(m2·s)[14-15].实验共持续150 d.
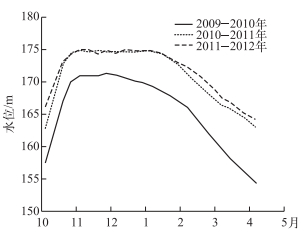
|
图 1 2009-2012年秋、冬季三峡库区消落带水位变化 Fig.1 Water levels of autumn and winter in the Three Gorges Reservoir during 2009-2012 |
于实验开始的第0、7、15、30、60、90、120、150 d分别随机选取中华蚊母树幼苗对其叶片进行取样, 然后放入液氮罐中进行冷冻保存以用于可溶性蛋白、脯氨酸、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)含量等指标的测定, 每个处理设3次重复.同时在每次取样的当天每个处理再选取3棵植株, 将所有叶片全部取完, 放入105℃烘箱中杀青15 min, 后调至70℃烘干48 h, 叶片烘干后, 研磨混匀, 以用于可溶性糖含量的测定.
1.3 指标测定 1.3.1 生物量的测定实验结束后, 每处理选取6株植株, 将植株从花盆中取出, 清洗根部的土, 分根、茎、叶放入105℃烘箱中杀青15 min, 后调至70℃烘干至恒重, 以用于生物量的测定.
1.3.2 可溶性蛋白、丙二醛及抗氧化酶活性的测定参照Grace等[16]的方法, 稍作修改.称取植物组织叶片0.3 g, 在液氮中研成粉末, 加入3 ml提取缓冲液[0.1 mol/L K2HP04-KH2PO4(pH=7.6), 1 mmol/L EDTA, 0.3% Triton X-100, 4% PVP]及少许石英砂于冰浴中研磨匀浆, 14652转/min、4℃离心20 min, 取上清液并分装保存于-70℃超低温冰箱, 用于MDA、可溶性蛋白含量及抗氧化酶活性的测定.可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[17], MDA含量的测定采用硫代巴比妥酸比色法[17], SOD活性的测定利用氮蓝四唑比色法[13], CAT活性的测定参照Knörzer等[18]的方法, APX活性的测定参照Nakanno等[19]的方法.
1.3.3 脯氨酸的测定脯氨酸含量的测定参照李合生[17]的方法.称取样品0.1 g, 加入3%磺基水杨酸3 ml研磨成匀浆, 转移至试管中, 沸水浴10 min, 冷却后转移至10 ml离心管中, 3000转/min离心10 min.取上清液1 ml, 置于10 ml带塞试管中, 加入1 ml冰乙酸、1 ml酸性茚三酮沸水浴30 min, 冷却后加入3 ml甲苯, 摇匀振荡30 s, 静置片刻, 取上层红色甲苯液相于比色杯中, 在520 nm处测定吸光度.利用脯氨酸制作标准曲线.
1.3.4 可溶性糖的测定利用Waters2695型高效液相色谱仪(美国)测定可溶性糖的含量.色谱条件:色谱柱为sugar-pak1(美国); 流动相为水; 流速0.6 ml/min; 柱温70℃; 检测器为视差检测器.可溶性糖的提取参照于建国等[20]的方法, 略有改动.称取0.5 g研磨好的植物干样于三角瓶中, 加入50 ml蒸馏水, 用锡箔纸封口消煮2 h, 放凉后定容至50 ml, 过滤.
1.4 数据处理与分析利用Excel 2007软件进行数据处理及作图, 利用SPSS 19.0软件进行单因素(one-way ANOVA)方差分析以及Tukey多重比较(α=0.05).图、表数据为平均值±标准误.
2 结果与分析 2.1 生长指标的变化淹水显著影响植株的生物量以及根冠比, 经过150 d的水淹, PF和CF组植株叶、根、茎生物量、总生物量以及根冠比均呈显著下降趋势(表 1).至水淹150 d, PF组植株叶、根、茎生物量、总生物量以及根冠比分别比CK组植株下降了53.7%、62.1%、40.6%、54.0%和30.4%, CF组植株叶、根、茎生物量、总生物量以及根冠比分别比CK组植株下降了48.8%、62.1%、43.8%、52.4%和31.1%.
| 表 1 不同淹水环境下中华蚊母树幼苗生物量的变化* Tab.1 Changes of biomass of D. chinense seedlings under different flooding levels |
水淹前90 d, 淹水没有影响中华蚊母树幼苗叶片MDA含量, PF和CF组植株叶片MDA含量均与CK组植株无显著差异, 自水淹120 d开始, PF和CF组植株叶片MDA与CK组植株相比显著增加, 但两者之间差异并不显著, 至水淹150 d, PF和CF组植株叶片MDA含量分别达到33.42和34.90 μmol/g(FW), 相比CK组植株增加了20.2%和25.5% (图 2A).

|
图 2 不同水淹环境下中华蚊母树MDA、可溶性蛋白、脯氨酸和可溶性糖随时间的变化(a表示CK与PF组差异显著; b表示CK与CF组差异显著; c表示PF与CF组处理差异显著, P < 0.05.下同.) Fig.2 Changes of MDA, soluble protein, proline and soluble sugar of D. chinese under different flooding levels and durations of water submergence stress |
淹水对可溶性蛋白的影响在不同淹水处理有所差异(图 2B), 淹水虽然导致PF组植株可溶性蛋白含量的下降, 但除水淹90 d与CK组植株差异显著外, 其他水淹时间段均与CK组植株差异不显著; CF组植株在水淹前60 d与CK组植株差异不显著, 但随后显著增加, 与CK组植株差异显著, 至水淹150 d, CF组植株可溶性蛋白含量为1.78 mg/g(FW), 相比CK组植株增加了39.6%.
随着水淹时间的延长, 2个水淹处理植株脯氨酸含量均呈先上升后下降的趋势, PF组植株自水淹15 d开始植株脯氨酸含量显著高于CK组植株, 至水淹60 d达到最大值8.14 μg/g(FW)后逐渐降低, 自水淹90 d后与CK组植株差异不显著; CF组植株自水淹7 d开始显著高于CK组植株, 至水淹30 d达到最大值9.09 μg/g(FW)后逐渐降低,水淹90 d后与CK组差异不显著(图 2C).
中华蚊母树幼苗叶片可溶性糖含量对不同水淹处理有不同的响应, 淹水没有影响PF组植株叶片可溶性糖的含量, 在整个淹水期间PF组植株可溶性糖含量均与CK组植株无显著差异, 但受水淹影响, CF组植株叶片可溶性糖含量显著下降, 自水淹7 d开始, CF组植株叶片可溶性糖含量显著低于CK组植株(图 2D).
2.3 抗氧化酶活性的变化淹水显著增加中华蚊母树幼苗叶片SOD活性, 自水淹60 d开始, PF和CF组植株叶片SOD活性显著增加, 但在整个淹水期间两者之间差异均不显著, 随着水淹时间的延长, 2个水淹处理植株SOD活性在后期逐渐趋于平缓, 至水淹150 d, PF和CF组植株SOD活性分别比CK组植株增加了22.5%和28.8% (图 3A).
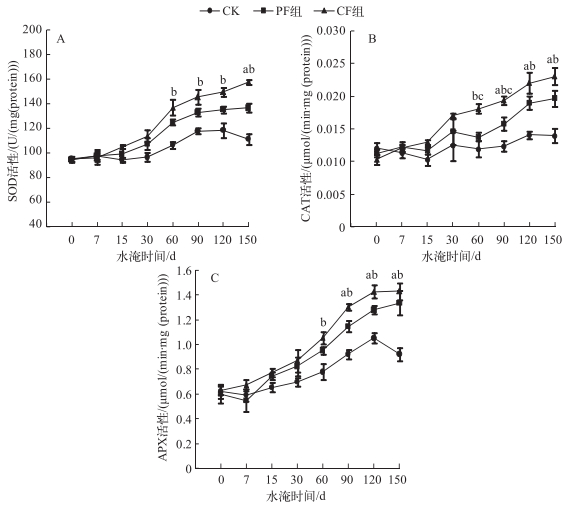
|
图 3 不同水淹环境下中华蚊母树SOD、CAT和APX活性随时间的变化 Fig.3 Changes of SOD, CAT and APX activities of D. chinese under different flooding levels and durations of water submergence stress |
从水淹15 d开始, PF和CF组植株叶片CAT活性均随水淹时间的递增呈增加趋势(图 3B), PF组植株CAT活性自水淹90 d开始显著高于CK组植株, 至水淹150 d, PF组植株CAT活性为0.018 μmol/(min·mg(protein)), 相比CK组植株增加了27.9%;而CF组植株CAT活性从水淹60 d开始显著高于CK组植株, 至水淹150 d, CF组植株CAT活性为0.023 μmol/(min·mg(protein)), 相比CK组植株增加了65.0%.
淹水显著影响了中华蚊母树幼苗叶片APX活性, 随着水淹时间的延长, 所有水淹处理植株叶片APX活性均升高(图 3C), CF组植株叶片APX活性从水淹60 d开始, 均显著高于CK组植株, 在水淹120 d达到最大值1.430 μmol/(min·mg(protein))后, 逐渐降低.而PF组植株随着水淹时间的延长, 叶片APX活性逐渐升高, 至水淹90 d, PF组植株APX活性显著高于CK植株.
3 讨论水淹条件下植物的生长能力及存活率是衡量植物耐淹能力的重要指标[21-22], 一些耐淹植物可以通过调节自身的生长来适应水淹环境, 已有研究表明[10-11], 中华蚊母树幼苗在遭遇水淹胁迫后, 可以通过形成不定根、特化皮孔以及减少叶片数量来增强对水淹的抗逆能力.水淹环境下植株生物量的调整也是其适应水淹环境的重要策略, 由于水淹条件下植株光合生产减弱, 营养物质的利用率降低, 能量的利用是植株在淹水环境下存活的关键因素, 因此, 很多耐淹植物如美洲格尼帕树(Genipa americana)[23]、巴西红厚壳(Calophyllum brasiliense Camb.)[24]和空心莲子草(Tabebuia avellanedae)[25]等均会采取“忍耐水淹”的机制, 降低其生物量, 以减少能量的利用.本研究发现, 淹水条件下中华蚊母树幼苗根、茎、叶生物量均降低, 表明中华蚊母树幼苗采取了“忍耐水淹”的机制, 降低对能量的消耗, 以适应长期的水淹胁迫.水淹条件下根冠比的降低以及根生长的抑制是耐淹植物适应水淹环境的重要策略之一, 植株降低根生物量的分配比例可以降低根呼吸, 从而减少能量的消耗[24,26].本研究中, 中华蚊母树幼苗同样具有这一适应策略, 表明中华蚊母树幼苗具有极强的适应水淹环境的能力.同时, 在长达150 d的水淹下, 处于半淹和全淹环境的中华蚊母树幼苗存活率均为100%, 也进一步证实中华蚊母树幼苗对水淹较强的耐受能力.但这与Li等[27]的研究结果有所差异, Li等研究发现中华蚊母树在全淹环境下的成活率为93%, 由于不同水淹深度水体的含氧量和水压等因素有所差异, 对植物造成的胁迫程度也会有所不同, Li等实验植株的淹水程度明显高于本研究, 可能是造成两者研究结果有所差异的原因, 这也暗示了中华蚊母树幼苗对浅淹环境更具适应性.
MDA是生物膜系统发生膜质过氧化作用的主要产物之一, 其含量的高低常常被用来作为反映细胞膜脂过氧化作用强弱和质膜破坏程度的一个重要指标[28].通常情况下, 植物在遭受淹水胁迫时往往会发生膜脂过氧化作用(MDA含量显著增加), 在对消落带狗牙根(Cynodon dactylon)[7]、双穗雀稗(Paspalum distichum)[29]、南川柳(Salix rosthornii)[30]等耐淹植物的研究中也均发现了这一现象, 本实验对中华蚊母树幼苗叶片MDA含量的研究表明, 中华蚊母树幼苗在水淹前90 d 2个水淹处理组植株叶片MDA含量均与CK组植株差异不显著, 体现了中华蚊母树幼苗对短期淹水具有较强的适应性; 水淹120 d后, 中华蚊母树幼苗叶片MDA显著增加, 且随着水淹深度的递增而逐渐升高, 说明此时淹水已对中华蚊母树幼苗细胞膜系统造成了损伤.值得提出的是, 彭秀等[31]研究发现, 中华蚊母树幼苗叶片MDA含量在水淹30 d后就显著增加, 与本研究有所差异, 由于彭秀等实验采用的是1年生幼苗, 这种差异是否由不同年龄的幼苗对水淹的适应能力有所不同而引起还有待进一步的研究, 同时这一问题的解决将有助于提高库区消落带植被恢复的有效性.
可溶性蛋白、脯氨酸以及可溶性糖是植物逆境胁迫下主要的渗透调节物质, 具有保护酶和植物组织细胞膜结构的功能, 本研究显示PF组植株和CF组植株叶片脯氨酸含量在淹水初期(水淹前60 d)显著增加, 有研究认为脯氨酸除作为渗透调节物质外, 还具有清除活性氧, 增强植株抗氧化能力的作用[32-33], 水淹前期植株并未出现脂膜过氧化作用以及抗氧化酶活性的升高, 很可能与脯氨酸等物质的调节有关, 但随着水淹时间的继续增加, PF和CF组植株脯氨酸含量均下降到了CK组植株水平, 这与陈桂芳等[12]研究中华蚊母树生理特性对淹水的响应所得的结果一致, 推测可能是由于中华蚊母树幼苗在长期的淹水环境中, 同化作用受到了抑制, 能量物质的积累减少, 从而导致中华蚊母树幼苗缺乏合成更多脯氨酸的原料和能量来源[34].有研究表明, 受水淹影响, 植株蛋白质的合成会受到抑制, 导致可溶性蛋白含量降低[30, 35], 本研究中, PF组植株叶片可溶性蛋白含量在整个淹水期间均与CK组植株无显著差异, 表明植株在部分淹水环境下蛋白质的合成可能并未受到影响, 而CF组植株叶片可溶性蛋白含量在淹水后期出现了上升, 高含量的可溶性蛋白有助于维持植物细胞较低的渗透势, 从而增强植株的耐脱水能力, 抵御水淹胁迫引起的伤害, 由于全淹植株遭受的胁迫更大, 植株可溶性蛋白含量的升高或许是对全淹环境的一种积极适应.对中华蚊母树幼苗可溶性糖含量的研究表明, 中华蚊母树幼苗可溶性糖含量对不同淹水处理的响应有所差异, 在整个淹水期间, PF组植株可溶性糖在叶和根中的含量均与CK组植株差异不显著, 且根中的可溶性糖含量要略高于CK组植株, 有研究表明[36], 植物为了适应逆境环境会主动积累一定量的可溶性糖以降低冰点和渗透势, 中华蚊母树幼苗在面对植株部分淹水时能够维持较高的可溶性糖的含量在一定程度上可以缓解水淹胁迫对植株造成的伤害, 这或许是中华蚊母树幼苗对部分淹水环境的适应.与PF植株对水淹的响应不同, 受水淹影响, CF组植株可溶性糖显著下降, 且随着水淹时间的递增而逐渐降低, 由于CF组植株处于全淹环境中, 植株只能进行微弱的水下光合, 能源物质的积累减少, 加之缺氧加重, 无氧呼吸增强, 植株为了获取生命活动所需的能量, 可能加剧了对自身糖类物质的消耗.彭秀等[31]研究发现, 处于全淹环境的中华蚊母树叶片可溶糖含量有所上升, 由于本研究考虑消落带水体带来的低光强环境, 处于全淹环境下的中华蚊母树水下光强低于10 μmol/(m2·s), 中华蚊母树可能无法利用这种低光强制造足够的糖类物质, 这也暗示, 植物对不同的水体环境的适应能力也有所差异, 在今后的实验设计中, 应尽可能模拟消落带实际的水体环境.
植株缺氧是水淹对植物造成的最主要胁迫作用[37], 缺氧后, 植物原本正常的呼吸作用受到干扰, 植株体内活性氧(ROS)产生与清除的动态平衡被打乱, 从而使植株体内氧自由基过量积累.为抵御淹水胁迫下过多活性氧自由基积累对植物自身造成的毒害作用, 植物在长期的进化过程中形成了一套复杂的抗氧化酶系, 如SOD、CAT、APX等[38], SOD是植物体内防御自由基毒害的一种关键酶, 能够通过歧化反应使超氧自由基转变为氧气和过氧化氢, CAT和APX等酶可以进一步催化过氧化氢分解为水和氧气[39-40], 因此, 这些抗氧化酶在体内的协同作用可以清除过量的ROS, 从而减轻淹水胁迫下ROS积累对植物细胞膜的伤害[41].有研究表明, 生长在消落带或河岸带的狗牙根[42]、南川柳[30]、互花米草(Spartina alterniflora)[43]等耐淹植物均能够通过提高体内抗氧化酶的活性来抵御或减轻淹水对植株造成的伤害.本研究结果显示, 在水淹初期, PF和CF组植株叶片SOD、CAT以及APX等酶的活性均未明显升高, 由于非酶促抗氧化系统在维持植株抗氧化系统的均衡中也发挥了重要作用, 因此, 笔者认为中华蚊母树之所以在水淹前期没有提升抗氧化酶的活性, 很有可能与非酶促系统(如脯氨酸含量的升高)在此期间发挥了重要的作用有关, 但还需进一步的验证.随着水淹时间的增加, 非酶促抗氧化系统可能不足以维持ROS产生与清除的动态平衡(如脯氨酸含量在后期降低), 为了减轻ROS的积累对植株造成的伤害, 中华蚊母树幼苗逐渐提高了SOD、CAT以及APX等抗氧化酶的活性, 且随着水淹深度的增加而逐渐增加, 充分体现了中华蚊母树幼苗对淹水环境极强的适应和调节能力.
本研究结果表明, 中华蚊母树幼苗在面对秋、冬季节不同的淹水环境均表现出一定的可塑性.在生物量方面, 中华蚊母树幼苗在面对不同淹水环境时均能减少生物量以及根冠比来减缓自身生长, 降低能耗.在渗透调节物质方面, 植株根据淹水强度的不同启用了不同的渗透调节物质来抵御水淹环境, 如脯氨酸在PF和CF组植株水淹的前期发挥了重要作用, 可溶性蛋白在CF组植株中发挥了重要作用, 而可溶性糖对于PF组植株抵御水淹环境起到重要作用.在植株抗氧化酶活性方面, PF和CF组植株能够通过抗氧化酶(SOD、CAT和APX等)共同作用的途径来抵御淹水胁迫下过多活性氧自由基对植株本身产生的有害影响.笔者先前研究表明[44], 不定根和特化皮孔的生成、减缓自身生长、维持正常的光合色素含量以及稳定的光合速率是中华蚊母树幼苗适应秋、冬季不同淹水环境的重要原因.通过本研究进一步表明, 中华蚊母树幼苗这种面对秋、冬季不同水分环境所体现出来的生理适应机制, 也是中华蚊母树幼苗能够在三峡库区消落带秋、冬季复杂水分环境中存活下来的一个重要方面.
| [1] |
Wu JG, Huang JH, Han XG et al. The Three Gorges Dam:An ecological perspective. Frontiers in Ecology and the Environment, 2004, 2(5): 241-248. DOI:10.1890/1540-9295(2004)002[0241:TTGDAE]2.0.CO;2 |
| [2] |
王晓荣, 程瑞梅, 封晓辉等. 三峡库区消落带回水区水淹初期土壤种子库特征. 应用生态学报, 2009, 20(12): 2891-2897. |
| [3] |
王勇, 刘义飞, 刘松柏等. 三峡库区消涨带植被重建. 植物学通报, 2005, 22(5): 513-522. |
| [4] |
李娅, 曾波, 叶小齐等. 水淹对三峡库区岸生植物秋华柳(Salix variegata Franch.)存活和恢复生长的影响. 生态学报, 2005, 28(5): 1923-1930. |
| [5] |
冯义龙, 朱旭东. 三峡库区冬季蓄水后石门消落带示范区植物生长情况初报. 园林科技, 2012, 3: 14-17. |
| [6] |
Kozlowaki TT. Responses of woody plants to flooding and salinity. Canada: Heron Publishing, 1997.
|
| [7] |
Tan S, Zhu M, Zhang Q. Physiological responses of bermudagrass (Cynodon dactylon) to submergence. Acta Physiologiae Plantarum, 2010, 32(1): 133-140. DOI:10.1007/s11738-009-0388-y |
| [8] |
刘泽彬, 程瑞梅, 肖文发等. 水淹胁迫对植物光合生理生态的影响. 世界林业研究, 2013, 26(3): 33-38. |
| [9] |
王朝英. 中华蚊母对水分胁迫的生长及生理生化响应[学位论文]. 重庆: 西南大学, 2013.
|
| [10] |
刘泽彬, 程瑞梅, 肖文发等. 模拟水淹对中华蚊母树生长及光合特性的影响. 林业科学, 2014, 50(9): 73-81. |
| [11] |
Li XL, Li N, Yang J et al. Morphological and photosynthetic responses of riparian plant Distylium chinense seedlings to simulated autumn and winter flooding in Three Gorges Reservoir Region of Yangtze River, China. Acta Ecological Sinica, 2011, 31(1): 31-39. DOI:10.1016/j.chnaes.2010.11.005 |
| [12] |
陈桂芳, 蔡孔瑜, 李在军等. 淹水对中华蚊母树生长及生理的影响. 西南林学院学报, 2008, 28(5): 42-44. |
| [13] |
秦洪文, 刘正学, 周大祥等. 中华蚊母树对反季节完全水淹的生理响应. 河南农业科学, 2012, 41(11): 126-128. DOI:10.3969/j.issn.1004-3268.2012.11.031 |
| [14] |
张艳红, 曾波, 付天飞等. 长期水淹对秋华柳(Salix variegata Franch)根部非结构性碳水化合物含量的影响. 西南师范大学学报:自然科学版, 2006, 31(3): 153-156. |
| [15] |
Luo FL, Nagel KA, Scharr H et al. Recovery dynamics of growth, photosynthesis and carbohydrate accumulation after de-submergence:a comparison between two wetland plants showing escape and quiescence strategies. Annals of Botany, 2011, 107(1): 49-63. DOI:10.1093/aob/mcq212 |
| [16] |
Grace SC, Logan BA. Acclimation of foliar antioxidant systems to growth irradiance in three broad-leaved evergreen species. Plant Physiology, 1996, 112(4): 1631-1640. DOI:10.1104/pp.112.4.1631 |
| [17] |
李合生. 植物生理生化实验原理与技术. 北京: 高等教育出版社, 2000.
|
| [18] |
Knörzer OC, Burner J, Boger P. Alterations in the antioxidative system of suspension-cultured soybean cells (Glycine max) induced by oxidative stress. Physiologia Plantarum, 1996, 97(2): 388-396. DOI:10.1034/j.1399-3054.1996.970225.x |
| [19] |
Nor'Aini MF, Finch RP, Burdon RH. Salinity, oxidative stress and antioxidant responses in shoot cultures of rice. Journal of Experimental Botany, 1997, 48(2): 325-331. DOI:10.1093/jxb/48.2.325 |
| [20] |
于建国, 王文芝. 现代实用仪器方法. 北京: 中国林业出版社, 1994.
|
| [21] |
Mommer L, Lenssen JP, Huber H et al. Ecophysiological determinants of plant performance under flooding:a comparative study of seven plant families. Journal of Ecology, 2006, 94(6): 1117-1129. DOI:10.1111/jec.2006.94.issue-6 |
| [22] |
Vreugdenhil SJ, Kramer K, Pelsma T. Effects of flooding duration, frequency and depth on the presence of saplings of six woody species in north-west Europe. Forest Ecology and Management, 2006, 236(1): 47-55. DOI:10.1016/j.foreco.2006.08.329 |
| [23] |
Mielke MS, de Almeida AF, Gomes FP et al. Leaf gas exchange, chlorophyll fluorescence and growth responses of Genipa americana seedlings to soil flooding. Environmental and Experimental Botany, 2003, 50(3): 221-231. DOI:10.1016/S0098-8472(03)00036-4 |
| [24] |
de Oliveira VC, Joly CA. Flooding tolerance of Calophyllum brasiliense Camb. (Clusiaceae):morphological, physiological and growth responses. Trees, 2010, 24(1): 185-193. DOI:10.1007/s00468-009-0392-2 |
| [25] |
Davanso VM, Souza LAD, Medri ME et al. Photosynthesis, growth and development of Tabebuia avellanedae Lor. Ex Griseb. (Bignoniaceae) in flooded soil. Brazilian Archives of Biology and Technology, 2002, 45(3): 375-384. DOI:10.1590/S1516-89132002000300016 |
| [26] |
Chen H, Qualls RG, Miller GC. Adaptive responses of Lepidium latifolium to soil flooding:biomass allocation, adventitious rooting, aerenchyma formation and ethylene production. Environmental and Experimental Botany, 2002, 48(2): 119-128. DOI:10.1016/S0098-8472(02)00018-7 |
| [27] |
Li XL, Luan CY, Yang J et al. Survival and recovery growth of riparian plant Distylium chinense seedlings to complete submergence in the Three Gorges Reservoir region. Procedia Engineering, 2012, 28: 85-94. DOI:10.1016/j.proeng.2012.01.687 |
| [28] |
阎秀峰, 李晶, 祖元刚. 干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响. 生态学报, 1999, 19(6): 850-854. |
| [29] |
谭淑端, 朱明勇, 张克荣等. 水淹对双穗雀稗抗氧化酶活性及碳水化合物含量的影响. 草业学报, 2013, 22(1): 217-224. DOI:10.11686/cyxb20130126 |
| [30] |
王朝英, 李昌晓, 张晔. 水淹-干旱胁迫对南川柳苗木生长及生理特性的影响. 林业科学, 2013, 49(12): 164-170. |
| [31] |
彭秀, 肖千文, 罗韧等. 淹水胁迫对中华蚊母树生理生化的影响. 四川林业科技, 2006, 27(2): 17-20. |
| [32] |
Morgan JM. Osmoregulation and water stress in higher plants. Annual Review of Plant Physiology, 1984, 35(1): 299-319. DOI:10.1146/annurev.pp.35.060184.001503 |
| [33] |
周大祥, 姜振华, 胡廷章等. 深淹胁迫下三峡库区狗牙根的生理响应. 江苏农业科学, 2012, 40(5): 345-347. |
| [34] |
肖强, 郑海雷, 叶文景等. 水淹对互花米草生长及生理的影响. 生态学杂志, 2005, 24(9): 1025-1028. |
| [35] |
詹嘉红, 蓝宗辉. 水淹对铺地黍部分生理指标的影响. 广西植物, 2011, 31(6): 823-826. |
| [36] |
何诚诚. 不同试验处理对库尔勒香梨叶绿体超微结构和光合特性的影响[学位论文]. 乌鲁木齐: 新疆农业大学, 2013.
|
| [37] |
Pezeshki SR. Wetland plant responses to soil flooding. Environmental and Experimental Botany, 2001, 46(3): 299-312. DOI:10.1016/S0098-8472(01)00107-1 |
| [38] |
Suleman P, Redha A, Afzal M et al. Temperature-induced changes of malondialdehyde, heat-shock proteins in relation to chlorophyll fluorescence and photosynthesis in Conocarpus lancifolius (Engl.). Acta Physiologiae Plantarum, 2013, 35(4): 1223-1231. DOI:10.1007/s11738-012-1161-1 |
| [39] |
Yang Y, Han C, Liu Q et al. Effect of drought and low light on growth and enzymatic antioxidant system of Picea asperata seedlings. Acta Physiologiae Plantarum, 2008, 30(4): 433-440. DOI:10.1007/s11738-008-0140-z |
| [40] |
吴月燕, 项锡娜, 王忠华等. 光胁迫对容器幼苗生长和生理生化特性的影响. 植物生理学报, 2013, 49(5): 469-476. |
| [41] |
Liang Y, Chen Q, Liu Q et al. Exogenous silicon (Si) increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (Hordeum vulgare L.). Journal of Plant Physiology, 2003, 160(10): 1157-1164. DOI:10.1078/0176-1617-01065 |
| [42] |
谭淑端, 朱明勇, 党海山等. 三峡库区狗牙根对深淹胁迫的生理响应. 生态学报, 2009, 29(7): 3685-3691. |
| [43] |
古志钦, 张利权. 互花米草对持续淹水胁迫的生理响应. 环境科学学报, 2009, 29(4): 876-881. |
| [44] |
刘泽彬. 三峡库区消落带两种植物对淹水环境适应性的模拟研究[学位论文]. 北京: 中国林业科学研究院, 2014.
|
 2016, Vol. 28
2016, Vol. 28 


