淡水或海洋藻类的生长受诸多因素影响, 如光照强度、水温、溶解氧、营养盐、pH值等.目前, 国内外关于光照条件对藻类生长影响的实验室研究和报道较多, 但基本都以固定的光照强度、色谱、光照周期对藻类生长的影响为主.如徐慧等分别采用6个光照强度, 研究了不同光照强度对小球藻生长的影响, 建立藻类最大光密度、最大比增长率与光照强度的拟合方程[2].殷志坤等[3]通过机制实验和模拟分析, 研究了磷限制下光照强度和温度交互作用对水华鱼腥藻生长动力学的影响, 确定了该藻生长的最适光照强度和温度分别为2675.12±262.93 lx和21.03±1.55℃.沈英嘉等和刘青等研究了在不同光照时间、光照强度和光谱下, 特定藻的生长速率及叶绿素含量, 发现当光照周期为12L :12D, 光照强度为5 000 lx时小球藻(Chlorella sp.)、湛江等鞭金藻(Isochrysis zhanjiangensis)、青岛大扁藻(Platymonas helgolandica)和绿色杜氏藻(Dunaliella viridis)4种藻的生长速率均最大, 铜绿微囊藻在9L :15D的比增长率和最大细胞数均最大, 在每日2 h的光照周期下生长均受到抑制[4-5].孙霞通过调查与现场培养相结合的方式研究了东海赤潮高发区水体表面太阳光照对水体中赤潮藻类生长和种群演替的影响, 发现当温度和盐度合适时, 海域中部赤潮易发区域光照和磷酸盐是影响浮游藻类季节变化的主要因素之一, 且光照是该海域浮游植物季节演替过程的重要影响因子之一[6].
在自然水环境中, 受风力及水流等因素影响, 藻类一般会在水体内发生被动迁移, 其接受的水下光照强度波动很大, 进而引起其不同程度上的生长抑制.近年来, 国外学者们已在一些分层湖泊、水库、海洋等水环境中发现了内波, 并通过现场观测研究了内波引起的水质效应, 如破坏垂向水质分层、沉积物运输、营养盐循环供给、引起藻类在不同水深范围内被动迁移[7-8]. Hingsamer等[1]报道了分层湖泊中受风力扰动形成的内波, 发现内波可引起藻类本身在不同水深处波动, 从而接受的光照强度也随之波动, 并记录了Ammer湖中随内波运动在不同深度的光量子强度、藻叶绿素含量、溶解氧等的变化情况. Pannard等[9]在Bromont湖进行了内波及藻类变化的追踪记录, 表明在小型湖泊里跃温层内波运动会引起水团垂直偏移, 进而影响藻类的光可用性和养分通量, 导致藻类生物量随之发生变化.虽然已有研究报道了强、弱两种光强循环照射下藻类光合作用的抑制[10], 也有学者利用不断黑暗交替的管式流动光反应器研究了恒定光强中穿插周期性黑暗对藻生长的影响, 但尚无类似内波中周期性波动的光照强度对藻类生长影响的相关研究[11].由于缺乏光照强度周期性变化的模拟方法, 目前光照强度随时间周期性增大、减小的条件对藻类生长影响的定量实验室研究尚未开展.
叶绿素荧光动力学已形成藻类胁迫效应及机制研究的一个热点, 随着荧光检测技术迅速发展, 强光、弱光、高温、低温、毒性等逆境胁迫生理研究已开始得到应用[12-16], 但本文中的光照强度周期性波动对不同藻类的生长状态以及光合作用影响机理的研究尚未涉及.本文通过自行设计的基于单片机控制的光强模拟反应器, 使用调制荧光叶绿素呈像系统Imaging Pam, 采用光照强度周期性变化的光照条件, 对水库中较常见的藻类铜绿微囊藻(Microcystis aeruginosa)和斜生栅藻(Scenedesmus obliquus)的生长和光合作用进行研究, 旨在揭示此特殊光照条件下藻类的生长抑制特性及适应机制, 并为将来内波控藻效果及机理提供初步理论支撑.
1 材料与方法 1.1 光反应器光反应器(图 1)由内外两部分组成, 内部包括黑色的藻类生长池(长360 mm、宽320 mm、高300 mm)、实时温度监测系统和上方均匀排布的LED光照系统组成;外部包括透明水池(长540 mm、宽520 mm、高350 mm)、空调水浴相结合的智能温控系统. LED光照系统由单片机、电机驱动模块、直流电源和电子调光控制器等构成, 主要是为藻类生长提供光源, 光照强度和时间通过独立设计的电子调光控制器加以控制, 具体是通过设置单片机内的程序和辅助调节单片机上的时间按键实现不同特性光照的调节, 其中电路利用PWM脉宽控制LED光强变化.
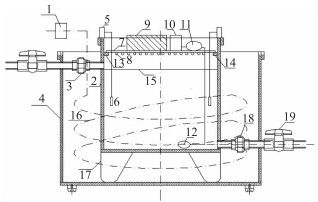
|
图 1 光反应器(1:温控开关, 2:黑色藻生长池, 3、18:螺纹旋钮, 4:透明水池, 5:温度仪, 6:温度探头, 7:铝板, 8:LED灯, 9、10:单片机系统, 11:曝气泵, 12:均匀布气头, 13、14:支撑, 15:隔气膜, 16:碳纤维潜水加热线, 17:支撑柱, 19:阀门) Fig.1 Light intensity reactor |
本实验所用铜绿微囊藻(Microcystis aeruginosa FACHB-912)和斜生栅藻(Scenedesmus obliquus FACHB-14), 均由中国科学院武汉水生生物研究所提供.培养基为藻类通用培养基BG-11.藻种在培养箱中温度设为25±1℃, 白天光照强度为3000 lx, 光暗比12 h :12 h, 每天人工摇晃2~3次, 培养至对数期用于实验.
仪器:水下数字照度计(ZDS-10W, 上海嘉定学联)、紫外分光光度计(日立U3900, 日本日立)、调制荧光叶绿素呈像系统(Imaging Pam, 德国WALZ)、光照培养箱(MGC-250, 上海一恒).
培养基准备和藻液制备方法:将新配制的培养基置于锥形瓶(1000 ml), 用封口膜绑扎, 于121℃灭菌30 min, 自然降温至40℃以下, 将预先培养至对数生长期的铜绿微囊藻、斜生栅藻接入, 使用日立U3900测定两种藻类的初始光密度, 保持每次实验中接入反应器的藻的初始光密度一致.
实验中每天早、中、晚各使用干净玻璃棒搅拌藻液3次, 使其均匀.每个条件设置3个平行样.
1.3 光照强度周期性波动不同于藻类静态培养时白天12 h采用的恒定光照强度, 白天12 h内采用周期性波动变化的光照强度.
光照强度波动周期:根据Hingsamer等实际观测的内波周期, 取为12 h[1].
最大光照强度:根据张运林等的研究[17], 太湖水面5-8月的平均光合有效辐射强度为6.11 MJ/(m2 ·d), 以其作为光反应器模拟入射光的最大光照强度, 由单位换算[18], 可得平均每日入射光强为19508 lx.本实验采用26条13 cm的LED灯带, 可使用藻液表面光强为19500 lx.由于藻类生长池深度较小, 且每天搅拌, LED灯均匀分布, 可认为光反应器不同位置处藻类所受光强一致.
最小光照强度:以实际湖库中藻类被胁迫迁移至选取下限水深的光照强度计算, 取为634 lx.
波动周期内光照强度:在一个光照强度波动周期内, 藻类所受光照强度在最大光照强度和最小光照强度之间变化, 首先根据Hingsamer等[1]实际观测的内波存在区域上限、下限水深及波幅, 按正弦波计算不同时刻藻类胁迫迁移所至的水深;然后采用Lambert-Beer光衰减方程计算不同水深处的光照强度, 以此作为波动周期内不同时刻的光照强度.
太阳辐射强度在水体中的衰减遵从Lambert-Beer光衰减规律[19]:
| $ {I_z} = PAR \cdot {I_0} \cdot {{\rm{e}}^{ - k \cdot z}} $ | (1) |
式中,Iz为水深Z处光照;I0为水面处光照, PAR为水深Z处光照可被浮游植物利用进行光合作用的百分比, 一般取50 %;k为光的衰减系数, k=kw+kd+kc.其中kw代表纯水引起的光的衰减, 一般为0.03 m-1; kc代表浮游植物自遮引起的光的衰减, kc=βs·Chl; βs为浮游植物自遮系数, 一般为0.03; kd代表水体中无机悬浮颗粒物质引起的光的衰减, 一般为0.12[6].综上,模拟水库水体状况, 采用k=0.21.
综上所述, 白天光照12 h内, 一个波动周期内, 藻类所受的光照强度变化如图 2所示;由此计算得到藻类白天12 h所受的时平均光照强度为6153 lx.考虑因为单片机调节精度, 在恒定光照强度对照组中, 铜绿微囊藻和斜生栅藻所受时光照强度均为6100 lx.
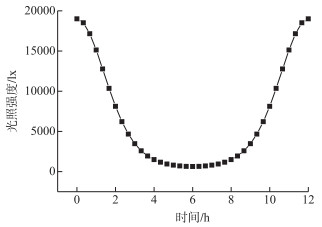
|
图 2 光照强度的周期性变化 Fig.2 Variation of light intensity during one period of 12 h |
对于不同生长期的藻类而言, 其个体数量(细胞数)与光密度值基本呈正比, 尤其是对数期. 680 nm为藻类最为灵敏的吸收波长, 故本研究中采用藻液在680 nm波长下的吸光度来表征反应液中两种藻类的生物量[20-21].
藻类色素主要包括叶绿素和类胡萝卜素两大类.只有少数特殊状态下, 叶绿素a具有吸收和转化光能的作用, 而大部分的叶绿素a只吸收和传递光能.藻类的类胡萝卜素功能主要为两方面:一是作为辅助捕光色素促进细胞的光合生产;二是对光氧化的保护作用, 它可消散来自高度激发的三线态叶绿素a或单线态氧的能量.提高类胡萝卜素相对含量是藻类抵御高光强损伤以及维持甚至在一定程度上提高光合作用的一种响应机制[22-24], 所以叶绿素a和类胡萝卜素含量反映外界环境对藻类光合作用的影响, 可反映藻类生理状态, 测定方法参考文献[25].
荧光光合作用参数能灵敏反映藻类的光合作用效率和相对电子传递速率等, 微观表征藻类光合作用活性.采用PAM调制叶绿素荧光技术, 藻样在经过暗适应(15~30 min)后, 打开测量光, 所有电子门均处于开启状态, 得到参数Fo;此时PSⅡ处于完全关闭状态, 给出一个饱和脉冲, 所有的电子门就将该用于光合作用的能量转化为荧光和热, 得到最大叶绿素荧光Fm, 最大可变荧光Fv= Fm-Fo, 它反映PSⅡ的电子传递情况, 是开放的PSⅡ反应中心捕获激发能的效率以及光合作用中PSⅡ原初电子受体QA的氧化还原状态和其他可能耗散能量的途径.
1.5 数据处理和分析采用Excel 2003和SPSS 16.0软件对数据进行统计分析, 数据图绘制使用Origin 8.0完成.
2 结果与讨论 2.1 藻类生长——吸光度变化由图 3可见, 在时平均光照强度相同的情况下, 如果光照强度周期性波动, 则铜绿微囊藻和斜生栅藻均生长缓慢且吸光度低,并且其颜色上也有明显差异, 图 4为第1、15和24天的4组藻液, 在光照强度周期性波动条件下, 斜生栅藻明显发黄,铜绿微囊藻颜色也为黄绿色.
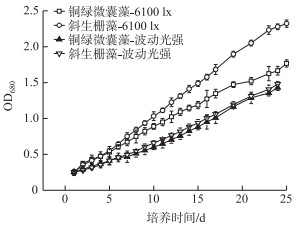
|
图 3 铜绿微囊藻和斜生栅藻在两种光强规律下的生长曲线 Fig.3 Growth curves of Microcystis aeruginosa and Scenedesmus obliquus under two light intensity regularities |
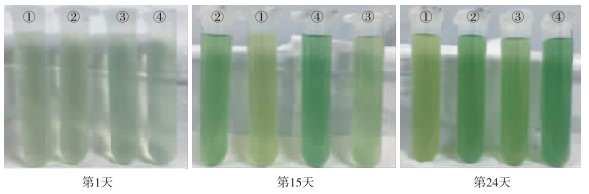
|
图 4 铜绿微囊藻和斜生栅藻在第1、15和24天的颜色(①代表波动光下的斜生栅藻;②代表 6100 lx下的斜生栅藻;③代表波动光下的铜绿微囊藻;④代表 6100 lx下的铜绿微囊藻) Fig.4 The photograph of Microcystis aeruginosa and Scenedesmus obliquus in the first, fifteenth and twenty-forth day |
藻类的生长与入射的太阳光照强度和持续照射的时间有关, 即与其累计接受的总光照辐射量有关[26], 但是在总光照辐射量相同的情况下, 如果光照强度周期性波动, 两种藻类的生长均受到较大程度的干扰(其中对斜生栅藻的干扰尤其严重).培养至第24天时, 光照周期性波动下斜生栅藻的光密度值比6100 lx恒定光强下下降了24 %.由此可见, 在强光强、适合光强和低光强的交替变化下, 因光照强度频繁波动而影响藻类的生长, 表现为铜绿微囊藻和斜生栅藻均增长速率减缓, 颜色发黄.虽然两种藻类的吸光度在同步增加, 在第24天, 铜绿微囊藻吸光值达到1.43、斜生栅藻达到1.477, 但是相比同等初期生物量,在6100 lx恒定光强条件下两种藻类的生物量均有所减少, 斜生栅藻的减少幅度大于铜绿微囊藻.对比其叶绿素、类胡萝卜素含量可得原因, 符合曹佳春等[27]所述的黄绿色藻为Ⅱ级亚健康藻体, 黄色藻为Ⅲ级半健康藻体.
单因素方差分析结果表明, 第1~9天, 两种光强对铜绿微囊藻和斜生栅藻吸光度影响的差异均不显著(P>0.05), 而从第10天开始, 差异显著(P<0.01), 两种藻在波动光强中吸光度变化差异显著(P<0.01).
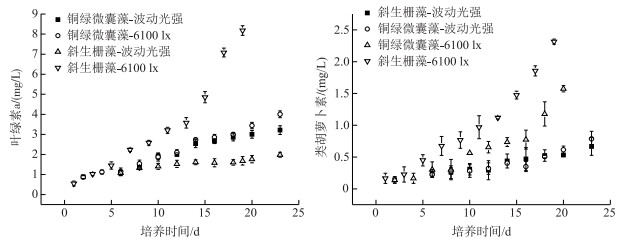
2.2 叶绿素和类胡萝卜素含量叶绿素和类胡萝卜素含量对藻类的生长起关键作用, 其产生与含量又与光照强度有很大关系.从图 5可以看出,在培养5天后, 周期性波动光照对两种藻类的叶绿素和类胡萝卜素含量均有明显影响, 差异显著(P<0.001), 尤其是对于斜生栅藻, 其叶绿素a和类胡萝卜素含量增长十分缓慢, 铜绿微囊藻的类胡萝卜素含量增长较为缓慢.
|
图 5 铜绿微囊藻和斜生栅藻叶绿素和类胡萝卜素含量变化 Fig.5 Changes in Chl.a and CAR contents of Microcystis aeruginosa and Scenedesmus obliquus |
综合图 3~5, 在光照强度周期性波动条件下, 斜生栅藻藻液体泛黄, 光密度值增加缓慢;铜绿微囊藻藻液颜色较淡, 光密度值增长也慢.对比藻体中叶绿素a和类胡萝卜素含量可以发现, 当光照强度在高、低强度之间频繁波动变化时, 斜生栅藻自身叶绿素a和类胡萝卜素生成会受到极大抑制, 与6100 lx光强条件下相比两种色素含量显著降低(P<0.001).相对于恒定时均光照强度6100 lx, 当藻类培养至第20天时, 铜绿微囊藻叶绿素a含量减少12.7 %, 而斜生栅藻叶绿素a含量则减少78 %;铜绿微囊藻和斜生栅藻的类胡萝卜素含量分别减少55.5 %和74 %.结果表明, 对于铜绿微囊藻, 周期性波动的光照条件对叶绿素a含量影响较小, 而对类胡萝卜素影响则很大.类胡萝卜素的不足导致藻捕光功能的不全, 并且藻无法抵御模拟光强中的高光损伤;同时,叶绿素a含量降低使得本来捕光不足的藻光能转换减慢, 这也进一步间接影响了藻类的生长.综上, 分层水体中藻类如果因内波驱使而上下浮动时, 频繁变化的不利光照条件将会对斜生栅藻的生长产生严重影响.与斜生栅藻相比, 铜绿微囊藻有一定的自身调节功能, 虽然反应器藻液深度只有13 cm, 即使不考虑铜绿微囊藻的气囊调节能力[28], 铜绿微囊藻还是具有更强的调节能力, 自然环境里铜绿微囊藻很容易成为水体藻类暴发的优势种群.
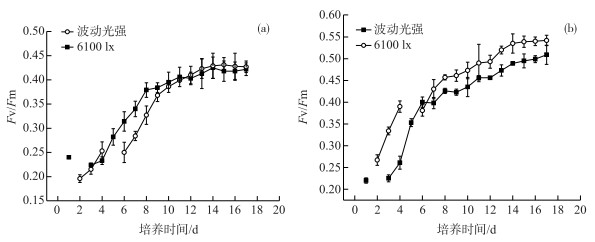
2.3 藻类光合活性——光合作用参数变化为了揭示光照波动条件对铜绿微囊藻及斜生栅藻生长的抑制机制, 采用PAM技术对不同光照条件下光合作用参数进行了分析. Fv/Fm是PSⅡ最大光化学量子产量, 反映浮游植物的最大PSⅡ光能转化效率[29], 亦反映浮游植物的潜在最大光合作用能力[30].当藻类生长受到胁迫时, 其值下降, 比如, 尖细斜生栅藻随着其与塑料中的成分塑化剂(DEHP)接触时间的增加, 其最大光化学效率逐渐降低[31].
相对恒定光强6100 lx而言, 两种藻类对光照强度波动的适应能力不同.铜绿微囊藻在模拟波动光强条件下的Fv/Fm值差异较小, 在光照波动初期, Fv/Fm值总体呈现低于恒定光强条件下对应数值的趋势;在光照波动后期(11天后), Fv/Fm值总体呈现略高于恒定光强条件下对应数值的趋势(图 6);这说明铜绿微囊藻在经过了一个短暂的适应期后, 其光合作用能力会得到恢复.虽然在光照培养过程中, 铜绿微囊藻类胡萝卜素的合成受阻, 捕光效率下降, 但这似乎并不影响其光合作用能力的恢复.不同于铜绿微囊藻, 斜生栅藻在波动光强条件下的Fv/Fm值总体低于恒定光强6100 lx条件下的对应值(图 6), 即其最大光化学量子产量(潜在光合作用能力)受光照波动而下降, 说明叶绿体PSⅡ光化学活性可能受到破坏, 光合电子传递受阻.其他学者也报道了藻类Fv/Fm在胁迫条件下的变化特性, 比如盐生杜氏藻细胞处于强白光(1850 μmol/(m2 ·s))下5~30 min后, 其潜在PSⅡ原除光化效率、PSⅡ活性降低, 叶绿素和胡萝卜素出现一定程度的降解, 是一种光合作用下调的适应性光保护反应[32].
|
图 6 铜绿微囊藻(a)和斜生栅藻(b)Fv/Fm的变化 Fig.6 Changes in Fv/Fm of Microcystis aeruginosa (a) and Scenedesmus obliquus (b) |
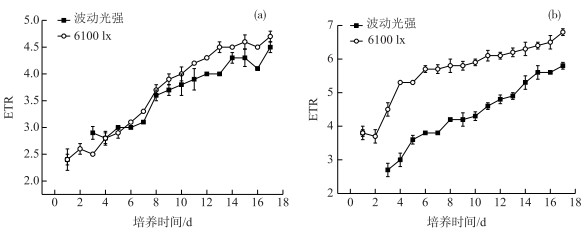
YⅡ为任一光照状态下PSⅡ的实际量子产量(实际光合能力和实际光合效率), 计算公式为:YⅡ=(Fm′-F)/Fm′[33-34]. ETR(相对电子传递速率)=Yield(实际量子产量)×PAR(光照强度)×0.5×Absorptivity(吸光系数), 其中吸光系数表示样片对入射光的吸收百分比, 0.5表示吸收的光量子一半用于PSⅡ(稳态条件下). ETR下降表示QA→QB的电子传递受到限制.在臧正蓉对高温、低温还有高光强时三角褐指藻(Phaeodactylum tricornutum)光合活性影响的研究中, YⅡ均降低, 且最高光强12800 lx光照强度下YⅡ降低更明显[35].
培养6天后, 在6100 lx光照强度条件下的铜绿微囊藻YⅡ值比波动光照条件下略高, 而斜生栅藻YⅡ值则比波动光照条件下显著提高30 %左右(P<0.01,图 7), 说明在波动光强下铜绿微囊藻实际光合能力受到较弱的抑制, 而斜生栅藻实际光合能力则受光照波动而明显抑制.相比6100 lx光强,周期性波动光强下YⅡ的降低反映了光强波动对斜生栅藻细胞同化能力(NADPH和ATP)的遏制[36], 从而影响了其对CO2的固定以及光合作用.光照强度条件对ETR的影响特性与YⅡ类似(图 8).

|
图 7 铜绿微囊藻(a)和斜生栅藻(b)YⅡ的变化 Fig.7 Changes in YⅡ of Microcystis aeruginosa (a) and Scenedesmus obliquus (b) |
|
图 8 铜绿微囊藻(a)和斜生栅藻(b)ETR的变化 Fig.8 Changes in ETR of Microcystis aeruginosa (a) and Scenedesmus obliquus (b) |
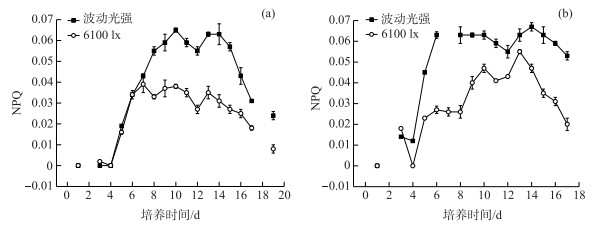
NPQ反映PSⅡ耗散过剩光能进行自我保护的下调作用, 即PSⅡ天线色素吸收的光能不能用于光合作用传递, 而是以热的形式耗散掉[37].
在藻类吸收的总光能中, 一部分光能通过光合电子传递链传递, 以驱动光化学反应用于碳同化;一部分光能以热能的形式耗散掉, 不能用于光合生产.与相关荧光参数的实验规律相同[38-39], 本实验中也发现藻类对光能的热耗散与光合电子传递速率有负相关关系.绿色植物受到光抑制时会伴随Fv/Fm降低和NPQ增加[40].同时许多研究发现, 光照强度会影响藻的NPQ, 随着光照强度的升高, NPQ会逐渐增大[41-42].而在不同光照强度条件下的藻类培养实验中, 当光照强度周期性波动时, 藻类培养5天后的NPQ显著大于恒定光照强度6100 lx条件下的NPQ(P<0.01)(图 9), 表明其卡尔文循环的活性受抑制的程度增大, 潜在的热耗散能力增强, 对藻体本身是一种保护作用[36].换而言之, 在光照强度波动条件下, 藻类对光强的利用很不充分, 频繁变化的光照强度使藻类一直处于适应状态, 对光能利用效率低, 大部分的光能以热耗散的形式损失.
|
图 9 铜绿微囊藻(a)和斜生栅藻(b)NPQ的变化 Fig.9 Changes in NPQ of Microcystis aeruginosa (a) and Scenedesmus obliquus (b) |
1) 在总光照辐射量相同的情况下, 如果光照强度周期性频繁波动, 铜绿微囊藻和斜生栅藻的生长均会受到一定程度的干扰, 其中对斜生栅藻的干扰尤为严重, 斜生栅藻生物量的减少幅度大于铜绿微囊藻.
2) 光照强度周期性频繁波动明显影响两种藻类的叶绿素和类胡萝卜素含量, 尤其是斜生栅藻.当藻类培养至第20天时, 铜绿微囊藻叶绿素a含量减少12.7 %, 而斜生栅藻叶绿素a含量则减少78 %;铜绿微囊藻和斜生栅藻的类胡萝卜素含量分别减少55.5 %和74 %.
3) 相对恒定光照强度6100 lx而言, 在光照强度周期性波动条件下, 斜生栅藻颜色发黄, 捕光性能降低;Fv/Fm、YⅡ、ETR下降, 光合作用活性以及电子传递受阻;热耗散NPQ增加, 光能利用率降低, 处于自身保护机制;铜绿微囊藻颜色稍黄, 捕光性能虽降低, 但Fv/Fm、YⅡ、ETR总体呈现先降低、后略升高的趋势;当光照强度周期性波动时, 两种藻类的NPQ在后期均大幅提高, 说明光合作用抑制而导致热耗散增加.
4) 铜绿微囊藻对于光照强度周期性波动的适应能力强于斜生栅藻.
| [1] |
Hingsamer P, Peeters F, Hofmann H. The consequences of internal waves for phytoplankton focusing on the distribution and production of Planktothrix rubescens. PLoS One, 2014, 9(8): e104359. DOI:10.1371/journal.pone.0104359 |
| [2] |
Xu H, Ji DB, Cui YJ et al. Effects of different light intensity on the growth of Chorella vulgaris. Microbiology, 2016, 43(5): 1027-1034. [徐慧, 纪道斌, 崔玉洁等. 不同光照强度对小球藻生长的影响. 微生物学通报, 2016, 43(5): 1027-1034. DOI:10.13344/j.microbiol.china.150803] |
| [3] |
Yin ZK, Li Z, Wang S et al. Effect of light and temperature on growth kinetics of Anabaena flosaquae under phosphorus limitation. Environmental Science, 2015, 36(3): 963-968. [殷志坤, 李哲, 王胜等. 磷限制下光照和温度对水华鱼腥藻生长动力学的影响. 环境科学, 2015, 36(3): 963-968. DOI:10.13227/j.hjkx.2015.03.027] |
| [4] |
Shen YJ, Chen DH. Effect of different light cycle on growth of Microcystis aeruginosa and Microcystis viridis. J Lake Sci, 2004, 16(3): 285-288. [沈英嘉, 陈德辉. 不同光照周期对铜绿微囊藻和绿色微囊藻生长的影响. 湖泊科学, 2004, 16(3): 285-288. DOI:10.18307/2004.0316] |
| [5] |
Liu Q, Zhang XF, Li TW et al. Effects of light on growth rate, chlorophyll level and cell cycle in four alga species. Journal of Dalian Fisheries University, 2006, 21(1): 24-30. [刘青, 张晓芳, 李太武等. 光照对4种单胞藻生长速率、叶绿素含量及细胞周期的影响. 大连海洋大学学报, 2006, 21(1): 24-30.] |
| [6] |
Sun X. Effects of light on the growth of red tide algae in the red tide of the East China Sea[Dissertation]. Qingdao: Ocean University of China, 2005. [孙霞. 光照对东海赤潮高发区赤潮藻类生长的影响[学位论文]. 青岛: 中国海洋大学, 2005. ]
|
| [7] |
Visser PM, Ibelings BW, Bormans M et al. Artificial mixing to control cyanobacterial blooms:a review. Aquatic Ecology, 2015, 50(3): 423-441. |
| [8] |
Yang D, Ye H, Wang G. Impacts of internal waves on chlorophyll a distribution in the northern portion of the South China Sea. Chinese Journal of Oceanology and Limnology, 2010, 28(5): 1095-1101. DOI:10.1007/s00343-010-9971-8 |
| [9] |
Pannard A, Beisner BE, Bird DF et al. Recurrent internal waves in a small lake:Potential ecological consequences for metalimnetic phytoplankton populations. Limnology & Oceanography Fluids & Environments, 2011, 1(1): 91-109. |
| [10] |
Kono M, Terashima I. Long-term and short-term responses of the photosynthetic electron transport to fluctuating light. J Photochem Photobiol B, 2014, 137(8): 89-99. |
| [11] |
Iluz D, Abu-Ghosh S. A novel photobioreactor creating fluctuating light from solar energy for a higher light-to-biomass conversion efficiency. Energy Conversion & Management, 2016, 126: 767-773. |
| [12] |
Zhou CY, Hua DX, Le J et al. Study on detection of chlorophyll fluorescence kinetics by plant water stress. Journal of Agricultural Mechanics, 2017, 48(1): 148-154. [周春艳, 华灯鑫, 乐静等. 结合图像的叶绿素荧光动力学植物水分胁迫探测方法. 农业机械学报, 2017, 48(1): 148-154. DOI:10.6041/j.issn.1000-1298.2017.01.019] |
| [13] |
Nguyen BT, Chen Y, Lin XQ et al. Chlorophyll fluorescence characteristics of Vietnam between different Chinese fir provenances. Journal of Sichuan Agricultural University, 2016, 34(1): 34-38. [Nguyen BT, 陈宇, 林小琴等. 不同种源越南杉木幼龄期叶绿素荧光特征比较. 四川农业大学学报, 2016, 34(1): 34-38.] |
| [14] |
Han J, Wu Y, Zhao L et al. Effects of photoperiod on the growth, flowering and chlorophyll fluorescence kinetics of forced Paeonia lactiflora. Journal of Beijing Forestry University, 2015, 37(9): 62-69. [韩婧, 吴益, 赵琳等. 光周期对促成栽培芍药生长开花和叶绿素荧光动力学影响. 北京林业大学学报, 2015, 37(9): 62-69.] |
| [15] |
Gao TP, Guo R, Wang D et al. Effects of super-aqua sorbent composition on yield index and chlorophyll fluorescence parameters of dry-land potato. Journal of Lanzhou University, 2013, 32(5): 1221-1226. [高天鹏, 郭睿, 王东等. 保水剂与钾肥对旱地马铃薯产量和叶绿素荧光动力学参数的影响. 生态学杂志, 2013, 32(5): 1221-1226.] |
| [16] |
Li QF, Li ZM, Ji JW et al. Applications of chlorophyll fluorescence kinetics in the physiological resistance studies of plant. Hubei Agricultural Sciences, 2013, 52(22): 5399-5402. [李钦夫, 李征明, 纪建伟等. 叶绿素荧光动力学及在植物抗逆生理研究中的应用. 湖北农业科学, 2013, 52(22): 5399-5402. DOI:10.3969/j.issn.0439-8114.2013.22.003] |
| [17] |
Zhang YL, Qin BQ. The basic characteristic and climatological calculation of the photosythetically available radiation in Taihu region. Acta Energiae Solaris Sinica, 2002, 23(1): 118-123. [张运林, 秦伯强. 太湖地区光合有效辐射(PAR)的基本特征及其气候学计算. 太阳能学报, 2002, 23(1): 118-123.] |
| [18] |
Zhang ZB. Study on light transfer and growth kinetics of microalgae in autotrophic culture[Dissertation]. Nanchang: Jiangxi Normal University, 2008. [张志斌. 微藻光自养培养中光传递及其生长动力学研究[学位论文]. 南昌: 江西师范大学, 2008. ]
|
| [19] |
Walsby AE, Dubinsky Z, Kromkamp JC et al. The effects of diel changes in photosynthetic coefficients and depth of Planktothrix rubescens on the daily integral of photosynthesis in Lake Zurich. Aquatic Sciences, 2001, 63: 326-349. DOI:10.1007/PL00001358 |
| [20] |
Shen PP, Wang ZH, Qi YZ et al. An optical density method for determination of microalgal biomass. Journal of Jinan University, 2001, 22(3): 115-119. [沈萍萍, 王朝晖, 齐雨藻等. 光密度法测定微藻生物量. 暨南大学学报:自然科学与医学版, 2001, 22(3): 115-119.] |
| [21] |
Yin Y, Zhang YL, Wang MZ et al. Effects of different irradiation intensity on the growth and absorption properties of Microcystis aeruginosa and Scenedesmus obliqnus. J Lake Sci, 2012, 24(5): 755-764. [殷燕, 张运林, 王明珠等. 光照强度对铜绿微囊藻(Microcystis aeruginosa)和斜生栅藻(Scenedesmus obliqnus)生长及吸收特性的影响. 湖泊科学, 2012, 24(5): 755-764. DOI:10.18307/2012.0517] |
| [22] |
Xu K, Jiang H, Juneau P et al. Comparative studies on the photosynthetic responses of three freshwater phytoplankton species to temperature and light regimes. Journal of Applied Phycology, 2012, 24(5): 1113-1122. DOI:10.1007/s10811-011-9741-9 |
| [23] |
Paerl HW, Rd FR, Moisander PH et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria. The Scientific World Journal, 2001, 1(1): 76. |
| [24] |
Paerl HW. Cyanobacterial carotenoids:Their roles in maintaining optimal photosynthetic production among aquatic bloom forming genera. Oecologia, 1984, 61(2): 143-149. DOI:10.1007/BF00396752 |
| [25] |
Починок ФН ed. Translated by Jin JH, Ding ZR. Manual of research methods for crustacean biochemistry and physiology. Beijing: Science Press, 1981: 255-258. [Починок ФН著. 荆家海, 丁钟荣译. 植物生物化学分析方法. 北京: 科学出版社, 1981: 255-258. ]
|
| [26] |
Deng XR. Solar radiation energy and plant. Hubei Agricultural Sciences, 1964(6): 56-60. [邓先瑞. 太阳辐射光能与植物. 湖北农业科学, 1964(6): 56-60.] |
| [27] |
Cao JC, Wu Q, Zhang JH et al. Studies on photosynthetic physiological characteristics and grade evaluation for free-floating algae (Ulva prolifera) along Qingdao coast. Journal of Shanghai Ocean University, 2013, 22(6): 922-927. [曹佳春, 吴青, 张建恒等. 青岛海域漂浮浒苔光合生理特性及藻体状态等级评价研究. 上海海洋大学学报, 2013, 22(6): 922-927.] |
| [28] |
Gao ZJ. Study on the distribution and growth of Microcystis aeruginosa mixed with water mixture[Dissertation]. Yangzhou: Yangzhou University, 2012. [高郑娟. 扬水曝气混合对铜绿微囊藻分布及生长抑制作用的研究[学位论文]. 扬州: 扬州大学, 2012. ]
|
| [29] |
Liang Y, Feng LX, Yi CL et al. Application and prospect of chlorophyll fluorescence technology in environmental research of microalgae. Marine Sciences, 2007, 31(1): 71-76. [梁英, 冯力霞, 尹翠玲等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景. 海洋科学, 2007, 31(1): 71-76.] |
| [30] |
Liu CQ, Xie M, Zhao J et al. Study on the toxicity effect of plasticizer on Sclerotium sclerotiorum by chlorophyll fluorescence kinetics. Acta Hydrobiologica Sinica, 2016, 40(3): 552-556. [刘常青, 谢慕, 赵剑等. 叶绿素荧光动力学检测塑化剂对尖细栅藻的毒性效应. 水生生物学报, 2016, 40(3): 552-556. DOI:10.7541/2016.74] |
| [31] |
Zhang M, Kong F, Wu X et al. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing. Hydrobiologia, 2008, 603(1): 267-278. DOI:10.1007/s10750-008-9277-4 |
| [32] |
Lin ZF, Peng CL, Lin GZ et al. High light-induced changes of the differential absorbance at 505 nm and chlorophyll fluorescence in leaves and in green alga Dunaliella salina. Journal of Tropical & Subtropical Botany, 1997(3): 27-34. [林植芳, 彭长连, 林桂珠等. 强光诱导叶片和盐藻在505 nm的差示吸收和叶绿素荧光的变化. 热带亚热带植物学报, 1997(3): 27-34.] |
| [33] |
Genty B, Briantais JM, Baker NR. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. BBA-General Subjects, 1989, 990(1): 87-92. DOI:10.1016/S0304-4165(89)80016-9 |
| [34] |
Chen F, Wang S, Pan X. Synchronous analysis of the effects of NaCl stress on photosystems Ⅰ (PSI) and Ⅱ (PSⅡ) activities of Chlorella pyrenoidosa. Chinese Journal of Applied and Environmental Biology, 2015, 21(4): 695-699. [陈飞, 王淑智, 潘响亮. 盐胁迫对蛋白核小球藻光系统Ⅰ(PSⅠ)和光系统Ⅱ(PSⅡ)的影响同步监测分析. 应用与环境生物学报, 2015, 21(4): 695-699.] |
| [35] |
Zang ZR, Xie XJ, Zhao PP et al. Effect of different temperatures and light conditions on the growth and fucoxanthin content of Phaeodactylum tricornutum. Marine Sciences, 2015, 39(7): 1-6. [臧正蓉, 解修俊, 赵佩佩等. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响. 海洋科学, 2015, 39(7): 1-6. DOI:10.11759/hykx20140403002] |
| [36] |
Liang Y, Feng LX, Tian CY et al. Effects of high temperature stress on chlorophyll fluorescence kinetics of Dunaliella salina and Pyramimonas sp. Journal of Fishery Sciences of China, 2007, 14(6): 961-968. [梁英, 冯力霞, 田传远等. 高温胁迫对盐藻和塔胞藻叶绿素荧光动力学的影响. 中国水产科学, 2007, 14(6): 961-968.] |
| [37] |
Jiang H, Wu B, Yan B et al. Application of microalgae chlorophyll fluorescence technique in environment monitoring. Journal of Environmental Engineering Technology, 2012, 2(2): 172-178. [姜恒, 吴斌, 阎冰等. 微藻叶绿素荧光技术在环境监测中的应用. 环境工程技术学报, 2012, 2(2): 172-178.] |
| [38] |
D'Ambrosio N, Arena C, Santo AVD. Temperature response of photosynthesis, excitation energy dissipation and alternative electron sinks to carbon assimilation in Beta vulgaris L. Environmental & Experimental Botany, 2006, 55(3): 248-257. |
| [39] |
Ralph PJ, Gademann R. Rapid light curves:A powerful tool to assess photosynthetic activity. Aquatic Botany, 2005, 82(3): 222-237. DOI:10.1016/j.aquabot.2005.02.006 |
| [40] |
Feng JC, Hu XL, Mao XJ et al. Application of chlorophyll a fluorescence transient in study of plant physiology under stress conditions. Economic Forest Reseaches, 2002(4): 14-18. [冯建灿, 胡秀丽, 毛训甲. 叶绿素荧光动力学在研究植物逆境生理中的应用. 经济林研究, 2002(4): 14-18.] |
| [41] |
He Y. Chlorophyll fluorescence quenching characteristics of seven coniferous and broadleaved species in different light intensities. Scientia Silvae Sinicae, 2006, 42(2): 27-31. |
| [42] |
Lian JY, Xu ZF, Xie WH et al. The characteristics of chlorophyll fluorescence in Merremia boisiana. Journal of Tropical and Subtropical, 2005, 13(5): 443-446. [练琚蕍, 徐志防, 叶万辉等. 金钟藤叶绿素荧光特征初探. 热带亚热带植物学报, 2005, 13(5): 443-446.] |
 2018, Vol. 30
2018, Vol. 30 
