(2: 山西大学生命科学学院, 太原 030006)
(2: School of Life Science, Shanxi University, Taiyuan 030006, P. R. China)
浮游植物作为水体中的主要初级生产力,在维持水生态系统健康和平衡中发挥着极其重要的作用[1].然而,随着经济的快速发展和日益频繁的人类活动,大量的污染物尤其是未经处理的工业废水、农业废水和生活污水持续不断地排入缓流水体中,造成营养盐水平(特别是氮、磷元素)严重超标,从而大大加速了水体富营养化进程.在极短的时间内水华藻类大规模生长,迅速成团成片地漂浮在水体表面,打破了水体原有的稳态,影响了水生动植物及人类的正常生活,并且带来了巨大的危害[2].
原核生物蓝藻门(Cyanophyta)种类和真核生物绿藻门(Chlorophyta)、裸藻门(Englenophyta)、硅藻门(Bacillariophyta)、甲藻门(Dinophyta)、金藻门(Chrysophyta)和隐藻门(Cryptophyta)的一些种类都可在一定条件下形成水华.其中,蓝藻水华已成为全球富营养化水体中发生最广、危害最大的水华类型[3-4].分类学是揭示生物多样性的初始途径.在藻类分类学中,经典方法主要是通过描述细胞的形状、大小、细胞排列、异形胞和厚壁孢子的大小及相对位置等特征来区分不同藻种.但是,环境或细胞生理生态的变化可能会影响藻细胞的形态而出现复合型或过渡类型,这些类型的出现可能对传统分类结果造成误判[5].近年来,分子生物学迅猛发展,分子生物学技术也在藻类多样性研究中得到了广泛应用.作为分类研究,有分子数据的支撑,可进一步从基因角度为分类提供依据.核苷酸和蛋白质都是遗传信息的载体,因此,利用核苷酸和氨基酸序列的同源性来推断物种间的系统发生关系,可以更准确地反映它们的原始进化关系[6].
山西省水资源严重匮乏,省内河流屈指可数,其中最大且最长的河流是汾河,它在维持山西生态环境、经济发展和居民生活中起着不可估量的作用.汾河太原河段处于汾河流域的中段.随着工业发展和城市人口的迅速膨胀,水体富营养化日益严重,导致水质开始恶化. 2011年8月,汾河太原段暴发了大规模的蓝藻水华,被污染的水域长达数公里,其后每年都会发生面积不等的水华.水华发生后,首先需准确判断水华藻的种类,对于藻毒素污染的预警、水华的监测和控制起到极其重要的指导作用.因此,本文通过对汾河太原河段浮游植物的大量采集,分离纯化其中的水华优势种并进行形态观察,探究水华藻的形态多样性.运用分子生物学技术,基于比较保守的cpcBA-IGS、gyrB和cpSSU基因序列,同GenBank数据库中的序列建立分子系统发育树进行系统发育分析,探讨水华藻种的系统分类地位,以期为汾河太原河段生态系统的可持续发展和生态保护提供科学数据.
1 材料与方法 1.1 采样时间及位点2012—2016年,每年的5月(春季)、7月(夏季)和10月(秋季),在山西省汾河太原河段设置10个采样位点(图 1)进行浮游植物样品采集.按照文献[7-8]采集浮游植物样品.
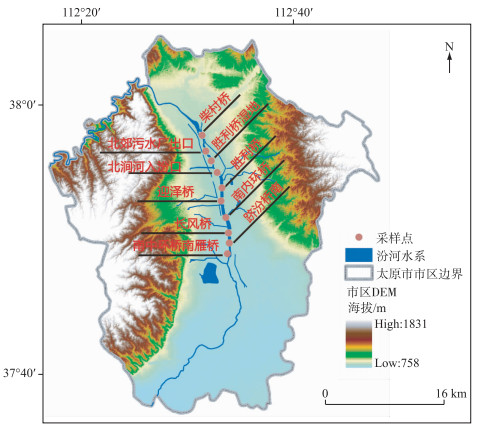
|
图 1 汾河太原河段采样点分布 Fig.1 Distribution of sampling sites in Taiyuan region of Fenhe River |
藻种的分离纯化采用经典的毛细管分离法.用毛细管挑取的单藻细胞移入装有MA(微囊藻适用)或AF-6(裸藻适用)培养基[9]的24孔细胞培养板中培养.纯化后的藻种编号为TY001、FH0002、FH0003、FH0004、FH0005、FH0006、FH0007、FH0008、FH0009、FH0010和TY501,并保存于太原师范学院生物系藻种培养室中.用Olympus BX51型光学显微镜(Olympus,日本)进行观察和拍照.
1.3 分离纯化的微囊藻和裸藻的分子系统研究 1.3.1 基因组DNA提取本研究采用改进的CTAB法提取藻类基因组DNA[5, 10].
1.3.2 PCR扩增用于本研究的PCR扩增引物均由上海生工生物工程股份有限公司合成,详见表 1. PCR反应体系为20 μl,包含200 μmol/L dNTPs,1.5 mmol/L MgCl2,10×buffer PCR缓冲液2 μl,10 mg/ml BSA 1 μl,引物各10 pmol,1 U TaqDNA聚合酶,10~20 ng的DNA模板,其余量用双蒸水补足. 20 μl反应体系于MJ Mini BioRad PCR仪(BioRad, USA)中扩增,扩增条件为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸50 s,共35次循环,72℃延伸10 min.
| 表 1 本研究所用的PCR扩增引物 Tab.1 Primers of PCR in this study |
PCR扩增产物由北京华大基因科技有限公司进行双向测序,并拼接测序得到的正反向序列(BioEdit软件),然后用Clustal X 1.83软件对拼接序列和GenBank数据库中下载的相关基因序列进行对位排列.使用DAMBE 5.3软件来估计核苷酸替代饱和性.运用分子进化遗传分析软件MEGA 6.06基于Kimura2-parameter模型构建NJ和MP系统发育树,PHYML 3.0软件构建ML系统发育树.
2 实验结果本研究共鉴定出5种水华优势种,5月份发生的裸藻水华优势种为裸藻属的膝曲裸藻(Euglena geniculata)和血红裸藻(E. sanguinea).而7—9月份发生的微囊藻水华优势种为微囊藻属的铜绿微囊藻(Microcystis aeruginosa)、挪氏微囊藻(M. novacekii)和惠氏微囊藻(M. wesenbergii).分离纯化共得到11株单克隆水华藻,其中铜绿微囊藻8株,挪氏微囊藻2株,血红裸藻1株.
2.1 形成水华的裸藻的形态特征 2.1.1 膝曲裸藻(E. geniculata)的形态特征E. geniculata Dujardin, Hist. nat. Zooph. -Inf., p. 362, 1841; Chu, Sinensia, 17: 100, fig. 9, 1947.
细胞形态多变,常为纺锤形,前端钝圆,末端渐尖.表质具螺旋线纹,自左向右环绕.细胞长约75 μm,宽约20 μm.眼点明显,呈表玻型.核的前后两端各具1个呈星形的色素体.每个星形色素体由多个条带状色素体辐射排列而成,中央具1个带副淀粉粒的蛋白核.鞭毛约与体长相等(图 2 A和B).
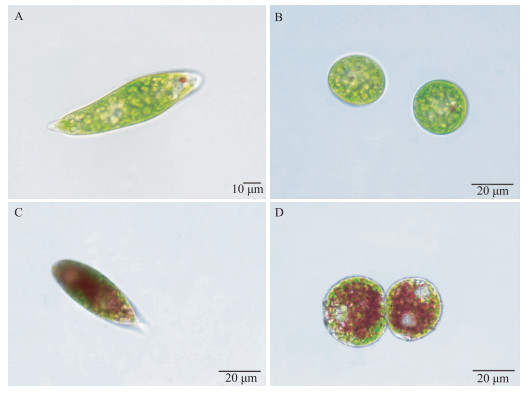
|
图 2 膝曲裸藻(A和B)和血红裸藻(C和D)的光学显微照片 Fig.2 Light microscope photographs of E. geniculata (A and B) and E. sanguinea(C and D) |
E. sanguinea Ehrenberg, Abh. Berl. Akad. Wiss. Physik. aus d. Jahre, 1830; Chu, Sinensia, 17: 103, figs. 11-17, 1947.
细胞形态多变,常为纺锤形,前端钝圆,末端渐尖呈尾状.表质具螺旋线纹,自左向右环绕.细胞长约50 μm,宽约20 μm.具多个呈星形的色素体,每个星形色素体由多个条带状色素体辐射排列而成,中央具1个带副淀粉粒的蛋白核.含有裸藻红素.鞭毛约为体长的1.5倍.眼点明显,呈表玻型(图 2 C和D).
2.2 形成水华的微囊藻的形态特征 2.2.1 铜绿微囊藻(M. aeruginosa)的形态特征M. aeruginosa Kützing, 1845—1849; Chu, p. 83, pl. XXⅧ, fig. 91, 1950.
群体团块较大,自由漂浮,肉眼可见,橄榄绿色或深绿色.细胞球形,直径4.5~5.8 μm,有气囊(gas vesicle).群体中实,发育早期为球形或者椭圆形.群体呈树枝状.胶被不密贴细胞,距离2 μm以上,常出现穿孔.胶被无色或淡黄绿色,无折光、无层理且不明显.胶被内细胞排列较紧密(图 3 C和D).

|
图 3 微囊藻水华群体(A和B)及铜绿微囊藻(C和D)、挪氏微囊藻(E和F)和惠氏微囊藻(G和H)的光学显微照片 Fig.3 Light microscope photographs of Microcystis blooms (A and B) and M. aeruginosa (C and D), M. novacekii (E and F), M. wesenbergii (G and H) |
M. novacekii Compère, 1974; Komárek & Anagnostidis in Ettl et al., Süßwasserflora von Mitteleuropa 19/1, 231, fig. 302. 1999.
群体团块较小,自由漂浮.细胞球形,直径3.8~5.6 μm,有气囊.由胶被连接3~5个小群体形成形状不等的大群体,群体不形成树枝状,未见穿孔.胶被不密贴细胞,距离5 μm以上.胶被较明显,呈无色或淡黄绿色,无折光.胶被内细胞排列较疏松(图 3 E和F).
2.2.3 惠氏微囊藻(M. wesenbergii)的形态特征M. wesenbergii Komárek, 1968; He J-W et al. in Acta Hydrobiologica Sin. 20: 192, fig. 1. 1996.
群体团块较大,自由漂浮,肉眼可见.群体形态变化最多.细胞球形或近球形,直径4.6~8.2 μm,有气囊.群体胶被非常明显,无色透明,有层理,有折光.胶被内细胞少,但排列较疏松,有时充满整个胶被.小群体常由胶被连成更大的球形、树枝状或网状群体(图 3 G和H).
2.3 微囊藻的分子系统研究 2.3.1 基于cpcBA-IGS序列的微囊藻分子系统研究82株蓝藻的cpcBA-IGS序列用于系统发育树的构建,其中有10株本研究分离纯化的微囊藻,71株GenBank数据库下载的微囊藻cpcBA-IGS序列,外类群定为集胞藻(NC_000911 Synechocystis sp. PCC 6803).基于cpcBA-IGS序列的碱基转换与颠换同GTR遗传距离的相关性分析显示,这些序列的突变位点未达到饱和.经ModelTest软件计算结果显示,用微囊藻的cpcBA-IGS序列构建ML系统发育树的最优进化模型为GTR+I+G.
采用82株蓝藻的cpcBA-IGS序列构建的系统发育树(图 4)显示,3种树的拓扑结构基本一致.本研究分离纯化得到的8株铜绿微囊藻分布在3个大支上,其中,2株铜绿微囊藻FH0003和FH0007同GenBank数据库中的3株铜绿微囊藻(越南梅家河的KF840319 M. aeruginosa H107、西班牙Pinilla水库的EU643818 M. aeruginosa UAM-VMA-7和EU643815 M. aeruginosa UAM-VMF-1A)分为一个聚类,且有较高的自展支持率.铜绿微囊藻FH0004和中国滇池的AY568706 M. aeruginosa FACHB-907分为一个聚类,FH0002和韩国水库的HM020406 M. aeruginosa CBE-29分为一个聚类,这4株藻又聚为一个大类.分离纯化的2株挪氏微囊藻FH0008和FH0010形成一个独立簇,在ML、MP和NJ系统发育树中的支持率分别为93%、99%和92%.铜绿微囊藻FH0006和FH0009形成一个聚类,与FH0005、TY001聚成一个大的簇.
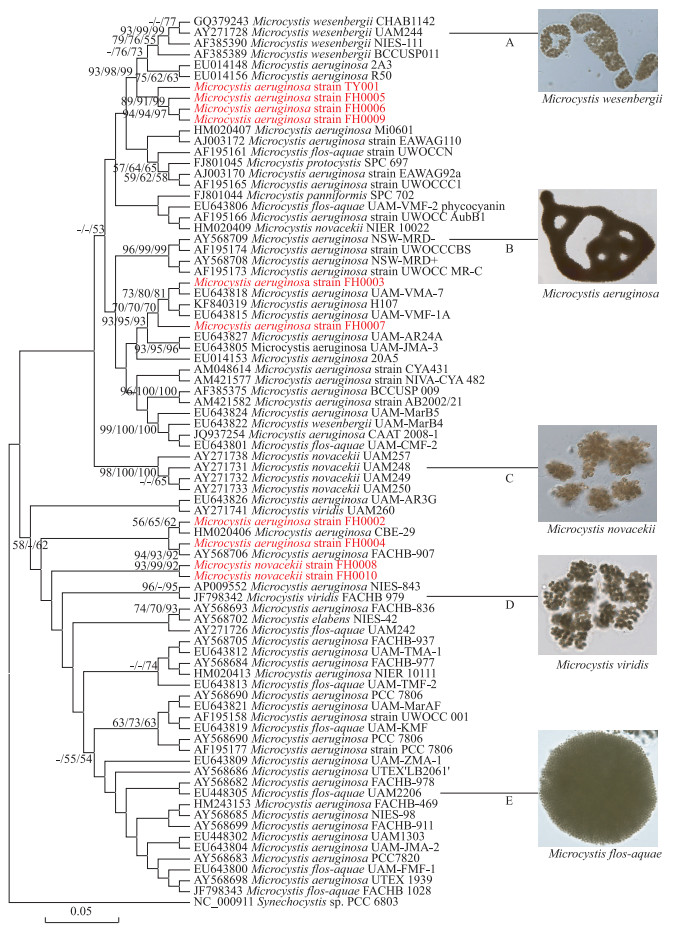
|
图 4 基于cpcBA-IGS序列构建的分子系统树(节点处数字代表ML、MP和NJ方法所构建的系统树的支持率,低于50%的未显示) Fig.4 The phylogenetic tree based on sequences of cpcBA-IGS |
23株蓝藻的gyrB基因序列用于系统发育树的构建,其中有10株本研究分离纯化的微囊藻,12株GenBank数据库下载的微囊藻gyrB基因序列,外类群定为集胞藻(NC_000911 Synechocystis sp. PCC 6803).基于gyrB基因序列的碱基转换与颠换同GTR遗传距离的相关性分析显示,这些序列的突变位点未达到饱和.经ModelTest软件计算结果显示,用微囊藻的gyrB基因序列构建ML系统发育树的最优进化模型为TrN+I+G.
采用23株蓝藻的gyrB基因序列构建的系统发育树(图 5)显示,3种树的拓扑结构基本一致.分离纯化的挪氏微囊藻FH0008和FH0010形成一个独立簇,在ML、MP和NJ系统发育树中的支持率分别为95%、98%和97%.同微囊藻cpcBA-IGS序列构建的系统发育树显示的结果相同,自展支持率数值也非常接近.铜绿微囊藻FH0006和FH0009形成一个聚类,并与铜绿微囊藻FH0005、TY001聚成一个大的簇. FH0003和FH0007也聚成一类,但是与片状微囊藻(江苏太湖的CP011339 M. panniformis FACHB-1757)又聚成一个大的簇. FH0002和FH0004形成一个聚类,但又与水华微囊藻(广东汤溪水库的GU248273 M. flos-aquae TX016)聚成一个大的簇. GenBank数据库中的铜绿微囊藻gyrB基因序列也没有全部形成一个聚类.
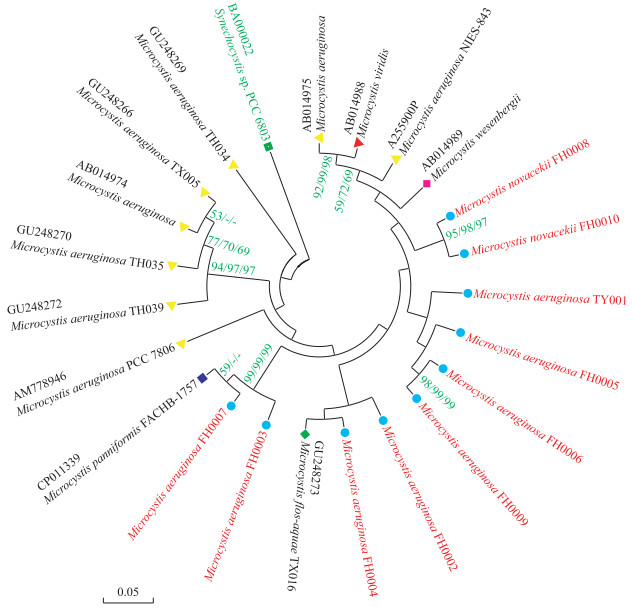
|
图 5 基于gyrB基因构建的分子系统树(节点处数字分别代表ML、MP和NJ方法所构建的系统树的支持率,低于50%的未显示) Fig.5 The phylogenetic tree based on sequences of gyrB gene |
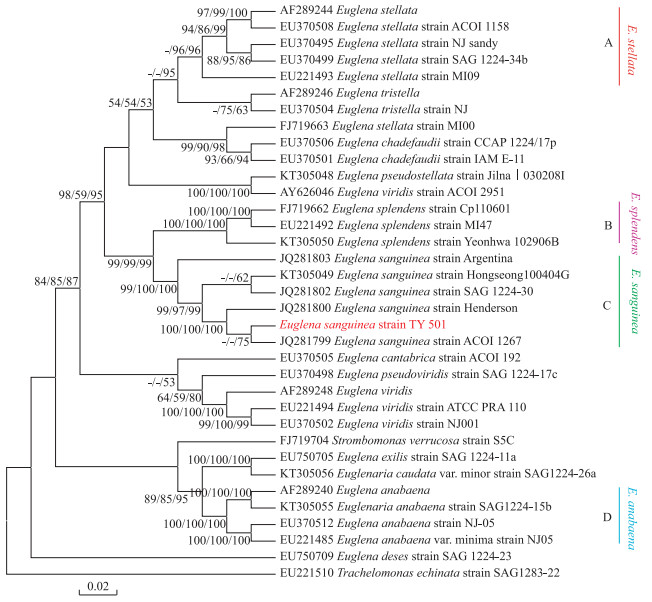
35株裸藻的cpSSU序列用于系统发育树的构建,有2株设定为外类群,即具瘤陀螺藻(FJ719704 Strombomonas verrucosa)和1株囊裸藻(EU221510 Trachelomonas echinata).基于cpSSU序列的碱基转换与颠换同GTR遗传距离的相关性分析显示,这些序列的突变位点未达到饱和.经ModelTest软件计算结果显示,用裸藻的cpSSU序列构建ML系统发育树的最优进化模型为GTR+I+G.
采用35株裸藻的cpSSU序列构建的系统发育树(图 6)显示,使用3种方法构建的系统发育树有非常相似的拓扑结构.本研究中分离纯化的得到的1株裸藻TY501与GenBank数据库中葡萄牙Montemor-o-Velho的血红裸藻JQ281799 E. sanguinea ACOI 1267和美国德克萨斯亨德森水产养殖场的JQ281800 E. sanguinea Henderson亲缘关系较近,3种树中显示的自展支持率均为100%.这3株血红裸藻与GenBank数据库中序列相似性较高的其他裸藻分为一个聚类C,并获得较高的支持率,与其他裸藻种(聚类A、B和D)明显区分开,分成不同的聚类.光学显微镜下根据形态特征观察也鉴定为血红裸藻.形态观察和分子生物学数据相吻合,可以确定这株水华裸藻为血红裸藻.
|
图 6 基于cpSSU序列构建的分子系统树(节点处数字代表ML、MP和NJ方法所构建的系统树的支持率,低于50%的未显示) Fig.6 The phylogenetic tree based on sequences of cpSSU |
随着人类活动的加剧,我国淡水水体的富营养化日益加重,众多水库和湖泊发生水华的频度和规模也在增大,发生的水华常以微囊藻为优势种,并且多种微囊藻以不同的比例同时出现[2].本研究发现,汾河太原河段发生的微囊藻水华常以铜绿微囊藻、惠氏微囊藻和挪氏微囊藻为优势种,这3种藻同时出现且形成大规模水华漂浮在水面.我国的淡水湖泊太湖、巢湖、东湖和鄱阳湖也同时存在多种微囊藻形成的水华[14].但是,目前对于微囊藻的分类还有些问题没有理清.首先,微囊藻的分类鉴定主要依据其群体形态,然而,环境变化可能引起微囊藻单细胞或群体形态的变化,实验室单克隆培养的微囊藻群体形态和野外采集的微囊藻有较大的区别.其次,微囊藻的16s rRNA基因高度保守,研究发现微囊藻藻种之间的基因型相似性较高[15].因此,对于不同生境的微囊藻属种类的分类及分子系统研究,一般多采用综合方法,如形态、超微结构、生理生化和分子生物学等.日益肆虐的微囊藻水华威胁着水体环境和人类健康,揭示微囊藻属的系统分类地位和多样性,寻求生态环保型的水华治理方法变得极为重要[12, 15].
目前,我国学者对于微囊藻水华危害和生态学高度重视且研究最多,而对于微囊藻多样性的研究还较薄弱.虞功亮等[15]和杨平等[16]通过传统分类学方法分别描述了滇池和鄱阳湖的微囊藻.张军毅等[17]结合分子生物学方法报道了江苏太湖微囊藻的新记录种片状微囊藻(Microcystis panniformis),并和其他微囊藻种进行了比较.和我国南方水体相比,我国北部地区发生的水华很少,微囊藻水华的研究较少,分离纯化得到的微囊藻种更少.本研究从我国华北黄土高原山西省的汾河太原河段中分离到了2种微囊藻(铜绿微囊藻和挪氏微囊藻),其中挪氏微囊藻在汾河流域是首次发现并得到纯化藻株,同时也对其分子系统进行了研究. 16S rRNA基因(16S rDNA)普遍存在于蓝藻等生物体内,但由于该基因具有高度的保守性和一定的变异性,被广泛应用于蓝藻分子系统研究中[18].最近研究发现,这个基因保守度较高而不宜应用在种以下水平的分类研究[19],因此,本研究也未采用16S rRNA基因来揭示微囊藻各藻种的多样性. DNA促旋酶β亚基编码基因gyrB[20]和藻蓝蛋白的两个藻胆色素亚基之间的间隔区序列(cpcBA-IGS)[21]突变频率较高且含有丰富遗传变异信息,是蓝藻分类和分子系统研究的有效分子标记,也常常用于这些相似形态种的种间和种内分子多样性和分类地位进行判断.然而Xu等[22]的研究发现cpcBA-IGS并不能把表型不同的微囊藻区分开,而多糖生物合成相关基因可把惠氏微囊藻和鱼害微囊藻区分开. Tan等[21]研究发现cpcBA-IGS序列可以区分惠氏微囊藻和其他微囊藻种.而本研究中分子标记cpcBA-IGS序列未能将惠氏微囊藻和其他微囊藻区分开,可能的原因是,随着不同国家和不同地区测定的微囊藻序列的增多,单一基因序列不能很好地区分种以下水平的微囊藻藻株.刘海林等[20]使用gyrB基因对微囊藻的种间和种内相似性进行了研究,结果表明,表型和基因型的聚类无直接关系,同一地区或同一河流的微囊藻也可能不会聚为一簇.本研究基于cpcBA-IGS序列和gyrB基因构建的ML、MP和NJ系统发育树结果也印证了这一观点.本研究发现在同一河段采集到的铜绿微囊藻也没有聚为一簇,说明同一地域同一藻种不同藻株之间也可能有较大的基因差异,而不同地域的藻株可能有相同或相似的基因型.因此,需得到更多的水华藻样品进行大数据分析,尤其要在现有单克隆水华藻较少的北方地区采集更多的样品,分离纯化很多的水华藻株进行系统研究.目前,铜绿微囊藻等几种微囊藻已完成全基因组测定,可更深入地研究微囊藻种间的系统发育关系,并可为微囊藻水华暴发机制和防控研究提供参考.
3.2 汾河太原河段引起水华发生的裸藻种的探讨我国的大中型淡水湖、水库和江河常发生蓝藻、绿藻和硅藻水华,裸藻水华很少发生.每年的4月初到11月底,在有机质丰富的静止水体中,如池塘、鱼塘等,以绿色裸藻、变形裸藻和血红裸藻为优势种的裸藻水华经常发生[23],对鱼、虾等养殖业造成了极大的损失.本研究发现,2013年后,每年5月初,太原天气刚刚转暖,汾河太原河段的跻汾桥和南中环桥段都会发生一定规模的裸藻水华,持续时间大约为1个月,然后裸藻生物量急剧下降,优势种迅速转变为其他门类.经鉴定,发生裸藻水华的优势种类为膝曲裸藻和血红裸藻.可能的原因是汾河太原河段经过冰封期营养物质的积累,有机质更加丰富,裸藻可适应较低的温度,在太原天气转暖的同时,裸藻生物量逐渐升高,达到一定温度后,膝曲裸藻和血红裸藻生物量迅速大规模增加,发生水华.水华发生后,需准确判断水华裸藻种的分类地位,对水华的监测和控制及裸藻的利用有很重要的指示作用.经传统分类方法鉴定,本研究中分离纯化得到的裸藻藻种为血红裸藻.基于cpSSU序列构建的ML、MP和NJ系统发育树显示,本研究中的血红裸藻和NCBI数据库中的血红裸藻聚为一个大的分支,表明分子分类的结果支持传统分类鉴定的结论,并且cpSSU是区分血红裸藻和其他裸藻很好的分子标记序列.有鱼虾养殖户曾猜测某些裸藻死亡分解后会释放出毒素,且毒性较大,并可引起鱼虾逐渐中毒死亡[24].目前,虽然并未发现裸藻产毒素的报道,但本研究也未能排除某些裸藻种会产生毒素,在以后的研究中,可对野外采集或分离纯化到的裸藻进行产毒分析.以上结果表明,对于裸藻种的分类地位的研究具有非常重要的意义.
4 结论通过形态观察共鉴定出5种水华优势种,分别为裸藻属的膝曲裸藻(E. geniculata)和血红裸藻(E. sanguinea),微囊藻属的铜绿微囊藻(M. aeruginosa)、挪氏微囊藻(M. novacekii)和惠氏微囊藻(M. wesenbergii).分离纯化共得到11株单克隆水华藻,其中铜绿微囊藻8株,挪氏微囊藻2株,血红裸藻1株.运用cpcBA-IGS、gyrB和cpSSU基因序列构建系统发育树,进一步确定水华藻的系统分类地位,结果表明cpcBA-IGS是研究汾河太原河段铜绿微囊藻分类很好的分子标记,而cpSSU基因可很好地区分血红裸藻和其他裸藻种.
| [1] |
Xie B, Zhang S, Li L et al. Community structure of phytoplankton in the sea farming of Haizhou Bay and its relationships with environmental factors. Acta Scientiae Circumstantiae, 2017, 37(1): 121-129. [谢斌, 张硕, 李莉等. 海州湾海洋牧场浮游植物群落结构特征及其与水质参数的关系. 环境科学学报, 2017, 37(1): 121-129.] |
| [2] |
Yang P, Dai GF, Fang YY et al. A discussion on diversity of bloom-forming cyanobacteria in Aixi Lake. Jiangxi Hydraulic Science & Technology, 2017, 43(3): 162-166. [杨平, 戴国飞, 方媛瑗等. 艾溪湖水华蓝藻多样性探讨. 江西水利科技, 2017, 43(3): 162-166.] |
| [3] |
Xie P. A review on the causes of cyanobacterial blooms from an evolutionary, biogeochemical and ecological view of point. Beijing: Science Press, 2007. [谢平. 论蓝藻水华的发生机制-从生物进化、生物地球化学和生态学视点. 北京: 科学出版社, 2007.]
|
| [4] |
Huang HM, Xiao X, Lin F et al. Continuous-release beads of natural allelochemicals for the long-term control of cyanobacterial growth:preparation, release dynamics and inhibitory effects. Water Research, 2016, 95: 113-123. DOI:10.1016/j.watres.2016.02.058 |
| [5] |
Wang J. Taxonomic and molecular phylogenetic studies of Nostoc (Cyanobacteria)[Dissertation]. Taiyuan: Shanxi University, 2011. [王捷. 念珠藻属(蓝藻)的分类及分子系统研究[学位论文]. 太原: 山西大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10108-1012279331.htm ]
|
| [6] |
Li XC, Dreher TW, Li RH. An overview of diversity, occurrence, genetics and toxin production of bloom-forming Dolichospermum (Anabaena) species. Harmful Algae, 2016, 54: 54-68. DOI:10.1016/j.hal.2015.10.015 |
| [7] |
Zhang ZS, Huang XF. Research methods for freshwater plankton. Beijing: Science Press, 1991. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.]
|
| [8] |
Wang J, Feng J, Xie SL et al. Phytoplankton diversity and off-flavor-producing Microcystis in the Taiyuan region of the Fenhe River. Acta Ecologica Sinica, 2015, 35(10): 3357-3363. [王捷, 冯佳, 谢树莲等. 汾河太原河段浮游植物多样性及微囊藻产异味物质研究. 生态学报, 2015, 35(10): 3357-3363.] |
| [9] |
Kasai F, Kawachi M, Erata M et al eds. NIES-collection, list of strains: Microalgae and Protozoa. Tsukuba: National Institute for Environmental Studies Japan, 2004: 257.
|
| [10] |
Doyle JJ, Doyle JL. The cytosolic glutamine synthetase gene family in Leguminosae:gene phylogeny and evolution of its role nodulation. American Journal of Botany, 1997, 84S: 188. |
| [11] |
Neilan BA, Jacobs D, Goodman AE. Genetic diversity and phylogeny of toxic cyanobacteria determined by DNA polymorphisms within the phycocyanin locus. Applied and Environmental Microbiology, 1995, 61(11): 3875-3883. |
| [12] |
Yoshida M, Yoshida T, Satomi M et al. Intra-specific phenotypic and genotypic variation in toxic cyanobacterial Microcystis strains. Journal of Applied Microbiology, 2008, 105: 407-415. DOI:10.1111/jam.2008.105.issue-2 |
| [13] |
Stacy B, Woongghi S, Karl MK et al. Phylogeny of the photosynthetic euglenophytes inferred from the nuclear SSU and partial LSU rDNA. International Journal of Systematic and Evolutionary Microbiology, 2003, 53: 1175-1186. DOI:10.1099/ijs.0.02518-0 |
| [14] |
Chai WB. Studies on diversity, spatial-temporal distribution and toxin of bloom-forming cyanobacteria in Poyang Lake[Dissertation]. Nanchang: Jiangxi Normal University, 2013. [柴文波. 鄱阳湖水华蓝藻多样性、动态及毒素研究[学位论文]. 南昌: 江西师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10414-1013375903.htm ]
|
| [15] |
Yu GL, Song LR, Li RH. Taxonomic notes on water bloom forming Microcystis species (Cyanophyta) from China-An example from samples of the Dianchi Lake. Acta Phytotaxonomica Sinica, 2007, 45(5): 727-741. [虞功亮, 宋立荣, 李仁辉. 微囊藻属常见种类的分类学讨论——以滇池为例. 植物分类学报, 2007, 45(5): 727-741.] |
| [16] |
Yang P, Chai WB, Huang J et al. Study on morphological diversity of Microcystis (Cyanophyta) from Poyang Lake, China. Journal of Jiangxi Normal University, 2014, 38(5): 496-500. [杨平, 柴文波, 黄静等. 鄱阳湖微囊藻属形态多样性研究. 江西师范大学学报, 2014, 38(5): 496-500.] |
| [17] |
Zhang JY, Zhu BC, Wu ZJ et al. Microcystis panniformis-A newly recorded species of Microcystis in China. J Lake Sci, 2012, 24(4): 647-650. [张军毅, 朱冰川, 吴志坚等. 片状微囊藻(Microcystis panniformis)——中国微囊藻属的一个新记录种. 湖泊科学, 2012, 24(4): 647-650. DOI:10.18307/2012.0421] |
| [18] |
Chen D, Zhang Q, Qian KC et al. Sequence analysis of 16S rRNA gene from 3Microcystis flos-aquae in Guangdong Reservoirs. Ecologic Science, 2006, 25(1): 41-42. [陈迪, 章群, 钱开诚等. 广东省水库3株水华微囊藻16S rRNA序列分析. 生态科学, 2006, 25(1): 41-42.] |
| [19] |
Wu ZX, Gan NQ, Song LR. Genetic diversity:Geographical distribution and toxin profiles of Microcystis strains (Cyanobacteria) in China. Journal of Integrative Plant Biology, 2007, 49(3): 262-269. DOI:10.1111/jipb.2007.49.issue-3 |
| [20] |
Liu HL, Zhang Q, Li ML et al. Sequence analysis of gyrB gene from Microcystis in Lake Taihu and Tangxi Reservoir (Guangdong Province). J Lake Sci, 2010, 22(2): 221-226. [刘海林, 章群, 李名立等. 太湖与广东汤溪水库微囊藻gyrB基因序列分析. 湖泊科学, 2010, 22(2): 221-226. DOI:10.18307/2010.0211] |
| [21] |
Tan WH, Liu Y, Wu ZX et al. CpcBA-IGS as an effective marker to characterize Microcystis wesenbergii (Komárek) Komárek (cyanobacteria). Harmful Algae, 2010, 9(6): 607-612. DOI:10.1016/j.hal.2010.04.011 |
| [22] |
Xu ST, Sun QQ, Zhou XH et al. Polysaccharide biosynthesis-related genes explain phenotype-genotype correlation of Microcystis colonies in Meiliang Bay of Lake Taihu, China. Scientific Reports, 2016, 6: 35551. DOI:10.1038/srep35551 |
| [23] |
Liu GX. Characteristics of bloom-forming Euglena in aquaculture ponds and its regulation and control. China Fisheries, 2009(2): 59-60. [刘国祥. 水产养殖池塘裸藻水华的特点、危害和调控. 中国水产, 2009(2): 59-60.] |
| [24] |
Li LT. Harms of bloom-forming Euglena and its control measures in Penaeus vannamei pond. Scientific Fish Farming, 2013(2): 59-60. [李连同. 南美白对虾塘发生裸藻水华的危害及防控对策. 科学养鱼, 2013(2): 59-60.] |
 2018, Vol. 30
2018, Vol. 30 

