(2: 中国科学院水生生物研究所藻类生物学重点实验室, 武汉 430072)
(3: 武汉市鄂正农科技发展有限公司, 武汉 430071)
(2: Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: Wuhan Ezhengnong Science and Technology Limited Company, Wuhan 430071, P. R. China)
水体富营养化及蓝藻水华暴发是当今全球范围内的环境问题之一.我国的许多大中型浅水湖泊如太湖、巢湖、滇池等的蓝藻水华暴发范围和强度都已经相当严重,造成水体生态系统结构和功能的紊乱,影响旅游、养殖等行业的健康发展[1-3].鱼腥藻(Anabaena)水华出现频度和规模仅次于微囊藻水华,而鱼腥藻的形态、生理生态和有害产物(如毒素和异味物质)具有更高的多样性.如Liu等通过11年的调查,发现太湖梅梁湾的鱼腥藻含量达到蓝藻总量的8.4%,而在大湖湖中区的比例更高,是第2大水华蓝藻种类[4].为了控制不同种类蓝藻水华的暴发,除了对蓝藻水华共性的生理生态等进行研究之外,更需要对不同水华蓝藻的控制等进行个性研究.利用生物控制特别是细菌的溶藻作用来去除蓝藻水华是近10多年间的研究热点之一.当前研究大多数集中在微囊藻溶藻细菌的筛选和制备,对鱼腥藻的种类如水华鱼腥藻(A. flos-aquae)有溶解作用的细菌也先后被发现,如蜡状芽孢杆菌(Bacillus cereus)、短小芽孢杆菌(B. pumilus)[5]、金黄杆菌属(Chryseobacterium)[6],也为这个最常见的鱼腥藻水华种类的防治提供了生物治理的途径.真紧密鱼腥藻(A. eucompacta)是李仁辉等1999年在日本湖泊中发现的鱼腥藻新种[7],这个种类的藻丝形状、细胞大小以及异形胞(heterocyst)和厚壁孢子(akinete)的位置都和水华鱼腥藻有较大的区别.最近该种类经常在武汉市及其周边的一些小型城市湖泊和池塘中暴发,形成蓝藻水华. 2015年5月下旬,武汉市江汉区菱角湖暴发全湖性的蓝藻水华,绝对优势种类为真紧密鱼腥藻,最后使用改性土壤絮凝剂—复合微生物工程菌剂(EZN01)应急处理,取得了全湖性的鱼腥藻水华去除效果.本研究从此土壤中进行菌种筛选,初选到一株使真紧密鱼腥藻藻液黄化的菌株,研究该菌株的生理生化特征,分析其系统发育特征,并用该菌株对真紧密鱼腥藻A. eucompacta CHAB 1799进行溶藻试验,确定其溶藻方式,旨在为淡水水体微生物控藻技术提供一定的数据参考,为治理蓝藻水华提供更多技术备选,同时丰富溶藻细菌资源库.
1 材料与方法 1.1 材料 1.1.1 供试藻种及培养条件供试藻种选用真紧密鱼腥藻A. eucompacta CHAB 1799,来源于中国科学院水生生物研究所有害藻类学科组藻种库.藻种在25±1℃,光照强度为30 μmol/(m2·s),光暗周期比为12 h:12 h的条件下培养.
1.1.2 培养基细菌培养基为牛肉膏蛋白胨和R2A培养基[8],蓝藻培养基为CT完全培养基[9].牛肉膏蛋白胨培养基配方是牛肉膏3 g、蛋白胨10 g、NaCl 5 g、蒸馏水1000 ml,pH为7.2,固体培养基则另外添加琼脂15~18 g.
1.2 方法 1.2.1 溶藻细菌的分离称取10 g采自武汉新洲地区的土壤,放入盛有90 ml无菌水的三角瓶中,加入无菌玻璃珠,在28℃、180转/min的条件下振荡,1 h后在超净工作台取上清液,用无菌水进行10倍的梯度稀释,取10-3、10-4、10-5的稀释液100 μl涂布于牛肉膏蛋白胨固体平板,于28℃倒置培养2天,挑取不同形态的菌落进一步用平板划线分离法纯化,纯化后的细菌用甘油保藏法保存在-80℃冰箱.溶藻菌的筛选采用液体感染法.挑取单克隆于液体牛肉膏蛋白胨培养基中扩大培养,控制其OD600 nm值在1.2~1.5之间,使其处于对数生长期后期.以5%的体积比添加菌液到藻液中,新鲜的牛肉膏蛋白胨液体培养基做空白对照,培养条件见1.1.1节,7 d后测定其叶绿素a浓度,计算溶藻效率[10].
1.2.2 菌株WP的分子生物学鉴定采用原核微生物通用引物27 F(AGAGTTTGATCCTGGCTCAG)及1492 R(ACGGCTACCTTGTTACGACTT)对菌株WP的16S rRNA基因进行PCR扩增. PCR反应体系(20 μl)包括TSINGKE© Master Mix 10 μl,上下游引物各0.5 μl,ddH2O 8 μl,模板DNA 1 μl. PCR扩增条件为:95℃预变性5 min,35个循环反应包括95℃变性30 s、55℃退火30 s和72℃延伸50 s,最后72℃延伸5 min. PCR产物纯化和克隆后进行测序.测序获得的拼接结果进行校对后,通过BLAST比对,相关序列于Bioedit 7.1.3.0进行序列比对分析,最后用MEGA 7进行系统发育树的构建.
1.2.3 菌株WP的扫描电镜观察用洁净微量吸管吸取对数期菌液,小心滴加在铜片或者载玻片上,形成一个小液珠,静置2~3 min,使样品吸附在膜上,用滤纸片从液滴边缘吸去部分菌液,2.5%戊二醛4℃固定2~4 h,用0.1 M磷酸盐缓冲液(pH=6.4~7.2)漂洗样品3次,每次15 min;用梯度浓度的乙醇溶液(10%、30%、50%、70%、80%和90% (v/v))依次对样品进行脱水处理,每次10 min,100%乙醇再脱水两次,每次10 min;再用乙醇和叔丁醇的混合溶液(乙醇:叔丁醇=3:1、1:1和1:3)依次进行置换,每次10 min,再用纯叔丁醇置换两次,每次10 min;冷冻干燥,镀金膜,利用S-4800型扫描电子显微镜(Scanning Electron Microscope, SEM, Hitachi公司)进行观察.
1.2.4 菌株WP生长曲线的测定挑取单克隆于新鲜无菌R2A培养基中扩大培养.扩大培养后的菌液再接种到新鲜R2A培养基中,控制其初始OD600 nm为0.04,在28℃,180转/min条件下培养,定时取样,用分光光度计测定其OD600 nm.
1.2.5 不同生长时期细菌对溶藻效果的影响取停滞期(OD600 nm= 0.15)、对数期(OD600 nm= 1.2)、稳定期(OD600 nm= 1.5)的菌液,分别以5%的体积比添加到藻液中,以R2A为空白对照,培养条件见1.1.1节,每隔3天取样测定其叶绿素a浓度.
1.2.6 不同生长时期藻液对溶藻效果的影响取对数期的菌液,以体积比5%添加到处于停滞期、对数期、稳定期的藻液中,以R2A为空白对照,培养条件同1.1.1节,每隔3天取样测定其叶绿素a浓度.
1.2.7 菌株WP的溶藻方式取对数后期的发酵液室温离心(10000 g,10 min),上清液过0.22 μm(Millipore)的膜两次,用牛肉膏蛋白胨固体培养基检测上清液是否除菌完全.发酵液离心后的沉淀为菌体,用新鲜无菌液体R2A培养基洗菌3遍,最后等体积重悬.以5%的体积比添加上清液、菌体、发酵液到藻液中,以R2A为空白对照,培养条件见1.1.1节,7天后测定其叶绿素a浓度,计算溶藻效率.
2 结果 2.1 菌株WP的形态特征及溶藻过程分离获得一株细菌,命名为WP.菌株WP在牛肉膏蛋白胨固体平板上形成的菌落呈圆形,表面湿润,扁平,光滑,边缘整齐,菌落不透明,米黄色,质地疏松,易被接种环挑起.经亚甲基蓝染色后的菌株WP如图 1 a所示,其扫描电镜照片如图 1 b所示,菌株WP呈棒杆状,长约1.3~1.7 μm,宽约0.45~0.55 μm,芽孢端生,球形,膨大,革兰氏染色阳性,多以单个细胞的形式出现.

|
图 1 菌株WP的形态学特征(a:光学显微镜照片;b:扫描电镜图) Fig.1 Morphological characteristics of the WP strain (a: Light microscope picture; b: SEM picture) |
真紧密鱼腥藻正常细胞藻丝较长,营养细胞饱满圆润(图 2a);菌液接种后第2天,藻丝中部分藻细胞出现黄化裂解,藻丝胶被外围细菌增多(图 2b);接种后第4天,视野中几乎看不到健康的藻丝,大多数营养细胞黄化裂解(图 2c);接种后第7天,视野中都是细胞碎片,几乎看不到健康的营养细胞,可见到少数的孢子和异形胞与细菌群体汇聚在一起(图 2d).
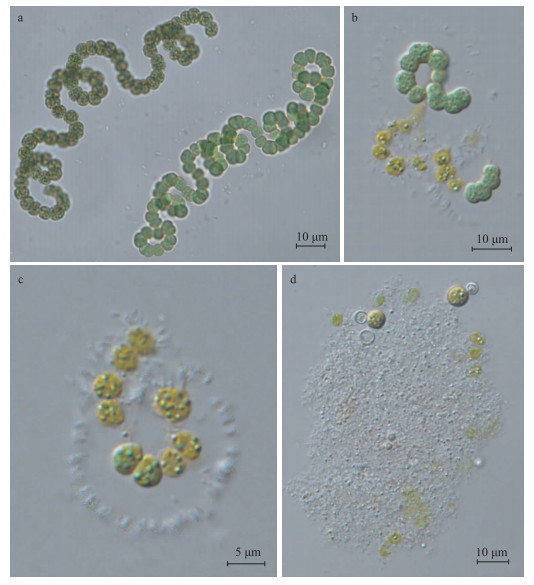
|
图 2 WP菌株溶解真紧密鱼腥藻的照片 (a:加入菌剂前;b:加入菌剂后第2天;c:加入菌剂后第4天;d:加入菌剂后第7天) Fig.2 A. eucompacta CHAB 1799 cells lysed by Lysinibacillus sp. WP (a: A. eucompacta filaments before addition of the strain WP; b~d: A. eucompacta cells lysed after the treatment) |
对菌株WP的16S rDNA序列进行PCR扩增,获得了1516 bp长度的序列.通过BLAST比对分析,构建系统发育树(图 3),与菌株WP同源性最近的是L. fusiformis NRS-350 (AF169537),其相似性达到了99.6%.从系统发育树可以看出,Lysinibacillus属为独立分支,分子生物学鉴定菌株WP隶属于Lysinibacillus属.
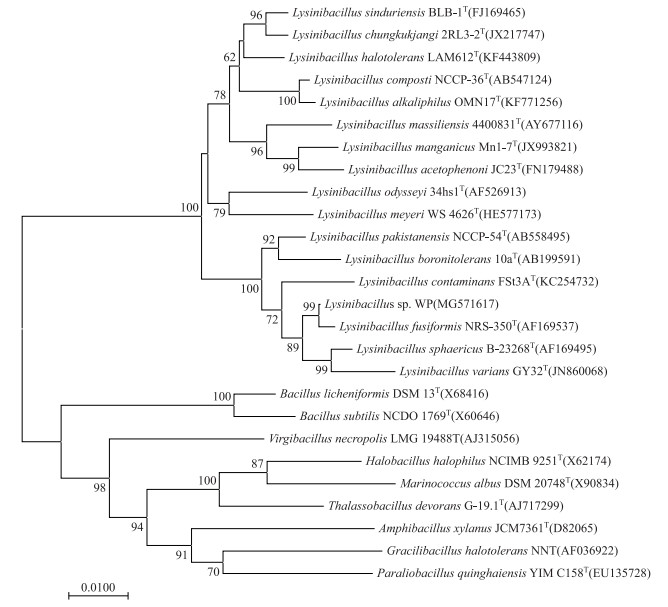
|
图 3 细菌WP的系统发育树 Fig.3 The NJ phylogentic tree based on 16S rDNA sequences including the WP strain and related strains |
从细菌WP的生长曲线(图 4)可以明显看出菌株WP的生长分为3个阶段:停滞期(0~2 h)、对数期(2~14 h)和稳定期(14~28 h). 28 h之后,菌株WP进入衰亡期.溶藻细菌密度对溶藻效果产生显著性影响,只有当溶藻细菌密度达到一定值时才能产生溶藻作用[11].对数生长期细菌新陈代谢旺盛,增殖速率快,且有较高的细菌密度,能够达到阈值要求,因此大部分试验均采用对数生长期的细菌.
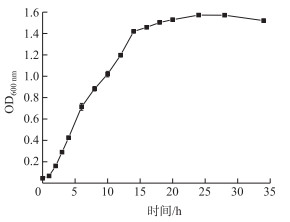
|
图 4 菌株WP的生长曲线 Fig.4 Growth curve of Lysinibacillus sp. WP |
不同生长时期的细菌对真紧密鱼腥藻CHAB 1799的溶藻效果如图 5所示.藻液的初始叶绿素a浓度为1.00±0.01 mg/L,停滞期、对数期和稳定期的菌液分别与藻液共培养9天后,其叶绿素a浓度分别为0.66±0.00、0.57±0.00和0.62±0.04 mg/L,溶藻效率分别为70.72% ±1.50%、74.66% ±1.34%和72.57% ±2.74%,3个时期的菌液对真紧密鱼腥藻CHAB 1799的生长均产生强烈的抑制作用.
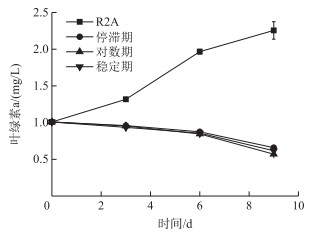
|
图 5 不同生长时期的菌株WP对真紧密鱼腥藻CHAB 1799的溶藻效果 Fig.5 The algicidal effects of different growth stages of WP strain on A. eucompacta CHAB 1799 |
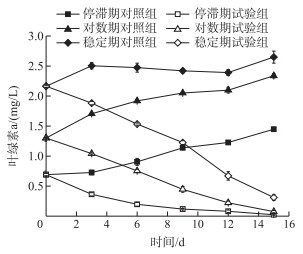
菌株WP对不同生长时期藻液的溶藻效果见图 6.停滞期、对数期和稳定期的藻液初始叶绿素a浓度分别为0.69±0.02、1.30±0.01和2.16±0.02 mg/L.菌液接种后第3天,对照组的藻液叶绿素a浓度均上升,真紧密鱼腥藻CHAB 1799生长正常,试验组的藻液叶绿素a浓度均下降,CHAB 1799生长受到抑制.在接种后第6天,停滞期试验组的叶绿素a浓度剧烈下降到0.20±0.03 mg/L.试验期间,对数期试验组和稳定期试验组的藻液叶绿素a浓度几乎均呈直线下降趋势,在菌液接种后第15天,藻液叶绿素a浓度分别下降到0.08±0.02和0.31±0.05 mg/L,溶藻效率分别达到96.78% ±0.88%和88.26% ±1.91%.
|
图 6 菌株WP对不同生长时期藻液的溶藻效果 Fig.6 The algicidal effects of the WP strain on A. eucompacta CHAB 1799 at different growth stages |
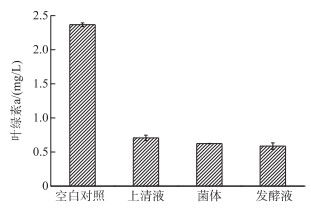
共培养的第7天,上清液、菌体和发酵液的叶绿素a浓度分别为0.71±0.04、0.62±0.00和0.59±0.05 mg/L,溶藻效率分别为70.15% ±1.72%、73.64% ±0.08%和75.21% ±2.00%,三者对鱼腥藻均有较强的溶藻效果(图 7).
|
图 7 上清液、菌体和发酵液对真紧密鱼腥藻CHAB 1799的溶藻效果 Fig.7 The algicidal effects of cell-free filtrate, washed cells and culture of the WP strain on A. eucompacta CHAB 1799 |
应用高效溶藻菌去除蓝藻水华是一种环境友好型的生物方法,是蓝藻水华去除研究的热点之一.由于微囊藻水华在蓝藻水华中的优势性、规模性和危害性,大部分的研究都集中在微囊藻溶藻菌的分离筛选和溶藻特性方面,少数是针对鱼腥藻水华的.在全球气候的急剧变化、区域性极端气候出现以及外源污染物质消减等条件下,鱼腥藻水华出现的频率和规模有扩大的趋势.鱼腥藻是一类含有异形胞的丝状蓝藻,具有固氮作用,形成水华的鱼腥藻种类比微囊藻及其他水华蓝藻属的种类更加多样,鱼腥藻水华暴发的促发因素、持续时间及造成的危害比微囊藻水华更加复杂和不确定.鱼腥藻水华的治理原理及方法与微囊藻水华也不尽相同,甚至相同的方法对不同种类鱼腥藻水华治理的效果也不同.本研究从我国武汉新洲地区的土壤中分离出一株能溶解真紧密鱼腥藻的菌株WP,经过形态和分子生物学鉴定,确定该菌株属于Lysinibacillus,是革兰氏阳性菌,而李三华等[12]从武汉东湖分离到一株可溶解真紧密鱼腥藻的不动杆菌属细菌Acinetobacter sp. A01,该菌株是革兰氏阴性菌. 2007年Ahmed等[13]将Lysinibacillus属是从芽孢杆菌属Bacillus中独立出来,成立了一个新属.有关Lysinibacillus属细菌溶藻方面的研究多集中在国内,国外几乎没有报道.卢兰兰等[14]从滇池蓝藻水华聚集区分离获得一株溶藻菌L. fusiformis DC-L4,共培养4天后对铜绿微囊藻905的溶藻率为82.1%,其他学者也分别从黄化的微囊藻藻液和小麦中分离到L. fusiformi的不同菌株,这些菌株同样具有较强的溶解微囊藻的能力[15-16].而刘国勇等[17]从香溪河春季水华聚集区分离获得一株溶藻菌L. fusiformis H5,对硅藻、甲藻、隐藻的生长均有一定的抑制效果.本研究首次揭示了Lysinibacillus属的细菌对鱼腥藻的溶解能力,特别是对新型真紧密鱼腥藻,表明Lysinibacillus属的细菌具有广谱性的藻类溶解能力.同时为治理此类蓝藻水华提供了微生物治理的技术途径,丰富了溶藻细菌资源库.
预实验研究结果表明,溶藻菌Lysinibacillus sp. WP对真紧密鱼腥藻CHAB 1799发生溶藻作用的细菌阈值为6×103 cfu/ml,显著低于或等于已报道的溶藻菌[10, 18],可以看出WP是一株很有潜力的溶藻菌.真紧密鱼腥藻CHAB 1799的生理状态及初始接种浓度是影响溶藻效果的重要因素,而菌株WP的生理状态几乎不会影响其溶藻能力.这与Kang等[19]的报道一致.
溶藻细菌的作用方式一般分为两种:一种是直接溶藻,需要溶藻菌与藻直接接触才能产生溶藻作用. Jung等分离到一株溶藻细菌Pseudomonas fluorescens HYK0210-SK09,该菌株对硅藻细胞进行直接攻击,其溶藻活性物质位于细菌细胞质,且对硅藻有特异性的溶藻效果[20];另一种是间接溶藻,溶藻菌通过分泌胞外溶藻活性物质达到抑制藻类生长或者杀死藻类的目的.大多数溶藻菌的作用方式属于间接溶藻.本文的溶藻细菌WP,其细菌培养液、上清液和菌体均有强烈的溶藻作用.经离心、过膜后的上清液不含菌体WP,却有较强的溶藻能力,说明菌株WP分泌了一些胞外溶藻活性物质,不需要直接与藻类接触,也能产生溶藻作用,该菌株的溶藻方式为间接溶藻.菌体经新鲜R2A培养基洗菌3遍,可看作基本不含其代谢产物,但是菌体仍对真紧密鱼腥藻CHAB 1799有较强的溶藻效果,这个结果区别于已经发现的Lysinibacillus属的溶藻菌,这可能是菌株WP与CHAB 1799共培养时,能够迅速利用藻类培养基或藻类代谢产物作为碳源、氮源,生长繁殖,进而产生溶藻活性物质并分泌出来,达到抑制藻类生长的目的.溶藻活性物质的性质和类别、溶藻机理等有待进一步研究.
利用细菌的多样性筛选并应用溶解不同蓝藻的细菌,是通过微生物治理蓝藻水华的主要技术途径.本研究筛选到一株能够有效溶解水华蓝藻——真紧密鱼腥藻的细菌Lysinibacillus sp. WP,通过研究其溶藻特性,为这种新型蓝藻水华的应急和长期治理提供了理论和技术支持.
4 结论1) 筛选到一株溶解真紧密鱼腥藻的菌株WP,根据形态、生理及分子系统鉴定,该菌株属于Lysinibacillus属,是首次报道的溶解鱼腥藻的Lysinibacillus属细菌.
2) Lysinibacillus sp. WP对真紧密鱼腥藻CHAB 1799产生溶藻作用的细菌密度阈值为6 × 103 cfu/ml,该菌株的生长时期对溶藻效果几乎没有影响,其对不同生长时期的真紧密鱼腥藻CHAB 1799均有较强的溶藻作用,且作用方式为间接溶藻.
| [1] |
Liu LP. Characteristics of blue algal bloom in Dianchi Lake and analysis on its cause. Research of Environmental Sciences, 1999, 12(5): 36-37. [刘丽萍. 滇池水华特征及成因分析. 环境科学研究, 1999, 12(5): 36-37. DOI:10.13198/j.res.1999.05.41.liulp.010] |
| [2] |
Zhang H, Huang Y. Character of algae bloom in Chaohu Lake base on NOAA/AVHRR. China Environmental Science, 2009, 29(7): 727-732. [张红, 黄勇. 基于NOAA/AVHRR卫星资料的巢湖水华规律分析. 中国环境科学, 2009, 29(7): 727-732.] |
| [3] |
Zhang YH, Li WF, Chen QW. Spatial-temporal variance of the intensity of algal bloom and related environmental and ecological factors in Lake Taihu. Acta Ecologica Sinica, 2016, 36(14): 4337-4345. [张艳会, 李伟峰, 陈求稳. 太湖水华程度及其生态环境因子的时空分布特征. 生态学报, 2016, 36(14): 4337-4345. DOI:10.5846/stxb201412112468] |
| [4] |
Liu X, Lu XH, Chen YW. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China:an 11-year investigation. Harmful Algae, 2011, 10(3): 337-343. DOI:10.1016/j.hal.2010.12.002 |
| [5] |
Huang CM, Pan WB, Li Y et al. Effect of three algicidal bacteria strains on antioxidase activities of Anabaena flos-aquae. Environmental Science and Technology, 2009, 22(6): 10-13. [黄昌妙, 潘伟斌, 李燕等. 三株溶藻菌对水华鱼腥藻抗氧化酶活性的影响. 环境科技, 2009, 22(6): 10-13.] |
| [6] |
Ye JY, Zhong YR, Yu L et al. Identification of an algae-lysing bacterium of Anabaena flos-aquae and primary research on their relationship. Journal of Anhui Agricultural Sciences, 2011, 39(29): 18121-18124. [叶姜瑜, 钟以蓉, 俞岚等. 一株水华鱼腥藻溶藻菌的分离鉴定及菌藻关系初探. 安徽农业科学, 2011, 39(29): 18121-18124. DOI:10.3969/j.issn.0517-6611.2011.29.134] |
| [7] |
Li RH, Watanabe MW. Anabaena eucompacta sp. nov. (Nostocales, Cyanobacteria), a new planktonic species with tightly spiraled filaments from Japan. Bulletin of the National Science Museum, Tokyo Serie B, 1999, 25(3): 89-94. |
| [8] |
Salvatore M, Marisa C, Francesca T et al. Comparison of plate count agar and R2A medium for enumeration of heterotrophic bacteria in natural mineral water. World Journal of Microbiology and Biotechnology, 1998, 14(5): 727-730. DOI:10.1023/A:1008893627877 |
| [9] |
Ichimura T. Media for freshwater cyanobacteria. In: Nishizawa K, Chihara M eds. Methods in phycology. Tokyo: Kyouritsu Shuppan, 1979: 295-296.
|
| [10] |
Shao J, Jiang Y, Wang Z et al. Interactions between algicidal bacteria and the cyanobacterium Microcystis aeruginosa:lytic characteristics and physiological responses in the cyanobacteria. International Journal of Environmental Science and Technology, 2014, 11(2): 469-476. DOI:10.1007/s13762-013-0205-4 |
| [11] |
Mu R, Fan Z, Pei H et al. Isolation and algae-lysing characteristics of the algicidal bacterium B5. Journal of Environmental Sciences, 2007, 19(11): 1336-1340. DOI:10.1016/S1001-0742(07)60218-6 |
| [12] |
Li SH, Zhang QY. Partial biological characteristics and algicidal activity of an algicidal bacterium. Environmental Science, 2013, 34(2): 583-588. [李三华, 张奇亚. 1株溶藻菌的部分生物学特性及溶鱼腥藻作用. 环境科学, 2013, 34(2): 583-588. DOI:10.13227/j.hjkx.2013.02.001] |
| [13] |
Ahmed I, Yokota A, Yamazoe A et al. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov.. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(5): 1117-1125. DOI:10.1099/ijs.0.63867-0 |
| [14] |
Lu LL, Li GB, Shen YW et al. Isolation, identification and characterization of blue-green algae-lysing strain DC-L14 from Lake Dianchi, China. Chinese Journal of Applied and Environmental Biology, 2009, 15(1): 106-109. [卢兰兰, 李根保, 沈银武等. 溶藻细菌DC-L14的分离、鉴定与溶藻特性. 应用与环境生物学报, 2009, 15(1): 106-109. DOI:10.3724/SP.J.1145.2009.00106] |
| [15] |
Liu L, Chen X, Li Q et al. Isolation, identification and algicidal effect of an algicidal bacterium Lysinibacillus fusiformis TL. Fresenius Environmental Bulletin, 2016, 25(12): 5842-5848. |
| [16] |
Zhang J, Wei KF, Li CC et al. Identification and algae-lytic characteristics of endophyte algicidal bacteria ZB 1 strain isolated from wheat. Southwest China Journal of Agricultural Sciences, 2017, 30(5): 1068-1073. [张菊, 韦坤逢, 李灿灿等. 小麦内生溶藻细菌ZB1的分离鉴定及其溶藻特性. 西南农业学报, 2017, 30(5): 1068-1073.] |
| [17] |
Liu GY, Hu YP, Shi XD et al. Isolation, identification and characterization of algae-lysing strain H5 from Xiangxi Bay of Three Gorges Reservoir. Journal of Anhui Agricultural Sciences, 2012, 40(28): 13955-13956, 13959. [刘国勇, 胡亚平, 石小丹等. 溶藻细菌H5的分离、鉴定及溶藻特性研究. 安徽农业科学, 2012, 40(28): 13955-13956, 13959. DOI:10.3969/j.issn.0517-6611.2012.28.098] |
| [18] |
Xuan H, Dai X, Li J et al. A Bacillus sp. strain with antagonistic activity against Fusarium graminearum kills Microcystis aeruginosa selectively. Science of the Total Environment, 2017, 583: 214-221. DOI:10.1016/j.scitotenv.2017.01.055 |
| [19] |
Kang YH, Kim JD, Kim BH et al. Isolation and characterization of a bio-agent antagonistic to diatom, Stephanodiscus hantzschii. Journal of Applied Microbiology, 2005, 98(5): 1030-1038. DOI:10.1111/j.1365-2672.2005.02533.x |
| [20] |
Jung SW, Kim BH, Katano T et al. Pseudomonas fluorescens HYK0210-SK09 offers species-specific biological control of winter algal blooms caused by freshwater diatom Stephanodiscus hantzschii. Journal of Applied Microbiology, 2008, 105(1): 186-195. DOI:10.1111/j.1365-2672.2008.03733 |
 2018, Vol. 30
2018, Vol. 30 


