人类活动的增强已显著改变了区域与全球尺度上生物地球化学循环的时空模式,导致了自然环境功能退化、生物多样性减少、生态系统结构变化等严重的生态环境问题[1].目前,水体富营养化是我国部分湖泊面临的主要环境问题之一,其导致了水质恶化、生态系统服务功能退化和生态系统健康下降[2].
初级生产者与初级消费者是淡水生态系统结构的重要组成[3-5],是维持系统生产力、多样性和稳定性功能的基础[6].其中,高等水生植物和浮游植物作为湖泊生态系统中的主要初级生产者,是维持湖泊生态结构和功能的重要组分.富营养水体中常出现浮游植物的大量繁殖,同时沉水植物等高等水生植物群落结构退化、覆盖度下降,可以导致湖泊生态系统由草型湖泊向藻型湖泊的稳态转变[7-8].浮游动物在湖泊生态系统的物质和能量循环中起到承上启下的作用,即捕食浮游植物的同时又作为更高一级消费者(如鱼类)的主要食物[9].因此,湖泊初级生产者和初级消费者在湖泊系统的碳、氮等元素循环过程中起到了重要的储存与传递作用,可以反映湖泊生物地球化学循环的传递过程及其变化.
稳定同位素示踪技术已广泛应用于生态学研究中,探讨不同生态系统中物质和能量流动的主要特征和循环路径[10].高等水生植物、浮游植物、浮游动物作为生产者和初级消费者能直接记录湖泊营养源的变化特征[11],同时利用生物体内的碳、氮稳定同位素信号能定量区分食物网中的主要碳源和不同生物的营养级水平[12-13],是了解湖泊生态系统中碳、氮等元素循环与传递过程的重要分析手段. Grey[14]和Ngochera等[15]利用稳定同位素示踪技术研究发现,湖泊营养水平的上升增强了浮游植物和浮游动物在有机碳传输过程上的耦合,导致了浮游植物和浮游动物碳同位素的同步富集且呈现显著相似的信号.目前国内关于湖泊生物碳、氮稳定同位素的研究较多关注于大型湖泊等水体.如Wen等[16]测定了太湖贡湖湾和梅梁湾的高等水生植物碳、氮同位素的时空变化特征,结果表明,沉水植物碳稳定同位素值较高,漂浮植物与挺水植物碳稳定同位素值偏低,营养水平较高的梅梁湾中沉水植物氮稳定同位素值信号明显高于贡湖湾,而时间变化规律总体上并无明显特征.黄亮等[17]调查长江中游9个湖泊水生植物C、N、P元素及碳同位素,发现植物叶片中的碳稳定同位素值和C、N元素与其所处的水环境特征密切相关.徐军[18]对比了云南星云湖和抚仙湖颗粒有机物的碳、氮同位素信号,发现星云湖颗粒有机物的碳、氮同位素均高于抚仙湖,表明碳、氮稳定同位素的空间差异反映了湖泊营养水平的不同.
综上所述,国内已有研究中对湖泊多个生物门类开展碳、氮稳定同位素的对比研究较少,目前围绕云南湖泊水生植物和浮游生物的碳、氮同位素信号特征及其分布模式的区域调查还未见报道.基于此,本研究选择云南省东部地区10个湖泊,以高等水生植物、浮游植物和浮游动物作为研究对象,通过测定湖泊不同生物类别的碳、氮稳定同位素信号及元素组成,有助于识别云南高原湖泊典型水生生物在元素循环过程中的同位素分馏效应和元素含量的空间变化规律及其生态指示意义.
1 研究区概况与研究方法 1.1 研究区概况滇东位于云南省东部,整体位于扬子准地台与华南褶皱系的西隅,地势北高南低,碳酸盐广泛分布[19].属于北热带气候类型[20],本次调查湖泊(图 1)平均降水量为717.60~983.00 mm;其中星云湖、杞麓湖为断陷湖,月湖、长湖是喀斯特溶蚀湖,三角海、异龙湖、差黑海已发展为水库.星云湖平均水深最大,为6.01 m;杞麓湖湖泊面积最大,为36.95 km2,相反,草甸海湖面面积最小,为1.30 km2[21];调查湖泊中湖面海拔梯度为1280.83~1908.41 m(表 1).研究的湖泊多数位于盆地中,河流径流短,汇水面积小,多数湖泊仅有一条出口河流.受高原气候的影响,湖面蒸发量常高于湖面降水量.整体而言,湖泊高水位一般出现在9—12月,最低水位出现在5—6月.滇东10个湖泊整体环境较好,但部分湖泊随着湖区周边工农业生产的发展以及人口数量的增加,出现湖泊水位下降、湖面面积缩小、水体污染严重、生物多样性锐减等问题.比如,星云湖湖泊污染较严重、水生植物覆盖度低,已成为重富营养水平的湖泊[22],星云湖、大屯海、杞麓湖、长桥海和异龙湖湖泊水体也受到了不同程度的污染,月湖、长湖、差黑海等湖泊水体透明度较高,生长的高等水生植物种类较多.
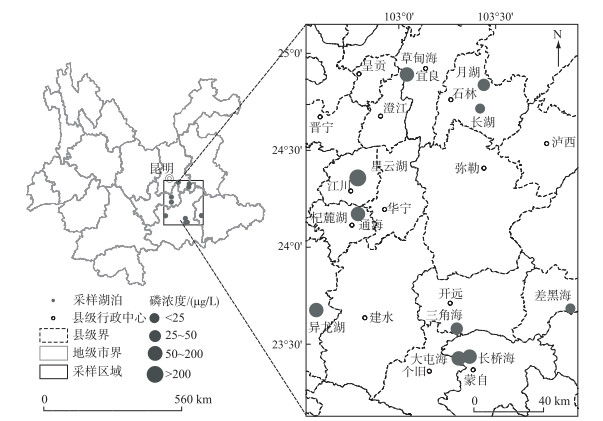
|
图 1 滇东地区10个采样湖泊分布 Fig.1 Map showing the ten study lakes in Eastern Yunnan |
| 表 1 滇东10个湖泊位置坐标及其他相关信息 Tab.1 Summary of site location and key catchment features of ten study lakes in Eastern Yunnan |
2016年7月底至8月初集中对滇东10个湖泊开展湖泊水质与生物的野外调查.根据湖泊大小,分别在星云湖、异龙湖和长桥海布置4、3和7个采样点,其余湖泊均布置2个采样点.分别采集了湖泊表层水样、高等水生植物、浮游植物和浮游动物,共计173个样品.在湖泊沿岸带主要采集沉水植物和漂浮植物.沉水植物以篦齿眼子菜(Potamogeton pectinatus)、光叶眼子菜(Potamogeton lucens)、微齿眼子菜(Potamogeton maackianus)、穿叶眼子菜(Potamogeton perfoliatus)、穗状狐尾藻(Myriophyllum spicatum)、小茨藻(Najas minor)、黑藻(Hydrilla verticillata)、狸藻(Utricularia vulgaris)为代表.漂浮植物以大薸(Pistia stratiotes)、凤眼蓝(Eichhornia crassipes)为代表.将采集的水生植物清洗干净风干后带回实验室,用10%盐酸酸化处理,然后用蒸馏水清洗干净,60℃下烘干,磨成粉末后待测.浮游植物和浮游动物样品使用采水器采集,分别经22和64 μm孔径网筛过滤,得到的浮游动物(个体> 64 μm)和浮游植物样品(大小为22~64 μm)低温保存.样品带回实验室后,将浮游植物、浮游动物样品装入玻璃皿中进行镜检并挑出杂质,10%盐酸酸化处理,以去除浮游植物、浮游动物体内可能存在的无机碳,用蒸馏水清洗干净,在-50℃下冻干至恒重后磨成均匀粉末待测.
用采水器采集表层水样并低温保存.在野外使用GF/C玻璃纤维滤膜(0.45 μm)过滤水样,滤膜用于测定叶绿素a(Chl.a)浓度. Chl.a浓度采用丙酮萃取分光光度法测定;总氮(TN)浓度采用碱性过硫酸钾消解紫外分光光度法测定;总磷(TP)浓度采用钼锑抗分光光度法测定[23].湖泊水化学指标均用紫外分光光度计(UV1750)测定.湖泊水温、pH等用YSI 6600测定;透明度用塞氏盘测定;采样点水深用手持式水深仪测定.
1.3 稳定同位素分析高等水生植物、浮游植物、浮游动物样品用美国Thermo Scientific的MAT 253气体稳定同位素比质谱仪联用Flash EA元素分析仪,采用快速燃烧法测定样品碳、氮同位素组成(δ13C、δ15N)和总碳(TC)、TN含量.稳定C、N同位素计算公式为:
| $ {\rm{ \mathsf{ δ} }}X\left( ‰ \right) = \left( {\frac{{{R_{{\rm{sample}}}}}}{{{R_{{\rm{standard}}}}}} - 1} \right) \times 1000 $ | (1) |
式中,X表示13C或15N,Rsample为样品13C/12C或15N/14N,Rstandard为标样13C/12C或15N/14N,分析精度<0.1‰.样品测试在云南师范大学高原地理过程与环境变化云南省重点实验室完成.
1.4 数据处理进行统计分析前对数据进行正态分布检验与数据转换的预处理,应用Student's t-test检验[24]方法进行差异显著性检验,所有统计分析均在R软件[25]和Grapher 9中进行,本文所有数据均为平均值±标准差.
2 结果与分析 2.1 基本水化学参数滇东10个湖泊采样时表层平均水温为23.27~30.40℃;各湖泊采样点平均水深为2.80~8.55 m,其中星云湖、三角海、长湖、差黑海中各采样点平均水深在5.00 m以上,大屯海采样点平均水深最低,小于3.00 m;水体平均透明度为0.23~2.10 m,其中月湖、长湖、差黑海水体透明度较高,大于1.00 m,异龙湖、大屯海、长桥海、星云湖和杞麓湖水体透明度较低,低于0.50 m;湖泊水体平均TP浓度为13.27~547.88 μg/L,其中星云湖TP平均含量最高,长湖最低.各湖泊水体平均TN浓度为0.53~3.40 mg/L,其中杞麓湖和异龙湖平均TN浓度超过3.00 mg/L;各湖泊水体Chl.a浓度为3.35~200.46 μg/L,星云湖最高,超过200.00 μg/L,其次为大屯海、杞麓湖、长桥海,Chl.a平均浓度超过100.00 μg/L,湖泊初级生产力高.根据世界经济协作与发展组织(OECD)提出的湖泊营养状况分类标准[26]并综合所有水质参数数据表明,星云湖属于重富营养湖泊,大屯海、杞麓湖、草甸海、长桥海和异龙湖属于富营养湖泊,三角海、月湖属于中—富营养湖泊,而长湖、差黑海属于中营养湖泊(表 2).
| 表 2 采样湖泊湖沼学基本特征 Tab.2 Key limnological characteristics of ten study lakes |
此次调查的滇东湖泊水4种类型的水生生物δ13C和δ15N存在明显差异(图 2).沉水植物的平均δ13C值变化范围较大,且显著高于其他3类水生生物的同位素值,平均值为-12.04‰±4.57‰;沉水植物的δ15N平均值为5.43‰±5.84‰,变化范围也相对较广.漂浮植物的δ13C值较稳定且最为偏负,为-28.99‰±0.86‰,而δ15N值波动幅度大,为5.58‰±7.38‰;浮游植物的δ13C值与浮游动物相似,平均值分别为-21.88‰±2.97‰和-20.85‰±2.70‰,而浮游植物的δ15N值为7.26‰±3.83‰,浮游动物δ15N值更高,为11.02‰±3.18‰. t检验结果表明,沉水植物和漂浮植物的δ13C与浮游植物和浮游动物的存在显著差异(P < 0.05),浮游植物和浮游动物的δ13C差异不显著(P>0.05);初级生产者漂浮植物、沉水植物和浮游植物的δ15N值差异不显著(P>0.05),而初级消费者浮游动物的δ15N值则与3类初级生产者存在显著差异(P < 0.05).湖泊中浮游植物与浮游动物δ13C值和δ15N值之间具有很好的线性关系(图 3),决定系数R2分别为0.80(P>0.05)和0.74(P < 0.001),表明浮游动物的δ13C值和δ15N值对浮游植物的变化最为敏感.
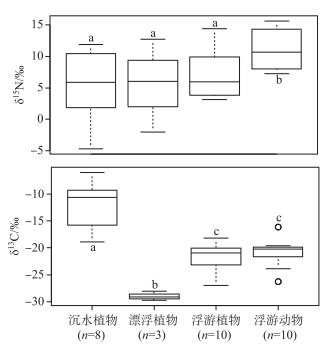
|
图 2 4种水生生物氮、碳稳定同位素信号分布特征(箱线图上下两条短线表示数据范围,箱子包含中间50%的数据,箱子中横线为中位数,空心小圆圈表示异常值;n表示湖泊数量;不同字母表示显著差异,P < 0.05) Fig.2 Boxplot showing the distribution of nitrogen and carbon isotopes of four biological groups (The box included 50% of the observational data. Lines extending vertically from the boxes indicating variability outside the upper and lower quartiles. The band inside the box indicates the median value. The outliers (circle) are observational data that are distant from other points. The letter n denotes number of sampling lakes. The boxes with different letters show a significant difference with P-value less than 0.05) |
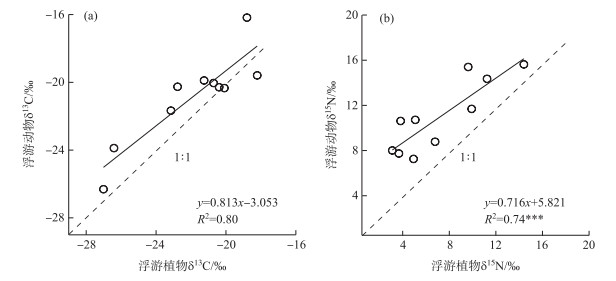
|
图 3 滇东湖泊的浮游植物与浮游动物碳、氮稳定同位素信号散点图(数据为同一湖泊的平均值,虚线表示1:1线,实线表示回归线,星号代表回归分析显著水平(***,P < 0.001)) Fig.3 Scatter plots showing the relationship between phytoplankton and zooplanktonfor carbon (a) and nitrogen (b) stable isotopes of lakes in Eastern Yunnan, respectively (Each circle represents the averaged δ13C and δ15N values of phytoplankton and zooplankton from one lake, respectively. Dashed line indicates a 1:1 line. The solid line is drawn as the regression line. The symbol *** represent a significant level with a P-value less than 0.001) |
区域尺度上,调查的10个滇东湖泊浮游动物和浮游植物δ13C值的变化趋势基本一致,浮游动物δ13C值整体略高于浮游植物,尤其在中营养湖泊(长湖、差黑海)和中—富营养湖泊(三角海、月湖)中表现明显,而在重富营养湖泊(星云湖)中浮游动物和浮游植物δ13C值基本重叠(图 4).氮同位素组成方面,浮游植物和浮游动物的δ15N变化曲线具有同步性,但在同一湖泊中,浮游动物δ15N值较浮游植物显著偏正,富集程度为1.2‰~6.8‰,平均富集3.46‰左右(图 3b和图 4).沉水植物δ13C值波动范围较大,且在区域尺度上无明显变化趋势,但其δ15N值与浮游植物、浮游动物的变化模式一致,即随湖泊富营养化程度的增加而逐渐偏正.漂浮植物在多数湖泊未采集到,因此不做空间变化分析.
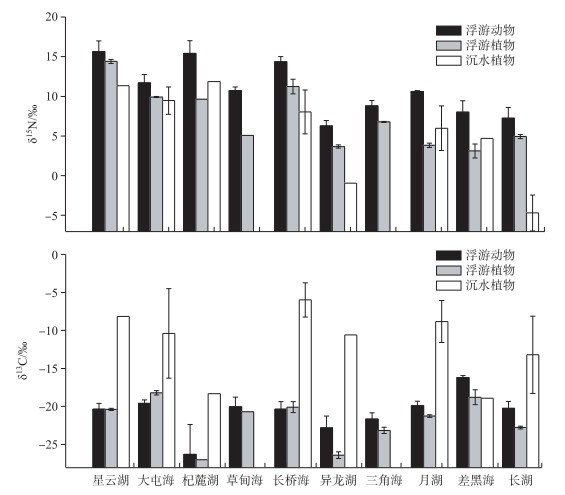
|
图 4 滇东湖泊的浮游植物、浮游动物与沉水植物碳、氮稳定同位素信号分布特征(湖泊排序按水体总磷浓度由高到低排列) Fig.4 Histograms showing the variation of carbon and nitrogen stable isotopes of three biological groups among lakes in Eastern Yunnan (Lakes are arranged according to the decreasing total phosphorus concentrations in lake water) |
为了探讨不同环境因子与不同湖泊生物碳、氮稳定同位素之间的关系,我们对滇东10个湖泊生物碳、氮同位素数据做了主成分分析(PCA).零模型检验结果表明,影响滇东10个湖泊浮游植物与浮游动物δ13C和δ15N变化的显著PCA轴有两个,分别解释了32.06%和23.50%(图 5a).驱动沉水植物δ13C和δ15N变化的显著PCA轴有一个,解释了55.19%(图 5b).由图 5a可知,湖泊水温和pH值是影响浮游植物δ13C值在空间变化上的主要因子,特别是水温(P < 0.001,r=0.41),其次,浮游动物与浮游植物δ13C值矢量方向呈锐角相交(P < 0.01,r=0.76),且与采样点水深呈反向变化关系.浮游植物和浮游动物δ15N的方向一致,与主轴1夹角最小.主轴1与水体TN、TP浓度等指示湖泊富营养水平的指标密切相关(r=-0.80、r=-0.62),表明主轴1代表了湖泊富营养水平.同时浮游植物和浮游动物δ15N值与水体TN、TP浓度呈显著正相关关系(P < 0.001,r=0.74;P < 0.001,r=0.72;P < 0.001,r=0.53;P < 0.001,r=0.40),指示浮游植物和浮游动物的δ15N值受湖泊营养水平(水体TN和TP浓度)的驱动. 图 5b显示,沉水植物的δ13C值与湖泊水体透明度呈负相关(P < 0.01,r=-0.44),而沉水植物δ15N变化与水体TN浓度密切相关(P < 0.001,r=0.52).
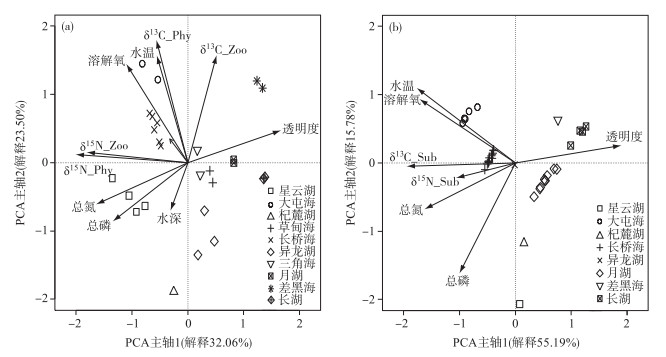
|
图 5 滇东湖泊浮游植物、浮游动物(a)和沉水植物(b)碳、氮稳定同位素与环境因子的PCA双图(δ13C_Phy:浮游植物碳稳定同位素;δ13C_Zoo:浮游动物碳稳定同位素;δ15N_Phy:浮游植物氮稳定同位素;δ15N_Zoo:浮游动物氮稳定同位素;δ13C_Sub:沉水植物碳稳定同位素;δ15N_Sub:沉水植物氮稳定同位素) Fig.5 PCA biplots showing the carbon and nitrogen isotopes for phytoplankton, zooplankton (a) and submerged macrophyte (b) and related environmental factors among lakes in Eastern Yunnan (δ13C_Phy means the δ13C values of phytoplankton; δ13C_Zoo means the δ13C values of zooplankton; δ15N_Phy means the δ15N values of phytoplankton; δ15N_Zoo means the δ15N values of zooplankton; δ13C_Sub means the δ13C values of submerged macrophyte; δ15N_Sub means the δ15N values of submerged macrophyte) |
滇东4种湖泊生物具有不同的碳、氮(C、N)元素含量,沉水植物和漂浮植物的C元素含量明显高于浮游植物和浮游动物,相反浮游动物的N元素含量最高,浮游植物次之,高等水生植物最低(表 3).经t检验得出,沉水植物和漂浮植物的C和N元素含量差异均不显著(P>0.05),浮游植物与浮游动物C和N元素含量也无显著差异(P>0.05),而沉水植物和漂浮植物等高等水生植物的C、N元素含量则与浮游植物和浮游动物等浮游生物具有显著差异(P < 0.05).
| 表 3 4种湖泊生物的总碳、总氮元素重量百分含量与碳氮比值的分布特征 Tab.3 Summary of percentage mass contents of C and N elements, and C/N ratios for four biological groups |
从表 3可以看出,沉水植物和漂浮植物C/N比值最高,而浮游植物和浮游动物C/N比值明显偏低.沉水植物和漂浮植物以及浮游植物和浮游动物的C/N比值均无显著差异(P>0.05),而沉水植物和漂浮植物的C/N比值与浮游植物和浮游动物的则具有显著差异(P < 0.05).
3 讨论 3.1 滇东地区湖泊典型水生生物稳定同位素信号的特征比较滇东地区不同类型的湖泊生物具有不同的碳稳定同位素组成,主要反映在生物利用的无机碳源比例存在差异性.就高等水生植物而言,云南湖泊的沉水植物δ13C值比漂浮植物信号更为偏正,且分布范围较广.虽然沉水植物和漂浮植物均系维管植物,但是两者具有不同的生长环境.漂浮植物的根不生在底泥中,整个植株漂浮在水面之上,发达的通气组织或膨大的叶柄能够保证它们与大气进行气体交换[27].暴露在大气中的漂浮植物叶片能够直接利用大气中的CO2作为碳源,使得大气中CO2的δ13C值是影响漂浮植物δ13C值的关键因素.通常大气中CO2的δ13C值稳定在-7.8‰左右[28],因此漂浮植物的δ13C值也相对较为稳定,变化范围小.而沉水植物整个植株完全沉没于水面之下,根茎生于底泥中,表皮细胞没有角质或蜡质层,能直接吸收水分、溶解氧和其他营养物质[29].同时沉水植物所利用的底栖碳源来源较广,包括碳酸氢盐(HCO3-)、溶解在水中的CO2和碳酸盐(CO32-)3种无机碳形式,且3种形式无机碳的δ13C值组成变化大.在进行光合作用时,由于CO2被消耗所用的能量低,因此溶解在水中的CO2是最容易利用的碳源.但是CO2在水中的扩散速度比在空气中小4个数量级,在富营养水中溶解性的CO2含量较低[30],水体中无机碳离子常以HCO3-形式存在[31].并且已有研究表明,HCO3-的δ13C值比CO2的δ13C值高7‰~11‰[32-33].这些因素导致本次空间调查中由于湖泊营养水平的不同,水体中各种无机碳比例存在差异,导致了沉水植物δ13C的变化幅度较大.同时,在同一湖泊的不同采样点,同一种沉水植物由于利用的无机碳源比例不同,也存在δ13C的明显差异.本次调查中,滇东地区湖泊沉水植物δ13C(-18.32‰~-5.98‰)与Keely等[34]、黄亮等[17]研究发现的水生植物δ13C(-50‰~-11‰)相比总体偏正.这可能反映了云南高原主要由二叠系和三叠系碳酸盐岩组成,河湖水化学性质由CO32-控制[35],当碳酸盐岩、水以及CO2发生反应时生成Ca2+和HCO3-,所以δ13C值偏正的碳酸盐岩碳源可能是导致喀斯特地区沉水植物δ13C值更为富集的重要原因.
滇东地区湖泊浮游植物的δ13C值比沉水植物偏负,指示水体中浮游植物的碳源虽与沉水植物相似,但由于浮游植物具有迁移能力[36],能够自由吸收更多容易吸收的CO2作为碳源,因此其δ13C值相对沉水植物的偏负.但滇东地区湖泊浮游植物δ13C值整体比西南地区其他区域显著偏正[37],可能反映了本地区湖泊浮游植物优势种的组成影响了其碳稳定同位素的分布特征. Wang等[37]调查发现,贵州喀斯特水库中夏季浮游植物δ13C值在-31‰~-18‰之间,当湖泊浮游植物群落中硅藻占优势时,浮游植物δ13C值更加偏负;当湖泊浮游植物群落中蓝藻、绿藻占优势时,浮游植物δ13C值偏正.本次滇东10个湖泊均为夏季集中采样,浮游植物中蓝藻、绿藻所占比例偏大,导致了浮游植物δ13C值出现相对偏正的特征.此外,浮游动物作为初级消费者大多以浮游植物为食,因此浮游植物碳稳定同位素的组成和变化会直接影响浮游动物碳稳定同位素信号.研究区中浮游动物与浮游植物具有显著相似的δ13C值,说明滇东地区湖泊中消费者浮游动物与其食物(浮游植物)在食物链传递过程中碳同位素分馏效应不显著.
本研究中滇东10个湖区浮游动物δ15N显著高于浮游植物(P < 0.05),表明在食物链的能量传递过程中氮同位素存在显著的分馏过程.经典水生动物食性研究表明,消费者δ15N与食物相比约增加3‰~5‰(平均为3.0‰±2.6‰)[38].本研究中主要的浮游动物个体偏小,以桡足类的剑水蚤、哲水蚤和枝角类的象鼻溞为主,且都是滤食性浮游动物,从水中滤食细小的浮游植物、细菌、碎屑等[39],导致浮游动物氮同位素存在明显的富集效应.但在不同湖泊中富集效应存在一定的差异性,可能反映了个别湖泊大个体浮游动物丰度较高,而大个体浮游动物的氮同位素比小个体浮游动物更为富集,因为某些大个体浮游动物(如剑水蚤)是捕食性浮游动物[40],因此存在氮同位素信号与食物链营养级上的差异.上述分析表明,滇东湖泊生态系统中相邻营养级之间的碳同位素信号较为相似,而氮同位素存在明显的分馏效应且平均富集系数为3.46‰,与北美温带地区的氮同位素富集系数(3.4‰)基本一致[41].
3.2 碳、氮稳定同位素信号的空间变化与影响因子识别在环境因子对同位素信号分布的影响上,部分营养水平低的湖泊中浮游动物表现为比浮游植物相对富集的δ13C信号,反映了营养水平低的湖泊中外源碳对浮游动物的碳源产生了较大影响.前人研究发现,贫营养湖泊中外源有机碳对浮游动物碳源的贡献量较高(如22%~75%[42]),较大程度地影响了湖泊中食物网结构[43],因此在贫营养湖泊中浮游动物和浮游植物两者间的δ13C值存在一定的相异性,即浮游动物δ13C值较浮游植物更为富集(图 4).然而,在富营养湖泊中,浮游动物碳源主要受到内源碳(如浮游植物)的影响[44],导致在有机碳传输过程中两者之间较强的耦合作用与显著相似的δ13C值.
在空间分布上,浮游植物的δ13C值受水温的影响最为明显(图 5a),如水温偏高的大屯海、长桥海和差黑海中浮游植物的δ13C值相对其他湖泊偏正.随着湖泊水温的升高,水体中溶解CO2减少[45],浮游植物更多地利用水体中HCO3-等无机碳源,导致浮游植物碳δ13C值偏正并使得浮游动物δ13C值也间接受控于水体水温.同时,浮游动物的δ13C值还受采样点水深影响.湖泊水深的不同可以导致栖息地等生物生境分布的差异,从而影响底栖与浮游类型的碳源贡献比例和食物网有机碳源的组成[45].在水深较浅的采样点,浮游动物碳源以底栖碳源为主,δ13C值偏正[46-47];而水较深的采样点,浮游植物等碳源对浮游动物的贡献占主导.同时,浮游生物的δ15N值也受到湖泊营养水平的显著影响.云南高原湖泊农村面源污染基本上占入湖污染物总量的30%~50%[48],种植业、蓄禽养殖业和农村生活污水排放导致云南高原湖泊水体TN浓度升高.由于氨的挥发以及硝化作用,动物排泄物或生活污水最终形成δ15N值高达10‰~20‰的NO3-[49-50],这些δ15N值显著偏正氮盐的持续输入,直接导致湖泊生态系统中水体与生物体内氮含量和δ15N值偏高. Cole等[51]和Udy等[52]的研究发现,水生植物氮同位素值随着流域污水和水体中DIN(溶解无机氮)浓度的增加而偏正.滇东的长桥海、大屯海、杞麓湖和星云湖等湖泊由于长期接收流域污染[21-22],湖泊水体TN浓度高、富营养化较为严重,导致生物体内δ15N值偏正;而差黑海、月湖、长湖等湖泊接收流域污染负荷较少、水体TN浓度较低[21],因此湖泊生物体内的氮稳定同位素信号相对偏负.同时,富营养湖泊中常出现有机质的大量分解和溶解氧水平的降低,导致沉积物中微生物的反硝化作用增强,可以产生较强的氮同位素分馏作用[49].较轻的氮同位素随反硝化作用生成的氮气而释放,剩余水体氮库中重同位素比例的增加可以导致水体中δ15N值偏正,从而造成富营养化水体中湖泊生物氮同位素信号的富集.
沉水植物碳稳定同位素在空间分布上与湖泊透明度相关,而透明度与湖泊藻类生物量存在密切的关系.在贫营养湖泊中,藻类生物量低且水体透明度较高,同时藻类吸收利用水体中溶解性CO2的强度小.因此,沉水植物能够较好地吸收水体中碳同位素较轻的溶解性CO2,从而导致沉水植物δ13C值呈现偏负的特征.另外,沉水植物δ13C值的变化还与沉水植物种类[16]、光合途径[53]、植株本身的生长速率[54]等因素有关.与浮游生物类似,沉水植物氮同位素信号还受水体染污物来源、TN浓度和反硝化作用强度的影响,如沉水植物氮同位素值偏正可能反映了流域污水δ15N值的偏高和溶解性无机氮浓度的增加.
3.3 水生生物C、N元素含量和C/N比值的分布特征及其与环境的关系云南东部地区湖泊生物对比结果表明,不同门类生物体内具有不同的元素含量特征.其中,高等水生植物C元素含量显著高于浮游植物和浮游动物,反映了不同种类湖泊生物具有差异性的生理生态特征.水生植物系维管束植物,碳是构成植物有机体的主要元素,植物体内与C元素结合的化合物占植物干物质重量的90%以上[55],使得水生植物C元素含量普遍较高.浮游植物由藻类细胞组成,具有纤维和其他多糖组成的细胞壁,而枝角类、桡足类等甲壳类浮游动物的个体主要由几丁质和碳酸钙组成[56],导致浮游植物和浮游动物C元素含量较水生植物偏低.其次,浮游生物体内主要由蛋白质、脂肪、核酸等构成[57],所以浮游生物个体的N元素含量普遍高于水生植物.与长江中下游地区湖泊调查结果相比[17],云南湖泊沉水植物C、N元素相对含量总体偏高,可能反映了云南湖泊水体受富含CO32-组分的喀斯特基岩影响,使得植物体内的C含量偏高,并导致水生植物吸收水体等环境中相应比率的N等营养元素[58].同时,水生植物叶片中的N是光合速率良好的指示物[59],可能也反映了低纬高原地区较长的生长季节并促进了水生植物对营养元素的吸收.
大量研究结果表明,水生维管束植物的C/N比值总体分布在12.6~18.5,而浮游生物C/N比值大体分布于6~8[60].类似地,滇东湖泊群中高等水生植物C/N比值明显高于浮游生物,其中沉水植物和漂浮植物的C/N平均值分别为18.39和15.67,而浮游植物和浮游动物平均值分别为7.68和6.90.大量现代调查和沉积物研究中,湖泊有机物C/N比值常被用于区分陆生和水生有机物来源[61].本次调查结果表明,云南高原湖泊水生植物和浮游生物的C/N比值均小于20,该阈值可以可靠地指示湖泊有机质的内源贡献,并为识别该地区湖泊沉积物记录中内源有机质的长期影响和贡献率提供重要的科学依据.
4 结论1) 滇东地区10个湖泊的空间调查显示,水生植物和浮游生物对碳源的利用途径不同是导致其碳稳定同位素分布差异的主要因素,其中浮游动物与浮游植物的δ13C显著相关.同时,浮游动物的δ15N信号比初级生产者显著富集(富集系数约为3.46‰),反映了湖泊食物网中氮同位素的分馏效应较为明显.
2) 空间分布上,浮游植物碳同位素组成受水温与水深等环境因子的显著影响.在营养水平较低的湖泊中,浮游动物受外源有机碳的影响较大,其δ13C信号较浮游植物相对富集;而在富营养湖泊中,浮游动物以浮游植物为主要食物来源,有机碳传输过程中两者的耦合关系增强而呈现更为相似的δ13C值.同时,沉水植物δ13C值则与水体透明度和Chl.a浓度等特征相关.另外,湖泊生物的δ15N值均受水体富营养化程度的影响,同时富营养化湖泊中反硝化作用的增强也可能产生了一定影响.
3) 滇东地区具有广泛分布的喀斯特地质背景,可能导致了湖泊生物体内的C、N元素含量总体高于长江中下游等其他地区.同时,云南高原湖泊水生植物和浮游生物的C/N比值都小于20,同时两者呈现差异性的分布特征.
4) 在识别了云南东部地区湖泊典型水生生物稳定同位素信号与元素组成的分布模式基础上,仍需进一步结合其季节变化特征并从生物群落组成上甄别出碳源变化与生物地球化学循环的驱动机制,可为云南湖泊的生态系统评价与生态修复提供重要的科学依据.
| [1] |
Li SJ, Dou HS, Shu JH et al. Water environmental problems of lakes and water ecosystem recovery in China. China Water Resources, 2006, 13: 14-17. [李世杰, 窦鸿身, 舒金华等. 我国湖泊水环境问题与水生态系统修复的探讨. 中国水利, 2006, 13: 14-17.] |
| [2] |
Qin BQ, Xu H, Dong BL et al. The principle and practice of eutrophic lake pestoration and management. Beijing: Higher Education Press, 2011. [秦伯强, 许海, 董百丽等. 富营养化湖泊治理的理论与实践. 北京: 高等教育出版社, 2011.]
|
| [3] |
Wang XM, Jin XQ, Xing XL et al. Effects of macrophyte on the lake ecosystem. Journal of Shandong Science, 2007, 20(2): 29-32. [王兴民, 金许秋, 邢晓丽等. 水生高等植物对湖泊生态系统的影响. 山东科学, 2007, 20(2): 29-32.] |
| [4] |
Benedict CR, Scott JR. Photosynthetic carbon metabolism of a marine grass. Plant Physiology, 1976, 57: 876-880. DOI:10.1104/pp.57.6.876 |
| [5] |
Benedict CR, Wong W. Fractionation of the stable isotopes of inorganic carbon by seagrasses. Plant Physiology, 1980, 65: 512-517. DOI:10.1104/pp.65.3.512 |
| [6] |
Heck KL, Able KW, Roman CT. Composition, abundance, biomass, and production of macrofauna in a new England estuary comparisons among eelgrass meadows and other nursery habitats. Estuaries, 1995, 18(2): 379-389. DOI:10.2307/1352320 |
| [7] |
Rong W, Dearing JA, Langdon PG. Flickering gives early warning signals of a critical transition to a eutrophic lake state. Nature, 2012, 492(7429): 419-422. DOI:10.1038/nature11655 |
| [8] |
Marten S, Steve C, Foley JA et al. Catastrophic shifts in ecosystems. Nature, 2001, 413(6856): 591-596. DOI:10.1038/35098000 |
| [9] |
Legende L, Rivkin RB. Planktonic food webs:Microbial hub approach. Marine Ecology Progress Series, 2008, 365: 289-309. DOI:10.3354/meps07467 |
| [10] |
Fanelli E, Cartes JE, Papiol V. Food web structure of deep-sea macrozooplankton and micronekton off the catalan slope:Insight from stable isotopes. Journal of Marine Systems, 2011, 87: 79-89. DOI:10.1016/j.jmarsys.2011.03.003 |
| [11] |
Li ZY, Jin XS, Zhuan ZM et al. Applications of stable isotope techniques in aquatic ecological studies. Acta Ecologica Sinica, 2005, 25(11): 3052-3059. [李忠义, 金显仕, 庄志猛等. 稳定同位素技术在水域生态系统中的应用. 生态学报, 2005, 25(11): 3052-3059. DOI:10.3321/j.issn:1000-0933.2005.11.036] |
| [12] |
Peterson BJ. Stable isotopes as tracers of organic matter input and transfer in benthic food webs:A review. Acta Oecologica, 1999, 20(4): 479-487. DOI:10.1016/S1146-609X(99)00120-4 |
| [13] |
Hobson KA, Welch HE. Determination of trophic relationships within a high arctic marine food web using δ13C and δ15N analysis. Marine Ecology Progress Series, 1992, 84: 9-18. DOI:10.3354/meps084009 |
| [14] |
Grey J. Stable isotope analysis of the origins of zooplankton carbon in lakes of differing trophic state. Oeologia, 2000, 123: 232-240. DOI:10.1007/s004420051010 |
| [15] |
Ngochera MJ, Bootsma HA. Temporal trends of phytoplankton and zooplankton stable isotope composition in tropical lake Malawi. Journal of Great Lakes Research, 2011, 37: 45-53. DOI:10.1016/j.jglr.2010.09.004 |
| [16] |
Wen ZR, Xu J, Xie P et al. Carbon and nitrogen stable isotopes of macrophytes from Lake Taihu. J Lake Sci, 2016, 28(1): 163-169. [温州瑞, 徐军, 谢平等. 太湖高等水生植物稳定碳、氮同位素特征. 湖泊科学, 2016, 28(1): 163-169. DOI:10.18307/2016.0119] |
| [17] |
Huang L, Wu Y, Zhang J et al. Distribution of C, N, P and δ13C in aquatic plants of some lakes in the middle Yangtze valley. Acta Geoscien Tica Sinica, 2003, 24: 515-518. [黄亮, 吴莹, 张经等. 长江中游若干湖泊水生植物体内C、N、P及δ13C分布. 地球学报, 2003, 24: 515-518. DOI:10.3321/j.issn:1006-3021.2003.06.006] |
| [18] |
Xu J. Ecological studies on the food web structures and trophic relationships offreshwater lakes in China using stable carbon and nitrogen isotopes[Dissertation]. Wuhan:Institute of Hydrobiology, Chinese Academy of Sciences, 2005. [徐军. 应用碳-氮稳定性同位素探讨淡水湖泊的食物网结构和营养级关系[学位论文]. 武汉: 中国科学院水生生物研究所, 2005. http://cdmd.cnki.com.cn/Article/CDMD-80119-2005152030.htm ]
|
| [19] |
Yunnan Bureau of Geology and mineral resources. Regional geology of Yunnan Province. Beijing: Geological Publishing House, 1990. [云南省地质矿产局. 云南省区域地质志. 北京: 地质出版社, 1990.]
|
| [20] |
Xu LH, Jiang CL. Actinomycetes in six lakes in central and south Yunnan. Acta Hydrobiological Sinica, 1987, 11(3): 274-277. [徐丽华, 姜成林. 滇中南六湖的放线菌. 水生生物学报, 1987, 11(3): 274-277.] |
| [21] |
Yang L, Li H. Yunnan wetlands. Beijing: China Forestry Publishing House, 2009, 11. [杨岚, 李恒. 云南湿地. 北京: 中国林业出版社, 2009, 11.]
|
| [22] |
Liu YY, Chen GJ, Shi HB et al. Responses of a diatom community to human activities and climate changes in Xingyun Lake. Acta Ecologica Sinica, 2016, 36(10): 3063-3073. [刘园园, 陈光杰, 施海彬等. 星云湖硅藻群落响应近现代人类活动与气候变化的过程. 生态学报, 2016, 36(10): 3063-3073.] |
| [23] |
"Water and wastewater monitoring and analysis method" editorial board of State Environmental Protection Administration of China. Monitoring and analysis methods of water and wastewater. fourth edition. Beijing: China Environmental Science Press, 2002, 243-285. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002, 243-285.]
|
| [24] |
Qian SS. Environmental and ecological statistics with R. Boca Raton: CRC Press, 2010.
|
| [25] |
Robert IK. R in action:Data analysis and graphics with R. Greenwich: Manning Publications, 2011.
|
| [26] |
Shu JH. Discussion on evaluation method of lake eutrophication in China. Environmental Pollution Control, 1990, 12(5): 2-6. [舒金华. 我国湖泊富营养化程度评价方法的探讨. 环境污染与防治, 1990, 12(5): 2-6.] |
| [27] |
Wu X, Yang XE, Li TQ. Study on purified efficiency of phosphorus and nitrogen from eutrophicated sight water by several floating macrophytes. Journal of Soil and Water Conservation, 2007, 21(5): 128-132. [吴湘, 杨肖娥, 李廷强. 漂浮植物对富营养化景观水体的净化效果研究. 水土保持学报, 2007, 21(5): 128-132.] |
| [28] |
Smith BN, Samuel E. Two categories of 13C/12C ratios for higher plants. Plant physiology, 1971, 47(3): 380-384. DOI:10.1104/pp.47.3.380 |
| [29] |
Li J. Accumulation of heavy metals in submerged macrophytes[Dissertation]. Kunming:Kunming University of Science and Technology, 2009. [李晋. 沉水植物对重金属铜的富集研究[学位论文]. 昆明理工大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10674-1011056167.htm ]
|
| [30] |
Yang QX. Study on the competition between submerged macrophytes and planktonic algae in eutrophic water. J Lake Sci, 1996, 8(1): 17-24. [杨清心. 富营养水体中沉水植物与浮游藻类相互竞争的研究. 湖泊科学, 1996, 8(1): 17-24. DOI:10.18307/1996.sup03] |
| [31] |
Zhuang YY, Zhao F. Restraint effect of higher aquatic plants on algae growth. Environmental Science Survey, 1995, 3(6): 44-49. [庄源益, 赵凡. 高等水生植物对藻类生长的克制效应. 环境科学导刊, 1995, 3(6): 44-49.] |
| [32] |
Bain JT, Proctor M. The requirement of aquatic bryophytes for free CO2 as an inorganic carbon source:sone experimental evidence. New Phytologist, 1980, 86(4): 393-400. DOI:10.1111/nph.1980.86.issue-4 |
| [33] |
Raven J. Exogenous inorganic carbon sources in plant photosynthesis. Biological Reviews, 1970, 45(2): 167-220. DOI:10.1111/j.1469-185X.1970.tb01629.x |
| [34] |
Keely JE, Sandquist DR. Carbon:Freshwater plants. Plant Cell Environment, 1992, 15: 1021-1035. DOI:10.1111/j.1365-3040.1992.tb01653.x/epdf |
| [35] |
Liu CQ. Earth surface biogeochemical processes and mass cycles:karstic catchment erosions and bioelements cycles in Southwest China. Beijing: Science Press, 2007.
|
| [36] |
Giorgio D, France RL. Ecosystem-specific patterns in the relationship between zooplankton and POM ormicroplankton δ13C. Limnology and Oceanography, 1996, 41(2): 359-365. DOI:10.4319/lo.1996.41.2.0359 |
| [37] |
Wang BL, Liu CQ, Xi P. Mechanisms controlling the carbon stable isotope composition of phytoplankton in karst reservoirs. Limnol, 2013, 72(1): 127-139. |
| [38] |
Deniro MJ, Epstein S. Influence of the diet on the distribution of nitrogen isotopes in animals. Geochim Cosmochim Acta, 1981, 45: 341-351. DOI:10.1016/0016-7037(81)90244-1 |
| [39] |
Institute of Animal, Chinese Acdemy of Science, Crustaceans Research Group. Chinese animal. Beijing: Science Press, 1979. [中国科学院, 中国动物志委员会. 中国动物志. 北京: 科学出版社, 1979.]
|
| [40] |
Zhang ZS, Huang XF. Research methods of freshwater plankton. Beijing: Science Press, 1991. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.]
|
| [41] |
Post DM. Using stable isotopes to estimate trophic position:models, methods, and assumptions. Ecology, 2002, 83: 703-718. DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
| [42] |
Yokokawa T, Nagata T. Linking bacterial community structure toarbon fluxes in marine environments. Journl of Oceanography, 2010, 66(1): 1-12. DOI:10.1007/s10872-010-0001-4 |
| [43] |
Wetzel RG. Limnology:Lake and river ecosystems. Eos Transactions American Geophysical Union, 2001, 21(2): 1-9. DOI:10.1016/B978-0-08-057439-4.50017-4 |
| [44] |
Grey J. Stable isotope analysis of the origins of zooplankton carbon in lakes of differing trophic state. Oecolo Gia, 2000, 123: 232-240. DOI:10.1007/s004420051010 |
| [45] |
Hutchinson GE. A treatise on limnology, Vol Ⅰ:Geography, physis and chemistry. New York: John Wiley and Sons, 1957.
|
| [46] |
Kalff J. Limnology. Prentice Hall, Upper Saddle River, NJ. Benjamin Cummings, 2002.
|
| [47] |
France RL. Differentiation between littoral and pelagic food webs in lakes using stable carbon isotopes. Limnology and Oceanography, 1995, 40: 1310-1313. DOI:10.4319/lo.1995.40.7.1310 |
| [48] |
Sun ZX. Primary study on prevention and control of agricultural pollution in Yunnan Plateau Lake. China Lake Forum, 2011. [孙治旭. 云南高原湖泊农业而源污染防治方法初探. 中国湖泊论坛, 2011. ]
|
| [49] |
Heaton T. Isotopic studies of nitrogen pollution in the hydrosphere and atmosphere:a review. Chemical Geology:Isotope Geoscience Section, 1986, 59: 87-102. DOI:10.1016/0168-9622(86)90059-X |
| [50] |
Kreitler CW, Jones DC. Natural soil nitrate:The cause of the nitrate contamination of ground water in Runnels County, Texasa. Ground Water, 1975, 13(1): 53-62. DOI:10.1111/gwat.1975.13.issue-1 |
| [51] |
Cole ML, Valiela I, Kroeger KD et al. Assessmental of a δ15N isotopic method to indicate anthropogenic eutrophication in aquatic ecosystems. Journal of Environmental Quality, 2004, 33: 124-132. DOI:10.2134/jeq2004.1240 |
| [52] |
Udy JW, Dennison WG. Growth and physiological responses of three seagrass species to elevated sediment nutrients in Moreton Bay, Australia. Journal of Experimental Marine Biology and Ecology, 1997, 217: 253-277. DOI:10.1016/S0022-0981(97)00060-9 |
| [53] |
Farquhar GD, Richards RA. Isotopic composition of plant carbon correlates with water-use efficiency of wheat genotpes. Australian Journal of Plan Physiology, 1984, 11: 539-552. DOI:10.1071/PP9840539 |
| [54] |
Deines P. The carbon isotopic composition of diamonds:relationship to diamond shape, color, occurrence and vapor composition. Geochimicaet Cosmochimica Acta, 1980, 44(7): 943-961. DOI:10.1016/0016-7037(80)90284-7 |
| [55] |
Kandall C, Silva SR, Kelly VJ. Carbon and nitrogen isotopic compositions of particulate organic matter in four large systems across the United States. Hydrol Process, 2011, 15: 1301-1346. DOI:10.1002/hyp.216 |
| [56] |
Christer B, Lars-Anders H, Han BP. The biology of lakes and ponds. Beijing: Higher Education Press, 2013, 4. [Christer Bronmark, Lars-Anders Hansson, 韩博平. 湖泊与池塘生物学. 北京: 高等教育出版社, 2013, 4.]
|
| [57] |
Wang JL, Li SP. Environment in microbiology. Beijing: Higher Education Press, 2004, 1. [王家玲, 李顺鹏. 环境微生物学. 北京: 高等教育出版社, 2004, 1.]
|
| [58] |
Liu X, Zhang Y, Han W et al. Enhanced nitrogen deposition over China. Nature, 2013, 494: 459-462. DOI:10.1038/nature11917 |
| [59] |
Field C, Mooney HA. The photosynthesis nitrogen relationship in wild plants. On the economy of plant from and function. Cambridge: Cambridge University Press, 1986, 25-55.
|
| [60] |
Lu FY, Liu ZQ, Ji HB. Carbon and nitrogen isotopes analysis and sources of organic matter in the upper reaches of the Chaobai River. Science China:Earth Sciences, 2012, 42(12): 1912-1922. [卢凤云, 刘竹青, 季宏兵. 潮白河上游有机质的碳、氮稳定同位素分析及来源探讨. 地球科学, 2012, 42(12): 1912-1922.] |
| [61] |
Meyers PA, Leenheer M, Bourbonniere R. Diagenesis of vascular plant organic matter components during burial in lake sediments. Aquatic Geochem, 1995, 1: 35-52. DOI:10.1007/BF01025230 |
 2018, Vol. 30
2018, Vol. 30 


