2016年以来太湖水体总磷浓度高位波动而总氮浓度持续下降[1],且伴随着蓝藻水华的大面积暴发[2-4]. 研究显示,自2014年起太湖水体总氮浓度已低于2 mg/L[5-7],尤其在夏季,由于水华蓝藻介导的反硝化作用的存在[8-9],水体总氮浓度最高下降了40.02 % [9],蓝藻生长受到氮限制[10],而总磷浓度则在0.08 mg/L左右波动[11],导致全湖水体氮磷比持续下降[12]. 关于2016年后太湖总磷浓度升高的原因,研究人员提出了多种假设,其中内源性磷释放被认为是最重要的磷来源. 水华蓝藻从沉积物中泵吸磷[13],使太湖水体中水华蓝藻密度与湖体总磷[4]、颗粒态磷[11]和溶解态磷浓度[3]均呈现正相关. 蓝藻衰亡后将吸收的磷释放到湖水中,这一过程是太湖总磷浓度维持较高水平的原因所在[13].
多聚磷酸盐(PolyP)存在于自然界的所有生命体中[14-15],为3个及以上正磷酸根(PO43-)通过高能磷酸键组成的线性或环状分子[16-17]. 作为一种比ATP存在历史更为久远的储能分子,PolyP被认为是早期地球生物重要的能量前体[18]. 此外,PolyP在生物体内具有重要的生理功能. 大量研究发现,当藻类或聚磷微生物处于磷胁迫状态时,存在超量吸磷的现象[19],并在胞内积累PolyP,而PolyP可以作为无机磷储存库,以避免细胞内磷匮乏. 此外,PolyP还可作为反应底物,提供磷酸根,用于合成其他生命物质. 例如,在PolyP-葡萄糖激酶(polyphosphate-glucose phosphotransferase,PPKG)作用下,蓝藻细胞利用葡萄糖和PolyP为底物生成6-磷酸-葡萄糖[20]. 除此之外,PolyP还有着维持细胞渗透压[21]、纠正蛋白质分子错误折叠[22]和促进细菌严谨反应[23]等生物学功能.
通常而言,生物细胞中PolyP含量维持在较低水平[16],而当细胞处于各种不利环境时,PolyP出现累积现象,使生物能适应应激环境. 目前已明确的胁迫条件包括:1)营养元素匮乏. Aksoy等[24]对莱茵衣藻(Chlamydomonas reinhardtii)的研究发现,在硫缺乏条件下,莱茵衣藻胞内酸性钙体含量明显增多,同时负责编码多聚磷酸盐聚合酶(polyphosphate polymerase)的相关基因表达显著上调,表明PolyP在细胞适应不利环境中发挥重要作用. 2)氧化应激. 次氯酸钠和双氧水处理使大肠杆菌在短时间内合成大量PolyP,研究者认为PolyP作为一种分子伴侣与细胞内具有重要功能的蛋白质结合,防止其变性[16]. 3) 藻类生长处于稳定期. 研究发现处于稳定期的莱茵衣藻细胞内有PolyP增多的现象[25-26],但目前仍不清楚PolyP增多的原因是与营养元素缺乏有关,还是与细胞受到其他胁迫有关. 4)重金属离子中毒. 当生物处于重金属离子或过量微量元素离子环境中时,其体内将合成大量PolyP,作为螯合剂与金属离子结合,以降低重金属离子毒性,PolyP含量与细胞对阳离子毒性的耐受程度存在显著正相关[27],在重金属离子中毒的莱茵衣藻体内就能观测到大量与重金属离子结合的PolyP储存在酸性钙体内[28]. 藻类通过吸收磷酸盐在胞内合成PolyP,提高了藻类细胞内磷含量,而当藻类衰亡时,大量磷被释放到水体中,导致水体总磷浓度提升.
湖泊水体蓝藻生长主要胁迫因子包括营养盐缺乏、氧化胁迫以及藻类生长处于稳定期等. 研究显示,在浅水湖泊中由于氮素自净作用的增强,蓝藻生长受到氮限制[29]. 同时,湖泊水体总氮中一般以硝态氮为主,由于反硝化作用使硝态氮被大量还原为氮气[30],水华蓝藻的生长进一步受到低氮浓度的限制. 低硝态氮作为一种胁迫因子对蓝藻吸收磷和合成多聚磷酸盐的影响以及其生理机制有待深入研究. 因此,本研究采用太湖野外水华蓝藻和纯铜绿微囊藻(Microcystis aeruginosa)进行低硝态氮浓度室内培养,测定其细胞内各种形态磷含量和生理生化指标,探索其累积多聚磷酸盐的过程和机制,有助于探明太湖近期总磷浓度高位波动的原因.
1 材料与方法 1.1 蓝藻及其培养野外水华蓝藻采自太湖,于24 h内送至实验室进行试验,水华蓝藻中微囊藻占藻类总细胞量的80 % 以上;铜绿微囊藻来自本实验室,在(25±1)℃、光照强度30 μmol photons/(m2 ·s)、光照周期10 L ∶14 D的条件下,采用BG-11培养基培养[31].
所有试验藻液先在无氮磷的BG-11培养基中进行3 d的饥饿培养. 随后以不同硝态氮浓度的BG-11培养基(硝态氮浓度分别为0、2、10、60和120 mg/L)培养野外水华蓝藻或铜绿微囊藻,作为实验组;使用完全营养的BG-11培养基(含硝态氮250 mg/L)培养野外水华蓝藻或铜绿微囊藻作为对照组. 实验组和对照组均设置3个平行. 在实验处理30 h后,取实验组及对照组藻液,测定各项指标.
1.2 藻细胞生物量测定野外水华蓝藻及铜绿微囊藻生物量分别采用每升藻液中藻细胞干重表征[32].
1.3 蓝藻中各形态磷含量测定取1 mL水华蓝藻或铜绿微囊藻藻液,加0.8 mL 5 % 过硫酸钾溶液于121℃消解,消解液采用钼锑抗分光光度法测定磷含量[33],并计算藻细胞胞内总磷(CTP)含量. 取3 mL藻液,使用1.5 mL 10 % 的三氯乙酸溶液抽提藻细胞内磷酸盐,提取液采用钼锑抗分光光度法测定磷含量,并计算藻中磷酸盐磷(Pi-P)含量.
目前广泛使用DAPI染色法定量测定细胞内PolyP含量[34],然而该方法应用于光合生物中具有一定的局限性[35]. 因此,本研究采用碱性次氯酸钠溶液抽提胞内PolyP,水解后采用钼锑抗分光光度法测定多聚磷酸盐磷(PolyP-P)含量[32].
1.4 铜绿微囊藻多聚磷酸盐颗粒电镜观察取10 mL铜绿微囊藻培养液离心浓缩,重悬于1 mL电镜固定液中,室温放置2 h后于4℃固定保存及运输,送至武汉塞维尔生物科技有限公司(武汉,中国)进行电镜观察. 采用透射电镜观察铜绿微囊藻胞内多聚磷酸盐颗粒位点及数量特征[26].
1.5 铜绿微囊藻生理生化活性测定通过叶绿素荧光变化表征铜绿微囊藻的光合活性[36],用Water-PAM Ⅱ藻类叶绿素荧光仪(WALZ,Germany)测定其叶绿素荧光参数. 超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、总蛋白(total protein)含量和热休克蛋白(HSP)含量均使用商业试剂盒(南京建成生物工程研究所,南京,中国)测定,操作方法分别见其说明书.
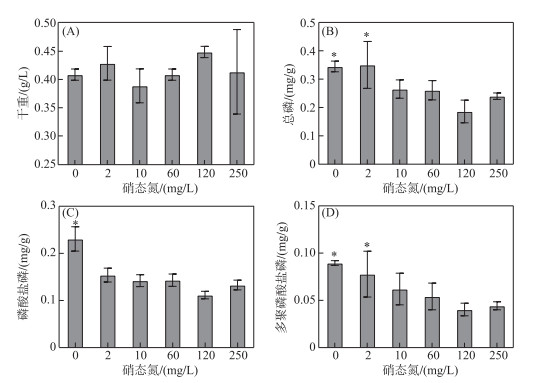
2 结果 2.1 低浓度硝态氮对水华蓝藻吸收磷的影响在不同硝态氮浓度下培养太湖野外水华蓝藻,测定水华蓝藻各形态磷含量变化趋势. 结果显示,在不同硝态氮浓度下培养30 h后,水华蓝藻生物量并未发生显著变化(图 1A),仍与初始生物量(0.40 g/L)相当,表明在此期间水华蓝藻并无显著的生长或衰亡,处于迟滞期. 但与对照组相比,当培养基中硝态氮浓度低于2 mg/L时,单位干重水华蓝藻中磷含量显著增加(P < 0.05). 其中,当培养基中硝态氮浓度下降为2 mg/L,水华蓝藻细胞内CTP和PolyP-P含量分别为(0.35 ± 0.08)和(0.07 ± 0.02) mg/g,显著高于对照组水华蓝藻细胞内相应形态磷含量(P < 0.05,图 1B、D). 同时,处于缺氮培养(硝态氮浓度为0 mg/L)时水华蓝藻CTP、Pi-P以及PolyP-P含量分别为(0.35±0.02)、(0.23±0.03)和(0.09±0.003) mg/g,也显著高于对照组水华蓝藻相应形态磷含量(P < 0.05,图 1B、C、D). 综上可知,在低硝态氮浓度下,水华蓝藻过量吸收磷并累积PolyP.
|
图 1 不同硝态氮浓度对水华蓝藻干重(A)以及胞内总磷(B)、磷酸盐磷(C)和多聚磷酸盐磷(D) 含量的影响 (平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P < 0.05)) Fig.1 Effect of different nitrate-nitrogen concentrations on the dry weight (A) and the total phosphorus (B), phosphate-phosphorus (C) and polyphosphate-phosphorus (D) contents in cells of blooming cyanobacteria (mean ± standard deviation, n=3. * indicates a significant difference with P < 0.05 between the experimental and control groups) |
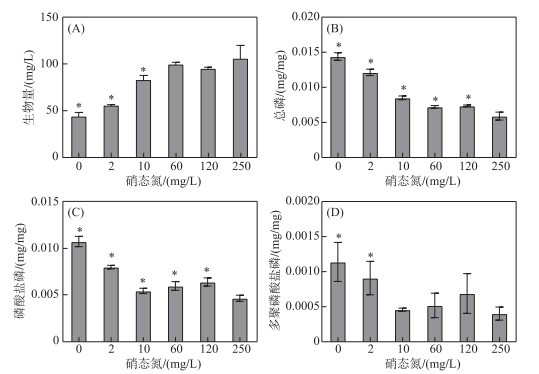
从太湖采集的水华蓝藻以微囊藻属为主,因此,以铜绿微囊藻为模式生物进行研究,测定了不同硝态氮浓度下铜绿微囊藻细胞内CTP、Pi-P以及PolyP-P含量,结果如图 2所示. 低硝态氮浓度(0及2 mg/L硝态氮)下,铜绿微囊藻生物量与初始接种量相比(50 mg/L)无显著差异;而与对照组相比,当氮浓度降至10、2及0 mg/L时,微囊藻生物量显著低于250 mg/L硝态氮浓度下(P < 0.05),分别为对照组的77.4 %、53.1 % 和42.3 %,低硝态氮培养液中铜绿微囊藻生长受到抑制. 同时,随着培养液中初始硝态氮浓度下降,铜绿微囊藻细胞内CTP和Pi-P含量均显著升高(P < 0.05),特别是当硝态氮浓度低于2 mg/L时,铜绿微囊藻细胞内PolyP-P含量较对照组显著累积(P < 0.05),其结果与太湖水华蓝藻吸收磷的趋势一致. 比较图 1和图 2可看出,在低浓度硝态氮条件下,铜绿微囊藻和太湖水华蓝藻细胞内CTP、Pi-P及PolyP-P的绝对含量存在较大的差异,太湖水华蓝藻各种形态磷含量可达到纯铜绿微囊藻的20~50倍.
|
图 2 不同硝态氮浓度对铜绿微囊藻生物量(A)以及胞内总磷(B)、磷酸盐磷(C)和多聚磷酸盐磷(D) 含量的影响 (平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P < 0.05)) Fig.2 Effect of different nitrate-nitrogen concentrations on the biomass (A)and the total phosphorus (B), phosphate-phosphorus (C) and polyphosphate-phosphorus (D) contents in cells of Microcystis aeruginosa (mean ± standard deviation, n=3. * indicates a significant difference with P < 0.05 between the experimental and control groups) |
不同生长状态的铜绿微囊藻细胞超微结构电镜观察结果显示,缺氮条件(硝态氮浓度为0 mg/L)培养的铜绿微囊藻细胞内酸性钙体数量高于对照组(图 3). 而酸性钙体是单细胞生物储存PolyP的主要场所[37],因此,低硝态氮时铜绿微囊藻细胞倾向于累积PolyP.

|
图 3 缺氮培养条件下铜绿微囊藻细胞内酸性钙体透射电镜图片 (图中箭头指示黑色颗粒为酸性钙体. A:缺氮培养组(硝态氮浓度为0 mg/L);B:对照组(硝态氮浓度为250 mg/L). 1:分裂细胞;2:完整细胞;3:凋亡细胞. 放大倍率为10000倍) Fig.3 Acidocalcisomes in Microcystis aeruginosa under no nitrate nitrogen condition (The black particles are acidocalcisomes. A: the nitrogen-deficient culture group (nitrate-nitrogen concentration is 0 mg/L); B: the control group (nitrate-nitrogen concentration is 250 mg/L). 1: a dividing cell; 2: an intact cell; 3: an apoptotic cell. Magnification was 10000×) |
为了探究低硝态氮浓度下蓝藻吸磷并累积PolyP的生理机制,采用纯铜绿微囊藻为实验对象,测定不同硝态氮浓度下其光合活性及抗氧化酶系统活性.
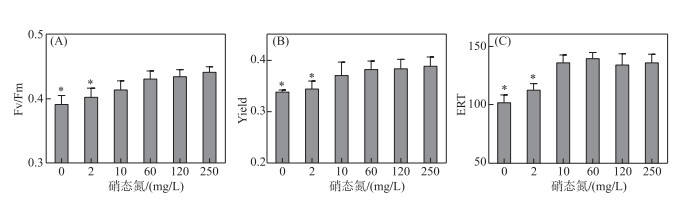
2.3.1 低浓度硝态氮对微囊藻光合作用活性的影响叶绿素荧光分析技术广泛应用于蓝藻光合系统生理状态的研究[36]. 如图 4所示,铜绿微囊藻在低硝态氮浓度(硝态氮浓度为2 mg/L)或无氮素环境中生长时,其PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ实际光合量子产量(Yield)以及PSⅡ最大电子传递速率(ERT)均显著低于对照组(P < 0.05). 然而,即使培养基缺氮(即硝态氮浓度为0 mg/L),铜绿微囊藻的光合荧光参数(Fv/Fm、Yield和ERT)仍能够达到对照组的88.7 %、87.1 % 和75.1 %,因此,在低氮环境培养初期,铜绿微囊藻仍然维持着较高的光合作用强度[31, 38-39].
|
图 4 不同硝态氮浓度下铜绿微囊藻的光合作用活性:(A) PSⅡ最大光化学量子产量(Fv/Fm);(B) PSⅡ实际光合量子产量(Yield);(C) PSⅡ最大电子传递速率(ERT) (平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P < 0.05)) Fig.4 Photosynthetic activity of Microcystis aeruginosa under different nitrate-nitrogen concentrations: (A) Maximum photochemical quantum yield of PSⅡ (Fv/Fm); (B) Actual photosynthetic quantum yield of PSⅡ (Yield); (C) Maximum electron transfer rate (ERT) of PS II (mean ± standard deviation, n = 3. * indicates a significant difference with P < 0.05 between the experimental and control groups) |
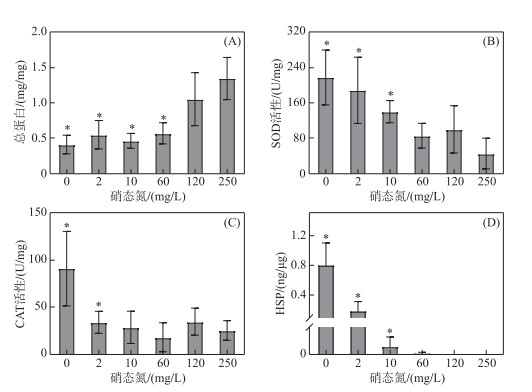
营养盐缺乏会影响生物合成蛋白质,如图 5A所示,当铜绿微囊藻胞外硝态氮浓度降低到60 mg/L时,藻细胞内总蛋白含量为0.6 mg/mg,仅为对照组的50 %,含量显著下降(P < 0.05). 在低浓度硝态氮条件下细胞中总蛋白含量下降导致铜绿微囊藻生长受阻,培养液中藻类生物量就低(图 2A). 由于氮元素是构成蛋白质分子的主要成分,因此,当培养液中氮素浓度下降时,藻细胞内合成的蛋白含量必将减少.
|
图 5 不同硝态氮浓度对铜绿微囊藻总蛋白含量、抗氧化酶活性及热休克蛋白含量的影响:(A) 总蛋白;(B) 超氧化物歧化酶(SOD);(C) 过氧化氢酶(CAT);(D) 热休克蛋白(HSP)) (平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P < 0.05) Fig.5 Effects of different nitrate-nitrogen concentrations on the total protein content, antioxidant enzyme activity and HSP content in Microcystis aeruginosa: (A) total protein; (B) superoxide dismutase (SOD); (C) catalase (CAT); (D) heat shock protein (HSP) (mean ± standard deviation, n=3. * indicates a significant difference with P < 0.05 between the experimental and control groups) |
当铜绿微囊藻细胞未受到氧化胁迫时,其SOD、CAT活性及HSP含量均处于较低水平,当铜绿微囊藻处于低氮胁迫时,其胞内氧化应激酶系统被激活(图 5B、C、D). 处于缺氮条件下藻细胞体内SOD和CAT活性分别为对照组的4.9和3.6倍,酶活性显著增强(P < 0.05). 同时,在高硝态氮浓度实验组藻细胞体内未检出HSP,而当培养液中硝态氮浓度降低到10 mg/L以下时,细胞内HSP含量急剧增加,微囊藻细胞内HSP含量从硝态氮浓度为2 mg/L时的0.19 ng/μg上升到无硝态氮培养中的0.80 ng/μg. 因此,低硝态氮浓度导致微囊藻处于氧化胁迫状态.
3 讨论当处于低硝态氮环境中时,水华蓝藻和铜绿微囊藻细胞内均呈现过量吸收磷并在细胞内累积PolyP的现象(图 1,2). 这与磷缺乏环境中藻细胞“奢侈吸磷”的现象类似,研究发现,当处于磷胁迫状态时,藻细胞会通过增加碱性磷酸酶(AKP)的含量及上调磷酸盐转运系统相关基因表达量等方式,从环境中吸收更多的PO43-储存在细胞内[40]. 本研究的结果显示,无论是水华蓝藻还是纯铜绿微囊藻,当处于低硝态氮培养状态时,在7.12 mg/L的Pi-P浓度培养液中微囊藻也存在“奢侈”吸磷收现象,其胞内PO43-含量显著升高(图 1C,2C),PolyP出现累积(图 1D,2D). 这表明细胞过量吸收磷的原因不仅仅是磷缺乏,且PolyP在光合微生物细胞内的生物功能也不只是作为磷酸盐的储存库,更可能是营养盐缺乏带来的其他胁迫条件导致了PolyP累积. 例如,Ota等[41]发现在缺硫的培养条件下,凯氏拟小球藻(Parachlorella kessleri)细胞内出现了大量PolyP颗粒,同时总磷含量出现显著上升,且其总磷和PolyP的累积量均多于磷缺乏条件下培养的细胞. 在氮缺乏和硫缺乏条件下培养的莱茵衣藻胞内也同样发现了PolyP累积,而无法合成PolyP的突变体细胞在营养盐胁迫条件下则具有更高的死亡率[24]. 因此,蓝藻合成PolyP与抗不利环境条件有关.
那么铜绿微囊藻在低硝态氮条件下累积PolyP的原因是什么?实验结果显示,虽然不利的环境条件会在一定程度上抑制铜绿微囊藻光合作用的活性[42-44],但在培养初期铜绿微囊藻仍维持着较高的光合活性,其各叶绿素荧光参数仍能够达到对照组的75.1 % ~88.7 % (图 4),表明蓝藻光合电子传递速率、光合量子产量还保持在较高水平[38]. 碳、氮的同化是光反应产生还原力的重要去向,然而在低浓度硝态氮培养液中,铜绿微囊藻的碳、氮同化速率均显著降低[38-39],因此,还原力更多流向O2,从而产生大量活性氧(ROS)[38-39],使细胞处于氧化应激状态. 已有研究发现,当藻类处于不利环境中,藻细胞就会累积大量ROS,并作为调控信号,以改变藻细胞的生物学过程,使其适应胁迫环境[45]. 本研究发现,在低硝态氮浓度下,铜绿微囊藻体内SOD和CAT活性显著上升(图 5B、C),用于清除细胞内过量的ROS,减轻细胞损伤[46],有利于细胞生存. 同时,含量增加的HSP被认为是细胞受到氧化胁迫的生物标志物[47],在本研究中,当铜绿微囊藻胞外硝态氮浓度降低到2 mg/L以下时,铜绿微囊藻细胞内可检测到HSP的存在(图 5D),进一步表明铜绿微囊藻在该条件下已受到氧化胁迫. 研究表明,在氧化胁迫条件下大肠杆菌细胞内合成大量PolyP以防止其胞内蛋白质受损[16]. 由此推测低浓度硝态氮引起的氧化应激反应促进了铜绿微囊藻细胞内PolyP累积.
蓝藻细胞内蛋白质中氮含量平均可达16 %,随着培养基中可利用氮浓度下降,蛋白质合成原料减少,导致铜绿微囊藻细胞内总蛋白含量显著降低(图 5A),因此,此时微囊藻胞内蛋白数量少,又出现氧化损伤,从而对铜绿微囊藻的生长产生不利影响. 我们发现,缺氮条件下培养的铜绿微囊藻胞内大量的PolyP颗粒在细胞光合片层周围累积(图 3),其原因可能是光合片层周边ROS浓度更高,导致原生质中该区域蛋白质受氧化损伤更严重,因此PolyP在该区域聚集以防止蛋白质失活. 早在1974年Jensen等[48]就观测到蓝藻细胞中PolyP与核糖体、类囊体等细胞结构结合,其原因可能与蛋白质的合成有关. 大量研究发现,在蛋白质折叠及氧化应激反应中PolyP起到了类似分子伴侣的作用,PolyP可作为蛋白质稳定支架,结合蛋白质解折叠中间体并将其稳定在富含可溶性β- 折叠的构象中,从而防止蛋白质因氧化胁迫、高温等条件造成的失活[49];当外界不利条件消失时,与PolyP结合的蛋白质又可在折叠酶的作用下恢复其原有结构及活性[50]. 在本研究中,低浓度硝态氮一方面导致铜绿微囊藻缺少合成蛋白质的原料,另一方面诱导细胞产生氧化损伤而造成蛋白质面临失活的风险,故其细胞内累积PolyP以减轻蛋白质的损伤,是一种对胞内蛋白质的保护机制.
在原核生物及部分真核生物体内,PolyP的合成由多聚磷酸盐激酶(PPK)催化,PPK将ATP分子末端的PO43-转移到PolyP末端,延长PolyP分子链[51]. 而ATP的合成则由ADP及PO43-在ATP合酶的催化下完成,因此,作为PolyP的最小组成单元,PO43-在细胞内含量将显著影响PolyP的合成. 本研究观测到,处于低硝态氮环境中的水华蓝藻和铜绿微囊藻超量吸收磷酸盐,为PolyP的累积提供了物质基础(图 1,2). 同时,透射电镜也观察到缺氮状态下铜绿微囊藻体内出现大量含有PolyP颗粒的酸性钙体(图 3). Goodenough等[26]通过冷冻切片观察氮限制环境下生长的莱茵衣藻,发现其体内的酸性钙体明显上升,而氮限制的莱茵衣藻在补充氮素后,其体内PolyP快速降解,且其利用次序先于培养基中磷. 对小球藻(Chlorella vulgaris)进行氮胁迫处理得到了相似的结果,缺氮时小球藻体内PolyP快速累积,向培养基中添加氮后又快速降解[52]. 因此,微囊藻合成PolyP是细胞适应氮营养盐缺乏环境的重要机制,而微囊藻为了合成PolyP,就必须增加细胞内磷酸盐含量,导致微囊藻“奢侈”吸磷.
低硝态氮条件下,水华蓝藻生物量并未发生显著变化,藻类生长处于迟滞期,但胞内总磷、磷酸盐及PolyP含量均显著上升(图 1),当细胞内含有大量磷的蓝藻进入衰亡期后,其“奢侈”吸收的磷被释放到水体中,从而造成水体总磷浓度上升. 研究发现,水华藻团发生堆积腐解后,其体内营养盐释放将导致上覆水中总磷浓度升高,磷释放量随藻密度的增加而增大,且黑暗等环境条件会加速这一过程[32, 53]. 同时,太湖水华蓝藻的磷释放潜能具有季节差异性,夏季蓝藻具有最高的磷吸收潜能,而秋、冬季蓝藻具有最高的磷释放潜能[54],本研究能很好地解释这一现象,夏季由于高温反硝化作用增强导致太湖水体总氮浓度下降,从而促使水华蓝藻过量吸收磷酸盐并储存在细胞内,而到秋、冬季,水华蓝藻衰亡,导致大量的磷酸盐释放到湖体中. 因此,在低氮条件下蓝藻“奢侈”吸磷,并在其衰亡后将过量磷释放到水体中,从而导致太湖水体总氮下降时总磷浓度仍然处于高位波动状态.
4 结论1) 当胞外硝态氮浓度为2 mg/L及以下时,水华蓝藻及纯铜绿微囊藻能过量吸收磷酸盐,并在细胞内累积PolyP.
2) 在低硝态氮培养液中,铜绿微囊藻碳、氮同化速率降低的同时,仍具有较高的光活性,导致其胞内ROS大量累积,使细胞处于氧化应激状态. 一方面,铜绿微囊藻通过增强细胞抗氧化酶系统活性抵御氧化损伤;另一方面,作为氧化胁迫的应答,合成PolyP,保护细胞内蛋白质等免受损伤,从而导致蓝藻“奢侈”吸磷.
| [1] |
Xin HR, Zhu GW, Wang XS et al. Variation and driving factors of black water event intensity in Lake Taihu during 2009 to 2018. Environmental Science, 2020, 41(11): 4914-4923. [辛华荣, 朱广伟, 王雪松等. 2009—2018年太湖湖泛强度变化及其影响因素. 环境科学, 2020, 41(11): 4914-4923. DOI:10.13227/j.hjkx.202004172] |
| [2] |
Zhu W, Cheng L, Xue ZP et al. Changes of water exchange cycle in Lake Taihu (1986-2018) and its effect on the spatial pattern of water quality. J Lake Sci, 2021, 33(4): 1087-1099. [朱伟, 程林, 薛宗璞等. 太湖水体交换周期变化(1986—2018年)及对水质空间格局的影响. 湖泊科学, 2021, 33(4): 1087-1099. DOI:10.18307/2021.0411] |
| [3] |
Zhu GW, Qin BQ, Zhang YL et al. Fluctuation of phosphorus concentration in Lake Taihu in the past 70 years and future control strategy. J Lake Sci, 2021, 33(4): 957-973. [朱广伟, 秦伯强, 张运林等. 近70年来太湖水体磷浓度变化特征及未来控制策略. 湖泊科学, 2021, 33(4): 957-973. DOI:10.18307/2021.0401] |
| [4] |
Wu HY, Jia GH, Xu B et al. Analysis of variation and driving factors of total phosphorus in Lake Taihu, 1980-2020. J Lake Sci, 2021, 33(4): 974-991. [吴浩云, 贾更华, 徐彬等. 1980年以来太湖总磷变化特征及其驱动因子分析. 湖泊科学, 2021, 33(4): 974-991. DOI:10.18307/2021.0402] |
| [5] |
Dai XL, Qian PQ, Ye L et al. Changes in nitrogen and phosphorus concentrations in Lake Taihu, 1985-2015. J Lake Sci, 2016, 28(5): 935-943. [戴秀丽, 钱佩琪, 叶凉等. 太湖水体氮、磷浓度演变趋势(1985—2015年). 湖泊科学, 2016, 28(5): 935-943. DOI:10.18307/2016.0502] |
| [6] |
Hong GX, Du MC, Zheng JZ. Analysis on variation tendency of water quality in Wuxi area of Taihu Lake and its causes. Yangtze River, 2019, 50(S1): 40-44, 55. [洪国喜, 杜明成, 郑建中. 太湖无锡水域水质变化特征及原因分析. 人民长江, 2019, 50(S1): 40-44, 55.] |
| [7] |
Fan QH, Shen HJ, Zhang T et al. Changes of total nitrogen concentration in Taihu Lake during 1987-2016. Environmental Monitoring and Forewarning, 2017, 9(6): 8-13. [范清华, 沈红军, 张涛等. 1987—2016年太湖总氮浓度变化趋势分析. 环境监控与预警, 2017, 9(6): 8-13.] |
| [8] |
Zhao F, Xu H, Zhan X et al. Spatial differences and influencing factors of denitrification and ANAMMOX rates in spring and summer in Lake Taihu. Environmental Science, 2021, 42(5): 2296-2302. [赵锋, 许海, 詹旭等. 太湖春夏两季反硝化与厌氧氨氧化速率的空间差异及其影响因素. 环境科学, 2021, 42(5): 2296-2302. DOI:10.13227/j.hjkx.202008303] |
| [9] |
Liu ZY, Xu H, Zhan X et al. Influence of cyanobacterial blooms on denitrification rate in shallow Lake Taihu, China. Environmental Science, 2019, 40(3): 1261-1269. [刘志迎, 许海, 詹旭等. 蓝藻水华对太湖水柱反硝化作用的影响. 环境科学, 2019, 40(3): 1261-1269. DOI:10.13227/j.hjkx.201808056] |
| [10] |
Xu H, Paerl HW, Qin B et al. Determining critical nutrient thresholds needed to control harmful cyanobacterial blooms in eutrophic Lake Taihu, China. Environmental Science & Technology, 2015, 49(2): 1051-1059. DOI:10.1021/es503744q |
| [11] |
Wang H, Chen HX, Xu ZA et al. Variation trend of total phosphorus and its controlling factors in Lake Taihu, 2010-2017. J Lake Sci, 2019, 31(4): 919-929. [王华, 陈华鑫, 徐兆安等. 2010—2017年太湖总磷浓度变化趋势分析及成因探讨. 湖泊科学, 2019, 31(4): 919-929. DOI:10.18307/2019.0421] |
| [12] |
Qin BQ, Zhang YL, Zhu GW et al. Are nitrogen-to-phosphorus ratios of Chinese lakes actually increasing?. PNAS, 2020, 117(35): 21000-21002. DOI:10.1073/pnas.2013445117 |
| [13] |
Yang LY, Yang XY, Ren LM et al. Mechanism and control strategy of cyanobacterial bloom in Lake Taihu. J Lake Sci, 2019, 31(1): 18-27. [杨柳燕, 杨欣妍, 任丽曼等. 太湖蓝藻水华暴发机制与控制对策. 湖泊科学, 2019, 31(1): 18-27. DOI:10.18307/2019.0102] |
| [14] |
Moreno-Sanchez D, Hernandez-Ruiz L, Ruiz FA et al. Polyphosphate is a novel pro-inflammatory regulator of mast cells and is located in acidocalcisomes. Journal of Biological Chemistry, 2012, 287(34): 28435-28444. DOI:10.1074/jbc.m112.385823 |
| [15] |
Cremers CM, Knoefler D, Gates S et al. Polyphosphate: A conserved modifier of amyloidogenic processes. Molecular Cell, 2016, 63(5): 768-780. DOI:10.1016/j.molcel.2016.07.016 |
| [16] |
Wang X. Construction and application of engineered bacteria and transgenic rice plants with highly effective phosphorus removal capability based on the over-expression of polyphosphate kinase 1 [Dissertation]. Nanjing: Nanjing University, 2018. [ [王鑫. 过表达多聚磷酸盐激酶的高效除磷工程菌和转基因水稻的构建与应用[学位论文]. 南京: 南京大学, 2018. ]
|
| [17] |
Mandala VS, Loh DM, Shepard SM et al. Bacterial phosphate granules contain cyclic polyphosphates: Evidence from 31P solid-state NMR. Journal of the American Chemical Society, 2020, 142(43): 18407-18421. DOI:10.1021/jacs.0c06335 |
| [18] |
Achbergerová L, Nahálka J. Polyphosphate—an ancient energy source and active metabolic regulator. Microbial Cell Factories, 2011, 10: 63. DOI:10.1186/1475-2859-10-63 |
| [19] |
Ohtake M, Kurita R, Tsunogai M et al. Storage capacity for phosphorus during growth and maturation in a brown alga Sargassum macrocarpum. Science of the Total Environment, 2021, 750: 141221. DOI:10.1016/j.scitotenv.2020.141221 |
| [20] |
Albi T, Serrano A. Two strictly polyphosphate-dependentgluco (manno) kinases from diazotrophic cyanobacteria with potential to phosphorylate hexoses from polyphosphates. Applied Microbiology and Biotechnology, 2015, 99(9): 3887-3900. DOI:10.1007/s00253-014-6184-7 |
| [21] |
Kulaev I, Kulakovskaya T. Polyphosphate and phosphate pump. Annual Review of Microbiology, 2000, 54(1): 709-734. DOI:10.1146/annurev.micro.54.1.709 |
| [22] |
Xie LH, Jakob U. Inorganic polyphosphate, a multifunctional polyanionic protein scaffold. Journal of Biological Chemistry, 2019, 294(6): 2180-2190. DOI:10.1074/jbc.REV118.002808 |
| [23] |
Keasling JD, van Dien SJ, Pramanik J. Engineering polyphosphate metabolism in Escherichia coli: Implications for bioremediation of inorganic contaminants. Biotechnology and Bioengineering, 1998, 58(2/3): 231-239. DOI:10.1002/(sici)1097-0290(19980420)58:2/3231:aid-bit16>3.0.co;2-f |
| [24] |
Aksoy M, Pootakham W, Grossman AR. Critical function of a Chlamydomonas reinhardtii putative polyphosphate polymerase subunit during nutrient deprivation. The Plant Cell, 2014, 26(10): 4214-4229. DOI:10.1105/tpc.114.129270 |
| [25] |
Komine Y, Eggink LL, Park H et al. Vacuolar granules in Chlamydomonas reinhardtii: Polyphosphate and a 70-kDa polypeptide as major components. Planta, 2000, 210(6): 897-905. DOI:10.1007/s004250050695 |
| [26] |
Goodenough U, Heiss AA, Roth R et al. Acidocalcisomes: ultrastructure, biogenesis, and distribution in microbial eukaryotes. Protist, 2019, 170(3): 287-313. DOI:10.1016/j.protis.2019.05.001 |
| [27] |
Moura KAF, Lizieri C, Wittig Franco M et al. Physiological and thylakoid ultrastructural changes in cyanobacteria in response to toxic manganese concentrations. Ecotoxicology, 2019, 28(8): 1009-1021. DOI:10.1007/s10646-019-02098-y |
| [28] |
Tsednee M, Castruita M, Salomé PA et al. Manganese co-localizes with calcium and phosphorus in Chlamydomonas acidocalcisomes and is mobilized in manganese-deficient conditions. Journal of Biological Chemistry, 2019, 294(46): 17626-17641. DOI:10.1074/jbc.RA119.009130 |
| [29] |
Qin BQ, Zhou J, Elser JJ et al. Water depth underpins the relative roles and fates of nitrogen and phosphorus in lakes. Environmental Science & Technology, 2020, 54(6): 3191-3198. DOI:10.1021/acs.est.9b05858 |
| [30] |
Moon DL, Scott JT, Johnson TR. Stoichiometric imbalances complicate prediction of phytoplankton biomass in US lakes: Implications for nutrient criteria. Limnology and Oceanography, 2021, 66(8): 2967-2978. DOI:10.1002/lno.11851 |
| [31] |
Ye Q. Physiological and biochemical responses of Microcystis aeruginosa to nitrogen and phosphorus deficiency [Dissertation]. Xiamen: Xiamen University, 2019. [ [叶倩. 铜绿微囊藻缺氮缺磷下的生理生化响应[学位论文]. 厦门: 厦门大学, 2019. ]
|
| [32] |
Wang MM, Zhang HF, Chen M et al. Dark accelerates dissolved inorganic phosphorus release of high-density cyanobacteria. PLoS One, 2020, 15(12): e0243582. DOI:10.1371/journal.pone.0243582 |
| [33] |
State Environmental Protection Administration. Monitoring and analysis methods of water and wastewater. Beijing: China Environmental Science Press, 2002. [国家环境保护总局. 水和废水监测分析方法. 北京: 中国环境科学出版社, 2002.]
|
| [34] |
Kulakova AN, Hobbs D, Smithen M et al. Direct quantification of inorganic polyphosphate in microbial cells using 4′-6-diamidino-2-phenylindole (DAPI). Environmental Science & Technology, 2011, 45(18): 7799-7803. DOI:10.1021/es201123r |
| [35] |
Bru S, Jimenez J, Canadell D et al. Improvement of biochemical methods of polyP quantification. Microbial Cell, 2017, 4(1): 6-15. DOI:10.15698/mic2017.01.551 |
| [36] |
Ma WM. Identification, regulation and physiological functions of multiple NADPH dehydrogenase complexes in cyanobacteria. Frontiers of Biology in China, 2009, 4(2): 137-142. DOI:10.1007/s11515-009-0005-x |
| [37] |
Docampo R, Huang GZ. Acidocalcisomes of eukaryotes. Current Opinion in Cell Biology, 2016, 41: 66-72. DOI:10.1016/j.ceb.2016.04.007 |
| [38] |
Kvíderová J, Kumar D. Response of short-term heat shock on photosynthetic activity of soil crust cyanobacteria. Protoplasma, 2020, 257(1): 61-73. DOI:10.1007/s00709-019-01418-7 |
| [39] |
Voronova EN, Konyukhov IV, Koksharova OA et al. Inhibition of cyanobacterial photosynthetic activity by natural ketones. Journal of Phycology, 2019, 55(4): 840-857. DOI:10.1111/jpy.12861 |
| [40] |
Wu P, Lu YJ, Lu Y et al. Response of the photosynthetic activity and biomass of the phytoplankton community to increasing nutrients during cyanobacterial blooms in Meiliang Bay, Lake Taihu. Water Environment Research, 2020, 92(1): 138-148. DOI:10.1002/wer.1220 |
| [41] |
Pang XQ. Study on the functional mechanisms of NdhF1 during cyanobacterial dormancy by nitrogen deficiency [Dissertation]. Shanghai: Shanghai Normal University, 2019. [庞晓琴. NdhF1在蓝藻缺氮休眠过程中的功能机制研究[学位论文]. 上海: 上海师范大学, 2019. ]
|
| [42] |
Yue DM. In situ growth and responses to nitrogen and phosphorus stravation on bloom-forming cyanobacteria [Dissertation]. Nanjing: Nanjing University, 2014. [ [岳冬梅. 太湖水华蓝藻原位生长及对氮磷营养限制的响应[学位论文]. 南京: 南京大学, 2014. ]
|
| [43] |
Dai JY, Chen D, Wu SQ et al. Dynamics of phosphorus and bacterial phoX genes during the decomposition of Microcystis blooms in a mesocosm. PLoS One, 2018, 13(5): e0195205. DOI:10.1371/journal.pone.0195205 |
| [44] |
Ota S, Yoshihara M, Yamazaki T et al. Deciphering the relationship among phosphate dynamics, electron-dense body and lipid accumulation in the green alga Parachlorella kessleri. Scientific Reports, 2016, 6: 25731. DOI:10.1038/srep25731 |
| [45] |
Dingman JE, Lawrence JE. Heat-stress-induced programmed cell death in Heterosigma akashiwo (Raphidophyceae). Harmful Algae, 2012, 16: 108-116. DOI:10.1016/j.hal.2012.02.003 |
| [46] |
Mokni M, Elkahoui S, Limam F et al. Effect of resveratrol on antioxidant enzyme activities in the brain of healthy rat. Neurochemical Research, 2007, 32(6): 981-987. DOI:10.1007/s11064-006-9255-z |
| [47] |
Tedeschi JN, Kennington WJ, Berry O et al. Increased expression of Hsp70 and Hsp90 mRNA as biomarkers of thermal stress in loggerhead turtle embryos (Caretta caretta). Journal of Thermal Biology, 2015, 47: 42-50. DOI:10.1016/j.jtherbio.2014.11.006 |
| [48] |
Jensen TE, Sicko LM. Phosphate metabolism in blue-green algae. I. Fine structure of the "polyphosphate overplus" phenomenon in Plectonema boryanum.. Canadian Journal of Microbiology, 1974, 20(9): 1235-1239. DOI:10.1139/m74-190 |
| [49] |
Gray MJ, Wholey WY, Wagner NO et al. Polyphosphate is a primordial chaperone. Molecular Cell, 2014, 53(5): 689-699. DOI:10.1016/j.molcel.2014.01.012 |
| [50] |
Yoo NG, Dogra S, Meinen BA et al. Polyphosphate stabilizes protein unfolding intermediates as soluble amyloid-like oligomers. Journal of Molecular Biology, 2018, 430(21): 4195-4208. DOI:10.1016/j.jmb.2018.08.016 |
| [51] |
Cui CX, Kong MY, Wang YH et al. Characterization of polyphosphate kinases for the synthesis of GSH with ATP regeneration from AMP. Enzyme and Microbial Technology, 2021, 149: 109853. DOI:10.1016/j.enzmictec.2021.109853 |
| [52] |
Chu FF, Shen XF, Lam PKS et al. Polyphosphate during the regreening of Chlorella vulgaris under nitrogen deficiency. International Journal of Molecular Sciences, 2015, 16(10): 23355-23368. DOI:10.3390/ijms161023355 |
| [53] |
Wu XT, Qi C, Xu XG et al. Simulation of cyanobacteia decay's impacts on nutrients in water. Acta Scientiae Circumstantiae, 2017, 37(8): 2846-2853. [吴馨婷, 祁闯, 许晓光等. 蓝藻腐解对水中营养盐影响的模拟研究. 环境科学学报, 2017, 37(8): 2846-2853. DOI:10.13671/j.hjkxxb.2016.0480] |
| [54] |
Wang MM, Zhang HF, Du CL et al. Spatiotemporal differences in phosphorus release potential of bloom-forming cyanobacteria in Lake Taihu. Environmental Pollution, 2021, 271: 116294. DOI:10.1016/j.envpol.2020.116294 |
 2022, Vol. 34
2022, Vol. 34 

