(2: 国家环境保护水土污染协同控制与联合修复重点实验室(成都理工大学),成都 610059)
(3: 贵州省地质矿产勘查开发局一○四地质大队,贵阳 558000)
(4: 地质灾害防治与地质环境保护国家重点实验室(成都理工大学),成都 610059)
(2: State Environmental Protection Key Laboratory of Synergetic Control and Joint Remediation for Soil & Water Pollution (SEKL-SW), Chengdu University of Technology, Chengdu 610059, P.R.China)
(3: 104 Geological Brigade of Guizhou Geological and Mineral Exploration and Development Bureau, Guiyang 558000, P.R.China)
(4: State Key Laboratory of Geohazard Prevention and Geoenvironment Protection, Chengdu University of Technology, Chengdu 610059, P.R.China)
水体富营养化是一个日益严重的全球性问题[1]. 研究表明,亚洲54 % 的湖泊和水库,欧洲、北美、南美和非洲分别53 %、48 %、41 % 和28 % 的湖泊发生了富营养化[2]. 水中过量的磷是造成富营养化最重要的原因之一[3-7]. Yao等指出,引起水体富营养化的磷酸盐最低边际浓度为0.02 mg/L[8];Xu等也提出总磷(TP)浓度为0.05~0.10 mg/L时水体发生富营养化[9]. Schindler等在湖泊研究中分析了美国、加拿大等国家的全湖实验案例,发现控制磷是减少淡水富营养化的关键[10]. 1989-2020年的《中国生态环境状况公报》也指出,湖库水体富营养化的主要污染指标是TP.
湖库水作为一种淡水资源,是国民生活、经济持续发展和社会稳定的重要保证. 作为封闭或半封闭水体,其水流量比河流小(水流速度),水力滞留时间长,光热条件较好,极易受人为干扰和环境因素影响而使湖库总磷限值超过富营养化极限浓度(0.05 mg/L),此时,湖库成为典型的微污染水体. 由于这种水体的蓄水特性,农田和城市径流的沉积物和营养物将进入湖/水库[11],导致营养物质的积累,使得湖水TP浓度超过标准的限制,因此,湖泊对磷的输入具有“积累效应”和“时滞效应”[10, 12],由于上述湖库的特点,即使少量磷的输入也极易造成湖库中藻类大量繁殖,使水体有朝富营养化发展的趋势,极易导致水华的发生. 水体富营养化严重威胁着水体生态环境的稳定与健康,同时也影响人们的生活环境. 为了有效控制湖泊和水库的富营养化,改善和稳定湖泊水质,磷的去除、特别是低浓度磷的去除已成为水质科学研究的重要方向.
生物、化学和物理化学/吸附法是常用的除磷方法[13-14]. 污水处理厂通常采用生物法与化学法结合进行深度脱磷,有时采用铁铝盐絮凝法,但过程和影响因素复杂. 化学方法主要是通过添加金属化合物,而将金属离子引入水中很容易造成二次污染. 吸附法与生物法和化学法相比更简单、高效、稳定、环保[15],可以有效去除水体中的悬浮物,也可以同时减少色度和浊度. 因此,吸附法得到了广泛的研究. 常用的除磷吸附剂包括铁/铝絮凝剂或改性剂、天然黏土/矿物复合材料或改性吸附剂、铈/锆锁磷材料、生物质材料和活性炭[14]. 铁铝絮凝剂是污水处理厂深度除磷常用的絮凝剂,但其铁盐具有腐蚀性,出水呈淡黄色. 铝盐在低温下难以水解,除磷效果不如铁盐. 此外,它们都容易受到环境条件的影响,并面临后续出水中和的问题[16];天然黏土/矿物和生物质材料除磷效率不高;活性炭对磷的吸附能力有限;锁磷剂需要对材料进行改性,对低磷酸盐的吸附去除能力有待提高[17];介孔材料制备复杂,成本高[18]. 除此以外,即使企业排放的污水达到了《城镇污水处理厂污染物排放标准》的A类标准(TP浓度为0.5 mg/L),排出的污水也极易造成湖、库等半封闭或封闭水体低浓度磷污染. 同时,Ramasahayam等的研究显示低浓度范围的磷酸盐较难去除[14]. 此外,大量除磷材料在变化的自然水体环境中存在易于再次释放的问题,同时还需要考虑环境生态风险. 为保障人体健康与生态安全,找到一种制备简单、能快速去除低浓度磷、除磷效果稳定、环境风险低的除磷剂,对及时控制湖库磷污染风险进而控制水体富营养化意义重大.
磷酸盐化合物的溶解度积常数用来判断磷酸盐的沉淀和溶解难易程度. 铝、钙、铁、硅、镁离子与磷酸盐结合的产物溶解度较低,最小值为1.6×10-58[19],可通过沉淀去除水中的磷. 因此,在湖库型微污染水体中,含有一种或多种上述金属离子的物质正在被广泛用于水中磷去除的研究. 根据湖库水体特点,从高效性、安全性、环境友好等角度考虑,研究选用含有上述离子的天然矿物或已长期广泛使用的水硬性材料,包含钠基膨润土、钙基膨润土、云母、凹凸棒土、白泥等16种天然矿物材料,粉煤灰、硅灰2种具火山灰活性材料,油井水泥、硫铝酸盐水泥、普通硅酸盐水泥3种水硬性材料,从中筛选出一种目标除磷材料——硫铝酸盐水泥. 硫铝酸盐水泥是一种富含钙、铝、硅、铁、镁[20]的低碱性水力胶凝材料. 从硫铝酸盐水泥的化学成分分析,其中含有CaO、Al2O3、Fe2O3等能与磷酸盐反应的成分;从其水化生成物中分析,钙亦能与磷酸盐结合,且形成的铝和铁胶体能够形成絮凝体,进而网捕去除磷酸盐. 因此,硫铝酸盐水泥对污染水体中磷的去除具有潜在的应用价值. 本研究以硫铝酸盐水泥及其制备的絮凝剂为研究对象,对其除磷性能、机理和对磷酸盐吸附的稳定性进行了一系列实验,论述了其经济性与安全性,并采用低磷污染水库水对材料的除磷性能进行了验证.
1 材料与方法 1.1 实验材料与方法本研究使用的硫铝酸盐水泥(代号R.SAC 42.5,简称R)购自峨眉山强华特种水泥有限公司,由铝原料和钙质原料煅烧后与石膏掺合而成. 主要矿物成分为硫铝酸钙、石膏和硅酸盐三钙,组成比如表 1所示.
| 表 1 硫铝酸盐水泥化学成分 Tab. 1 Chemical composition of the sulfoaluminate cement |
实验使用以无水磷酸氢二钾(购自成都科隆化工有限公司)配制的磷酸盐溶液,其浓度符合湖库环境地表水Ⅳ类水质标准(P为0.1 mg/L). 实验过程中,用1 ∶9的HCl(购自西龙科技有限公司)溶液和0.10 mol/L NaOH(购自成都古龙化工有限公司)溶液调节pH. 所用试剂均为分析级. TP浓度的测定方法为《水中总磷钼酸铵分光光度法》(GB 11893-1989)[21],所用分光光度计为MAPADA v-1100D.
1.2 R除磷性能及机理实验本文研究了R的加入量与磷去除率的关系. 通过加料量实验得到最佳加料比(“最佳”指目前研究阶段确定的所能达到的最好去除效果),通过加料模式实验得到最佳加料模式. 通过动力学实验研究了反应速率,通过等温吸附实验研究了吸附特性和最大吸附容量. 通过对R原料、R水化体(水化30 min,不调节pH)和R絮凝体(水化30 min,调节pH为7.0)的表征,分析了其组成和反应过程的变化,研究了R中除磷的主要成分及除磷方式. 通过对Zeta电位的连续测定,进一步证实了磷酸盐去除的主要方式. 实验方法如下:
最佳添加量实验:将0.01、0.05、0.10、0.20、0.50、1.0、2.0、5.0和10.0 g R分别加入1000 mL 0.10 mg/L的磷酸盐溶液中,水化30 min后调节pH为7.0,混匀,沉降12 h,取液面下约3 cm的上清液测定TP浓度,比较不同添加量下上清液TP浓度,优选出TP浓度最低时的添加量. 当TP浓度相等时,R添加更少量作为最佳添加量. 实验设置3组平行.
添加方式实验:分别取干重为0.10 g的R原料、R水化体和R絮凝体加入1000 mL的0.10 mg/L磷酸盐溶液中,室温下分别静置0、1、2、5、10、15、24 h,取液面下约3 cm的上清液测定TP浓度,比较不同添加方式下上清液TP浓度,优选出TP浓度最低时的添加方式. 实验设置3组平行.
吸附动力学实验[22-23]:在2个500 mL三角瓶中,分别加入250 mL 1.0 mg/L磷酸盐溶液(低浓度)和5.0 mg/L磷酸盐溶液(高浓度),再分别加入0.025 g的R絮凝体(干重),在25℃下,恒温振荡0、1、3、10、20、40、100、160 min,取样,过0.45 μm滤膜,测定TP浓度,根据吸附前后TP浓度差计算吸附量. 实验设置3组平行.
等温吸附实验[22-23]:分别在一系列150 mL锥形瓶中加入0.01 g R絮凝体(干重)和100 mL 0~5.0 mg/L的磷酸盐溶液,再分别进行以下3种处理:混匀,静置12 h;25℃恒温振荡30 min,静置12 h;25℃恒温振荡60 min,静置12 h. 取上清液测定TP浓度,根据起始浓度与平衡浓度之差,计算吸附量,得到不同处理方式下的等温吸附曲线. 实验设置3组平行.
表征分析实验:分别取R原料、除磷后R水化体(1.0 mg/L磷酸盐溶液中水化12 h得到的水化体)与R絮凝体(1.0 mg/L磷酸盐溶液中水化后pH调为7产生的絮凝体)进行表征. 采用扫描电子显微镜(SEM,日立S4800)观察R 3种状态的表面形态结构,分析其表观形态的变化与差异,以阐释R絮凝体能更好除磷的原因. SEM采用日立S4800分别对水泥原料、水化体和絮凝体进行扫描,水泥原料主要观察其颗粒形态结构,水化体主要观察、寻找棒状、针状等新物质的生成图,絮凝体主要观察其形貌的改变以及水化体中新生成物质的变化. 采用X射线衍射(XRD,D8 ADVANCE)分析物相,探知不同处理方式对物相组成的影响,分析R水化体和絮凝体对磷酸盐去除方式的差异. XRD主要对水泥原料、水化体和絮凝体进行物相变化分析,扫描2θ角度范围为10°~90°,连续扫描,衍射条件Cu靶Ka射线(λ=0.154056 nm),电压40 kV,电流30 mA,步为0.06,扫描速度为10°/min. 扫描结果采用jade6进行分析.
Zeta电位测定:取0.10 g R絮凝体(干重)加入1000 mL去离子水中,调节pH为7.0,25℃恒温条件下,测定水化0、10、20、30、40、50、60、70、80、90、100、110、120 min的水固混合液Zeta电位值. 之后,加入1.0 mL磷酸盐溶液(100 mg/L),混匀,测定反应时间为2、5、8、12、24、36、48 h的水固混合液Zeta电位值,进一步验证R絮凝体的除磷方式. 测定方法参考Elakneswaran等[24]的研究,测定仪器使用Zetasizer Nano-ZS.
R主要成分除磷效果实验:分别取R主要成分碳酸钙、硫铝酸钙、硅酸三钙和石膏0.10 g加入1000 mL磷酸盐溶液(0.10 mg/L)中,静置30 min,调节pH值为7.0,再静置12 h,测定上清液中TP浓度. 实验设置3组平行.
1.3 磷酸盐吸附稳定性试验环境因素如pH、温度、光照、扰动和溶解氧浓度的变化可能会导致被R絮凝体吸附的磷酸盐再次溶出,导致上覆水水质恶化. 因此,以下几组实验旨在研究上述5个环境因素的变化对已被R絮凝体吸附的磷酸盐再次解吸进入上覆水的影响程度.
pH稳定性实验:实验设置6组,分别取1000 mL 0.10 mg/L的磷酸盐溶液和0.10 g R加入1000 mL烧杯中,水化30 min,调节pH为7.0,静置12 h,测定pH并取上清液测定磷酸盐含量,再分别调节pH为5.0、6.0、7.0、8.0、9.0和10.0,静置12 h,用便携式pH计测定pH值并取上清液测定TP浓度. 每次取样后再调节pH到预设值,在室温条件下,连续检测10 d.
温度稳定性实验:实验设置6组,分别取1000 mL 0.10 mg/L的磷酸盐溶液和0.10 g R絮凝体(干重)加入1000 mL烧杯中,分别置于10、15、20、25、30、35℃的恒温培养箱中,静置12 h后取上清液测定TP浓度,连续检测10 d.
光照稳定性实验:实验设置2组,培养箱(宁波乐电仪器制造有限公司,RLD-450B-4)温度调节为25℃、光照强度为6000 lx,分别取1000 mL 0.10 mg/L的磷酸盐溶液和0.10 g R絮凝体(干重)加入1000 mL烧杯中,一组暴露在光下,另一组用锡箔纸避光,静置12 h后取上清液测定TP浓度,连续检测10 d.
扰动稳定性实验:实验设置5组,分别取250 mL 0.10 mg/L的磷酸盐溶液和0.025 g R絮凝体(干重)加入500 mL锥形瓶中,分别置于0、60、100和140 r/min的恒温振荡器(常州荣华仪器制造有限公司,THZ-82)中连续振荡,取样、静置、取上清液测定TP浓度,连续检测10 d.
溶解氧稳定性实验:实验设置2组,分别取1000 mL 0.10 mg/L的磷酸盐溶液和0.10 g R絮凝体(干重)加入1000 mL厌氧培养瓶中,一组实验暴露在空气中,另一组用N2鼓泡法排出水中的溶解氧,直至为0,封口,静置12 h后取上清液测定TP浓度,连续检测10 d. 溶解氧浓度使用便捷式溶解氧测定仪(JPB-607A)测定.
上述实验均设置3组平行.
1.4 水库水除磷实验实际水体成分往往比实验配水复杂,因此除磷剂在实验条件和实际条件中的除磷效果会有差异. 为验证R在实际低浓度磷污染水体中的除磷效果,研究选取磷酸盐轻微超标的水库(四川省内江市某水库)水进行除磷效果评估:分别在原水、过滤后的水(0.45 μm玻璃纤维滤膜)中依次添加0.10、0.50和1.0 g R絮凝体,混匀,静置12 h后取上清液测定水中TP浓度,完成实际除磷效果评估,并基于文献数据进行原材料安全性和经济性分析.
1.5 数据处理与分析使用Origin 2018软件进行数据分析和绘图.
2 结果与讨论 2.1 优选添加量及添加方式分析为了得到最佳的R添加量和最佳添加方式,对不同的R加入量、R添加方式与相应的TP去除率进行分析(图 1). 随着R投加量的增加,TP去除率升高(图 1a). 当添加量为0.05 g/L时,0.11 mg/L磷酸盐可去除98 %;当添加量为0.10 g/L时,磷酸盐小于最低检出浓度(0.01 mg/L),且本研究使用的磷酸盐溶液中,P的浓度为0.1 mg/L,远低于《城镇污水处理厂污染物排放标准》的A类标准(TP浓度为0.5 mg/L),因此,R对低浓度磷也有很好的去除效果.
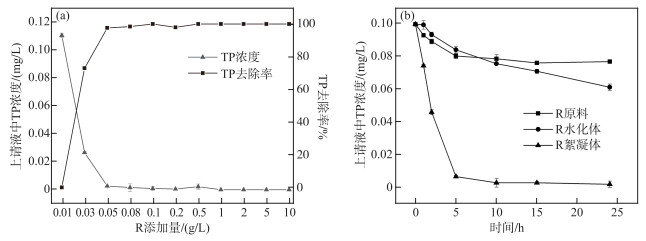
|
图 1 R添加量(a)和添加方式(b)对除磷的影响 Fig.1 Effect of R addition amount (a) and addition mode (b) on phosphorus removal |
静置0~5 h内,添加R絮凝体的实验组溶液中TP去除率更高;静置10~24 h内,溶液中TP浓度保持在约0.002 mg/L(图 1b). 相较于R原料与R水化体实验组,R絮凝体除磷效果更佳.
2.2 除磷机理分析 2.2.1 吸附动力学为探讨R对磷酸盐的吸附速率,本研究对两种不同初始浓度的磷酸盐溶液(1和5 mg/L)进行动力学吸附研究. 从图 2可以看出,在初始pH为7.0时,两种浓度的磷酸盐溶液中R除磷速率均较快,能够实现混匀即达到吸附平衡. 初始磷浓度为1.0 mg/L时,剩余磷酸盐浓度平均为0.30 mg/L,平均去除率为71 %,平均吸附量为7.23 mg/g. 当初始浓度为5.00 mg/L时,平均去除率为51 %,平均吸附量为23.96 mg/g. 采用拟一级和拟二级动力学模型对磷吸附实验数据进行了分析(图 2). 拟合发现伪一级动力学曲线与伪二级动力学曲线重合. 两种初始浓度的反应动力学曲线趋势一致,均呈直线上升再到水平不变,在反应时间为0时出现一个拐点,因此无法用动力学方程式表示. 由两种反应动力学原理分析,该过程中物理、化学吸附同步进行,R与磷酸盐之间形成吸附化学键.
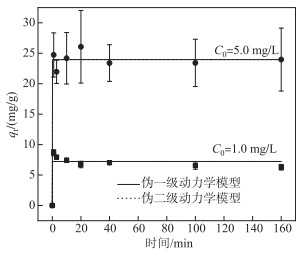
|
图 2 R对磷酸盐的吸附动力学模型(C0为TP初始浓度) Fig.2 Kinetics of phosphate adsorption by R |
根据2.2.1节的分析,R絮凝体在0.5 min内就可以完成对磷酸盐的去除. 为进一步探究R对磷酸盐的吸附特性,研究了混合、摇匀30 min、摇匀60 min 3种情况下的吸附效果. 在初始pH=7.0、R絮凝体添加量为0.10 g/L、磷酸盐初始浓度为0~5 mg/L的条件下,溶液中磷的浓度和平衡吸附量之间的关系如图 3所示. 从图 3中可以看出,R对磷酸盐的吸附量随初始磷酸盐浓度的增加先增加,然后逐渐减缓并趋于稳定. 采用Langmuir模型、Freundlich模型和线性模型对吸附实验数据进行拟合,选取R2最高的模型作为等温吸附模型. 拟合曲线见图 3,拟合参数见表 2.
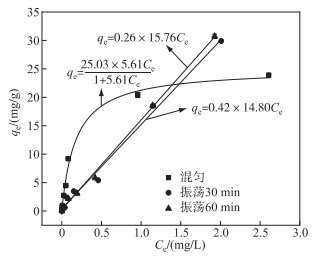
|
图 3 R对磷酸盐的等温吸附曲线(qe为平衡吸附量;Ce为TP平衡浓度) Fig.3 Adsorption kinetics of R adsorption of phosphate |
| 表 2 等温吸附模型拟合方程式与拟合程度* Tab. 2 Fitting equations and fitting parameters of isothermal adsorption models |
从表 2可以看到,在混匀即静置处理实验组数据拟合分析中,相对于Freundlich模型和线性拟合,Langmuir模型相关系数更高,R2为0.9912,对实验数据具有更好的拟合效果,能更好地描述R絮凝体与磷酸盐溶液混合时对磷酸盐的吸附行为,在拟合方程式中可得其最大吸附容量为25.03 mg/g. 在振荡30与60 min处理的实验组中,随着初始磷酸盐浓度的升高,R对磷酸盐的吸附量不断增大,并在初始磷酸盐浓度为5.0 mg/L时吸附容量达最大值,分别为29.90和30.73 mg/g. 其中在振荡30 min实验组中,3种模型拟合R2均达到0.99以上,但线性函数拟合程度相对更高,而振荡60 min实验组中线性函数能更好地描述R絮凝体对磷酸盐的吸附,也可以看作Langmuir和Freundlich模型的开始部分. 实验结果表明,在R与磷酸盐混合初期,反应主要为单层表面吸附,其表面的吸附位相同,被吸附的粒子完全独立. 随着振荡时间的增加,R依然保持絮凝体状态,振荡过程可能暴露更多的吸附位点,随着絮凝体沉降,溶液中更多的磷酸盐被除去,从而使吸附容量增大. 实验过程中,磷酸盐的吸附基本能够在0.5 min内完成,此反应速率比改性硅藻土[25]、镧改性的沸石[26]、PhoslockⓇ[27]等除磷剂快,去除效果亦比较明显,但由后期絮凝体网捕沉淀后,除磷效果增强,即增加水力停留时间,除磷效果更佳.
2.2.3 SEM和XRD分析为分析R水化过程中物相变化以及磷酸盐去除过程,研究了R 3种不同状态下的微观扫描图以及物相,3种状态分别是:R原料、除磷后的R水化体(1.0 mg/L的磷酸盐溶液中水化12 h的状态)与R絮凝体(1.0 mg/L的磷酸盐溶液中水化12 h后,调节pH为7.0时的絮凝体状态).
从XRD衍射图谱可以看出,R原料(图 4a)主要含有硫铝酸钙、石膏和碳酸钙,含有少量硅酸三钙. SEM扫描图 50、10和5 μm观察结果显示,R原料(图 5a~c)呈不规则块状体,相互独立,无物质穿插相连.

|
图 4 3种处理条件下R的XRD衍射图谱: (a)R原料;(b)R水化体;(c)R絮凝体 Fig.4 XRD diffraction patterns of R under three treatment conditions: (a) R raw materials; (b) hydrated R; (c) R floc |

|
图 5 3种处理条件下R的SEM扫描图:(a~c)R原料;(d~f)未呈絮状的R水化体;(g~i)呈絮状的R絮凝体 Fig.5 SEM scans of R under three treatment conditions: (a-c) R raw materials; (d-f) hydrated R; (g-i) R floc |
水化12 h后,XRD衍射图谱(图 4b)中硫铝酸钙衍射峰消失,石膏和碳酸钙衍射峰数增加,新增Ca15(PO4)2(SiO4)6衍射峰. SEM扫描图(图 5d~f)中有棒状和柱状钙矾石(3CaO ·Al2O3 ·3CaSO4 ·32H2O)生成,从分子式可知合成钙矾石的Ca ∶Al ∶S原子比为6 ∶2 ∶3,由R原料质量比例推断,假设反应完全,则有Ca、Al2O3剩余,但水化时水灰比过大(约10000 ∶1),钙矾石生成的反应不能完全进行,会伴有硅酸钙和铝酸钙的水化反应,产生疏松絮状的水化硅/铝酸钙[28-29],与未水化的水泥颗粒物共同构成略显蓬松的混合物. 根据新增的Ca15(PO4)2(SiO4)6衍射峰,结合2.2.1与2.2.2节分析推断,溶液中的PO43-主要与水泥成分中的硅酸三钙发生吸附反应,该反应过程很快完成. 有研究指出硅酸三钙(3CaO·SiO2,简写为C3S)早期水化的水泥浆体可以看成带有表面双电层的固相颗粒的分散体系[30],当C3S与水接触后迅速水解,Ca(OH)2溶出,C3S表面逐渐形成一层凝胶状的半渗透膜,即“富硅”的表面层. 由于Ca2+溶出并分散在水溶液中,该表面层呈负电位,而液相中的反离子Ca2+会因为发生化学吸附而再次附着在表面,使“富硅”表面层外呈正电位[31]. 在磷酸盐溶液中,PO43-带负电位,与“富硅”表面层外呈正电位的Ca2+发生吸附反应,形成硅磷酸钙,因此检测到Ca15(PO4)2(SiO4)6衍射峰.
通过Zeta电位测定实验发现,在0~120 min水化时间段内,水-固混合液Zeta电位随水化时间增加逐渐减小并趋于稳定(图 6). 在0 min时,由于使用HCl调节pH,加入的H+与C3S水化初期溶出的OH-反应,使得混合瞬间C3S表面Ca2+聚集,导致表面Zeta电位呈正值,随着水化的进行,溶出的Ca2+离子分散在水溶液中,C3S表面“富硅”层逐渐加厚,Zeta电位绝对值增大,直至稳定. 该实验进一步证明了磷酸盐被吸附到C3S表面,进而随铝胶体等一同沉淀的结论.
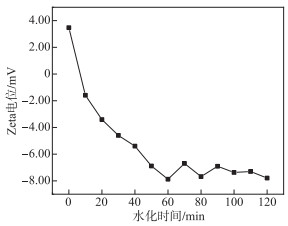
|
图 6 Zeta电位值随水化时间的变化 Fig.6 Zeta potential value changes with hydration time |
水化后用盐酸调节pH至7.0,R由固体颗粒转化为絮凝体. XRD衍射图谱(图 4c)中的主衍射峰是碳酸钙衍射峰,此外检测到两个Ca2SiO4-Ca3(PO4)2衍射峰. SEM图像(图 5j~i)显示,水化形成的棒状钙矾石消失,形成细针状物质(图 5h);混合物处于蓬松多孔状态,相互胶结程度明显高于水化未呈絮状时的胶结程度.
对于钙矾石等消失的原因,从其结构上看,Scholtzová等研究认为,钙矾石的结构式为{Ca6[Al(OH)6]2 · 24H2O}(3SO4)(2H2O),其基本结构单元为{Ca6[Al(OH)6]2 ·24H2O}6+,它是由1个[Al(OH)6]3-八面体和3个钙多面体交替排列的柱状结构,柱间的沟槽有2个水分子和3个SO42-基团,当溶液中H+增加,夺取钙矾石结构中OH-,导致其结构解体,因此钙矾石消失[32].
此外,在本实验pH为5~10的范围内,分散在水体中的铝盐因水解或生成的勃姆石以及三水铝石等再解离形成絮凝体[33],硅酸钙亦同上述分析形成“富硅”层. 随水化后期絮凝体增大,对溶液中离子吸附网捕吸附、沉降压缩,带正电荷的Ca2+会逐渐吸附在“富硅”层表面,形成表面正电位分散层,溶液中的PO43-亦与Ca2+结合,吸附在“富硅”层表面,形成Ca2SiO4-Ca3(PO4)2体系,随着絮凝体沉降,从而将PO43-从溶液中除去.
2.2.4 R主要成分除磷效果为确定R对磷酸盐的去除是综合效应或是某单组分作用,研究对各主要成分的除磷效果进行探究,并与R除磷效果进行对比. 实验结果如图 7所示,R的去除率在99 % 以上,上清液中剩余磷酸盐浓度接近0. R的主要成分中硅酸三钙除磷效果稍好,但去除率也仅为11.2 %,上清液中剩余磷酸盐浓度达0.089 mg/L,碳酸钙、硫铝酸钙和石膏的去除率分别为0、1.9 % 和3.6 %,磷酸盐剩余浓度分别为0.108、0.098和0.096 mg/L. 在相同实验下(室温水化30 min,pH=7.0),除了R形成絮凝体外,其余各成分依然为固体颗粒. 搅拌均匀后,相较于其他成分,R絮凝体沉降较慢,沉降过程可以形成网捕,增加磷酸盐的吸附几率,而其他3种成分,搅拌均匀后立即沉降,在相同实验条件下,这可能是导致其吸附量低的原因之一. 另外,在李振炫等[34]的研究中,方解石(碳酸钙)添加量为25 g/L时,也仅能将初始浓度为0.5 mg/L的磷酸盐去除75 %,其添加量是本研究中的250倍,且其去除条件为偏碱性环境. 同理,低含量的石膏及硫铝酸钙对磷酸盐的去除效率亦较差. 硅酸三钙单独作用虽然有一定效果,但缺乏絮凝体的网捕作用,因此除磷效果不及硫铝酸盐水泥. 综上所述,硫铝酸盐水泥对磷酸盐的去除是各成分综合作用的结果,具体协同增强的机理有待进一步分析.
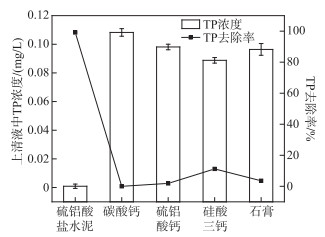
|
图 7 硫铝酸盐水泥及各主要成分除磷效果 Fig.7 Phosphorus removal effect of sulfoaluminate cement and its main components |
结合2.2.3节,从组分变化角度分析可得R絮凝体与PO43-反应的成分主要为硅酸三钙,其占比约为15.74 % (表 1),作用机理为硅酸三钙在水溶液中形成内表面”富硅”、外表面聚集Ca2+的双电层结构体,PO43-与外表面层的Ca2+结合,与双电层共同构成Ca2SiO4-Ca3(PO4)2体系,从而实现PO43-的吸附,再结合Al、Si等形成的絮凝体网捕、压缩、沉淀作用,最终实现磷酸盐的去除.
2.3 除磷稳定性分析根据2.1节分析可知,当R添加量为0.1 mg/L时,对磷酸盐的去除效果最好,R添加方式为絮凝体时磷酸盐的去除率最高. 因此,为了更好地探索环境因素对磷酸盐溶出的影响,研究其环境稳定性,后续实验选择0.10 g/L的R添加比例,选择的R添加形态为R絮凝体.
2.3.1 pH对磷酸盐去除效果的稳定性分析为了探索pH值对除磷效果的影响,研究分析了pH为5.0~10.0范围内的上覆水中磷酸盐的浓度变化. 如图 8a所示,第1天所测数据为pH值=7.0时的磷酸盐浓度值,该条件下磷酸盐浓度在0~0.012 mg/L范围内. 此后,调节pH到预设值,上清液中磷酸盐浓度随着pH值的变化而改变. 当pH值为10.0时,R由松散絮状体回到初始的固体颗粒状态,与pH值为7.0时相比,相对应的磷酸盐溶出极其显著(P < 0.0001),溶出最高值达0.075 mg/L,去除率仅有25 %. pH值为9.0时,R呈半固体颗粒半絮凝体状态,其磷酸盐溶出量仅次于pH值为10.0的试验组,与pH=7.0组相比,差异性依然非常显著(P < 0.001),但其最高溶出浓度仅为0.03 mg/L,去除率达60 %;pH值为5.0~8.0时,溶液中R均呈絮状体,上清液中磷酸盐浓度在0.01 mg/L范围内,去除率在90 % 以上,与pH=7.0组无显著性差异(P>0.05).

|
图 8 pH(a)、温度(b)、光照(c)、扰动(d)和溶解氧(e)对溶解磷酸盐浓度的影响 Fig.8 Effect of pH (a), temperature (b), illumination (c), perturbation (d) and dissolved oxygen (e) on the dissolved phosphate concentration |
有研究指出,在碱性pH下,水溶液中的羟基会与磷酸根离子竞争吸附剂上的表面吸附位点,导致磷酸根结合效率降低,因此,磷酸盐吸附通常随着溶液pH值的增加而下降[16]. 也有研究指出,当pH升高时.吸附剂的Zeta电位通常会下降. 从而导致材料与带负电的磷酸根阴离子之间的静电吸引受到阻碍[35-36].在2.2.3节分析中,钙矾石的结构组成中OH-占比较大,因而当溶液中pH值增加时,碱度增加,絮凝体中的Al、Ca、S等元素重新组合,形成钙矾石等物质,根据钙矾石溶度积(式(1))[30],其值为2.80×10-45,比磷酸钙溶度积小. pH值升高时,原与Ca2+结合的磷酸盐被重新释放进入上清液,而絮状体亦随pH值的增加逐渐变为固体. 因此,实验观察到pH值为9.0时,部分絮凝体变成固体颗粒,pH值为10.0时,全部絮凝体变成固体颗粒. 综上,证实了pH对R磷酸盐去除效果的影响更多的是通过羟基与磷酸根离子竞争吸附位点实现的. 实验过程中,上清液中磷酸盐浓度波动,这主要是由于每天加酸进行pH调节带来酸碱度波动.
| $ {K_{{\rm{sp}}}}{\rm{ = }}{\left( {{\rm{C}}{{\rm{a}}^{2 + }}} \right)^6} \cdot {\left( {{\rm{Al}}\left( {{\rm{OH}}} \right)_2^ - } \right)^2} \cdot {\left( {{\rm{SO}}_4^{2 - }} \right)^3} \cdot {\left( {{\rm{O}}{{\rm{H}}^ - }} \right)^4} = 2.80 \times {10^{ - 45}} $ | (1) |
温度是影响水质指标的重要因素,水温的升高也是引起水体富营养化的重要原因之一. 有研究发现随着温度的升高,溶液中FePO4、AlPO4和Ca3(PO4)2的浓度增加,磷酸盐吸附量增加[37]. 因此,本研究将对不同温度下磷酸盐的溶出进行分析,探究不同温度对已被R絮凝体吸附的磷酸盐再次溶出的影响. 磷酸盐溶出浓度与温度的关系如图 8b所示. 在10~35℃范围内,上清液中磷酸盐最高浓度为0.025 mg/L,最低去除率为75 %,该浓度值在湖库Ⅱ类水质(TP浓度为0.025 mg/L) 范围内. 在25~35℃温度范围内,R添加初期磷酸盐浓度较高,但随着沉淀时间的增加,磷酸盐浓度逐渐降低. 后期在实验温度范围内上清液中磷酸盐浓度保持在0.01 mg/L以内,去除率在90 % 以上,可以保持湖库Ⅰ类水质标准(TP浓度为0.01 mg/L). 吸附机理决定了环境温度变化对吸附剂吸附效果的影响. 一种情况是随温度升高,离子交换能力增强的化学吸附,另一种是随温度升高,吸附能力降低的物理吸附. 在10~35℃范围内,随温度的升高,磷酸盐的去除率增大,进一步证实了磷的去除是由于R絮凝体与磷酸盐之间的化学吸附作用. Wi s ' niewska指出,温度变化引起大分子的线性尺寸的变化,这将影响胶体的稳定系统[38]. 在实验后期,10~35℃的温度下除磷效果更好,上清液中磷酸盐的浓度波动较小. 结果表明,絮凝体R在除磷后期可以保持较低的磷酸盐浓度,且除磷效果不受环境温度的影响.
2.3.3 光照对磷酸盐去除效果的稳定性分析光照是影响水质指标的另一个重要因素,它会影响水生植物的生长,一些光催化物质和离子活性也会受其影响. Smolders等研究认为,沉积物顶层的氧化可以通过增加沉积物表面的光照水平来实现[39]. 在其研究实验中,光照强度的增加导致底栖藻类在沉积物表面上生长,这些藻类产生的氧气使得沉积物顶层氧化,从而导致硫化铁化合物氧化,结果,顶层中的可还原铁浓度增加,PO43-在该层中的结合更有效,因此PO43-向上覆水的释放减少. Gerhardt等研究中也指出,沉积物会随着光强度和水力条件发生动态变化,根据沉积物的结构和成分,光甚至可以穿透至沉积物中几毫米,导致更深层次沉积物的氧化增强[40]. 因此,本研究对光照的影响进行探索,光照强度采用6000 lx. 如图 8c所示,上清液中磷酸盐浓度最高为0.004 mg/L,最低去除率为99 %,说明在光照或黑暗条件下磷酸盐浓度均可保持在较低水平:去除率在99 % 以上,两组数据间无显著差异(P>0.05). 因此,光对R的除磷效果没有影响.
2.3.4 扰动对磷酸盐去除影响的稳定性分析扰动会导致底泥-水界面的特征变化,引起营养盐的迁移转化[41]. Fan等模拟了太湖梅梁湾的风速扰动,指出常见的4个平均风速范围分别为0~1、2~4、5~7和≥8 m/s,对应的振荡速率分别为0、60、100和140 r/min[42]. 本研究中,按此振荡速率探究扰动对R吸附磷酸盐的稳定性影响. 如图 8d所示,在0~60 r/min振荡速率范围内,上清液中磷酸盐浓度保持在0.005 mg/L以内,去除率保持在95 % 以上;当振荡速度为100 r/min时,上清液中磷酸盐浓度最高为0.031 mg/L,与静水条件相比,溶出显著(P < 0.05);当振荡速度为140 r/min时,上清液中磷酸盐最高浓度为0.039 mg/L,溶出极为显著(P < 0.0001). 但在检测的10 d范围内,磷酸盐指标仍保持在湖库Ⅲ类水以内,去除率在50 % 以上. 实验观察到0~60 r/min的实验组底部逐渐形成一层膜,低速振荡不会破坏这层膜,振荡速度为100 r/min时,膜碎块化,140 r/min时,无法成膜. 实验在结束时测得pH值分别为7.5、7.7、8.0和8.3,这可能是由于硅酸三钙水化时释放Ca(OH)2[43],使得溶液pH值升高. 由2.3.1节分析可知,随着pH值升高,吸附的磷酸盐重新释放进入水体.
2.3.5 溶解氧对磷酸盐去除稳定性的影响沉积物-水界面溶解氧的缺乏会促进以Fe(Ⅲ)为最终受体的无氧呼吸,从而增强Fe(Ⅲ)(氢)氧化物的还原溶解和随后的PO43-的释放[44]. 为探究无氧环境磷酸盐释放情况,本研究设计两组实验,即自然条件下(溶解氧浓度值约为7.5 mg/L)与溶解氧为0 mg/L条件下的磷酸盐释放情况. 如图 8e所示,第1天所测的两组磷酸盐浓度值为自然溶解氧条件下的检测值,第2~11天分别将两组实验的溶解氧设置为自然溶解氧条件与溶解氧为0 mg/L条件. 从图 8e可知,在检测时间段内,两组实验上清液中磷酸盐浓度均保持为0 mg/L,随时间变化,磷酸盐并未溶出. 因此表明,R絮凝体所吸附的磷酸盐不会因溶解氧降为0 mg/L而溶出,该吸附剂对磷酸盐溶解氧稳定性较好.
2.4 湖泊/水库水体除磷效果四川省内江市某水库水源有效蓄水能力约为1700万m3,主要用于供水和灌溉. 水库为轻度污染,TP值超出湖库Ⅲ类标准58 % (表 3). 从磷酸盐去除结果(表 4)可以看到,在添加0.10 g/L R和将pH值调整到7.0后,未过滤处理的实验组上清液TP浓度为0.048 mg/L,达到了湖库水源地Ⅲ类标准要求(TP为0.05 mg/L),而经过过滤处理的实验组磷浓度低于湖泊/水库的Ⅰ类界限(TP为0.01 mg/L). 当R浓度分别增加到0.50和1.00 g/L时,未过滤原水TP去除率超过97 %,上清液TP浓度接近0 mg/L. 过滤后,去除率为100 %,除磷效果明显. 相比于实验准备的溶液,在实际水体中去除相同浓度的磷酸盐时需要更多的R. 从过滤前后的除磷效果来看,过滤后使用R除磷更有效,磷去除率提高26 % 以上. 结果表明水体中悬浮物质对R的除磷效果有很大影响,此结果在Cai等[41]对磁性生物炭除磷的研究中也有体现. 另外,由于水体有机质通常带有负电荷,会与PO43-竞争吸附而占用带正电荷的Ca2+吸附位点,进而影响PO43-的吸附,这一点在Lürling等[45]的研究中有所验证. 与实验配制水相比,即使过滤后的水库水,R的除磷效率依然有所下降,在Reitzel等[46]对锁磷剂(PhoslockⓇ)的除磷研究中也体现了这一点. 在实际水库水中,即使过滤除去悬浮的有机质,但依然存留不可过滤的有机质,如部分腐殖酸等,这些有机质依然会与PO43-竞争占据吸附位点,导致去除相同浓度的磷酸盐时需要更多的R.
| 表 3 四川省内江市某水库水质指标 Tab. 3 Water quality indicators of a reservoir in Neijiang City, Sichuan Province |
| 表 4 不同R添加量对湖泊除磷效果的影响 Tab. 4 Effect of different addition amounts of R on phosphorus removal from a lake |
目前R已经广泛应用于各种涉水工程及其他建筑工程,并且在实施过程中并未发现由R带来的水生态环境危害. 从材料安全性考虑,R絮凝体的主要成分硫铝酸钙、石膏、碳酸钙及硅酸三钙,均对生态安全没有威胁性. 且除磷是各成分综合作用的结果,其添加量少,按0.10 g/L的添加量计算,水泥中Fe3+、Al3+和SO42-溶出值不超过《生活饮用水卫生标准》(GB 5749-2006)限值(铁为0.3 mg/L,铝为0.2 mg/L,硫酸盐为250 mg/L).
2.6 材料经济性分析我国具有丰富的水泥市场,年水泥生产量居世界前列,因此原材料来源广泛. 研究所用的硫铝酸盐水泥,其市场价约为800元/t,根据2.1节研究核算,按R添加量为0.03~0.10 g/L计算,除磷原材料成本在0.024~0.08元/t之间,与其他除磷剂成本(表 5)相比,硫铝酸盐水泥成本较优.
| 表 5 常用吸附剂除磷成本 Tab. 5 Cost of common adsorbent phosphorus removal |
由于R絮凝体对磷酸盐具有高亲和性,并且对磷酸盐有较大的吸附量,因此在高浓度及低浓度磷污染水体中均具有很好的应用潜力. 在各类污水处理厂等集中式污水处理工程中,可通过分离上清液和沉积物回收吸附磷酸盐后的R絮凝体,再通过调高pH(>10)和增强扰动(>100 r/min),使絮凝态的R转变为颗粒态,使吸附的磷酸盐溶出,从而达到回收磷酸盐的目的.
因此,硫铝酸盐水泥不仅具有很好的安全性,从原材料成本对比以及由R絮凝体吸附的磷酸盐具有可回收性来看,它还具有很好的经济性和实用性,在水体磷去除领域具有很好的利用前景.
3 结论絮凝态R是除磷效果最好的形态. R絮凝体(0.10 g/L,干重)对低浓度磷(P浓度为0.1 mg/L)的去除率达到了90 % 以上. 除磷速度快,固液混合后0.5 min内即可达到反应平衡. SEM和XRD分析表明,在R絮凝体中形成棒状和柱状钙矾石,并伴有松散的铝酸钙和硅酸钙. PO43-吸附在C3S表面,形成Ca2SiO4-Ca3(PO4)2体系,其除磷效果是各成分综合作用的结果.
R除磷后絮凝体稳定性高. 当pH为5.0~8.0范围内,TP浓度在10 d内低于0.01 mg/L. 温度、光照和溶解氧对除磷没有影响. 在低强度扰动下(< 60 r/min),TP浓度保持在0.01 mg/L以内;在100~140 r/min的扰动强度下,吸附的磷酸盐部分溶解. 在实际水库中,需要更多的R絮凝体(0.50 g/L)才能达到同样的效果,过滤后除磷效果更好.
R絮凝体对生态安全不构成威胁,对环境友好,具有较好的应用前景. 然而,实际水体的组成很复杂,这种材料的应用需要进一步优化,同时也需要进一步开发应用工艺与相关设备.
| [1] |
Sinha E, Michalak AM, Balaji V. Eutrophication will increase during the 21st century as a result of precipitation changes. Science, 2017, 357(6349): 405-408. DOI:10.1126/science.aan2409 |
| [2] |
Nyenje PM, Foppen JW, Uhlenbrook S et al. Eutrophication and nutrient release in urban areas of sub-Saharan Africa—A review. Science of the Total Environment, 2010, 408(3): 447-455. DOI:10.1016/j.scitotenv.2009.10.020 |
| [3] |
Alamgir A, Fatima N, Khan MA et al. A preliminary pollution appraisal of western backwater at Karachi Coastal area. Applied Water Science, 2019, 9(7): 1-6. DOI:10.1007/s13201-019-1049-y |
| [4] |
Carpenter SR. Eutrophication of aquatic ecosystems: Bistability and soil phosphorus. PNAS, 2005, 102(29): 10002-10005. DOI:10.1073/pnas.0503959102 |
| [5] |
Conley DJ, Paerl HW, Howarth RW et al. Controlling eutrophication: Nitrogen and phosphorus. Science, 2009, 323(5917): 1014-1015. DOI:10.1126/science.1167755 |
| [6] |
Sarwar M, Leichner J, Naja GM et al. Smart-phone, paper-based fluorescent sensor for ultra-low inorganic phosphate detection in environmental samples. Microsystems & Nanoengineering, 2019, 5: 56. DOI:10.1038/s41378-019-0096-8 |
| [7] |
Schelske CL. Eutrophication: focus on phosphorus. Science, 2009, 324(5928): 722. DOI:10.1126/science.324_722 |
| [8] |
Yao Y, Gao B, Chen JJ et al. Engineered biochar reclaiming phosphate from aqueous solutions: Mechanisms and potential application as a slow-release fertilizer. Environmental Science & Technology, 2013, 47(15): 8700-8708. DOI:10.1021/es4012977 |
| [9] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [10] |
Schindler DW, Carpenter SR, Chapra SC et al. Reducing phosphorus to curb lake eutrophication is a success. Environmental Science & Technology, 2016, 50(17): 8923-8929. DOI:10.1021/acs.est.6b02204 |
| [11] |
Carpenter SR. Phosphorus control is critical to mitigating eutrophication. PNAS, 2008, 105(32): 11039-11040. DOI:10.1073/pnas.0806112105 |
| [12] |
Correll D. Phosphorus: a rate limiting nutrient in surface waters. Poultry Science, 1999, 78(5): 674-682. DOI:10.1093/ps/78.5.674 |
| [13] |
Bunce JT, Ndam E, Ofiteru ID et al. A review of phosphorus removal technologies and their applicability to small-scale domestic wastewater treatment systems. Frontiers in Environmental Science, 2018, 6: 8. DOI:10.3389/fenvs.2018.00008 |
| [14] |
Ramasahayam SK, Guzman L, Gunawan G et al. A comprehensive review of phosphorus removal technologies and processes. Journal of Macromolecular Science, Part A, 2014, 51(6): 538-545. DOI:10.1080/10601325.2014.906271 |
| [15] |
Li H, Ru JY, Yin W et al. Removal of phosphate from polluted water by lanthanum doped vesuvianite. Journal of Hazardous Materials, 2009, 168(1): 326-330. DOI:10.1016/j.jhazmat.2009.02.025 |
| [16] |
Liu RT, Chi LN, Wang XZ et al. Review of metal (hydr)oxide and other adsorptive materials for phosphate removal from water. Journal of Environmental Chemical Engineering, 2018, 6(4): 5269-5286. DOI:10.1016/j.jece.2018.08.008 |
| [17] |
Xie J, Lai L, Lin LD et al. Phosphate removal from water by a novel zeolite/lanthanum hydroxide hybrid material prepared from coal fly ash. Journal of Environmental Science and Health, Part A, 2015, 50(12): 1298-1305. DOI:10.1080/10934529.2015.1055159 |
| [18] |
Huang WY, Zhang YM, Li D. Adsorptive removal of phosphate from water using mesoporous materials: A review. Journal of Environmental Management, 2017, 193: 470-482. DOI:10.1016/j.jenvman.2017.02.030 |
| [19] |
Collins KD, Neilson GW, Enderby JE. Ions in water: Characterizing the forces that control chemical processes and biological structure. Biophysical Chemistry, 2007, 128(2/3): 95-104. DOI:10.1016/j.bpc.2007.03.009 |
| [20] |
Aranda MAG, de la Torre AG eds. Sulfoaluminate cement. Cambridge: Woodhead Publishing, 2013: 488-522. DOI: 10.1533/9780857098993.4.488.
|
| [21] |
Editorial board of "Monitoring and analysis methods of water and wastewater", Ministry of Environmental Protection of the People's Republic of China. Monitoring and analysis methods of water and wastewater: fourth edition. Beijing: China Environmental Science Press, 2002: 243-257. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002: 243-257.]
|
| [22] |
Hou QJ, Meng PP, Pei HY et al. Phosphorus adsorption characteristics of alum sludge: Adsorption capacity and the forms of phosphorus retained in alum sludge. Materials Letters, 2018, 229: 31-35. DOI:10.1016/j.matlet.2018.06.102 |
| [23] |
Yoon SY, Lee CG, Park JA et al. Kinetic, equilibrium and thermodynamic studies for phosphate adsorption to magnetic iron oxide nanoparticles. Chemical Engineering Journal, 2014, 236: 341-347. DOI:10.1016/j.cej.2013.09.053 |
| [24] |
Elakneswaran Y, Nawa T, Kurumisawa K. Zeta potential study of paste blends with slag. Cement and Concrete Composites, 2009, 31(1): 72-76. DOI:10.1016/j.cemconcomp.2008.09.007 |
| [25] |
Wu L, Chen Y. Research on phosphorus removal from Chao Lake water with modified diatomite. Chinese Journal of Environmental Engineering, 2011, 5(4): 777-782. [吴蕾, 陈云峰. 改性硅藻土用于巢湖水脱磷研究. 环境工程学报, 2011, 5(4): 777-782. DOI:10.3724/SP.J.1011.2011.00468] |
| [26] |
He YH, Lin H, Dong YB et al. Simultaneous removal of ammonium and phosphate by alkaline-activated and lanthanum-impregnated zeolite. Chemosphere, 2016, 164: 387-395. DOI:10.1016/j.chemosphere.2016.08.110 |
| [27] |
Chen XY, Liu JX, Su YP et al. Study on effect of adsorption comparative of two kinds of phosphorus locking agent. Journal of Fujian Normal University: Natural Science Edition, 2016, 32(4): 56-60. [陈小燕, 刘键熙, 苏玉萍等. 两种锁磷剂锁磷效果对比研究. 福建师范大学学报: 自然科学版, 2016, 32(4): 56-60.] |
| [28] |
Liao GS, Xu L, Liao YS. Influence of silica fume on the hydration behavior of calcium sulphoaluminate cement. Journal of Building Materials, 2017, 20(6): 840-845. [廖国胜, 徐路, 廖宜顺. 硅灰对硫铝酸盐水泥水化行为的影响机理. 建筑材料学报, 2017, 20(6): 840-845. DOI:10.3969/j.issn.1007-9629.2017.06.003] |
| [29] |
Yu Y, Shen CJ, Sun S et al. Sulfate corrosion behavior of slag cement mortar. Corrosion Science and Protection Technology, 2014, 26(4): 355-359. [余洋, 沈承金, 孙恕等. 矿粉水泥砂浆抗硫酸盐腐蚀行为研究. 腐蚀科学与防护技术, 2014, 26(4): 355-359. DOI:10.11903/1002.6495.2013.205] |
| [30] |
Shen AQ, Zhang DL. Cement and cement concrete. Beijing: China Communications Press, 2000. [申爱琴, 张登良. 水泥与水泥混凝土. 北京: 人民交通出版社, 2000.]
|
| [31] |
Tadros ME, Skalny J, Kalyoncu RS. Early hydration of tricalcium silicate. Journal of the American Ceramic Society, 1976, 59(7/8): 344-347. DOI:10.1111/j.1151-2916.1976.tb10980.x |
| [32] |
Scholtzová E, Kucková L, Kožíšek J et al. Structural and spectroscopic characterization of ettringite mineral -combined DFT and experimental study. Journal of Molecular Structure, 2015, 1100: 215-224. DOI:10.1016/j.molstruc.2015.06.075 |
| [33] |
Zhao H, Liu HJ, Qu JH. Effect of pH on the aluminum salts hydrolysis during coagulation process: Formation and decomposition of polymeric aluminum species. Journal of Colloid and Interface Science, 2009, 330(1): 105-112. DOI:10.1016/j.jcis.2008.10.020 |
| [34] |
Li ZX, Diao JY, Huang LD et al. Removal of phosphate by calcite in open-system. Environmental Science, 2015, 36(12): 4523-4530. [李振炫, 刁家勇, 黄利东等. 开放系统下方解石对磷的去除. 环境科学, 2015, 36(12): 4523-4530. DOI:10.13227/j.hjkx.2015.12.026] |
| [35] |
Wang N, Feng JT, Chen J et al. Adsorption mechanism of phosphate by polyaniline/TiO2 composite from wastewater. Chemical Engineering Journal, 2017, 316: 33-40. DOI:10.1016/j.cej.2017.01.066 |
| [36] |
Xu R, Zhang MY, Mortimer RJG et al. Enhanced phosphorus locking by novel lanthanum/aluminum-hydroxide composite: Implications for eutrophication control. Environmental Science & Technology, 2017, 51(6): 3418-3425. DOI:10.1021/acs.est.6b05623 |
| [37] |
Xiong JB, He ZL, Mahmood Q et al. Phosphate removal from solution using steel slag through magnetic separation. Journal of Hazardous Materials, 2008, 152(1): 211-215. DOI:10.1016/j.jhazmat.2007.06.103 |
| [38] |
Wiśniewska M. The temperature effect on the adsorption mechanism of polyacrylamide on the silica surface and its stability. Applied Surface Science, 2012, 258(7): 3094-3101. DOI:10.1016/j.apsusc.2011.11.044 |
| [39] |
Smolders AJP, Lamers LPM, Lucassen ECHET et al. Internal eutrophication: How it works and what to do about it—a review. Chemistry and Ecology, 2006, 22(2): 93-111. DOI:10.1080/02757540600579730 |
| [40] |
Gerhardt S, Boos K, Schink B. Uptake and release of phosphate by littoral sediment of a freshwater lake under the influence of light or mechanical perturbation. Journal of Limnology, 2010, 69(1): 54. DOI:10.4081/jlimnol.2010.54 |
| [41] |
Cai SZ, Li DP, Tang XY et al. Distribution of external phosphorus in the sedimentary phosphorus forms under different disturbances. Environmental Science, 2017, 38(11): 4607-4614. DOI:10.13227/j.hjkx.201704166 |
| [42] |
Fan CX, Zhang L, Qin BQ et al. Estimation on dynamic release of phosphorus from wind-induced suspended particulate matter in Lake Taihu. Science in China Series D: Earth Sciences, 2004, 47(8): 710-719. DOI:10.1360/02yd0438 |
| [43] |
Shen Y, Zhang W, Chen X et al. Research progress of sulfoaluminate cement modification. Bulletin of the Chinese Ceramic Society, 2019, 38(3): 683-687. [沈燕, 张伟, 陈玺等. 硫铝酸盐水泥改性的研究进展. 硅酸盐通报, 2019, 38(3): 683-687.] |
| [44] |
Li YC, Yu S, Strong J et al. Are the biogeochemical cycles of carbon, nitrogen, sulfur, and phosphorus driven by the "FeⅢ-FeⅡ redox wheel" in dynamic redox environments?. Journal of Soils and Sediments, 2012, 12(5): 683-693. DOI:10.1007/s11368-012-0507-z |
| [45] |
Lürling M, Waajen G, van Oosterhout F. Humic substances interfere with phosphate removal by lanthanum modified clay in controlling eutrophication. Water Research, 2014, 54: 78-88. DOI:10.1016/j.watres.2014.01.059 |
| [46] |
Reitzel K, Andersen FØ, Egemose S et al. Phosphate adsorption by lanthanum modified bentonite clay in fresh and brackish water. Water Research, 2013, 47(8): 2787-2796. DOI:10.1016/j.watres.2013.02.051 |
| [47] |
Zheng XY, Li N, Qiu LJ et al. Advanced phosphorus removal from the second effluent of municipal sewage treatment plant. Chinese Journal of Environmental Engineering, 2019, 13(8): 1839-1846. [郑晓英, 李楠, 邱丽佳等. 城市污水处理厂二级处理出水中磷深度去除技术. 环境工程学报, 2019, 13(8): 1839-1846. DOI:10.12030/j.cjee.201811003] |
| [48] |
Wang H, Ma WF, Zeng FG. Study on the optimization of dephosphorization with several kinds of inorganic flocculants and advanced purification of sewage. Industrial Water Treatment, 2012, 32(4): 46-48. [汪辉, 马伟芳, 曾凡刚. 几种无机混凝剂除磷优化及污水深度净化研究. 工业水处理, 2012, 32(4): 46-48. DOI:10.3969/j.issn.1005-829X.2012.04.013] |
| [49] |
Wang XD, Zhang DQ, Liu Y et al. Study on removal of phosphorus from eutrophic water using phoslock. China Water & Wastewater, 2010, 26(23): 88-90. [王秀朵, 张大群, 刘瑶等. 锁磷剂用于富营养化水体除磷的研究. 中国给水排水, 2010, 26(23): 88-90. DOI:10.19853/j.zgjsps.1000-4602.2010.23.027] |
 2022, Vol. 34
2022, Vol. 34 

