(2: 贵州喀斯特环境生态系统教育部野外科学观测研究站, 贵阳 550025)
(2: Guizhou Karst Environmental Ecosystems Observation and Research Station, Ministry of Education, Guiyang 550025, P.R.China)
甲烷是仅次于二氧化碳的第二大温室气体,在大气中的含量呈现出快速增长的趋势[1]. 大气中甲烷的来源主要有两大途径,即自然源和人为源. 据估计,全球生态系统每年向大气中释放的甲烷总量约为500~600 Tg[2]. 湿地是一种被人们称为“地球之肾”的生态系统,国际《湿地公约》(拉姆萨尔公约)将湿地定义为:天然或人工,长久或暂时的沼泽地、湿原、泥炭地或水域地带,静止或流动,淡水或半咸水体,包括低潮时不超过6 m的水域[3]. 而贵州草海湖泊最大水深5.0 m,平均水深2.4 m[4],属于天然的淡水湖泊湿地[5],其在保护生态环境及维持生物多样性等方面可发挥重要作用[6]. 虽然全球湿地面积仅占全球陆地总面积的5%~8%,但湿地所释放出的甲烷量却约占全球甲烷排放总量的30%[7-8],这是由于湿地中存在植物根系代谢物或植物残体,这些物质会变成产甲烷微生物的底物,从而为甲烷的产生创造有利条件.
甲烷氧化菌是目前研究得较为成熟的一类功能细菌群[9],其可作为湿地生态系统中重要的生物过滤器,能够利用甲烷作为其唯一碳源和能源进行生长[10]. Hornibrook等[11]研究了湿地有氧土层中甲烷氧化菌氧化甲烷的能力,发现其可以消耗掉自然湿地产出的90%的甲烷. 因此,甲烷氧化菌对于大气甲烷的收支平衡及稳定大气中甲烷浓度具有十分重要的作用. 英国[12]、俄罗斯[13]以及欧洲大陆[14-15]的许多研究者们对湿地中甲烷氧化菌的多样性进行了研究. 国内对湿地甲烷氧化菌的研究起步较晚,但近几年来关于国内湿地中甲烷氧化菌的研究也取得了许多进展. 例如:Deng等[16]研究了青藏高原泥炭湿地中的甲烷氧化菌的多样性,发现Methylocystis是该地区甲烷氧化菌的优势菌种;Yun等[17]研究了东北松宁平原向海湿地沉积物中的甲烷氧化菌,并获得了该地区甲烷氧化菌多样性和丰度分布的第一个数据集;Liu等[18]研究了中国某富营养化湿地中的挺水植物中TypeⅠ型甲烷氧化菌的特性,发现该类甲烷氧化菌有望在富营养化湿地的碳、氮循环中发挥重要作用. 由此可知,目前对湿地中甲烷氧化菌的研究主要集中在基于16S rRNA测序和qPCR等技术上的微生物群落多样性、丰度及分布特征等方面,而对甲烷氧化菌的功能基因和代谢功能方面的研究较少,尤其是对环境样品中的甲烷氧化菌的种类与功能的相关性方面,鲜见报道. 因此,基于宏基因组学技术,以贵州草海的浅水沼泽、莎草湿地、深水沉积物为研究对象,对不同类型湿地中甲烷氧化菌的群落特征进行研究,并结合功能基因、代谢功能、物种与功能的相关性和关键环境因子进行分析,为进一步理解高原湿地中的物质循环及减缓温室效应提供理论依据,同时为保护湿地、了解及开发湿地微生物资源提供理论参考.
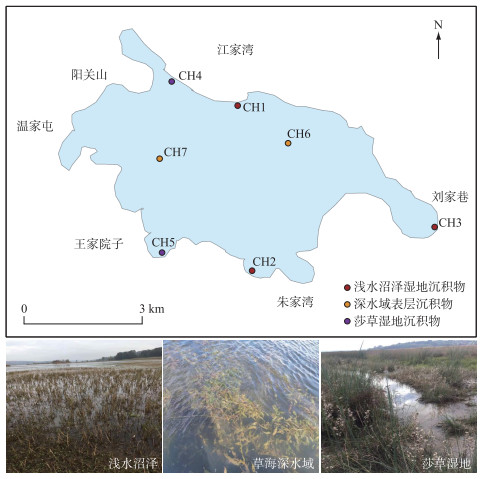
1 材料与方法 1.1 研究区域概况及样品的采集草海(26°47′32″~26°52′52″N,104°10′16″~104°20′40″E)是由喀斯特盆地积水发育而形成的一个完整的、典型的喀斯特高原湿地生态系统,也是地球上同纬度地区中为数不多的高原天然淡水湖泊. 地处云贵高原中部乌蒙山脉腹地,位于中国贵州省西北边缘,威宁彝族回族苗族自治县县城西南侧,面积96 km2,其中水域面积25 km2,湖面海拔2171.7 m. 草海因水草丰茂而得名,是贵州省最大的天然高原淡水湖泊,同时也是中国面积最大的岩溶构造湖,素有“高原明珠”之称.
于2020年10月下旬,在草海湿地中的浅水沼泽、莎草湿地及深水域进行采样(图 1),每个样点选取0.3 m×0.3 m作为1个样方,每个样方内随机采集2~3个点样品,采集0~10 cm的表层沉积物,然后将其进行混合,共7个样品,其中,浅水沼泽样品3个,莎草湿地样品2个、深水域沉积物2个. 每个样品分为2份,一份装入50 mL灭菌离心管后立即放入干冰桶(-80℃)中,用于宏基因组分析;另一份装入自封袋中,冷藏带回实验室,用于理化指标分析.
|
图 1 草海采样点分布 Fig.1 Distribution of sampling sites in Lake Caohai |
上覆水pH、氧化还原电位(ORP)采用便携式多参数测定仪进行现场测量. 沉积物根据贺蓓等[19]的方法分析pH值和电导率(EC),将沉积物与水按5 ∶1的比例混合后,采用HACH多参数数字化分析仪(HQ40d)进行测量;总氮(TN)采用《土壤质量全氮的测定凯氏法(HJ717—2014)》进行分析;总磷(TP)采用《土壤总磷的测定碱熔-钼锑抗分光光度法(HJ 632—2011)》进行分析;有机质(SOM)参考鲍士旦《土壤农化分析(第三版)》重铬酸钾法进行分析;根据杨叶琴等[20]的方法利用离子色谱(ICS-1100)分析阴离子种类和浓度.
1.3 宏基因组分析将采集的沉积物送至上海美吉生物医药科技有限公司,采用Fast DNA SPIN Kit for Soil试剂盒(MP bio, CA, USA)对DNA进行抽提,利用NanoDrop2000法和Quantus Fluorometer法分别检验DNA的纯度和浓度,利用1%的琼脂糖胶对DNA的完整性进行检测,然后将检测合格并纯化后的片段进行剪切(约400 bp)、接头连接,并使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集,磁珠回收PCR产物得到最终文库. 完成文库构建后进行桥式PCR,最后在IlluminaNovaSeq 6000平台进行高通量测序. 测序后使用fastp进行质量数据控制,然后将不同测序深度序列使用Megahit软件[21]进行拼接组装,使用MetaGene[22]对拼接结果中的contigs进行ORF预测,并将其翻译为氨基酸序列. 使用CD-HIT软件[23]将所有样品中预测出来的基因序列进行聚类(默认参数为:90% identity, 90% coverage),构建非冗余基因集. 使用BLASTP[24]将非冗余基因集与NR数据库(BLAST比对参数设置期望值(e-value)为1×10-5),以获得各个分类学水平上物种在各个样本中的丰度;使用KOBAS2.0[25]进行KEGG功能注释,然后基于KO、Pathway、EC(酶通路)、Module对应的基因丰度总和计算该功能类别的丰度.
1.4 数据分析本文基于物种类型共建立两个基因集:一是草海细菌基因集,该基因集包含本研究样本中的所有细菌的基因,用于分析草海整体细菌群落结构;二是草海甲烷氧化菌基因集,该基因集仅包含本研究样本中甲烷氧化菌的基因,且本文对甲烷氧化菌所进行的分析均基于草海甲烷氧化菌基因集. 基于R语言对样本进行PCoA(principal co-ordinates analysis)分析,基于Python软件的Networkx工具包,构建物种与功能的相关性网络图.
2 结果与分析 2.1 沉积物理化指标草海湿地上覆水及沉积物的理化性质如表 1所示,草海湿地上覆水的pH在5.93~8.87之间,平均值为7.81,总体上呈弱碱性. ORP在135.1~176.1 mV之间. 沉积物pH在5.65~7.78之间,平均值为6.94,总体上呈中性. EC为157.1~718.0 μS/cm,TN含量为909.37~7133.62 mg/kg,总磷含量为159.11~290.74 mg/kg,SOM含量为20.39~101.98 g/kg. 采样点CH4和CH5为莎草湿地,莎草湿地是草海鸟类的觅食地与栖息地,鸟类的粪便给沉积物中带来了大量的外源氮,故莎草湿地中TN含量较高. 采样点CH6和CH7位于草海湖中,由于草海湖中心遍布大量的沉水植物,枯萎的植物经过长年累积,使湖底具有丰富的有机物,而在有机物降解的过程中,释放了大量的磷,故深水域沉积物中SOM、TP、SO42-含量相对较高. 采样点CH3则靠近威宁县城,并且附近具有大量农田,而大量的人类活动使得CH3的TN、TP、SO42-含量高于其他两个浅水沼泽.
| 表 1 草海不同类型湿地上覆水及沉积物的理化性质 Tab. 1 Physical and chemical properties of overlying water and sediments in different types of wetlands in Lake Caohai |
对7个样品的reads进行过滤处理,共获得318690876条clean reads,每个样品的reads数目范围为41542722~50006378. 质控后的reads占原始数据reads的平均百分比为98%. 对contigs进行评估,发现contigs长度超过1000 bp的平均数目和平均N50分别为19044和523 bp,说明组装结果及序列长度可用.
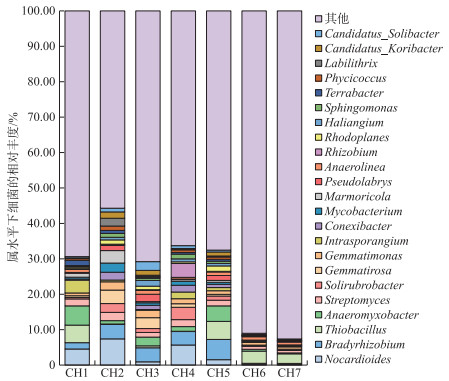
基于草海细菌基因集,将草海不同湿地类型中的微生物进行物种注释. 结果显示,注释到的细菌分为82个门、136个纲、251个目、472个科、1876个属、11661个种. 在属水平上(图 2),浅水沼泽中的优势菌属为类诺卡氏属(Nocardioides,4.30%)、大豆根瘤菌属(Bradyrhizobium,3.29%)和厌氧粘细菌(Anaeromyxobacter,2.92%). 莎草湿地中的优势菌属与浅水沼泽一致,只是相对丰度不同,分别为类诺卡氏属(3.53%)、大豆根瘤菌属(4.80%)和厌氧粘细菌(2.90%). 深水沉积物中的优势菌属为硫杆菌属(Thiobacillus,3.07%)、荚硫菌属(Thiocapsa,1.58%)和互营杆菌属(Syntrophobacter,1.35%). 这说明浅水沼泽和莎草湿地的优势菌属相同,主要为参与碳循环和氮循环的微生物,而深水沉积物中的优势菌属存在差异,主要为参与碳循环和硫循环的微生物.
|
图 2 属水平下草海不同湿地类型中细菌和甲烷氧化菌的群落结构特征 Fig.2 Community structure characteristics of bacteria and methanotrophs in different types of wetlands in Lake Caohai at the genus level |
此外,在细菌域中,草海不同类型湿地中的甲烷氧化菌在CH1~CH7中的占比分别为0.06%、0.07%、0.10%、0.05%、0.06%、0.30%和0.21%,可看出在草海湿地微生物中,甲烷氧化菌在各个样本中的相对丰度占比较小. 对于甲烷氧化菌来说,深水域沉积物中甲烷氧化菌的相对丰度较大,而其他两种类型湿地中甲烷氧化菌的相对丰度较小.
2.3 草海不同湿地类型中甲烷氧化菌的群落组成基于草海甲烷氧化菌基因集,将草海不同湿地类型中的甲烷氧化菌进行物种注释. 结果显示,注释到的甲烷氧化菌分为3个门、4个纲、4个目、6个科、14个属、56个种. 在属水平下(图 3),浅水沼泽中的优势甲烷氧化菌为甲基杆菌属(Methylobacter,0.0112%)、反硝化型厌氧甲烷氧化菌(Candidatus_Methylomirabilis,0.0111%)、甲基孢囊菌属(Methylocystis, 0.0093%)、甲基单胞菌属(Methylomonas,0.0087%)、甲基暖菌属(Methylocaldum,0.0051%). 莎草湿地和深水域沉积物中的优势甲烷氧化菌与浅水沼泽相似,但莎草湿地中疣微门甲烷氧化菌(Methylacidiphilum,0.0003%)的相对丰度较低,深水域沉积物中的甲烷氧化菌丰度高于浅水沼泽和莎草湿地,分别为甲基杆菌属(Methylobacter,0.0788%)、甲基单胞菌属(Methylomonas,0.0434%)、甲基暖菌属(Methylocaldun,0.0246%)、甲基微球菌属(Methylomicrobium,0.0262%)、甲基球菌属(Methylococcus,0.0181%). 虽然在草海不同类型的湿地中都检测到了反硝化型厌氧甲烷氧化菌的存在,但其相对丰度均较小. 以上结果说明了草海湿地中的甲烷氧化菌主要属于TypeⅠ型,且草海湿地中甲烷氧化菌氧化甲烷的过程主要为好氧氧化.

|
图 3 属水平下草海不同湿地类型中甲烷氧化菌的群落结构特征 Fig.3 Community structure characteristics of methanotrophs in different types of wetlands in Lake Caohai at the genus level |
基于草海甲烷氧化菌基因集,将其与KEGG的基因数据库进行比对,BLAST比对参数设置期望值为1×10-5. 结果显示,草海甲烷氧化菌基因集中,与碳代谢相关的功能基因共9种,分别为异柠檬酸脱氢酶(NAD+)基因IDH3(K00030)、柠檬酸合成酶基因ghA(K01681)、乌头酸水合酶基因acnA(K01681)、苹果酸脱氢酶基因mdh(K00024)、2-氧戊二酸脱氢酶基因sucA(K00164)、琥珀酸脱氢酶基因frdA(K00239)、二氢脂胺脱氢酸酶基因pdhD(K00382)、Ⅰ类富马酸脂水合酶基因fumA(K01676)、Ⅱ类富马酸脂水合酶基因fumC(K01679);与甲烷代谢相关的功能基因共3种,分别为颗粒性甲烷单加氧酶基因pmoA(K10944)、可溶性甲烷单加氧酶基因mmoX(K16157)、甲醇脱氢酶基因mxaF(K14028);与氮代谢相关的功能基因共6种,分别为固氮酶基因nifD、nifH、nifK(K02586、K02588、K02591)、亚硝酸还原酶大亚基基因nirB(K07708)、亚硝酸还原酶基因nirK(K00368)、硝酸盐还原酶基因narG(K00370);与硫代谢相关的功能基因共4种,分别为亚硫酸还原酶基因cysJ(K00380)、腺苷硫酸盐合成酶基因cysC(K00860)、硫酸腺苷酸转移酶基因cysD(K00957)、硫酸盐转运系统ATP结合蛋白酶基因cysA(K02045). 以上结论说明草海甲烷氧化菌基因集中,碳代谢功能基因主要与三羧酸(TCA,tricarboxylic acid cycle)循环有关,甲烷代谢的功能基因主要与甲烷的氧化有关,氮代谢的功能基因与固氮和反硝化作用相关,硫代谢的功能基因与同化硫酸盐还原、硫酸盐运输和硫酸盐异化还原有关.
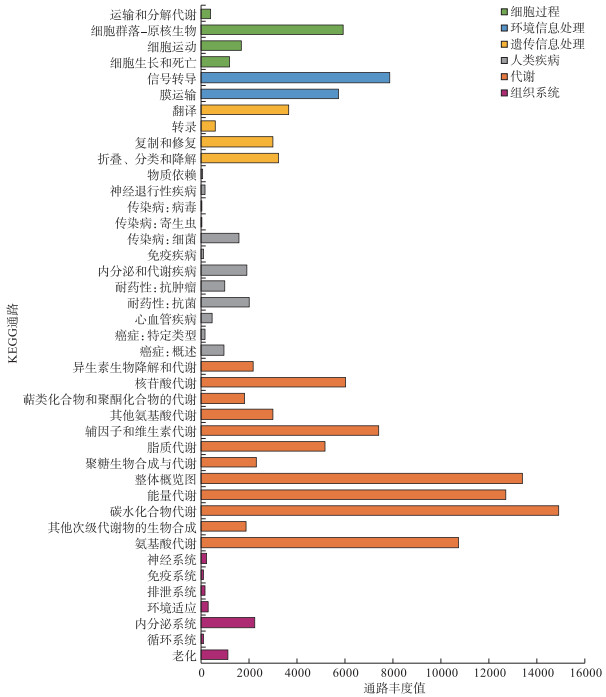
2.5 草海不同类型湿地中甲烷氧化菌的功能基于KEGG数据库对草海甲烷氧化菌基因集进行注释(图 4),结果显示草海甲烷氧化菌基因集共注释到6大类功能. 其中,丰度最大的功能是代谢(63.97%),其次是环境信息处理(10.65%)、遗传信息处理(8.21%)、细胞过程(7.22%)、人类疾病(6.62%)、组织系统(3.33%). 对代谢中的碳代谢、甲烷代谢、氮代谢和硫代谢的完整路径进行了进一步分析,发现存在11条与碳代谢相关的完整路径,分别为:Embden-Meyerhof途径(M00001)、涉及三碳化合物的核心模块的糖酵解(M0002)、丙酮酸氧化(M00307)、TCA循环(M00009)、第一次碳氧化(M00010)、第二次碳氧化(M00011)、磷酸戊糖循环(M00004)、磷酸戊糖氧化相途径(M00006)、磷酸戊糖非氧化相途径(M00007)、5-磷酸核糖-1-焦磷酸生物合成(M00005)、Entner-Doudoroff途径(M00008);存在2条与甲烷代谢相关的完整路径,分别为:甲烷氧化(M00174)和单磷酸核酮糖途径同化甲醛(M00345);存在4条与氮代谢相关的完整路径,分别为:固氮(M00175)、异化硝酸盐还原(M00530)、硝化(M00528)、完全硝化(M00804);仅存在1条与硫代谢相关的完整路径,即:同化硫酸盐还原(M00176).
|
图 4 基于KEGG下的草海甲烷氧化菌中的各项功能类别及丰度 Fig.4 Based on the functional categories and abundances of Lake Caohai methanotrophs under KEGG |
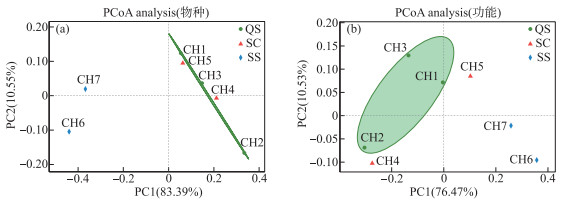
在属水平下利用Bray Curtis算法对草海不同类型湿地沉积物中的甲烷氧化菌进行物种(图 5a)和功能(图 5b)的PCoA(principal co-ordinates analysis)进行分析. 采样点与采样点之间在PCoA图中距离越近,说明这些采样点中的微生物群落结构和功能越类似[26]. 在浅水沼泽和莎草湿地中,其物种结构和功能的距离均最近,而深水沉积物中的物种结构和功能与浅水沼泽和莎草湿地距离较远,说明在草海湿地系统中,浅水沼泽和莎草湿地中甲烷氧化菌的群落结构和功能最相似,而深水域沉积物的甲烷氧化菌群落结构和功能与其他两种类型的湿地之间存在差异性.
|
图 5 草海不同类型湿地沉积物中物种(a)及功能(b)的PCoA分析 (QS:浅水沼泽;SC:莎草湿地;SS:深水域沉积物) Fig.5 PCoA analysis of species (a) and their functions (b) in different types of wetland sediments in Lake Caohai (QS: shallow-water marsh, SC: sedge wetland, SS: deep-water sediment) |
在种水平下,基于总丰度前50的甲烷氧化菌进行种类与功能的Spearman相关性系数(P)计算,选择0.5为相关系数阈值,绘制物种与功能相关性网络图(图 6,图中连线越粗表示节点间的相关性越强). 紧密系数表示网络中节点的中心系数值,紧密系数值越大说明该节点在网络中越重要. 结果显示,草海湿地中与碳代谢相关的甲烷氧化菌共有7种,其中相关性较强的是Methylacidiphilum_kamchatkense(紧密系数为0.57)和Methylacidiphilum_fumariolicum(紧密系数为0.57). 与甲烷代谢相关的甲烷氧化菌共有6种,其中相关性较强的是Candidatus_Methylomirabilis_oxyfera(紧密系数为0.50)和Methylobacter_tundripaludum(紧密系数为0.33). 与氮代谢相关的甲烷氧化菌共有6种,其中相关性较强的是Methylomonas_koyamae(紧密系数为0.50)和Methylacidiphilum_kamchatkense(紧密系数为0.57). 与硫代谢相关的甲烷氧化菌共有10种,其中相关性较强的是Methylosarcina_fibrata(紧密系数为0.43)和Methylomonas_denitrificans(紧密系数为0.43). 总体上看,Methylacidiphilum_fumariolicum和Methylacidiphilum_kamchatkense节点数最多,它们是草海湖泊湿地各个代谢功能中两种与功能相关性较大的物种.
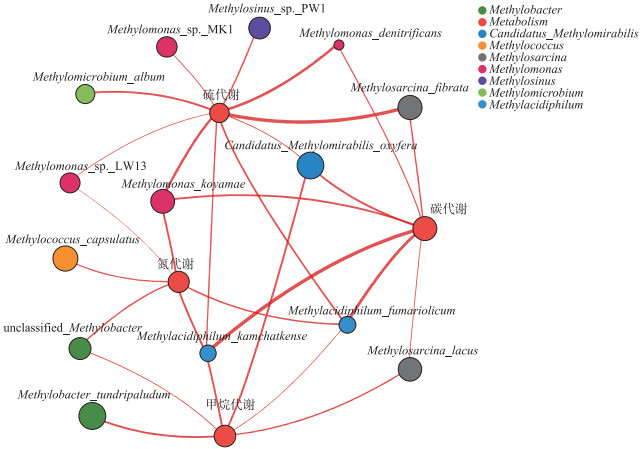
|
图 6 草海湿地沉积物中甲烷氧化菌的种类与功能的相关性 Fig.6 Correlation of types and functions of methanotrophs in the sediments of Lake Caohai wetland |
通过相关性数值可视化展示了草海3种类型沉积物样本中属分类水平下的甲烷氧化菌与环境因子(ORP、pH、EC、NO3-、SO42-、TN、TP、SOM)之间的关系(图 7). 可以看出ORP、TN、pH和SO42-与草海湿地沉积物中甲烷氧化菌的种类之间相关性较低,其中ORP与TypeⅠ型甲烷氧化菌(Methylobacter、Methylomonas、Candidatus_Methylomirabilis、Methylocaldum、Methylosarcina、Methylococcus、Methylohalobius)和疣微菌门甲烷氧化菌(Methylacidiphilum)呈负相关,与Type Ⅱ型甲烷氧化菌(Methylocystis、Methylosinus、Methylocapsa、Methyloferula、Methylocella)呈正相关. EC和NO3-仅与Type Ⅰ型甲烷氧化菌呈显著正相关. 此外,TP、SOM均与草海湿地中的TypeⅠ型和疣微门甲烷氧化菌呈正相关,且SOM与草海湿地中的TypeⅠ型甲烷氧化菌呈显著正相关. 以上结果表明了显著影响草海湿地沉积物中甲烷氧化菌的分布的主要环境因子为NO3-、EC、TP和SOM.

|
图 7 草海湿地沉积物中甲烷氧化菌种类与环境因子的关联分析 (*:P < 0.05, * *:P < 0.01, * * *:P < 0.001) Fig.7 Analysis of the correlation between the types of methanotrophs in the sediments of Lake Caohai wetland and the environmental factors (*: P < 0.05, **: P < 0.01, ***: P < 0.001) |
好氧甲烷氧化菌氧化甲烷的过程主要是利用自身的甲烷单加氧酶先把甲烷氧化为甲醇,然后在甲醇脱氢酶的作用下将甲醇氧化为甲醛,最后通过核糖酮单磷酸途径或丝氨酸等途径将甲酸转化为细胞物质[27]. 研究发现草海不同类型湿地中好氧甲烷氧化菌的种类均以TypeⅠ型为主. Lyautey等[28]研究了法国布尔歇湖中甲烷氧化菌的群落结构,发现在深水区和浅水区占主导地位的分别是属于TypeⅠ型甲烷氧化菌——甲基杆菌属和甲基球菌属. Grinsven等[29]发现富营养化湖泊富集培养物中Type Ⅰ型好氧甲烷氧化菌占主导地位. Yun等[30]发现位于我国青藏高原的永冻土湿地中能够检测出来的好氧甲烷氧化菌只存在两个属(Methylobacter和Methylocystis),且优势菌群为TypeⅠ型甲烷氧化菌. 因此,研究结果进一步证实了Type Ⅰ型甲烷氧化菌是淡水湿地中的优势好氧甲烷氧化菌群. 反硝化厌氧甲烷氧化菌氧化甲烷的过程主要是以亚硝酸盐为底物,然后通过将NO2-转化为氮气和氧气的过程来完成对甲烷的反硝化型厌氧氧化[31]. 而草海不同类型的湿地中都检测到了反硝化型厌氧甲烷氧化菌的存在. 目前,虽然这种反硝化型厌氧甲烷氧化菌未获得纯培养菌株,但是基于分子生物学技术,诸多研究证实了反硝化型厌氧甲烷氧化菌广泛存在于稻田[32]、河流[33]、湖泊[34]、污水[35]等多种环境中,而且反硝化型厌氧甲烷氧化过程既可以消耗甲烷,又可以连接地球生态系统中的碳、氮循环[36],说明反硝化型厌氧甲烷氧化菌也是微生物甲烷减排和参与物质循环中的一类重要微生物.
3.2 草海湿地中甲烷氧化菌的功能通过对草海不同类型湿地中甲烷氧化菌基因集的功能注释,发现其不仅存在甲烷代谢,而且还存在参与物质循环的功能的碳代谢、氮代谢、硫代谢. 甲烷氧化菌的某些功能在实验上已得到证实. Vorobev等[37]的研究证实了甲烷氧化菌中存在有丙酮酸还原酶和丝氨酸-乙醛酸氨基转移酶,而这些酶可以使得碳通过丝氨酸途径和核糖酮二磷酸途径被同化,而氮则被对氧敏感的固氮酶所固定,从而证实了甲烷氧化菌具有参与氮循环功能的潜力. Caldwell等[38]的研究则证实了厌氧甲烷氧化古菌和硫酸盐还原细菌参与的硫酸盐型厌氧甲烷氧化过程中,不仅能进行甲烷的厌氧氧化,而且还能在甲烷厌氧氧化的同时对硫酸盐进行还原. 本研究中PCoA分析结果发现深水沉积物中甲烷氧化菌的种类和功能组成与另外两种类型湿地存在一定差异,其原因在于湿地沉积物中的甲烷氧化程度主要受到水位的影响[39]. Sun等[40]研究发现,当湿地中的水位达到一定位置(地表下20~30 cm)时,湿地中的甲烷氧化菌氧化甲烷的能力则会大于产甲烷菌产生甲烷的能力,而夏品华等[41]研究发现水位梯度的变化会对好氧甲烷氧化菌的组成和结构造成一定的影响. 本研究中甲烷氧化菌的种类与功能相关性网络分析结果显示Candidatus_Methylomirabilis_oxyfera与甲烷代谢功能具有较强的相关性,Zhu等[42]基于同位素示踪法证实Candidatus_Methylomirabilis_oxyfera对氮循环和甲烷循环的贡献较大. 此外,Methylacidiphilum_fumariolicum和Methylacidiphilum_kamchatkense与草海湖泊湿地各个代谢功能相关性较大. Methylacidiphilum最初从意大利[43]、新西兰[44]和俄罗斯[45]的地热环境中分离出来的,是一种属于疣微门的甲烷氧化菌[46],最近研究表明,Methylacidiphilum不仅与甲烷氧化相关,其还与乙烷和丙烷氧化相关. 该类甲烷氧化菌不仅能够利用丙烷氧化途径中所具有的含氧C3化合物中间体进行生长[47],而且还能够利用各种底物(包括甲烷、甲醇和氢气)进行生长[48]. 这些结论进一步证实了甲烷氧化菌与各类代谢功能密切相关.
3.3 影响草海湿地中甲烷氧化菌分布的环境因子通过与环境因子进行相关性分析,发现环境中的NO3-、EC、TP和SOM显著影响了草海不同湿地类型中大多数甲烷氧化菌,尤其是TypeⅠ型甲烷氧化菌的群落结构. 有研究发现,Type Ⅱ型甲烷氧化菌具有固定分子氮的能力,与TypeⅠ型甲烷氧化菌相比,在氮含量相对较高的环境下,TypeⅡ型甲烷氧化菌的生长速率会降低[49],故NO3-含量是影响甲烷氧化菌种类的一个重要环境因素. 相对于TypeⅡ型甲烷氧化菌来说,TypeⅠ型甲烷氧化菌在进行细胞堆叠时需要较多磷,所以在环境中磷含量增加时TypeⅠ型甲烷氧化菌的相对丰度也会随之增加,故磷的含量会影响TypeⅠ型甲烷氧化菌的群落结构[50]. 有机质的输入能够刺激微生物代谢活性,从而使其与微生物群落的结构具有相关关系[51]. 沈李东[52]证明了钱塘江沉积物中有机质与反硝化型厌氧甲烷氧化菌呈正相关关系. Wang等[53]发现了有机质与水稻田中的反硝化型厌氧甲烷氧化菌的关系显著相关. 此外,微生物间可以通过种间的直接电子传递,以构成互养共生的关系,进而使得EC成为影响菌群的关键因素之一[54-55].
4 结论1) 草海不同类型湿地中的好氧甲烷氧化菌以属于变形菌门TypeⅠ型的甲基杆菌属和甲基单胞菌属为主,氧化类型以好氧氧化为主.
2) 草海浅水沼泽和莎草湿地的群落结构和功能相似,而深水域沉积物中的群落结构和功能存在一定差异性.
3) 草海湖泊湿地甲烷氧化菌Methylacidiphilum_fumariolicum和Methylacidiphilum_kamchatkense是碳、氮、硫和甲烷代谢过程的主要参与者.
4) 草海湖泊湿地中的Type Ⅱ型甲烷氧化菌仅与ORP呈正相关,而TypeⅠ型甲烷氧化菌和疣微菌门甲烷氧化菌(Methylacidiphilum)与ORP呈负相关,说明了草海湖泊湿地生态系统中的Type Ⅰ型甲烷氧化菌与Type Ⅱ型甲烷氧化菌对O2的适应性存在差异.
| [1] |
Qin Y, Huang H, Li Z et al. Research progress of aerobic methane oxidation process in inland waters. J Lake Sci, 2021, 33(4): 1004-1017. [秦宇, 黄璜, 李哲等. 内陆水体好氧甲烷氧化过程研究进展. 湖泊科学, 2021, 33(4): 1004-1017. DOI:10.18307/2021.0404] |
| [2] |
Saunois M, Stavert AR, Poulter B et al. The global methane budget 2000-2017. Earth System Science Data, 2020, 12(3): 1561-1623. DOI:10.5194/essd-12-1561-2020 |
| [3] |
Wang C, Lin HL. An integrated orderly classification system of natural wetland and its application in China. Acta Prataculturae Sinica, 2012, 21(1): 262-272. [王翀, 林慧龙. 中国内陆天然湿地的类型特征及分布规律-Ⅰ类的划分. 草业学报, 2012, 21(1): 262-272. DOI:10.11686/cyxb20120134] |
| [4] |
Zhu ZJ, Chen JA, Zeng Y. Paleotemperature variations at Lake Caohai, southwestern China, during the past 500 years: Evidence from combined δ18O analysis of cellulose and carbonates. Science China Earth Sciences, 2014, 44(2): 250-258. [朱正杰, 陈敬安, 曾艳. 草海地区过去500年来古温度重建: 来自沉积物纤维素结合碳酸盐氧同位素的证据. 中国科学: 地球科学, 2014, 44(2): 250-258. DOI:10.1007/s11430-014-4831-6] |
| [5] |
Wu S, Xia P, Lin T et al. Contents and distribution characteristics of nitrogen forms in sediments of Guizhou Lake Caohai under different water level levels. J Lake Sci, 2019, 31(2): 407-415. [吴胜利, 夏品华, 林陶等. 贵州草海不同水位梯度下沉积物氮赋存形态及分布特征. 湖泊科学, 2019, 31(2): 407-415. DOI:10.18307/2019.0210] |
| [6] |
Humbert S, Zopfi J, Tarnawski SE. Abundance of anammox bacteria in different wetland soils. Environmental Microbiology Reports, 2012, 4(5): 484-490. DOI:10.1111/j.1758-2229.2012.00347.x |
| [7] |
Suwat S, Steven CR. Ecology and characteristics of methanogenic archaea in animals and humans. Critical Reviews in Microbiology, 2014, 40(2): 97-116. DOI:10.3109/1040841X.2013.763220 |
| [8] |
Zhang X, Xu X, Jia G et al. Hiatus of wetland methane emissions associated with recent La Niña episodes in the Asian monsoon region. Climate Dynamics, 2020, 54(4): 4095-4107. DOI:10.1007/s00382-020-05219-0 |
| [9] |
Tikhonova EN, Kadnikov VV, Rusanov Ⅱ et al. Methane-oxidizing activity and phylogenetic diversity of aerobic methanotrophs in the Laptev Sea upper sediment horizons. Microbiology, 2021, 90(3): 314-323. DOI:10.1134/S0026261721030127 |
| [10] |
Deng YC, Che XR, Wu YB et al. A review of the physiological and ecological characteristics of methanotrophs and methanotrophic community diversity in the natural wetlands. Acta Ecologica Sinica, 2015, 35(14): 4579-4591. [邓永翠, 车荣晓, 吴伊波等. 好氧甲烷氧化菌生理生态特征及其在自然湿地中的群落多样性研究进展. 生态学报, 2015, 35(14): 4579-4591. DOI:10.5846/stxb201305060936] |
| [11] |
Hornibrook ERC, Bowes HL, Culbert A et al. Methanotrophy potential versus methane supply by pore water diffusion in peatlands. Biogeosciences, 2009, 6(57): 1491-1504. DOI:10.5194/bg-6-1491-2009 |
| [12] |
Chen Y, Dumont MG, Mcnamara N et al. Diversity of the active methanotrophic community in acidic peatlands assessed by mRNA and SIP-PLFA analyses. Environmental Microbiology, 2008, 10(2): 446-459. DOI:10.5194/bg-6-1491-2009 |
| [13] |
Danilova OV, Dedysh SN. Abundance and diversity of methanotrophic Gammaproteobacteria in northern wetlands. Microbiology, 2014, 83(2): 67-76. DOI:10.1134/s0026261714020040 |
| [14] |
Liebner S, Svenning MM. Environmental transcription of mmoX by methane-oxidizing Proteobacteria in a subarctic Palsa Peatland. Appl Environ Microbiol, 2013, 79(2): 701-706. DOI:10.1128/AEM.02292-12 |
| [15] |
Siljanen HMP, Anne S, Levente B et al. Seasonal variation in the function and diversity of methanotrophs in the littoral wetland of a boreal eutrophic lake. Fems Microbiology Ecology, 2012, 80(3): 548-555. DOI:10.1111/j.1574-6941.2012.01321.x |
| [16] |
Deng YC, Cui XY, Lüke C et al. Aerobic methanotroph diversity in Riganqiao peatlands on the Qinghai-Tibetan Plateau. Environmental Microbiology Reports, 2013, 5(4): 566-574. DOI:10.1111/1758-2229.12046 |
| [17] |
Yun JL, Yu ZS, Li K et al. Diversity, abundance and vertical distribution of methane-oxidizing bacteria (methanotrophs) in the sediments of the Xianghai wetland, Songnen Plain, northeast China. Journal of Soils & Sediments, 2013, 13(1): 242-252. DOI:10.1007/s11368-012-0610-1 |
| [18] |
Liu JM, Bao ZH, Cao WW et al. Enrichment of type i methanotrophs with nirs genes of three emergent macrophytes in a eutrophic wetland in China. Microbes And Environments, 2020, 35(1): ME19098. DOI:10.1264/jsme2.ME19098 |
| [19] |
He B, Li RL, Cai MW et al. Distribution and speciation of mercury (Hg) in Futian Mangrove Wetland, Shenzhen Bay. Ecology and Environmental Sciences, 2015, 24(3): 469-475. [贺蓓, 李瑞利, 柴民伟等. 深圳湾红树林沉积物-植物体系汞的分布规律和形态分配特征. 生态环境学报, 2015, 24(3): 469-475.] |
| [20] |
Yang YQ, Zhao CP, Zhao J. Determination of 3 anions in soil by ion chromatography. Physical Testing and Chemical Analysis, 2018, 54(3): 293-296. [杨叶琴, 赵昌平, 赵杰. 离子色谱法测定土壤中的3种阴离子. 理化检验(化学分册), 2018, 54(3): 293-296. DOI:10.11973/lhjy-hx201803010] |
| [21] |
Li D, Liu CM, Luo R et al. MEGAHIT: an ultra-fast single-node solution for large and complex metagenomics assembly via succinct de Bruijn graph. Bioinformatics, 2015, 31(10): 1674-1676. DOI:10.1093/bioinformatics/btv033 |
| [22] |
Noguchi H, Park J, Takagi T. MetaGene: prokaryotic gene finding from environmental genome shotgun sequences. Nucleic Acids Research, 2006, 34(19): 5623-5630. DOI:10.1093/nar/gkl723 |
| [23] |
Fu L, Niu B, Zhu Z et al. CD-HIT: accelerated for clustering the next-generation sequencing data. Bioinformatics, 2012, 28(23): 3150-3152. DOI:10.1093/bioinformatics/bts565 |
| [24] |
Altschul SF, Madden TL, Schäffer AA et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Research, 1997, 25(17): 3389-3402. DOI:10.1093/nar/25.17.3389 |
| [25] |
Kanehisa M, Goto S. KEGG: kyoto encyclopedia of genes and genomes. Nucleic Acids Research, 2000, 28(1): 27-30. DOI:10.1093/nar/27.1.29 |
| [26] |
Liu XD, Huang Y, Wang YH et al. Structural characteristics of microbial communities in the sediments of the Niyang River in Tibet. Environmental Science, 2020, 41(7): 3249-3256. [刘晓丹, 黄毅, 王永花等. 西藏尼洋河沉积物中微生物群落结构特征分析. 环境科学, 2020, 41(7): 3249-3256. DOI:10.13227/j.hjkx.201912150] |
| [27] |
Yun JL, Wang YF, Zhang HX. Ecology of aerobic methane oxidizing bacteria (methanotrophs). Acta Ecologica Sinica, 2013, 33(21): 6774-6785. [贠娟莉, 王艳芬, 张洪勋. 好氧甲烷氧化菌生态学研究进展. 生态学报, 2013, 33(21): 6774-6785. DOI:10.5846/stxb201207171013] |
| [28] |
Lyautey E, Billard E, Tissot N et al. Seasonal dynamics of abundance, structure, and diversity of methanogens and methanotrophs in lake sediments. Microbial Ecology, 2021. DOI:10.1007/s00248-021-01689-9 |
| [29] |
Grinsven SV, Damsté JSS, Harrison J et al. Nitrate promotes the transfer of methane-derived carbon from the methanotroph Methylobacter sp. to the methylotroph Methylotenera sp. in eutrophic lake water. Limnology and Oceanography, 2020, 66(3): 878-891. DOI:10.1002/lno.11648 |
| [30] |
Yun JL, Zhuang GQ, Ma AZ et al. Community structure, abundance, and activity of methanotrophs in the Zoige wetland of the Tibetan Plateau. Microbial Ecology, 2012, 63(4): 835-843. DOI:10.1007/s00248-011-9981-x |
| [31] |
Haroon MF, Hu SH, Shi Y et al. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage. Nature, 2013, 500: 567-570. DOI:10.1038/nature12375 |
| [32] |
Shen LD. Liu JQ, Yang YL et al. Activity, abundance and community composition of nitrite-dependent methanotrophs in response to fertilization in paddy soils. Applied Soil Ecology, 2021, 166: 103987. DOI:10.1016/J.APSOIL.2021.103987 |
| [33] |
Shen LD, Tian MH, Chen HX et al. Different responses of nitrite- and nitrate-dependent anaerobic methanotrophs to increasing nitrogen loading in a freshwater reservoir. Environmental Pollution, 2020, 263: 114623. DOI:10.1016/J.ENVPOL.2020.114623 |
| [34] |
Lomakina A, Pogodaeva T, Kalmychkov G et al. Diversity of NC10 bacteria and ANME-2d archaea in sediments of fault zones at Lake Baikal. Diversity, 2019, 12(1): 1-19. DOI:10.3390/d12010010 |
| [35] |
Meng H, Zhang X, Zhou Z et al. Simultaneous occurrence and analysis of both anammox and n-damo bacteria in five full-scale wastewater treatment plants. International Biodeterioration & Biodegradation, 2021, 156: 105112. DOI:10.1016/J.IBIOD.2020.105112 |
| [36] |
Zhou L, Li YX, Zhuang LJ et al. Vertical distribution characteristics and activity analysis of nitrite dependent anaerobic methane oxidation in an agricultural upland soil core. Acta Scientiae Circumstantiae, 2017, 37(2): 703-711. [周利, 李怡潇, 庄林杰等. 旱地土壤反硝化厌氧甲烷氧化菌的垂向分布特性与活性分析. 环境科学学报, 2017, 37(2): 703-711. DOI:10.13671/j.hjkxxb.2016.0315] |
| [37] |
Vorobev AV, Baani M, Doronina NV et al. Methyloferula stellata gen. nov., sp. nov., an acidophilic, obligately methanotrophic bacterium that possesses only a soluble methane monooxygenase. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(10): 2456-2463. DOI:10.1099/ijs.0.028118-0 |
| [38] |
Caldwell SL, Laidler JR, Brewer EA et al. Anaerobic oxidation of methane: mechanisms, bioenergetics, and the ecology of associated microorganisms. Environmental Science & Technology, 2008, 42(18): 6791-6799. DOI:10.1021/es800120b |
| [39] |
Li SQ, Zang KP, Song L. Review on methanogens and methanotrophs metabolised by methane in wetland. Marine Environmental Science, 2020, 39(3): 488-496. [李思琦, 臧昆鹏, 宋伦. 湿地甲烷代谢微生物产甲烷菌和甲烷氧化菌的研究进展. 海洋环境科学, 2020, 39(3): 488-496.] |
| [40] |
Sun X, Mu C, Song C. Seasonal and spatial variations of methane emissions from montane wetlands in Northeast China. Atmospheric Environment, 2011, 45(10): 1809-1816. DOI:10.1016/j.atmosenv.2011.01.019 |
| [41] |
Xia PH, Lin T. Spatio-temporal variation in the abundance and structure of aerobic methane-oxidizing bacteria in the littoral wetland, Yunnan-Guizhou Plateau lake. Acta Ecologica Sinica, 2021, 41(12): 1-10. [夏品华, 林陶. 云贵高原典型湖滨湿地好氧甲烷氧化细菌群落结构和数量的时空动态. 生态学报, 2021, 41(12): 1-10. DOI:10.5846/stxb202003160553] |
| [42] |
Zhu BL, Dijk GV, Fritz C et al. Anaerobic oxidization of methane in a minerotrophic peatland: enrichment of nitrite-dependent methane-oxidizing bacteria. Applied and Environmental Microbiology, 2012, 78(24): 8657-8665. DOI:10.1128/AEM.02102-12 |
| [43] |
Dunfield PF, Yuryev A, Senin P et al. Methane oxidation by an extremely acidophilic bacterium of the phylum Verrucomicrobia. Nature, 2007, 450: 879-882. DOI:10.1038/nature06411 |
| [44] |
Pol A, Heijmans K, Harhangi HR et al. Methanotrophy below pH 1 by a new Verrucomicrobia species. Nature, 2007, 450: 874-878. DOI:10.1038/nature06222 |
| [45] |
Islam T, Jensen S, Reigstad LJ et al. Methane oxidation at 55℃ and pH 2 by a thermoacidophilic bacterium belonging to the Verrucomicrobia phylum. Proceedings of the National Academy of the Sciences of the United States of America, 2008, 105(1): 300-304. DOI:10.1073/pnas.0704162105 |
| [46] |
Huub JM, Op-den C, Tajul I et al. Environmental, genomic and taxonomic perspectives on methanotrophic Verrucomicrobia. Environmental Microbiology Reports, 2009, 1(5): 293-306. DOI:10.1111/j.1758-2229.2009.00022.x |
| [47] |
Awala SI, Gwak JH, Kim YM et al. Verrucomicrobial methanotrophs grow on diverse C3 compounds and use a homolog of particulate methane monooxygenase to oxidize acetone. The ISME Journal, 2021. DOI:10.1038/s41396-021-01037-2 |
| [48] |
Carere CR, Hards K, Wigley K et al. Growth on formic acid is dependent on intracellular pH homeostasis for the Thermoacidophilic Methanotroph Methylacidiphilum sp. RTK17.1. Frontiers in Microbiology, 2021, 12: 651744. DOI:10.3389/fmicb.2021.651744 |
| [49] |
Mohanty SR, Bodelier PLE, Floris V et al. Differential effects of nitrogenous fertilizers on methane-consuming microbes in rice field and forest soils. Applied and Environmental Microbiology, 2006, 72(2): 1346-1354. DOI:10.1128/AEM.72.2.1346-1354.2006 |
| [50] |
Gao D, Sheng R, Whiteley AS et al. Effect of phosphorus amendments on rice rhizospheric methanogens and methanotrophs in a phosphorus deficient soil. Geoderma, 2020, 368: 114312. DOI:10.1016/j.geoderma.2020.114312 |
| [51] |
Traving SJ, Rowe O, Jakobsen NM et al. The effect of increased loads of dissolved organic matter on estuarine microbial community composition and function. Frontiers in Microbiology, 2017, 8: 351. DOI:10.3389/fmicb.2017.00351 |
| [52] |
Shen LD. Microbial ecology of nitrite-dependent anaerobic ammonia oxidation and anaerobic methane oxidation in wetlands[Dissertation]. Hangzhou: Zhejiang University, 2014: 65-68. [沈李东. 湿地亚硝酸盐型厌氧氨氧化和厌氧甲烷氧化微生物生态学研究[学位论文]. 杭州: 浙江大学, 2014: 65-68. ]
|
| [53] |
Wang SY, Zhu GB, Peng YZ et al. Anammox bacterial abundance, activity, and contribution in riparian sediments of the Pearl River Estuary. Environmental Science & Technology, 2012, 46(16): 8834-8842. DOI:10.1021/es3017446 |
| [54] |
Noemi C, Whendee LS, Eric AD et al. Iron reduction and soil phosphorus solubilization in humid tropical forests soils: The roles of labile carbon pools and an electron shuttle compound. Biogeochemistry, 2006, 78(1): 67-84. DOI:10.1007/s10533-005-2343-3 |
| [55] |
Kang SH, Choi WY. Oxidative degradation of organic compounds using zero-valent iron in the presence of natural organic matter serving as an electron shuttle. Environmental Science & Technology, 2009, 43(3): 878-883. DOI:10.1021/es801705 |
 2022, Vol. 34
2022, Vol. 34 

